Parodontitistherapie – invasiv, nicht-invasiv oder beides?
Parodontale Erkrankungen werden nach heutigem Kenntnisstand (siehe Beitrag Jepsen et al. in diesem Heft S. 66–71) durch einen dysbiotischen subgingivalen Biofilm in einem empfänglichen Patienten verursacht [Kinane et al., 2017].
Subgingivale Instrumentierung
Die Empfänglichkeit eines Patienten wird durch verschiedene modifizierbare (nicht ausreichende Mundhygiene, Rauchen, Adipositas, schlecht eingestellter Diabetes mellitus, aber auch lokale Faktoren wie überstehende Kronenränder, schlecht pflegbare Restaurationen) und nicht modifizierbare (genetische/epigenetische Prädisposition, systemische Erkrankungen) Risikofaktoren moduliert [Lertpimonchai et al., 2017; Aarabi et al., 2017; Gaio et al., 2016; Knight et al., 2016].
Der Kern der ursachenbezogenen Therapie der Parodontitis liegt in der möglichst effizienten Entfernung des subgingivalen Biofilms und der gleichzeitigen Reduktion der modifizierbaren Risikofaktoren [Laleman et al., 2017]. Von wesentlicher Bedeutung ist in dieser Behandlungsphase eine ausführliche Motivation und Instruktion des Patienten mit dem Ziel einer individuell optimierten häuslichen Mundhygiene und der Herstellung einer Compliance. Hierfür haben sich Mundhygiene-Sitzungen bewährt, bei denen neben einem ausführlichen Mundhygienetraining auch eine Entfernung von supra-gingivalen und gingivalen harten und weichen Belägen sowie gegebenenfalls von vorhandenen lokalen irritierenden Faktoren erfolgt, um dem Patienten die Etablierung einer optimierten Mundhygiene zu erlauben.
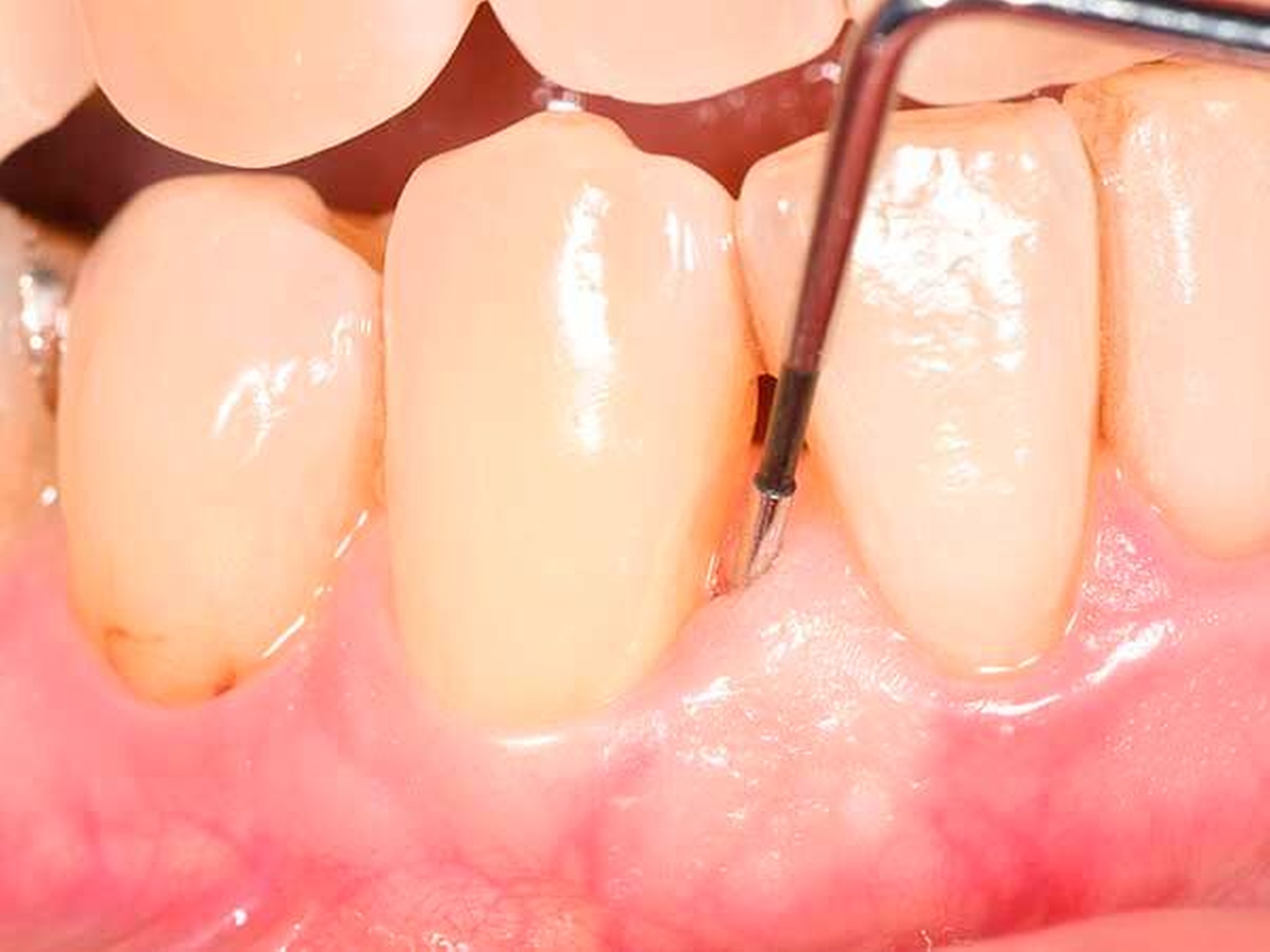
Für die subgingivale Instrumentierung kommen neben Handinstrumenten (wie Gracey-Küretten) auch maschinelle Instrumente mit Schall- oder Ultraschallantrieb infrage. In klinischen Studien zeigte eine Instrumentierung mit diesen Geräten keine deutlichen Unterschiede zwischen den verschiedenen Typen [Tunkel et al., 2002], zweckmäßigerweise können Hand- und maschinelle Instrumente kombiniert eingesetzt werden [Jepsen et al., 2011]. Eine übermäßige Bearbeitung der Wurzeloberflächen im Sinne einer klassischen Wurzelglättung sollte hierbei vermieden werden. Gleichzeitig ist eine Kürettage des Weichgewebes im Regelfall nicht indiziert [Heitz-Mayfield und Lang, 2013]. Neben einer seiten- oder quadrantenweisen Instrumentierung ist auch ein Full-Mouth-Scaling in einem Termin (oder an zwei Terminen innerhalb von 24 Stunden) möglich, allerdings ohne langfristig nachweisbaren klinischen Vorteil [Eberhard et al., 2015].
Als Alternative oder auch zusätzlich zu einer subgingivalen Instrumentierung mit Hand- oder Schall-/Ultraschallinstrumenten wurden optische Verfahren mit Lasern verschiedener Wellenlängen vorgeschlagen. Als der klassischen Instrumentierung ebenbürtig, wenn auch mit einem erhöhten Zeitaufwand verbunden, wird der Einsatz von Erbium:YAG-Hartgewebslasern angesehen [Sgolastra et al., 2012]. Andere Laser mit geringerer Wellenlänge eignen sich nicht so gut zur Entfernung mineralisierter Ablagerungen und werden daher ergänzend zur klassischen Instrumentierung eingesetzt. Bei diesem Einsatz ist unklar, ob ein zusätzlicher langfristiger klinisch relevanter Nutzen vorliegt [Sgolastra et al., 2013; Sgolastra et al., 2014]. Der adjuvante Einsatz einer photodynamischen Therapie zeigt ebenso wenig langfristige Erfolge bei stark heterogener Datenlage (siehe wissenschaftliche Stellungnahme von DG PARO und DGZMK). Ein Einsatz der PDT ist daher zum gegenwärtigen Zeitpunkt nicht anzuraten.
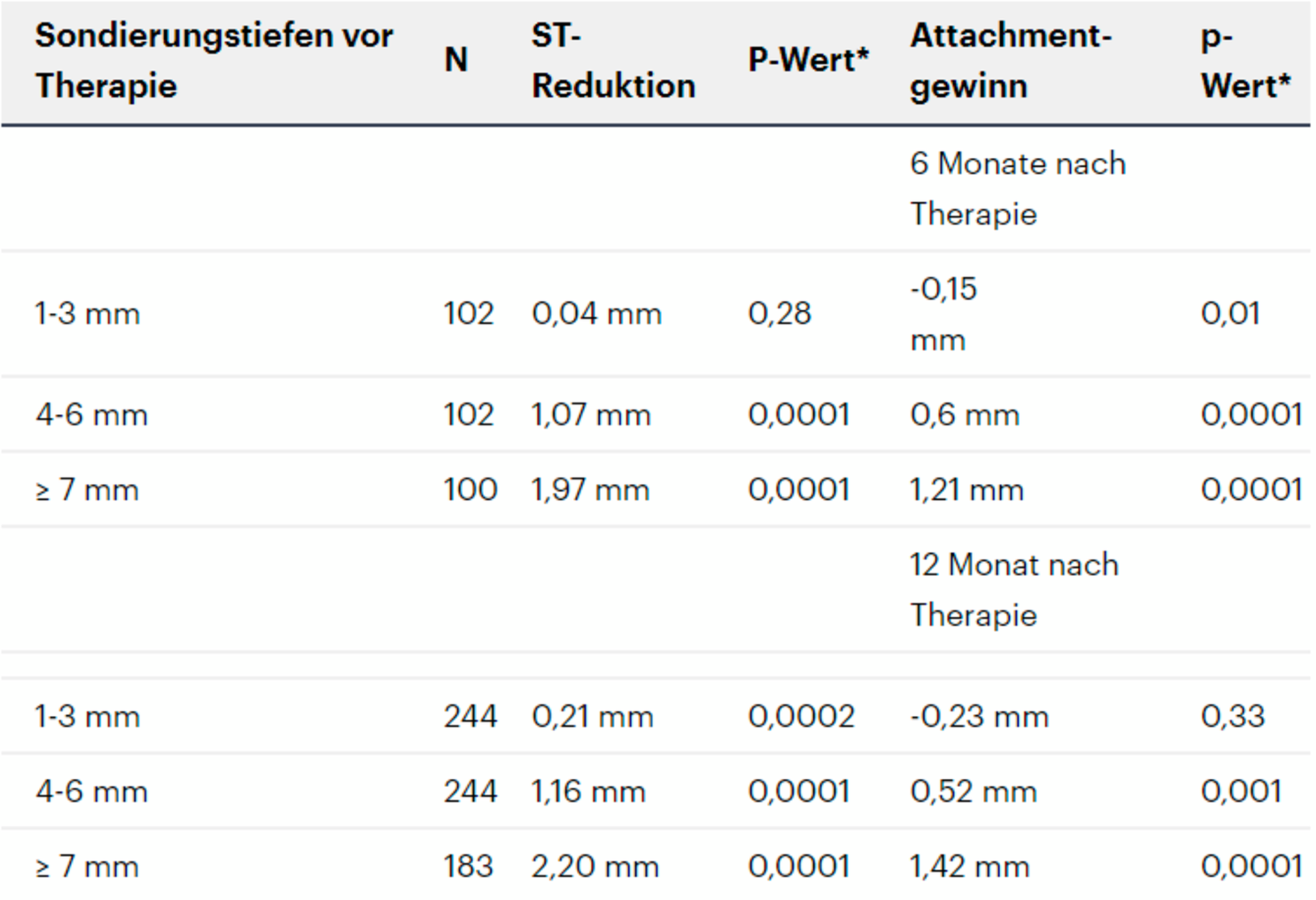
Reduktion der Sondierungstiefen (st) und Attachmentgewinne sechs und zwölf Monate nach nichtchirurgischer Therapie
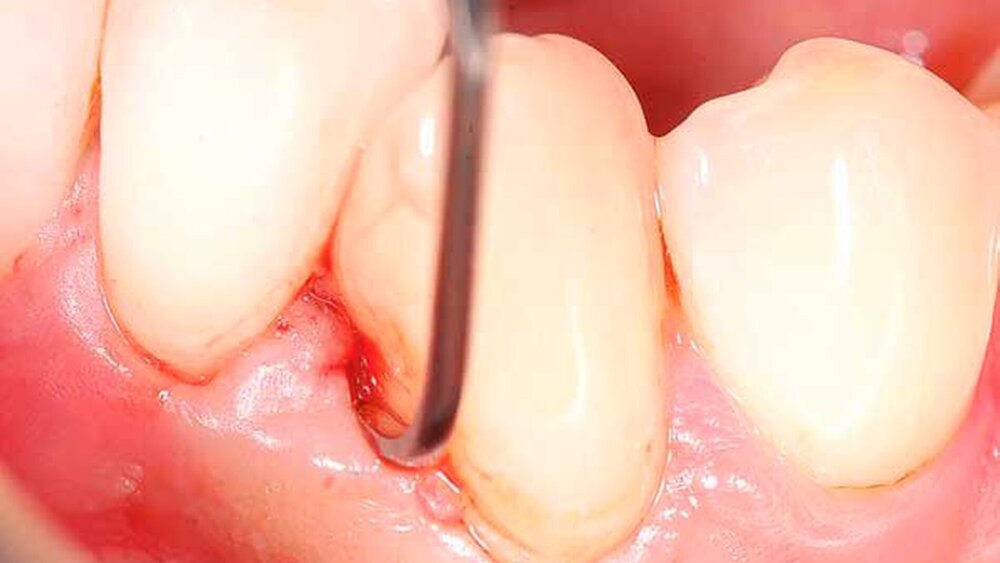
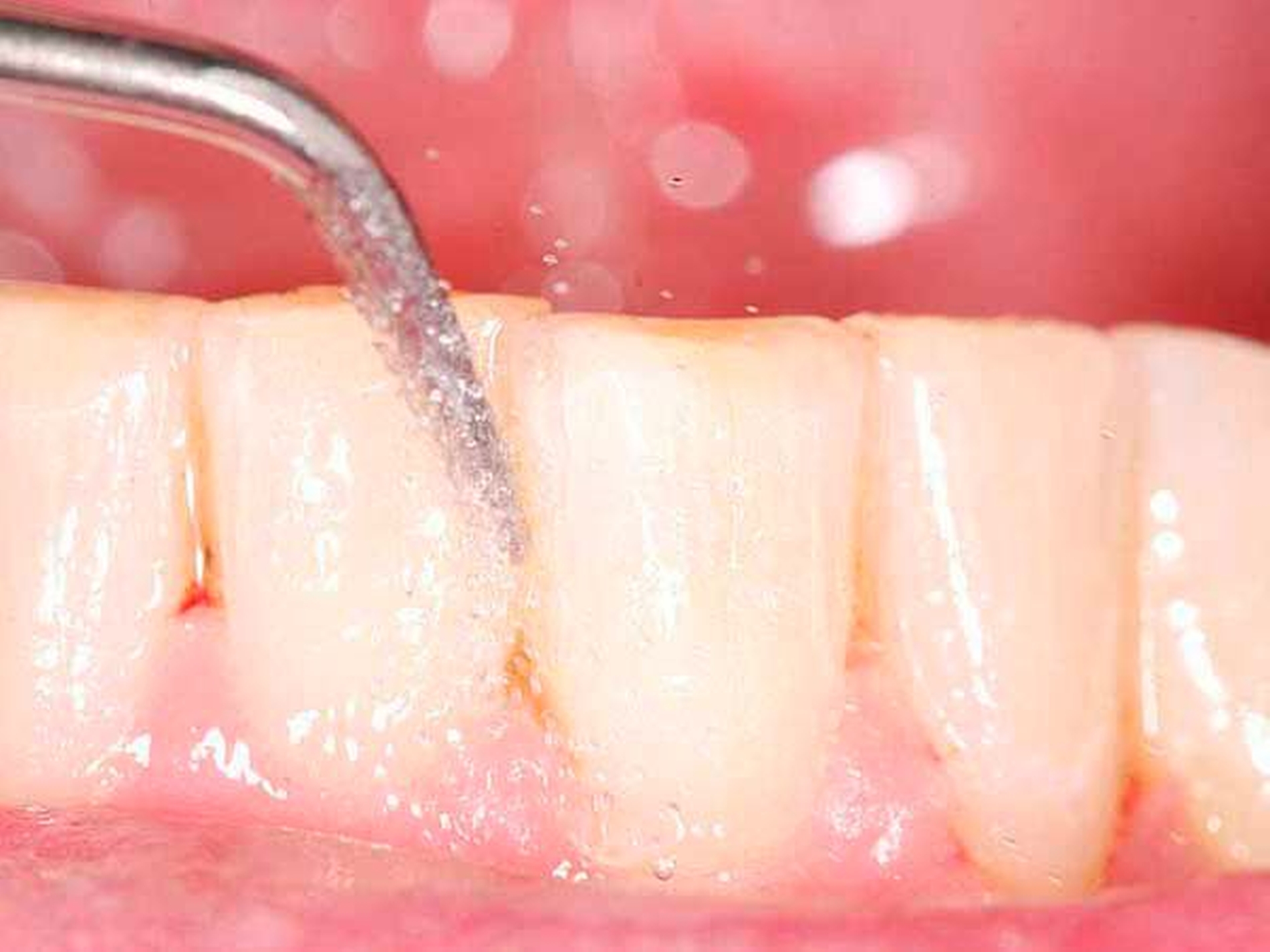
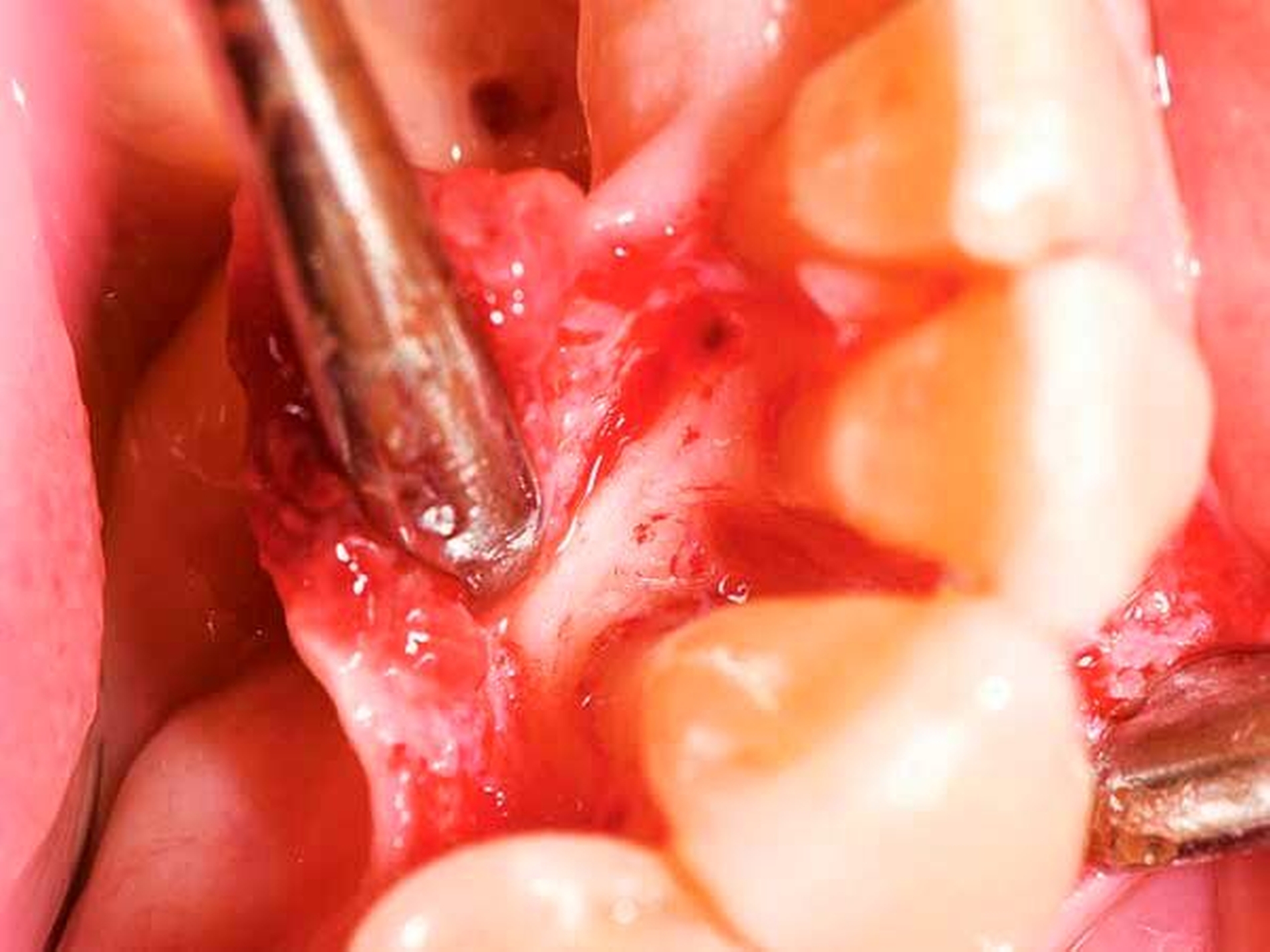
Von großem Interesse sind derzeit weiterhin subgingival eingesetzte Pulver-Wasserstrahl-Geräte. Mit gering abrasivem Pulver, häufig auf Glycin-Basis, können damit schnell und gründlich Biofilme, aber keine mineralisierten Ablagerungen entfernt werden [Flemmig et al., 2012]. Das Verfahren hat daher seine Stärke im Bereich der unterstützenden Parodontitistherapie, wo in der Regel keine ausgeprägten Konkremente zu erwarten sind. Für einen denkbaren Einsatz während der subgingivalen Instrumentierung liegen noch keine ausreichenden klinischen Daten vor, insbesondere ist wahrscheinlich die dem Verfahren immanente Gefahr eines Luftemphysems bei dem in der ersten Behandlungsphase oft noch stark aufgelockerten Gewebe (vgl. Abbildung 1) noch deutlich erhöht.
Im Mittel führt eine subgingivale Instrumentierung zu einer Reduktion der Taschensondierungstiefen von etwa 1,2 mm [Van der Weijden and Timmerman, 2002]. Diese Reduktion der Sondierungstiefe sowie die Veränderung des klinischen Attachmentlevels sind deutlich von der Sondierungstiefe vor Therapie abhängig [Hunt & Douglass, 2002] (Tabelle 1). In Situationen mit geringen Sondierungstiefen unter 3 bis 3,5 mm sollte auf eine energische subgingivale Instrumentierung verzichtet werden, um einen Verlust von Attachment zu vermeiden [Lindhe et al., 1982].
Eine ausführlichere Bewertung des langfristigen klinischen Nutzens verschiedener primärer und sekundärer Methoden für die subgingivale Instrumentierung sowie darauf aufbauende klinische Empfehlungen finden sich in der in Kürze veröffentlichten S3-Leitlinie „Subgingivale Instrumentierung“ von DG PARO und DGZMK.
Adjuvanter Einsatz von Antiseptika und Antibiotika
Da – auch mit modernsten Methoden zur subgingivalen Instrumentierung – keine vollständige Entfernung des Biofilms und der mineralisierten Ablagerungen zu erwarten ist, wurden verschiedene adjuvante oder additive Maßnahmen zur Verbesserung der Effizienz vorgeschlagen.
In der Vergangenheit wurde häufig ein Einsatz von während oder unmittelbar im Anschluss an die subgingivale Instrumentierung in die Tasche eingebrachten Antiseptika empfohlen, um den mechanisch nicht vollständig entfernten Biofilm zu bekämpfen. Systematische Übersichtsarbeiten konnten für den adjuvanten Einsatz von Chlorhexidin, sowohl als Gel als auch als Spülflüssigkeit, keinen zusätzlichen langfristigen klinisch relevanten Effekt nachweisen [Van der Sluijs et al., 2016; Cosyn und Sabzevar, 2005].
Auf einem massiven Einsatz von antiseptischem Chlorhexidin beruht auch das Konzept der Full-Mouth-Disinfection [Mongardini et al., 1999; Quirynen et al., 1999]. Hier soll eine Re-Infektion bereits instrumentierter Taschen durch sich an anderen Loci im Mund befindliche Bakterien mittels einer Instrumentierung in einer oder in mehreren Sitzungen in engstem zeitlichem Zusammenhang in Kombination mit wochenlangem intensivem Chlorhexidin-Einsatz verhindert werden. Für die Full-Mouth-Disinfection wurde allerdings in einer aktuellen systematischen Übersichtsarbeit nur ein kleiner, klinisch fraglich relevanter Vorteil festgestellt [Eberhard et al., 2015].
Der adjuvante Einsatz von systemischen Antibiotika bei der subgingivalen Instrumentierung wurde in den letzten Jahren von einigen Autoren, insbesondere von der Genfer Arbeitsgruppe um Prof. Andrea Mombelli, enthusiastisch empfohlen. Die Gruppe zeigt in ihren Arbeiten starke klinische Effekte des sogenannten „van Winkelhoff“-Cocktails, der Kombination einer oralen Gabe von Amoxicillin und Metronidazol, und zwar unabhängig vom Keimspektrum des subgingivalen Biofilms [Cionca et al., 2009, Cionca et al., 2010, Mombelli et al., 2013].
Durch den Einsatz von Amoxicillin und Metronidazol könne man die Notwendigkeit von späteren parodontalchirurgischen Maßnahmen reduzieren, so die Autoren [Mombelli et al., 2011]. Allerdings konnte ein derart deutlicher Behandlungseffekt von adjuvanten systemischen Antibiotika bei dem Gros der Patienten in der bislang weltweit größten publizierten und sehr gut kontrollierten und randomisierten Studie, der deutschen AB-PARO-Studie, nicht bestätigt werden [Harks et al., 2015]. Gerade Patienten mit einer nur moderat schweren Erkrankung scheinen nicht klinisch relevant von der Antibiotikatherapie zu profitieren [Jepsen und Jepsen, 2016]. Diesem gegenübergestellt werden sollten die oft schweren Nebenwirkungen der verwendeten Antibiotika, insbesondere des Metronidazols, sowie die erhebliche Problematik von Antibiotikaresistenzen. Daher wird empfohlen, den Einsatz von adjuvanten systemischen Antibiotika sehr restriktiv zu handhaben und für die schwersten Fälle von gerade rasch progredienten Parodontitiden zu reservieren. Die in Kürze erscheinende S3-Leitlinie der DG PARO zur adjuvanten systemischen Antibiotikatherapie wird klare Kriterien für und gegen den Einsatz von systemischen Antibiotika formulieren.
Eine interessante Alternative zu den vorgenannten adjuvanten oder additiven Maßnahmen, die allesamt auf eine möglichst starke anti-mikrobielle Wirkung abzielen, ist die gezielte Besiedlung der Mundhöhle mit gesundheitsförderlichen Bakterien, den sogenannten Probiotika [Teughels et al., 2007]. Die Studienlage zum Einsatz von Probiotika im Zusammenhang mit einer Parodontitistherapie ist derzeit allerdings noch sehr dünn, die vorliegenden Arbeiten weisen eine erhebliche Heterogenität sowie zum Teil ein hohes Biasrisiko auf – daher kann derzeit noch keine klare Empfehlung ausgesprochen werden [Martin-Cabezas et al., 2016] (siehe Beitrag Prof. Schlagenhauf, zm 23-24/2017).
Weitere Therapie bei kritischer Sondierungstiefe
Nach der subgingivalen Instrumentierung kann nach einigen Monaten das Ergebnis der ersten Phase der Parodontitistherapie gemessen und bewertet werden. Häufig wird für eine erste Reevaluation der Zeitpunkt von etwa drei Monaten nach subgingivaler Instrumentierung gewählt.
Sollten nun nach der ersten Therapiephase noch Taschen verblieben sein, stellt sich die Frage, wie und ob diese in der Folge addressiert werden sollten. Matuliene und Mitarbeiter zeigten eindrucksvoll an einer Kohorte von parodontal behandelten Schweizer Patienten mit regelmäßiger unterstützender Parodontitistherapie über einen Zeitraum von mehr als einem Jahrzehnt, dass gegenüber einem Zahn mit einer maximalen Sondierungstiefe von < 3 mm Zähne mit Sondierungstiefen von 5 oder 6 mm nach aktiver Therapie bereits ein etwa 2,5-mal höheres Risiko für einen Zahnverlust aufwiesen. Zähne mit Sondierungstiefen von 7 mm und mehr nach aktiver Therapie zeigten ein fast zehnfach erhöhtes Zahnverlustrisiko auf [Matuliene et al., 2008]. Daher ist zu fordern, Resttaschen nach der ersten Phase der Parodontitistherapie einer weiteren Therapie zuzuführen. Keinesfalls sollten Patienten mit Resttaschen in die unterstützende Parodontitistherapie überführt werden.
Aber welche therapeutischen Optionen sollten gewählt werden? Bereits vor fast vierzig Jahren konnten Lindhe und Mitarbeiter einen Vorteil für ein chirurgisches gegenüber einem nicht-chirurgischen Vorgehen ab einer „kritischen Sondierungstiefe“ von 5,4 mm nach Therapie zeigen [Lindhe et al., 1982]. Aktuellere Meta-Analysen zeigen eine leichte Verschiebung dieser kritischen Sondierungstiefe, wahrscheinlich eine Folge der verbesserten Möglichkeiten der anti-infektiösen Therapie [Heitz-Mayfield et al., 2002].
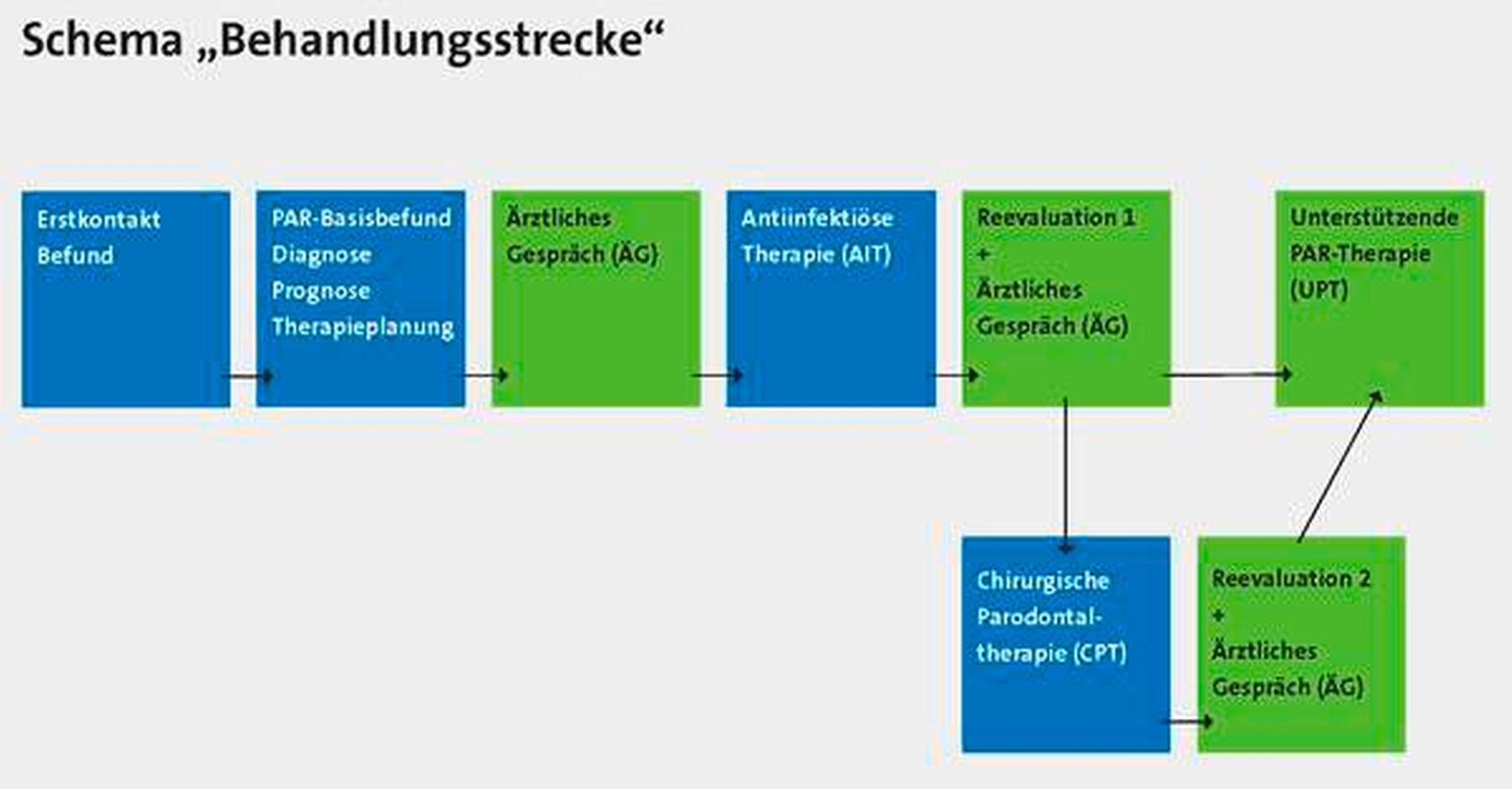
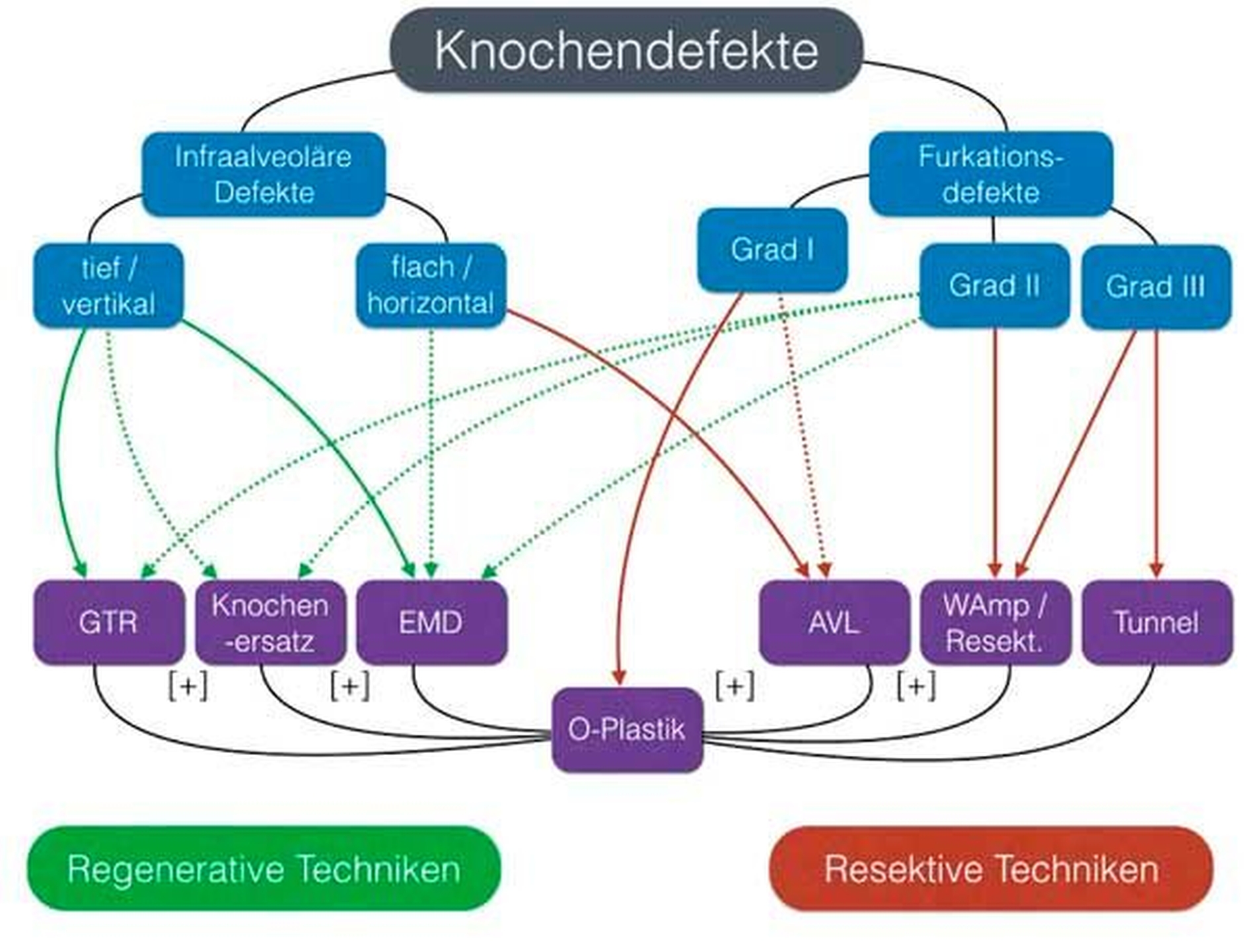
Bei der Wahl der möglichen korrektiven Eingriffe ist eine Evaluation der Defektkonfigurationen maßgeblich. In Abbildung 9 ist ein Flussdiagramm zur Entscheidungsfindung dargestellt.
Restiktive Paradontalchirurgie
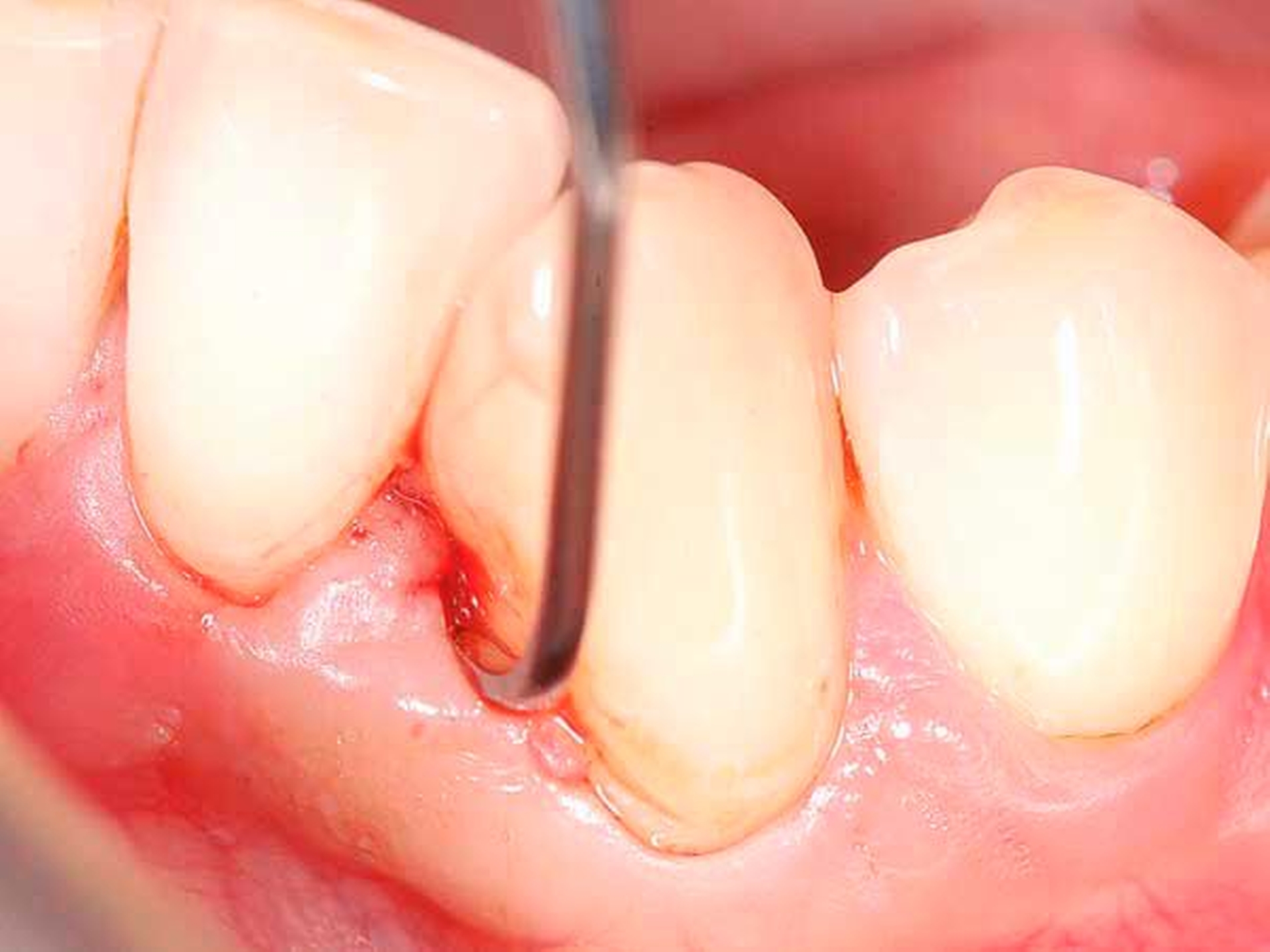
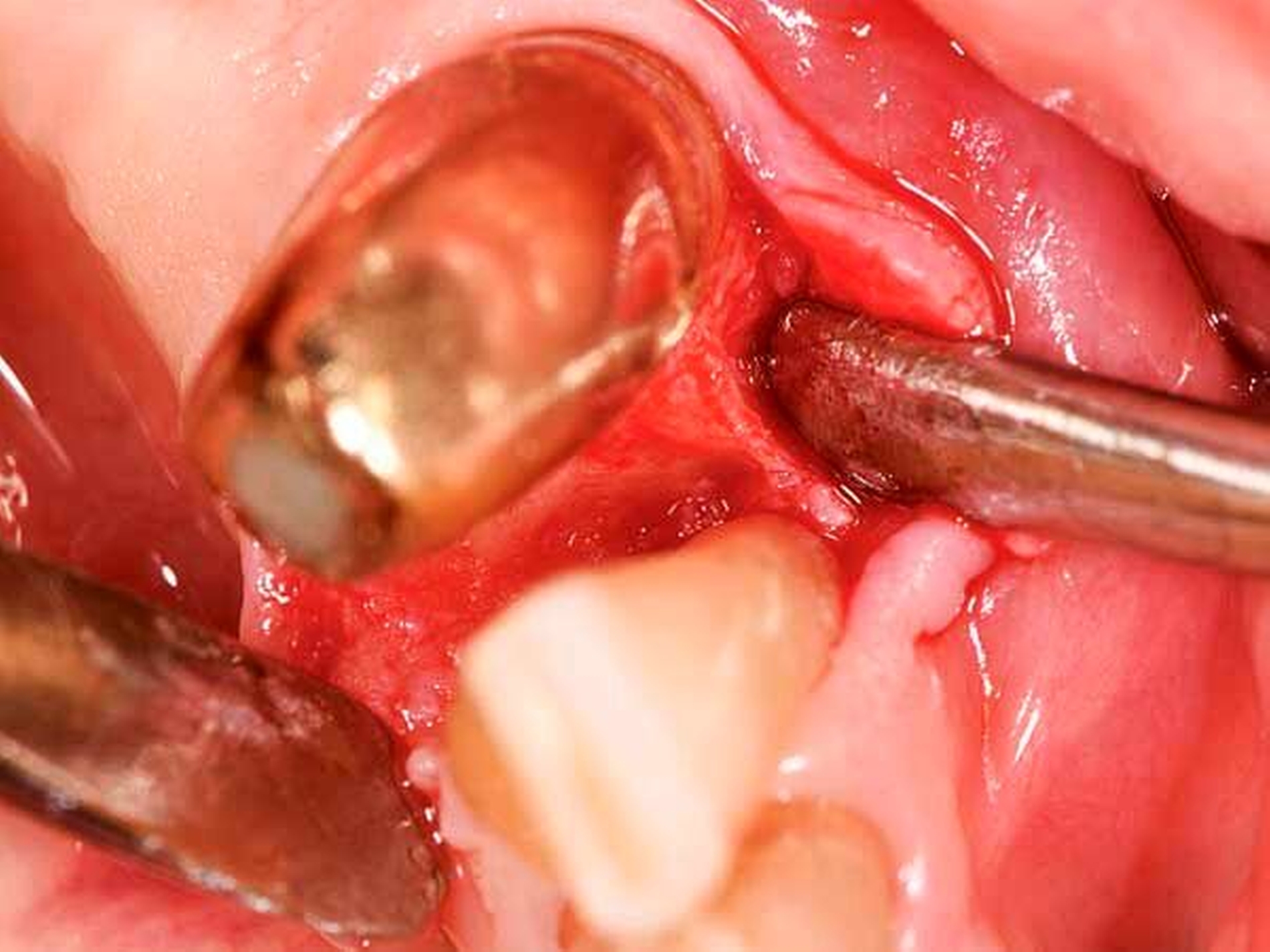
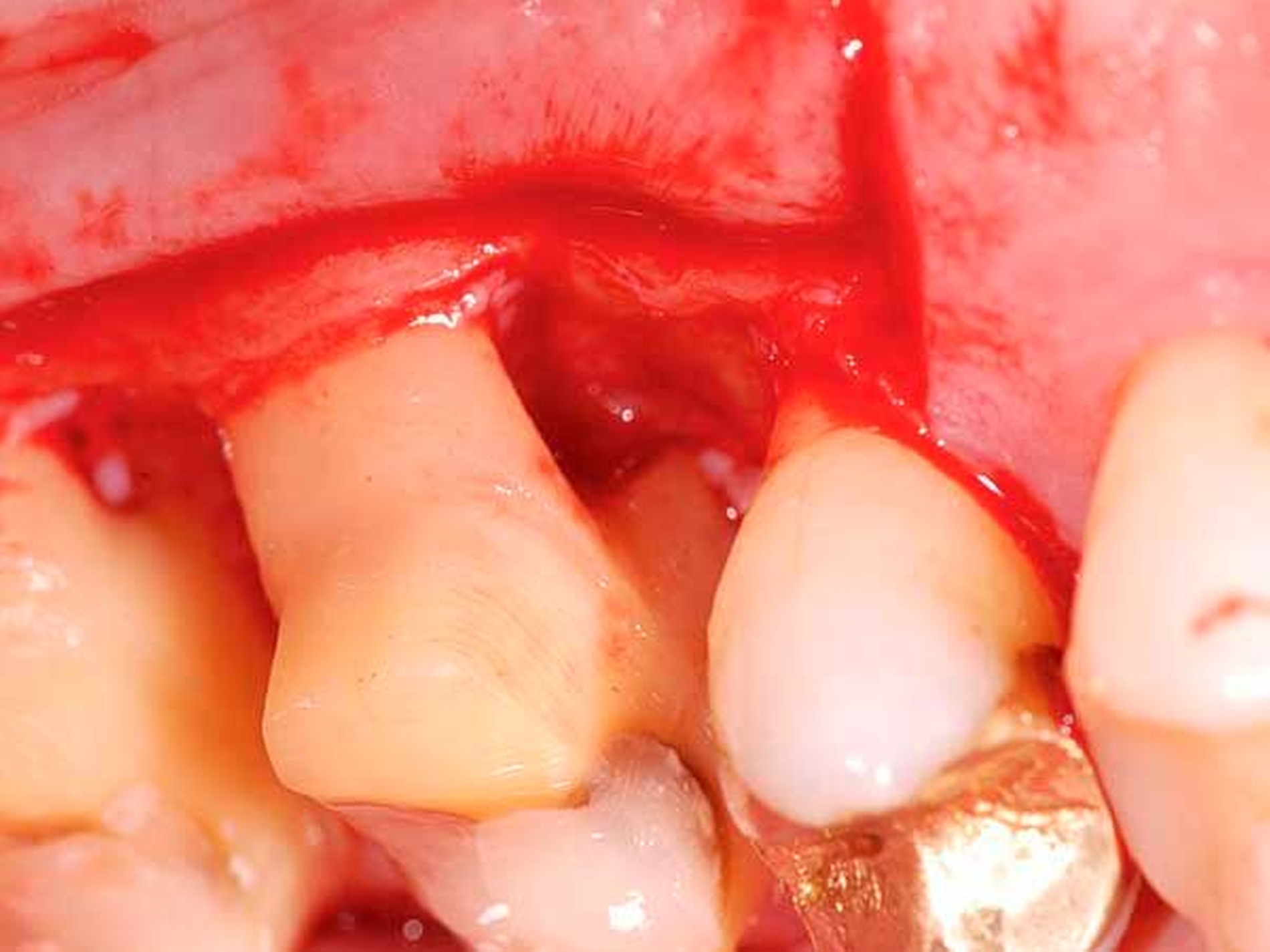
Eine klassische, sehr effiziente und vorhersagbare Möglichkeit der Adressierung von Resttaschen nach der ersten Therapiephase ist die resektive Parodontalchirurgie (Abbildung 5). Mittels eines apikalen Verschiebelappens mit resektiver Knochenchirurgie wird eine positive Gingivaarchitektur mit minimalen Sondierungstiefen auf reduziertem Niveau erschaffen [Carnevale und Kaldahl, 2000; Kebschull und Dommisch, 2013]. Diese Therapieoption wird aufgrund der ästhetischen Einschränkung durch starke Gingivarezession nur in der funktionellen Zone oder präprothetisch (zur Kronenverlängerung) durchgeführt. Die resektive Chirurgie ist bei tiefen Resttaschen ohne einer regenerativen Therapie zugängliche Defekte (siehe unten) indiziert.
Was geht regenerativ?
Die regenerative Parodontalchirurgie stellt eine der Revolutionen der Zahnheilkunde dar – erstmals können hier verloren gegangene Strukturen nicht nur repariert oder ersetzt, sondern neu hergestellt werden. Das Prinzip der regenerativen Chirurgie ist es, die bei der Heilung nach einer subgingivalen Instrumentierung oder einer klassischen Lappenoperation auftretende rasche Apikalmigration von schnell wachsenden Epithelzellen zu verhindern und so die Ausbildung eines New Attachments mit neuem azellulären Fremdfaserzement, neuem Faserapparat und neuem Knochen zu fördern.
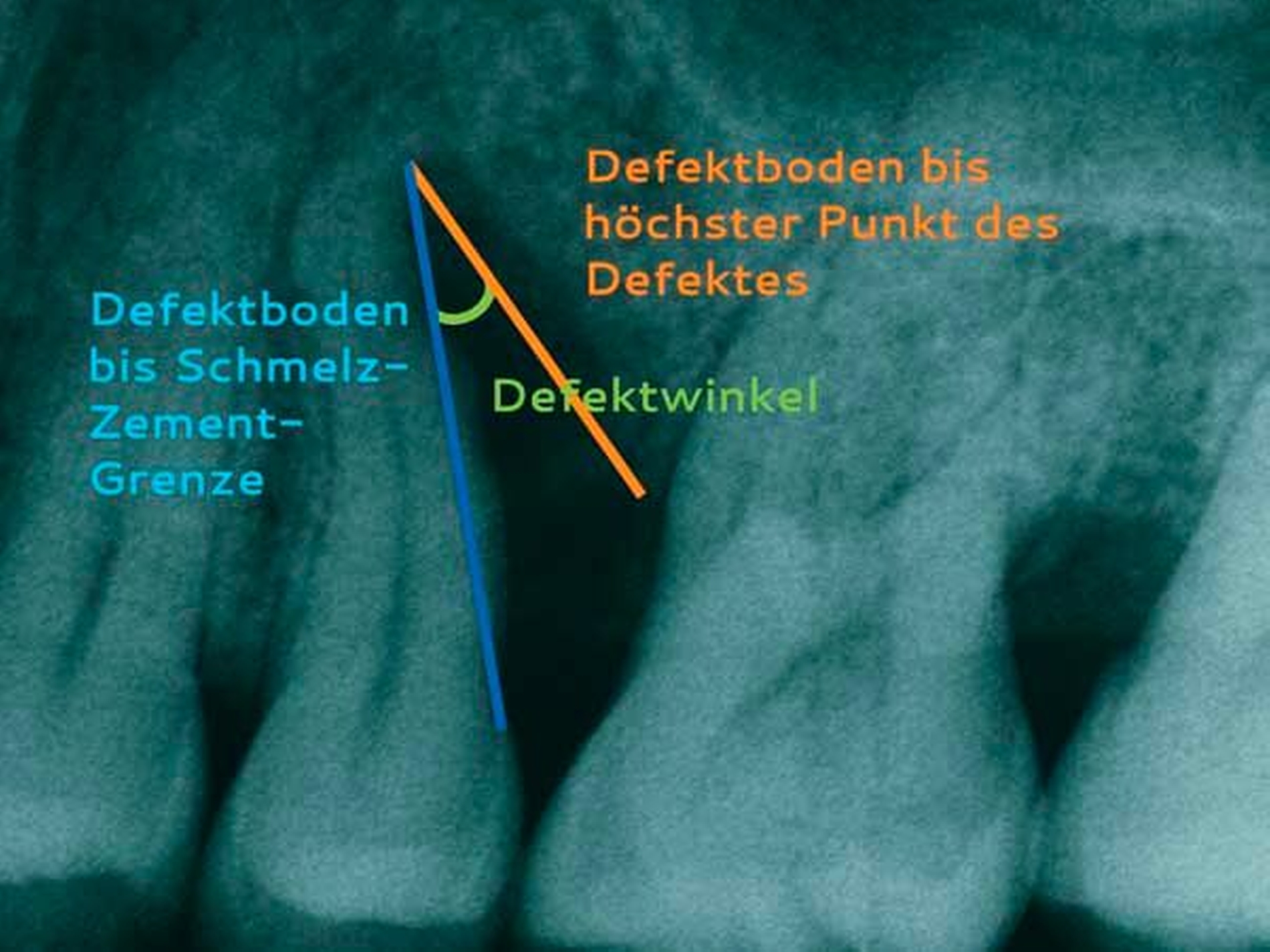
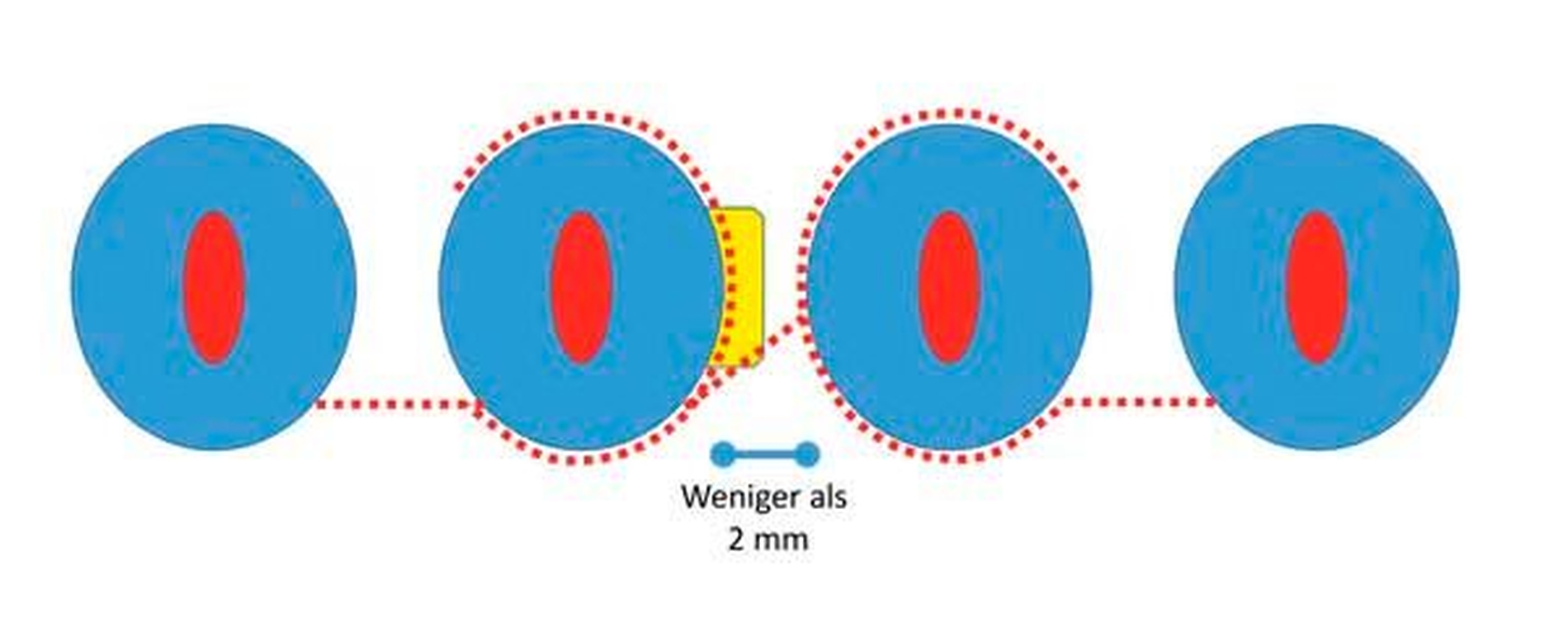
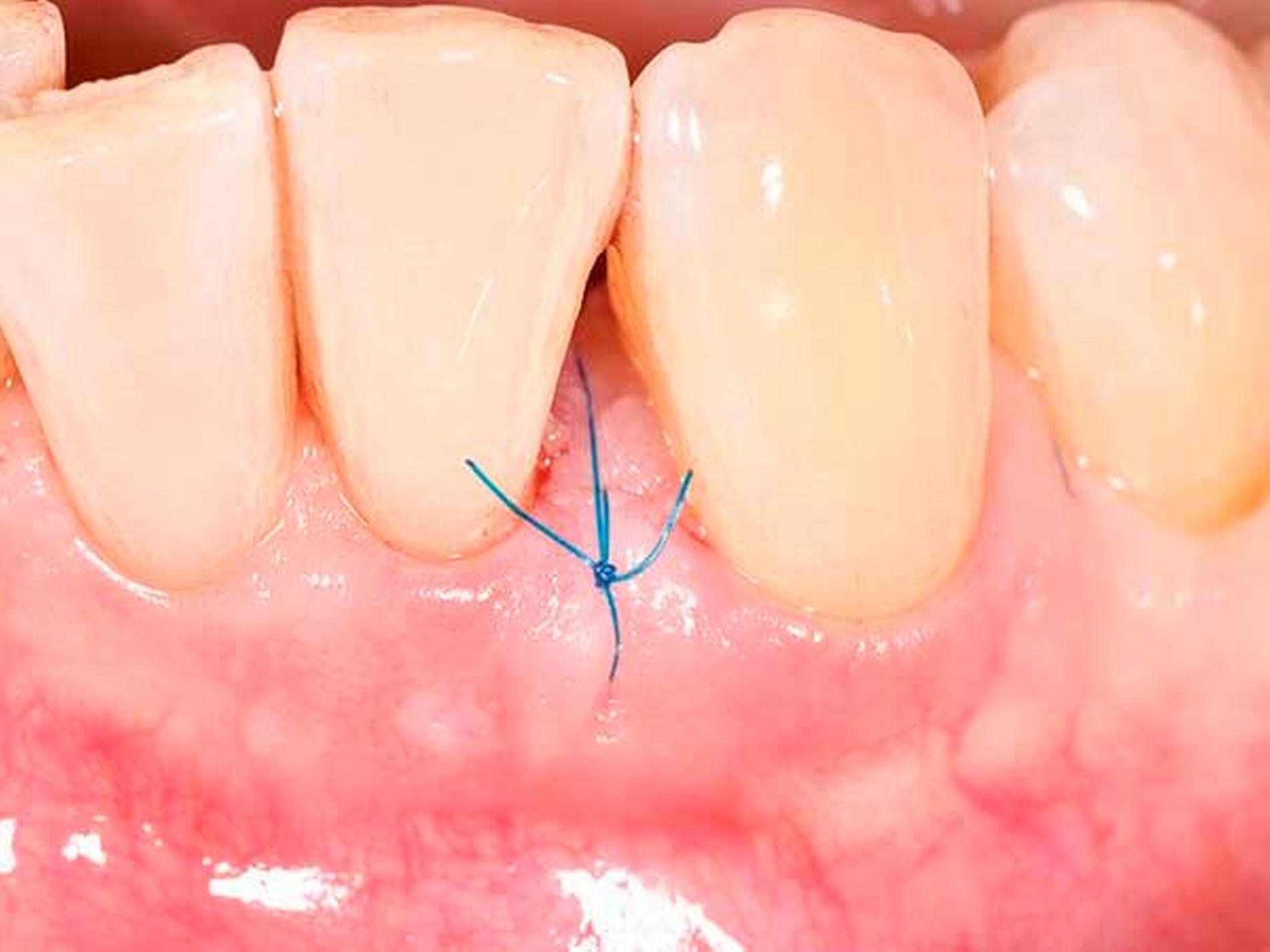
Es ist nachvollziehbar, dass eine solche Modifizierung der parodontalen Wundheilung nur Berücksichtigung von systemischen und lokalen Patientenfaktoren sowie einer optimalen chirurgischen Technik funktionieren kann. Als wesentlich hat sich auf Ebene der Patientenfaktoren herausgestellt, dass regenerative Eingriffe bei Patienten mit Vorliegen von Verhaltensfaktoren wie Rauchen oder mangelnder Compliance sowie von systemischen Faktoren wie einem schlecht eingestellten Diabetes mellitus oder einer hohen Stressbelastung mit einem deutlich erhöhten Misserfolgsrisiko vergesellschaftet sind. Auf lokaler Ebene ist zu fordern, dass der zu regenerierende Defekt eine möglichst große Tiefe sowie einen möglichst geringen Defektwinkel aufweisen sollte (Abbildung 6a). Mehr als die Hälfte der Variabilität eines regenerativen parodontalchirurgischen Eingriffs konnte in einer klassischen Studie auf die Kombination der Faktoren Defekttiefe und Defektwinkel zurückgeführt werden [Tonetti et al., 1996]. In einer deutschen Studie wurde erst bei Defekten einer intraossären Tiefe von 3 mm oder mehr sowie eines Defektwinkels von 25° und weniger ein deutlicher Attachmentgewinn nachgewiesen [Klein et al., 2001]. Zusätzlich erfordert ein regenerativer Eingriff optimierte Weichgewebeverhältnisse (Abbildung 6b) – die Zahl von parodontalpathogenen Bakterien des roten Komplexes ist direkt mit einer verschlechterten OP-Prognose assoziiert [Heitz-Mayfield et al., 2006], und die Möglichkeit eines primären Verschlusses der Lappen ist ein wesentlicher Faktor für den Erfolg des regenerativen Eingriffs [Cortellini und Tonetti, 2015]. Zur Sicherstellung der primären Deckung des OP-Gebiets sind verschiedene papillenerhaltende Lappentechniken beschrieben worden. Häufig werden in Abhängigkeit von der Breite der Interdentalpapille der modifizierte (Abbildung 7a bei dreiwändigen Defekten wie in Abbildung 7b; Abbildung 7c bei ein- oder zweiwändigen Defekten wie in Abbildung 7 d) oder der vereinfachte Papillenerhaltungslappen (Abbildungen 7e und 7f) angewendet.
Bei adäquater Fallauswahl sind regenerative Eingriffe mit guter Vorhersagbarkeit durchführbar und weisen eine sehr gute Langzeitprognose auf [Cortellini und Tonetti, 2004; Cortellini et al., 2017; Bröseler et al., 2017].
Konzepte für Molaren mit Furkationsbefall
Molaren mit fortgeschrittenem Furkationsbefall weisen gegenüber anderen Zahntypen sowie gegenüber nicht furkationsbefallenen Molaren deutlich erhöhte Misserfolgs- und schlussendlich auch Zahnverlustraten auf [Nibali et al., 2016]. Dies ist auf die schlechte Zugänglichkeit der Furkationsregion für die Biofilmkontrolle zurückzuführen (siehe auch Abbildung 8a). Eine nicht-chirurgische Therapie, auch in Kombination mit Adjuvantien wie einem lokalen Antibiotikum [Dannewitz et al., 2009], oder eine chirurgische Therapie mittels Accessflaps [Graziani et al., 2015] sind zur Resolution einer Furkationsbeteiligung nicht geeignet.
Die Möglichkeiten regenerativer Therapie sind bei Molaren mit fortgeschrittenem Furkationsbefall eingeschränkt: Nur bei Furkationsgrad von bukkal (sowohl im Ober- als auch im Unterkiefer) liegen Hinweise dafür vor, dass eine Verbesserung des Furkationsbefalls mittels eines regenerativen Eingriffs mit Membran- oder Schmelzmatrixproteinen verhältnismäßig vorhersagbar möglich ist. Eine regenerative Therapie von approximalen Furkationsdefekten im Oberkiefer sowie von lingualem Furkationsbefall im Unterkiefer ist regelmäßig nicht vorhersagbar möglich. Es gibt keine Hinweise aus der Literatur, dass eine durchgängige Furkation durch regenerative Maßnahmen wieder zu verschließen sei [Jepsen et al., 2002; Sanz et al., 2015b].
Daher gewinnen gerade im posterioren Oberkiefer oder bei Vorliegen einer durchgängigen Furkation resektive Maßnahmen wie die Amputation einer oder mehrerer Wurzeln (Abbildung 8b bis 8d), die Prämolarisierung sowie die Tunnelierung wieder an Bedeutung. Diese Maßnahmen sind klinisch herausfordernd, da neben einer hochwertigen parodontologischen Versorgung eine adäquate endodontologische Therapie und eine sinnvolle restaurative Versorgung für den Langzeiterfolg notwendig sind. Nachdem Autoren aus Italien [Carnevale et al., 1998] und den USA [Fugazzotto, 2001] schon länger von hervorragenden Überlebensraten wurzelamputierter Molaren berichtet haben, liegen nun auch aus Deutschland retrospektive Daten über bis zu 30 Jahre vor, nach denen ein Wurzel-amputierter Molar eine mediane Überlebenszeit von etwa 20 Jahren aufweist [Derks et al., 2017].
Alternativ wurde lange postuliert, Zähne mit fortgeschrittenem Furkationsbefall lieber frühzeitig zu extrahieren und durch dentale Implantate zu ersetzen. Diese sehr invasive Behandlungsoption verliert in jüngerer Zeit vor dem Hintergrund der erheblichen Inzidenz von periimplantären Erkrankungen [Derks und Tomasi, 2015], insbesondere bei Patienten mit der Vorgeschichte einer Parodontitis [Roccuzzo et al., 2014; Sousa et al., 2015], bei gleichzeitigem Fehlen von vorhersehbaren Therapiekonzepten für Periimplantitis [Renvert und Polyzois, 2015] deutlich an Bedeutung [Giannobile und Lang, 2016].
Endpunkte der aktiven Therapie, weiter zur UPT
Wie bereits erwähnt, führt das Belassen von Resttaschen zu einem deutlich erhöhten Risiko für zukünftigen Attachment- und Zahnverlust [Matuliene et al., 2008]. Daher sollte nach jeder Therapiephase das Therapieergebnis reevaluiert werden, und auf Basis des aktuellen Befunds die Indikation zur weitergehenden Therapie oder zum Übergang in ein stringentes Programm für eine unterstützende Parodontitistherapie gestellt werden..
Als Leitfaden für klinisch sinnvolle Endpunkte der aktiven Therapie, die einen Übergang in die UPT rechtfertigen würden, können die Kriterien der Schweizer Qualitätsleitlinien [Mombelli et al., 2014] herangezogen werden: Hier wird eine Reduktion der Sondierungstiefen unter 5 mm gefordert, Stellen mit Sondierungstiefen von 4 mm sollen – wenn überhaupt – nur „minimale Persistenz“ aufweisen. Zusätzlich sollen keine mineralisierten Ablagerungen auf den Wurzeloberflächen mehr vorliegen und die supragingivale Plaque soll durch den complianten Patienten substanziell reduziert worden sein. Dies führt zu einer klinisch gesunden Situation ohne Suppuration und mit nur minimaler Sondierungsblutung.
Die Teilnahme an einer risikoadaptierten und systematischen unterstützenden Parodontitistherapie ist für die Langzeitprognose des Parodontitispatienten von entscheidender Bedeutung [Lee et al., 2015; Sanz et al., 2015a].
Fazit
Heute können viele Fälle mittels sachgerechter anti-infektiöser Therapie und stringenter unterstützender Parodontitistherapie gelöst werden. Hierbei ist die mechanische subgingivale Instrumentierung von wesentlicher Bedeutung, die Wirksamkeit adjuvanter und additiver Methoden sollte nicht überbewertet werden. Insbesondere gilt es, den Einsatz von adjuvanten systemischen Antibiotika auf die Fälle mit schwerer und schwerster, gerade rasch progredienter Parodontitis zu beschränken, wo ein signifikanter Effekt der zusätzlichen Medikation zu erwarten ist und dieser Nutzen die nicht unerheblichen Risiken überwiegt.
Doch nicht alle Fälle sind durch minimal-invasive anti-infektiöse Therapien zufriedenstellend zu behandeln. Insbesondere Patienten mit tiefen intraossären Defekten oder Furkationsbefall bedürfen oft einer weitergehenden chirurgischen Therapie. Die regenerative Parodontalchirurgie besitzt großes Potenzial, ist allerdings auf Patienten mit günstigen Defekt- und Patientenfaktoren beschränkt. Eine Alternative bei Nicht-Vorliegen der für den vorhersagbaren Erfolg eines regenerativen Eingriffs notwendigen Faktoren kann ein klassischer tascheneliminierender Eingriff mittels apikalem Verschiebelappen, gegebenenfalls in Kombination mit der Resektion einer oder mehrerer Wurzeln, darstellen (Entscheidungshilfe: Abbildung 9).
PD Dr. med. dent. Moritz Kebschull
Oberarzt der Poliklinik für Parodontologie ,Zahnerhaltung und Präventive Zahnheilkunde, Zentrum für ZMK
Welschnonnenstr. 17, 53111 Bonn
moritz@kebschull.me
Univ.-Prof. Dr. med. dent. Dr. med. Søren Jepsen, MS
Direktor der Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde, Zentrum für ZMK
Welschnonnenstr. 17, 53111 Bonn
Univ.-Prof. Dr. med. dent. Henrik Dommisch
Charité Centrum ZMK CC 3
Direktor der Abteilung für Parodontologie und Synoptische Zahnmedizin
Aßmannshauser Str. 4–6, 14197 Berlin
Literaturverzeichnis
Aarabi, G., Zeller, T., Seedorf, H., Reissmann, D. R., Heydecke, G., Schaefer, A. S. & Seedorf, U. (2017) Genetic Susceptibility Contributing to Periodontal and Cardiovascular Disease. J Dent Res 96, 610-617. doi:10.1177/0022034517699786.
Carnevale, G. & Kaldahl, W. B. (2000) Osseous resective surgery. Periodontol 2000 22, 59-87.
Carnevale, G., Pontoriero, R. & di Febo, G. (1998) Long-term effects of root-resective therapy in furcation-involved molars. A 10-year longitudinal study. J Clin Periodontol 25, 209-214.
Cionca, N., Giannopoulou, C., Ugolotti, G. & Mombelli, A. (2009) Amoxicillin and metronidazole as an adjunct to full-mouth scaling and root planing of chronic periodontitis. J Periodontol 80, 364-371. doi:10.1902/jop.2009.080540.
Cionca, N., Giannopoulou, C., Ugolotti, G. & Mombelli, A. (2010) Microbiologic testing and outcomes of full-mouth scaling and root planing with or without amoxicillin/metronidazole in chronic periodontitis. J Periodontol 81, 15-23. doi:10.1902/jop.2009.090390.
Cortellini, P., Buti, J., Pini Prato, G. & Tonetti, M. S. (2017) Periodontal regeneration compared with access flap surgery in human intra-bony defects 20-year follow-up of a randomized clinical trial: tooth retention, periodontitis recurrence and costs. J Clin Periodontol 44, 58-66. doi:10.1111/jcpe.12638.
Cortellini, P. & Tonetti, M. S. (2004) Long-term tooth survival following regenerative treatment of intrabony defects. J Periodontol 75, 672-678. doi:10.1902/jop.2004.75.5.672.
Cortellini, P. & Tonetti, M. S. (2015) Clinical concepts for regenerative therapy in intrabony defects. Periodontol 2000 68, 282-307. doi:10.1111/prd.12048.
Cosyn, J. & Sabzevar, M. M. (2005) A systematic review on the effects of subgingival chlorhexidine gel administration in the treatment of chronic periodontitis. J Periodontol 76, 1805-1813. doi:10.1902/jop.2005.76.11.1805.
Dannewitz, B., Lippert, K., Lang, N. P., Tonetti, M. S. & Eickholz, P. (2009) Supportive periodontal therapy of furcation sites: non-surgical instrumentation with or without topical doxycycline. J Clin Periodontol 36, 514-522. doi:10.1111/j.1600-051X.2009.01414.x.
Derks, H., Westheide, D., Pfefferle, T., Eickholz, P. & Dannewitz, B. (2017) Retention of molars after root-resective therapy: a retrospective evaluation of up to 30 years. Clin Oral Investig. doi:10.1007/s00784-017-2220-1.
Derks, J. & Tomasi, C. (2015) Peri-implant health and disease. A systematic review of current epidemiology. J Clin Periodontol 42 Suppl 16, S158-171. doi:10.1111/jcpe.12334.
Eberhard, J., Jepsen, S., Jervoe-Storm, P. M., Needleman, I. & Worthington, H. V. (2015) Full-mouth treatment modalities (within 24 hours) for chronic periodontitis in adults. Cochrane database of systematic reviews, Cd004622. doi:10.1002/14651858.CD004622.pub3.
Flemmig, T. F., Arushanov, D., Daubert, D., Rothen, M., Mueller, G. & Leroux, B. G. (2012) Randomized controlled trial assessing efficacy and safety of glycine powder air polishing in moderate-to-deep periodontal pockets. Journal of Periodontology 83, 444-452. doi:10.1902/jop.2011.110367.
Fugazzotto, P. A. (2001) A comparison of the success of root resected molars and molar position implants in function in a private practice: results of up to 15-plus years. J Periodontol 72, 1113-1123. doi:10.1902/jop.2001.72.8.1113.
Gaio, E. J., Haas, A. N., Rosing, C. K., Oppermann, R. V., Albandar, J. M. & Susin, C. (2016) Effect of obesity on periodontal attachment loss progression: a 5-year population-based prospective study. J Clin Periodontol 43, 557-565. doi:10.1111/jcpe.12544.
Giannobile, W. V. & Lang, N. P. (2016) Are Dental Implants a Panacea or Should We Better Strive to Save Teeth? J Dent Res 95, 5-6. doi:10.1177/0022034515618942.
Graziani, F., Gennai, S., Karapetsa, D., Rosini, S., Filice, N., Gabriele, M. & Tonetti, M. (2015) Clinical performance of access flap in the treatment of class II furcation defects. A systematic review and meta-analysis of randomized clinical trials. J Clin Periodontol 42, 169-181. doi:10.1111/jcpe.12327.
Harks, I., Koch, R., Eickholz, P., Hoffmann, T., Kim, T. S., Kocher, T., Meyle, J., Kaner, D., Schlagenhauf, U., Doering, S., Holtfreter, B., Gravemeier, M., Harmsen, D. & Ehmke, B. (2015) Is progression of periodontitis relevantly influenced by systemic antibiotics? A clinical randomized trial. J Clin Periodontol 42, 832-842. doi:10.1111/jcpe.12441.
Heitz-Mayfield, L., Tonetti, M. S., Cortellini, P. & Lang, N. P. (2006) Microbial colonization patterns predict the outcomes of surgical treatment of intrabony defects. J Clin Periodontol 33, 62-68. doi:10.1111/j.1600-051X.2005.00872.x.
Heitz-Mayfield, L. J., Trombelli, L., Heitz, F., Needleman, I. & Moles, D. (2002) A systematic review of the effect of surgical debridement vs non-surgical debridement for the treatment of chronic periodontitis. J Clin Periodontol 29 Suppl 3, 92-102; discussion 160-102. doi:012 [pii].
Heitz-Mayfield, L. J. A. & Lang, N. P. (2013) Surgical and nonsurgical periodontal therapy. Learned and unlearned concepts. Periodontology 2000 62, 218-231. doi:10.1111/prd.12008.
Jepsen, K. & Jepsen, S. (2016) Antibiotics/antimicrobials: systemic and local administration in the therapy of mild to moderately advanced periodontitis. Periodontol 2000 71, 82-112. doi:10.1111/prd.12121.
Jepsen, S., Deschner, J., Braun, A., Schwarz, F. & Eberhard, J. (2011) Calculus removal and the prevention of its formation. Periodontol 2000 55, 167-188. doi:10.1111/j.1600-0757.2010.00382.x.
Jepsen, S., Eberhard, J., Herrera, D. & Needleman, I. (2002) A systematic review of guided tissue regeneration for periodontal furcation defects. What is the effect of guided tissue regeneration compared with surgical debridement in the treatment of furcation defects? J Clin Periodontol 29 Suppl 3, 103-116; discussion 160-102.
Kebschull, M. & Dommisch, H. (2013) Resektive Parodontalchirurgie. Zahnmedizin up2date 6, 525-551.
Kinane, D. F., Stathopoulou, P. G. & Papapanou, P. N. (2017) Periodontal diseases. Nat Rev Dis Primers 3, 17038. doi:10.1038/nrdp.2017.38.
Klein, F., Kim, T. S., Hassfeld, S., Staehle, H. J., Reitmeir, P., Holle, R. & Eickholz, P. (2001) Radiographic defect depth and width for prognosis and description of periodontal healing of infrabony defects. J Periodontol 72, 1639-1646. doi:10.1902/jop.2001.72.12.1639.
Knight, E. T., Liu, J., Seymour, G. J., Faggion, C. M., Jr. & Cullinan, M. P. (2016) Risk factors that may modify the innate and adaptive immune responses in periodontal diseases. Periodontol 2000 71, 22-51. doi:10.1111/prd.12110.
Laleman, I., Cortellini, S., De Winter, S., Rodriguez Herrero, E., Dekeyser, C., Quirynen, M. & Teughels, W. (2017) Subgingival debridement: end point, methods and how often? Periodontol 2000 75, 189-204. doi:10.1111/prd.12204.
Lee, C. T., Huang, H. Y., Sun, T. C. & Karimbux, N. (2015) Impact of Patient Compliance on Tooth Loss during Supportive Periodontal Therapy: A Systematic Review and Meta-analysis. J Dent Res 94, 777-786. doi:10.1177/0022034515578910.
Lertpimonchai, A., Rattanasiri, S., Arj-Ong Vallibhakara, S., Attia, J. & Thakkinstian, A. (2017) The association between oral hygiene and periodontitis: a systematic review and meta-analysis. Int Dent J. doi:10.1111/idj.12317.
Lindhe, J., Socransky, S. S., Nyman, S., Haffajee, A. & Westfelt, E. (1982) „Critical probing depths“ in periodontal therapy. J Clin Periodontol 9, 323-336.
Martin-Cabezas, R., Davideau, J. L., Tenenbaum, H. & Huck, O. (2016) Clinical efficacy of probiotics as an adjunctive therapy to non-surgical periodontal treatment of chronic periodontitis: a systematic review and meta-analysis. J Clin Periodontol 43, 520-530. doi:10.1111/jcpe.12545.
Matuliene, G., Pjetursson, B. E., Salvi, G. E., Schmidlin, K., Bragger, U., Zwahlen, M. & Lang, N. P. (2008) Influence of residual pockets on progression of periodontitis and tooth loss: results after 11 years of maintenance. J Clin Periodontol 35, 685-695. doi:CPE1245 [pii] 10.1111/j.1600-051X.2008.01245.x.
Mombelli, A., Cionca, N. & Almaghlouth, A. (2011) Does adjunctive antimicrobial therapy reduce the perceived need for periodontal surgery? Periodontol 2000 55, 205-216. doi:10.1111/j.1600-0757.2010.00356.x.
Mombelli, A., Cionca, N., Almaghlouth, A., Decaillet, F., Courvoisier, D. S. & Giannopoulou, C. (2013) Are there specific benefits of amoxicillin plus metronidazole in Aggregatibacter actinomycetemcomitans-associated periodontitis? Double-masked, randomized clinical trial of efficacy and safety. J Periodontol 84, 715-724. doi:10.1902/jop.2012.120281.
Mombelli, A., Schmid, J., Walter, C. & Wetzel, A. (2014) Qualitätsleitlinien Parodontologie. Swiss Dental Journal 124, 261-267.
Mongardini, C., van Steenberghe, D., Dekeyser, C. & Quirynen, M. (1999) One stage full- versus partial-mouth disinfection in the treatment of chronic adult or generalized early-onset periodontitis. I. Long-term clinical observations. J Periodontol 70, 632-645.
Nibali, L., Zavattini, A., Nagata, K., Di Iorio, A., Lin, G. H., Needleman, I. & Donos, N. (2016) Tooth loss in molars with and without furcation involvement - a systematic review and meta-analysis. J Clin Periodontol 43, 156-166. doi:10.1111/jcpe.12497.
Quirynen, M., Mongardini, C., Pauwels, M., Bollen, C. M., Van Eldere, J. & van Steenberghe, D. (1999) One stage full- versus partial-mouth disinfection in the treatment of chronic adult or generalized early-onset periodontitis. II. Long-term impact on microbial load. J Periodontol 70, 646-656.
Renvert, S. & Polyzois, I. N. (2015) Clinical approaches to treat peri-implant mucositis and peri-implantitis. Periodontol 2000 68, 369-404. doi:10.1111/prd.12069.
Roccuzzo, M., Bonino, L., Dalmasso, P. & Aglietta, M. (2014) Long-term results of a three arms prospective cohort study on implants in periodontally compromised patients: 10-year data around sandblasted and acid-etched (SLA) surface. Clin Oral Implants Res 25, 1105-1112. doi:10.1111/clr.12227.
Sanz, M., Baumer, A., Buduneli, N., Dommisch, H., Farina, R., Kononen, E., Linden, G., Meyle, J., Preshaw, P. M., Quirynen, M., Roldan, S., Sanchez, N., Sculean, A., Slot, D. E., Trombelli, L., West, N. & Winkel, E. (2015a) Effect of professional mechanical plaque removal on secondary prevention of periodontitis and the complications of gingival and periodontal preventive measures: consensus report of group 4 of the 11th European Workshop on Periodontology on effective prevention of periodontal and peri-implant diseases. J Clin Periodontol 42 Suppl 16, S214-220. doi:10.1111/jcpe.12367.
Sanz, M., Jepsen, K., Eickholz, P. & Jepsen, S. (2015b) Clinical concepts for regenerative therapy in furcations. Periodontol 2000 68, 308-332. doi:10.1111/prd.12081.
Sgolastra, F., Petrucci, A., Gatto, R. & Monaco, A. (2012) Efficacy of Er:YAG laser in the treatment of chronic periodontitis: systematic review and meta-analysis. Lasers Med Sci 27, 661-673. doi:10.1007/s10103-011-0928-8.
Sgolastra, F., Severino, M., Gatto, R. & Monaco, A. (2013) Effectiveness of diode laser as adjunctive therapy to scaling root planning in the treatment of chronic periodontitis: a meta-analysis. Lasers Med Sci 28, 1393-1402. doi:10.1007/s10103-012-1181-5.
Sgolastra, F., Severino, M., Petrucci, A., Gatto, R. & Monaco, A. (2014) Nd:YAG laser as an adjunctive treatment to nonsurgical periodontal therapy: a meta-analysis. Lasers Med Sci 29, 887-895. doi:10.1007/s10103-013-1293-6.
Sousa, V., Mardas, N., Farias, B., Petrie, A., Needleman, I., Spratt, D. & Donos, N. (2015) A systematic review of implant outcomes in treated periodontitis patients. Clin Oral Implants Res. doi:10.1111/clr.12684.
Teughels, W., Newman, M. G., Coucke, W., Haffajee, A. D., Van Der Mei, H. C., Haake, S. K., Schepers, E., Cassiman, J. J., Van Eldere, J., van Steenberghe, D. & Quirynen, M. (2007) Guiding periodontal pocket recolonization: a proof of concept. J Dent Res 86, 1078-1082.
Tonetti, M. S., Prato, G. P. & Cortellini, P. (1996) Factors affecting the healing response of intrabony defects following guided tissue regeneration and access flap surgery. J Clin Periodontol 23, 548-556.
Tunkel, J., Heinecke, A. & Flemmig, T. F. (2002) A systematic review of efficacy of machine-driven and manual subgingival debridement in the treatment of chronic periodontitis. J Clin Periodontol 29 Suppl 3, 72-81; discussion 90-71.
Van der Sluijs, M., Van der Sluijs, E., Van der Weijden, F. & Slot, D. E. (2016) The effect on clinical parameters of periodontal inflammation following non-surgical periodontal therapy with ultrasonics and chemotherapeutic cooling solutions: a systematic review. J Clin Periodontol 43, 1074-1085. doi:10.1111/jcpe.12613.
Van der Weijden, G. A. & Timmerman, M. F. (2002) A systematic review on the clinical efficacy of subgingival debridement in the treatment of chronic periodontitis. J Clin Periodontol 29 Suppl 3, 55-71; discussion 90-51. doi:009 [pii].