Erosives Potenzial von Getränken, Speisen und Medikamenten
Dentale Erosionen stellen insbesondere in den Industrieländern ein zunehmendes Problem dar [Lussi und Carvalho, 2014; Schlueter und Luka, 2018]. Zahnerosion bedeutet per definitionem chemisch verursachter Zahnhartsubstanzverlust ohne Beteiligung von Mikroorganismen [Pindborg, 1970].
Heute wird zwischen Zahnerosion und erosivem Zahnhartsubstanzverlust unterschieden. Unter Zahnerosion versteht man eine durch Säure verursachte Demineralisation der Zahnhartsubstanz. Wird diese Oberfläche nun durch mechanische Interaktion abradiert, spricht man von erosivem Zahnhartsubstanzverlust, „erosive tooth wear“ [Shellis et al., 2011]. Es kann aber bei übermäßigem Kontakt mit Säure auch ohne mechanische Belastung ein Zahnhartsubstanzverlust auftreten, der definitionsgemäß der Zahnerosion angehört – zum Beispiel im Rahmen einer beruflichen Exposition oder bei gehäuftem Erbrechen [Schlueter und Tveit, 2014].
Die Trink- und Ernährungsgewohnheiten haben sich in den vergangenen Jahrzehnten geändert, der Konsum von sauren Lebensmitteln und Getränken gehört vielerorts zum Alltag. Erosionen und erosiver Zahnhartsubstanzverlust stellen daher ein immer größer werdendes Problem dar und deren Prophylaxe gewinnt an Bedeutung. Erwähnenswert ist, dass eine substanzielle Wiedererhärtung demineralisierten Schmelzes durch im Speichel gelöste Mineralsalze Tage bis Monate braucht, um abrasiven Prozessen wie Zahnreinigung oder Kontakt von Zunge und Wange zu den Zähnen zu widerstehen. Man sollte deshalb von der Empfehlung Abstand nehmen, nach dem Essen mindestens 30 Minuten mit dem Zähneputzen zu warten, denn solche Wartezeiten sind vor dem Hintergrund der benötigten, viel längeren Remineralisationszeiten nicht von Nutzen [Bartlett et al., 2013; Lussi et al., 2014; O‘Toole et al., 2017; Steiger-Ronay et al., 2018]. Das sollte auch in der Patientenkommunikation berücksichtigt werden – beispielhaft sei hier die Broschüre „Prophylaxe von Erosionen“ der Universitäten Zürich und Bern sowie des Kompetenzzentrums Adipositas, Essverhalten und Psyche genannt (www.zzm.uzh.ch/de/patienten/downloads).
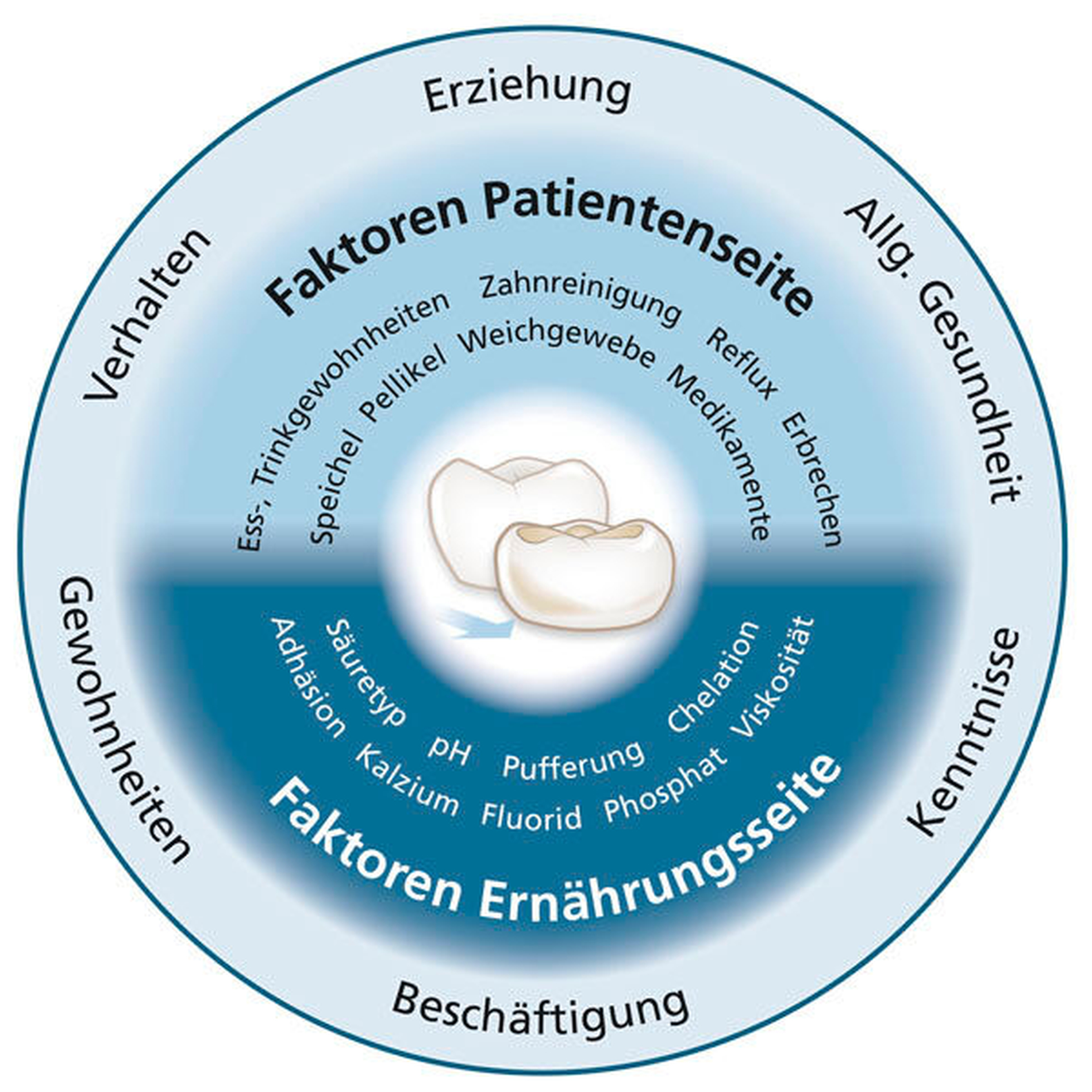
Nach Erbrechen oder Reflux kann man den Mund sofort mit Wasser spülen, um die Magensäure zu verdünnen und deren erosiven Effekt zu mindern [Lussi et al., 2012b]. Die Ursache des Erbrechens sollte mithilfe von Fachkollegen schnellstmöglich diagnostiziert und behandelt werden. Daneben gibt es viele andere wichtige Risiko- und schützende Faktoren, die unbedingt zu beachten sind (Abbildung 1) [Lussi et al., 2005].
Das Ziel der vorliegenden Arbeit ist es, eine Übersicht der Erosivität respektive des erosiven Potenzials von insgesamt 116 Getränken und Speisen zu geben. Ferner werden auch die Eigenschaften verschiedener häufig konsumierter Medikamente aufgeführt. Die vorliegenden Daten beruhen zum einen auf den Resultaten früherer Untersuchungen [Lussi et al., 2012a; Lussi und Carvalho, 2015], zum anderen auf neuen Untersuchungen mit weiteren Produkten, deren erosive Eigenschaften bislang noch nicht in einer Fachzeitschrift veröffentlicht wurden. Dabei werden bei den Produkten detaillierte Angaben der verschiedenen gemessenen und berechneten physikalischen und chemischen Parameter gegeben und es wird zusätzlich eine zusammenfassende Beurteilung des erosiven Potenzials aufgeführt. Geplant ist, diese Tabellen mit weiteren Produkten zu ergänzen und periodisch zu publizieren.
Material und Methoden
Herstellung der Schmelzprobekörper
Aus einem Pool von extrahierten Zähnen wurden 1.020 kariesfreie Prämolaren und 300 Milchzähne ohne Risse an den bukkalen Hälften mithilfe eines Stereomikroskops ausgewählt. Nachdem die Kronen von den Wurzeln getrennt wurden, wurden die bukkalen Seiten unter Wasserkühlung auf einer LaboPol-21-Poliermaschine (Struers, Ballerup, Dänemark) so geschliffen, dass im Zentrum der freiliegenden Fläche exakt 200 µm Schmelz abgetragen wurden. Die Oberflächen wurden bis zu einer Körnung von 3 µm poliert und danach bis zum Versuch in einer Aufbewahrungslösung gelagert. Direkt vor Versuchsbeginn wurden die Probekörper einer Endpolitur mit der Körnung 1 µm während einer Minute unterzogen (LaboPol-6, DP-Mol Polishing Cloth, DP-Stick HQ, Struers, Kopenhagen, Dänemark). Das Prozedere entsprach dem einer bereits in 2012 publizierten Untersuchung [Lussi et al., 2012a].
Härtemessung
Die Bestimmung der oberflächlichen Mikrohärte erfolgte mit der Härtemessung nach Vickers. Diese Methode ist neben der Härtemessung nach Knoop in der zahnärztlichen Forschung etabliert. Die Ausgangshärte der verschiedenen Schmelzprobekörper variiert von Zahn zu Zahn. Um den Vergleich zu ermöglichen, werden in dieser Arbeit die Resultate in Prozent bezogen auf die Ausgangshärte dargestellt. Das Vorgehen bei der Härtemessung war wie folgt: Ein Vickers-Diamant wurde 15 Sekunden mit einer Kraft von 50 mN (Fischerscope HM 2000 XYp; Helmut Fischer, Hünenberg, Schweiz) auf die Schmelzoberfläche gepresst, danach die Vickers-Härte automatisch aufgrund der Eindringtiefe berechnet. Bei jedem Messschritt wurden sechs Abdrücke ausgemessen und daraus der Mittelwert berechnet. Dieser Wert wurde für die weiteren Berechnungen verwendet. Dieses Prozedere wurde verwendet, um die Variationen der Schmelzhärte zu berücksichtigen. Pro Produkt wurden jeweils zehn Probekörper gemessen.
Wir haben in diese Zusammenstellung sowohl bleibende Zähne als auch Milchzähne integriert. Die Frage, ob Milchzähne anfälliger als bleibende Zähne auf erosive Demineralisationen sind, wird in der Literatur widersprüchlich diskutiert [Carvalho et al., 2014]. Wir konnten in einer vor Kurzem publizierten Untersuchung zeigen, dass im experimentellen Modell, das auch hier verwendet wurde, kein Unterschied zwischen bleibenden und Milchzähnen bestand [Lussi und Carvalho, 2015]. Auch in einer anderen Untersuchung mit ähnlichem Design und je 108 Milch- sowie 108 bleibenden Zähnen wurde mit einer einzigen Ausnahme kein Unterschied in der Anfälligkeit auf Erosionen von bleibenden und Milchzähnen festgestellt [Carvalho et al., 2017]. Trotzdem haben wir in der Tabelle vermerkt, ob die Messung an einem Milch- oder an einem bleibenden Zahn vorgenommen wurde.
Versuchsablauf
Von der gleichen gesunden Person ohne offene kariöse Läsionen mit normaler Speichelfließrate (stimulierte Fließrate 2,3 ml/min) wurde Paraffinwachs-stimulierter Speichel (Fluka; Sigma-Aldrich Chemie GmbH, München, Deutschland) unmittelbar vor der Messung gesammelt – jeweils um die gleiche Uhrzeit morgens in einem eisgekühlten Behälter. Eine Stunde vor einer Speichelentnahme durften die Probanden nichts mehr essen und keine koffeinhaltigen Getränke mehr trinken. Die Probekörper wurden dann für drei Stunden in diesen frisch gesammelten Speichel eingetaucht, um eine Pellikel zu bilden. Nach der Bildung der Pellikel wurden die Probekörper jeweils in die entsprechende Lösung unter ständiger Bewegung (95 U/min) bei 30 °C (Schüttelbad Salvis; Renggli AG, Rotkreuz, Schweiz) gegeben. Benutzt wurden immer 10 ml Lösung pro Probekörper. Nach zwei Minuten wurden die Probekörper der Lösung entnommen und Härtemessungen durchgeführt.
Getestete Substanzen und Medikamente
In der vorliegenden Studie wurden 116 beliebte Getränke, Speisen und Medikamente einbezogen (Tabelle). Zur besseren Übersicht wurden die Produkte in Gruppen eingeteilt:
Gruppe 1: Mineralwasser
Gruppe 2: Softdrinks, Erfrischungsgetränke, Limonaden
Gruppe 3: Energiegetränke, Sportgetränke
Gruppe 4: Früchte, Säfte, Smoothies
Gruppe 5: Milchprodukte
Gruppe 6: Tee, Eistee, Kaffee
Gruppe 7: Alkoholische Getränke
Gruppe 8: Medikamente
Gruppe 9: Kinderartikel
Gruppe 10: Verschiedenes
Kohlensäurehaltige Getränke wurden durch Rühren entgast, weil die Blasen eine korrekte Durchführung der Experimente nicht gestatten. Früchte wurden unmittelbar vor Beginn des Experiments zerkleinert/gepresst und der Saft wurde durch ein Sieb gefiltert. Tabletten und Pulver wurden in Wasser nach Herstellerangaben aufgelöst. Süßwaren wurden in deionisiertem Wasser (5,2 g in 10 ml) bei 45 °C unter Rühren aufgelöst und für das Experiment wieder abgekühlt. Kaugummi wurde während fünf Minuten im Mörser in deionisiertem Wasser gemahlen (2 g in 10 ml) und die resultierende Flüssigkeit im Experiment verwendet.
Klassifizierung des erosiven Potenzials
Die chemischen Analysen (pH, Pufferkapazität, titrierbare Säure, Fluorid-, Kalzium- und Phosphat-Konzentrationen) entsprachen denen aus einer 2012 publizierten Untersuchung [Lussi et al., 2012a]. Der Grad der Über- respektive Untersättigung bezüglich Hydroxylapatit (HAP) wurde mit einem Computerprogramm berechnet [Lussi et al., 2012a].
Damit die Tabellen schnell einen Überblick über das erosive Potenzial der verschiedenen Produkte geben, wurden sie in drei Gruppen eingeteilt. Ein Produkt wurde als nicht erosiv klassifiziert (Grad 0: ein Pfeil seitwärts ), sofern nach zwei Minuten eine Härtezunahme oder eine Härteabnahme von bis zu zwei Prozent beobachtet wurde. So wird der wichtigen Funktion des Speichels Rechnung getragen, der eine Anhebung des pH-Wertes bewirkt, die hier nicht simuliert werden konnte. Als erosiv (Grad 1: ein Pfeil nach unten ) wurden jene Produkte bezeichnet, die nach zwei Minuten bis zu 15 Prozent Härteverlust zeigten. Eine Härteabnahme von mehr als 15 Prozent nach zwei Minuten wurde als deutlich erosiv (Grad 2: zwei Pfeile nach unten ) klassifiziert. Einschränkend muss angemerkt werden, dass diese Einteilung die vielen anderen Faktoren nicht berücksichtigt, die – wie oben schon beschrieben – für eine Gesamtbeurteilung der Erosivität einbezogen werden müssen.
Ergebnisse
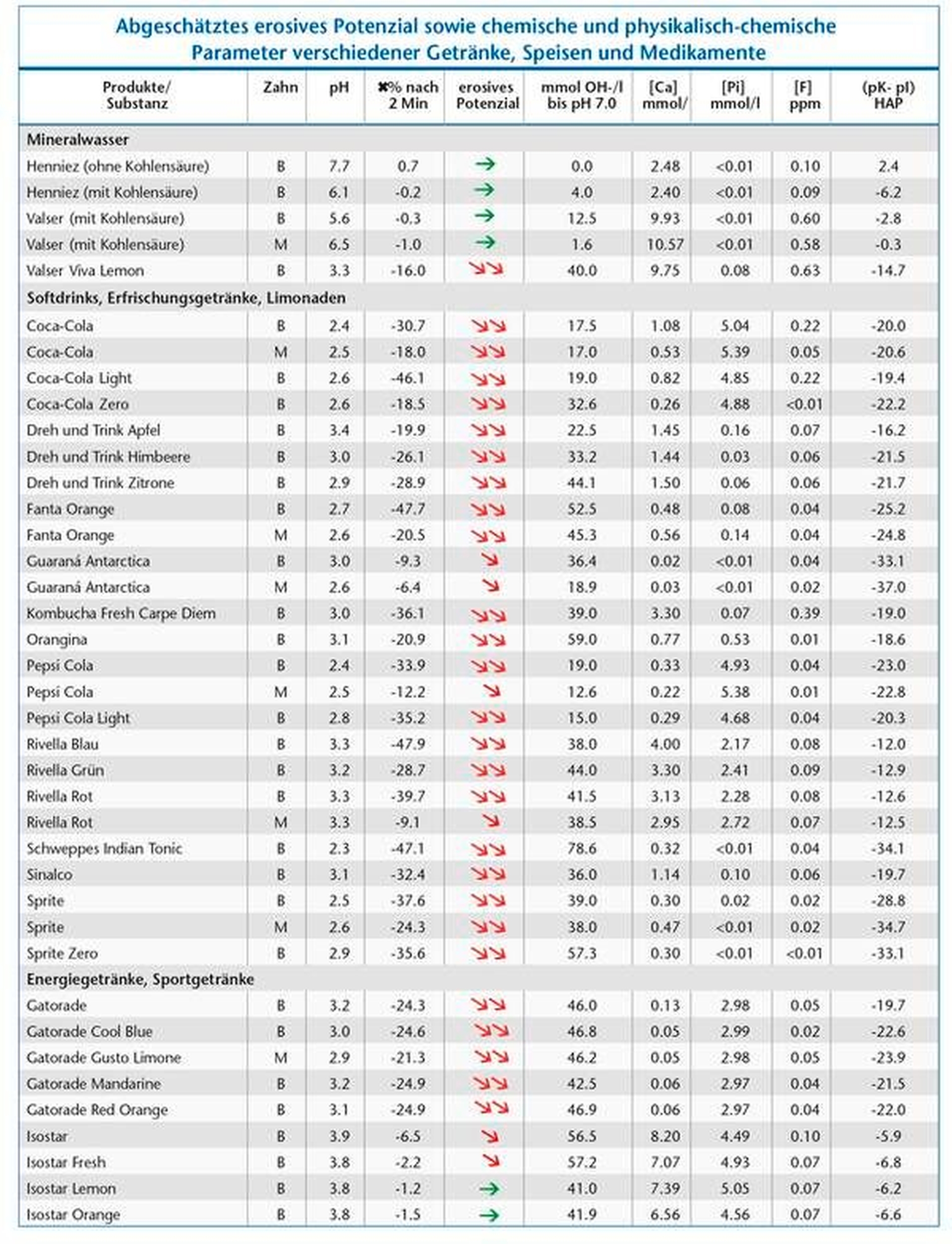
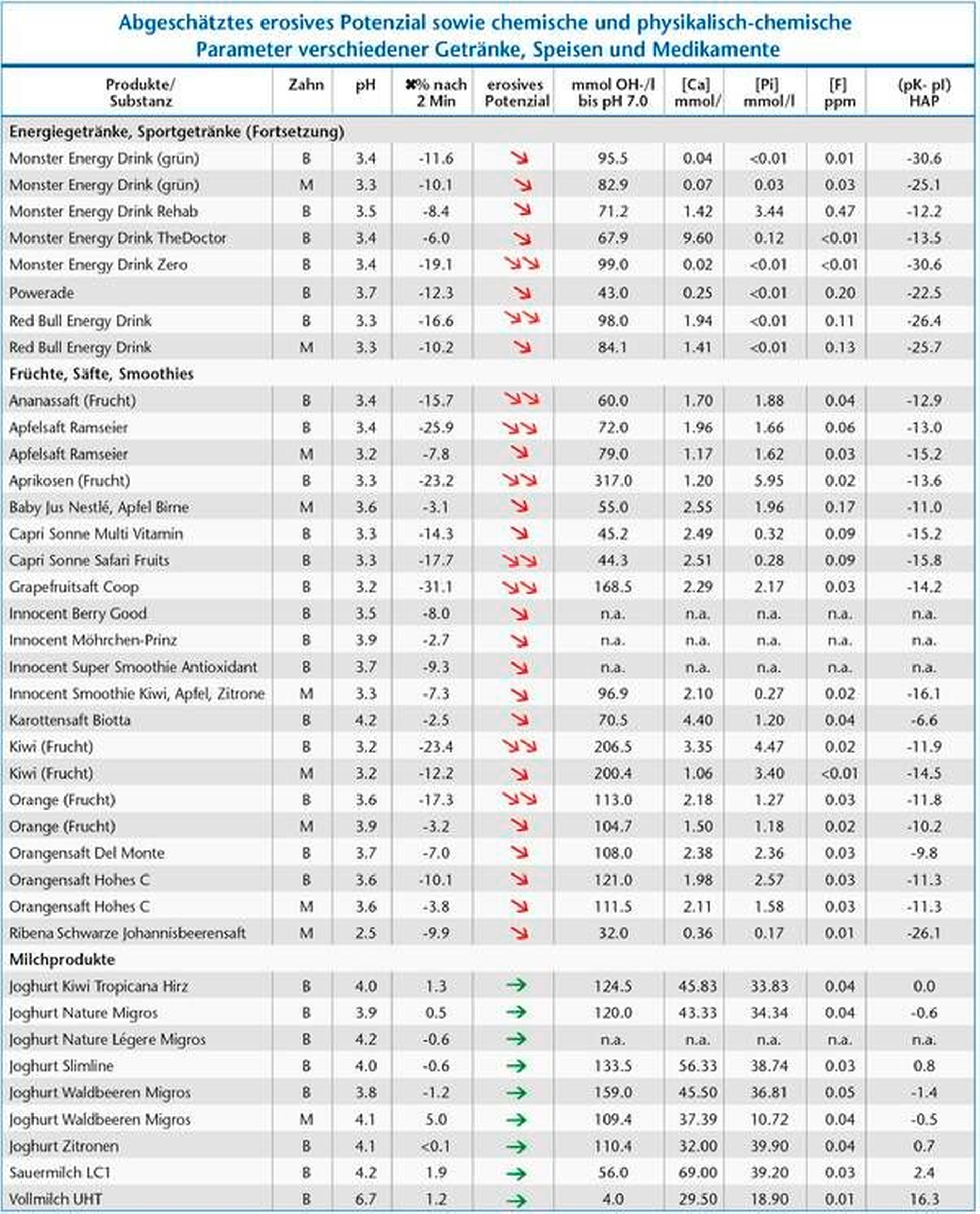
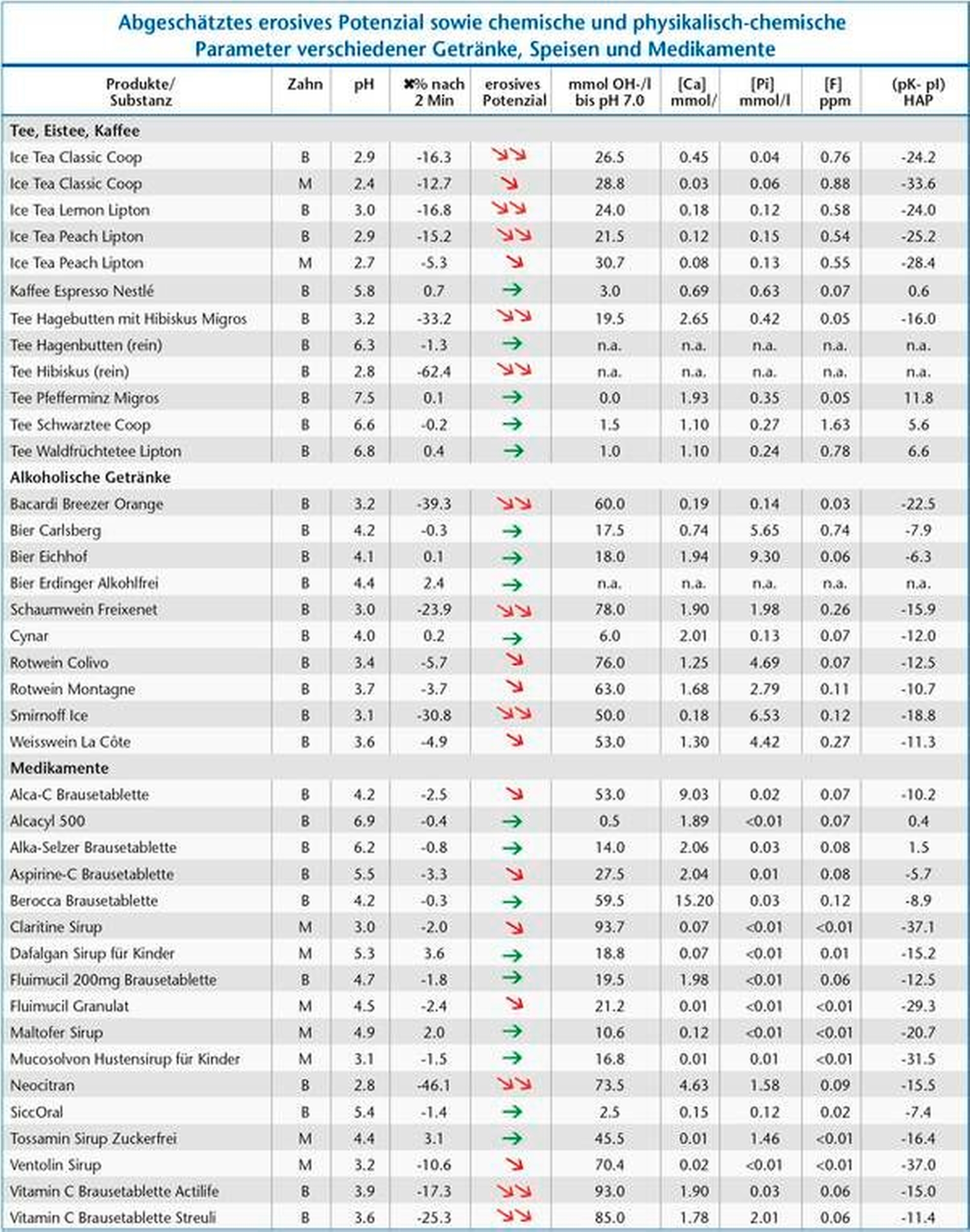
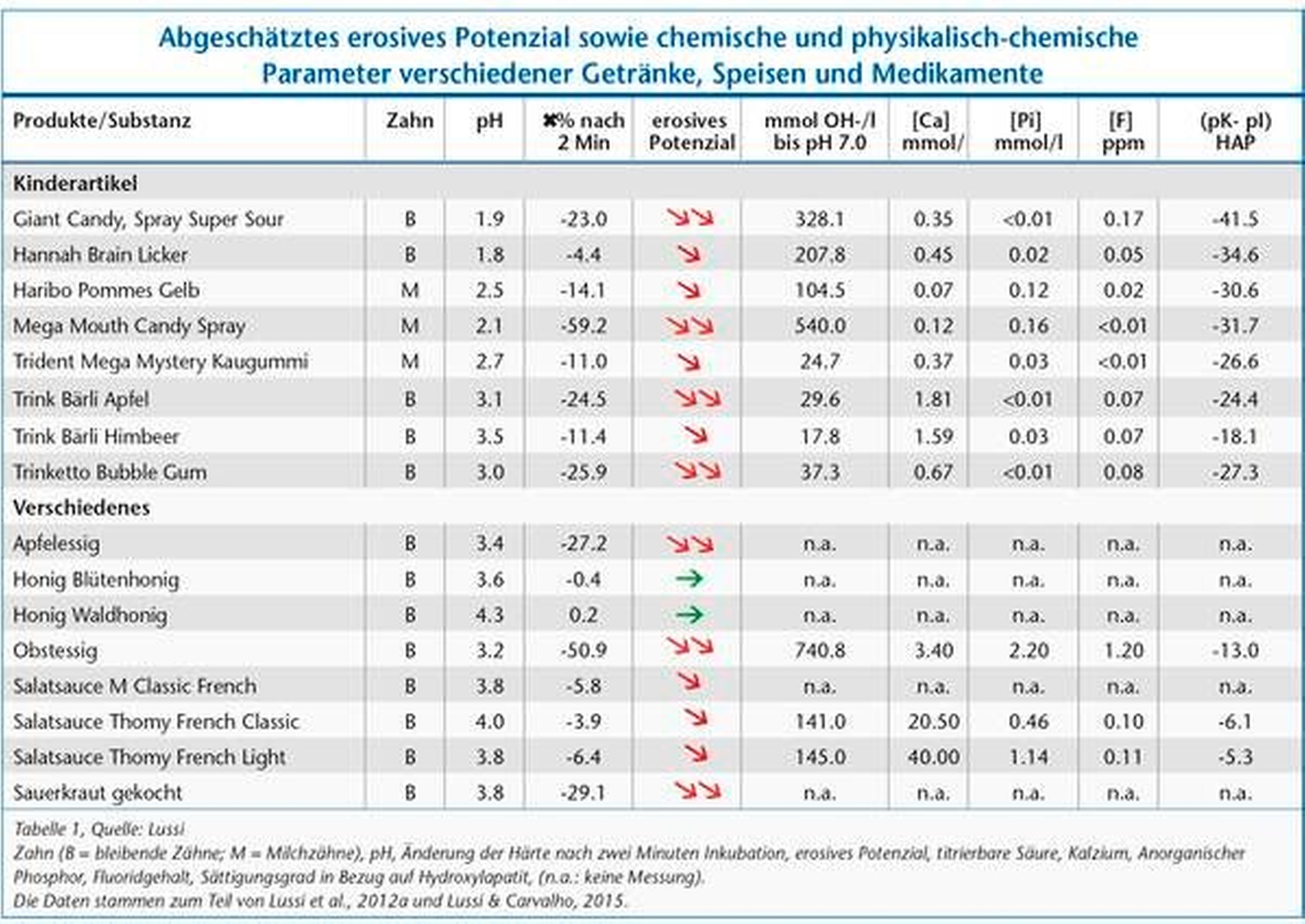
Tabelle 1 zeigt das abgeschätzte erosive Potenzial sowie chemische und physikalisch-chemische Parameter verschiedener Getränke, Speisen und Medikamente.
Diskussion
Die Entstehung von Zahnerosionen wird oftmals fälschlicherweise nur einem niedrigen pH-Wert von konsumierten Getränken und Speisen zugeschrieben. Diese Fehleinschätzung ist bedingt durch die allgemein bekannten kritischen pH-Werte von Karies in Schmelz und Dentin. Im Unterschied zur Karies, bei der es einen definierten kritischen pH-Wert von 5,3 bis 5,5 für Schmelz gibt, kann man dem Auftreten von Zahnerosionen aber keinen definierten pH-Wert zuordnen [Lussi et al., 2012a]. Der kritische pH-Wert ist definiert als derjenige, bei dem sich die Zahnhartsubstanz im chemischen Gleichgewicht mit der sie umgebenden Flüssigkeit befindet. Bei diesem pH-Wert ist die Flüssigkeit bezüglich des Zahnes gesättigt und es kommt insgesamt weder zu einer Auflösung des Zahnes noch zur Bildung neuer Kristalle. Dieser kritische pH-Wert berechnet sich aus den Konzentrationen (eigentlich den Aktivitäten) der gelösten Stoffe in der Flüssigkeit. Bei Karies ist diese Flüssigkeit die „Plaque-Flüssigkeit“, die individuell immer etwa gleich zusammengesetzt ist, also immer die gleichen Konzentrationen an gelösten Stoffen enthält. Deshalb gibt es bei Karies einen kritischen pH-Wert, der immer etwa gleich bleibt.
Im Fall von Zahnerosionen enthalten die den Zahn umgebenden Flüssigkeiten aber unterschiedlichste Konzentrationen an gelösten Stoffen, weshalb kein bestimmter kritischer pH-Wert definiert werden kann. Der entscheidende Faktor, ob es zur Demineralisation kommt, ist also insgesamt nicht der pH-Wert selbst, sondern der Sättigungsgrad an gelösten Stoffen in der mit den Zähnen in Kontakt tretenden Flüssigkeit beim jeweiligen pH-Wert. Ist der Gehalt an bestimmten gelösten Stoffen in der Flüssigkeit zu klein, ist diese untersättigt und es wird ein Gleichgewicht angestrebt, wobei es zur Demineralisierung der Zahnhartsubstanz kommt. Dieser Prozess schreitet so lange voran, bis das Gleichgewicht erreicht und die Flüssigkeit gesättigt ist. Ist der Gehalt an denselben gelösten Stoffen in der Flüssigkeit jedoch groß, ist diese bereits gesättigt oder gar übersättigt, kommt es nie zu einer Demineralisierung. Ob eine Flüssigkeit bezüglich der Zahnhartsubstanz gesättigt ist oder nicht, wird insbesondere durch den Kalziumgehalt und – in kleinerem Maße – durch den Gehalt an Phosphat und Fluorid der Getränke und Speisen beim jeweiligen pH-Wert bestimmt. Bei einem niedrigen pH-Wert ist es daher möglich, dass hohe Konzentrationen dieser Stoffe einer Erosion entgegenwirken, da die Flüssigkeit dadurch bezüglich der Zahnhartsubstanz ge- oder sogar übersättigt ist. Fehlen diese Stoffe jedoch oder sind nur geringe Konzentrationen davon vorhanden, kann es andererseits bereits bei einem höheren pH-Wert zur erosiven Demineralisation der Zahnhartsubstanz kommen, da die Flüssigkeit dann bezüglich der Zahnhartsubstanz untersättigt ist [Shellis et al., 2014].
Den Einfluss des Sättigungsgrades von Mineralien wie Kalzium, Phosphat und Fluorid in Speisen und Getränken auf die Zahnhartsubstanz macht man sich in der Prophylaxe zunutze. So kann beispielsweise das hohe erosive Potenzial von Orangensaft (pH-Wert von circa 4, Tabelle) durch Zugabe von Kalzium aufgehoben werden [Hughes et al., 1999; Wegehaupt et al., 2011]. Joghurt andererseits, der naturgemäß mit einem niedrigen pH-Wert versehen ist, weist aufgrund seines hohen Kalzium- und Phosphatgehalts kein erosives Potenzial auf (Tabelle). Das erosive Potenzial von Salatsaucen oder Fruchtsalat kann durch die Beimischung von Joghurt minimiert werden.
Weitere ernährungsseitige Faktoren, die die Erosion beeinflussen
Alle getesteten Biere (pH-Wert zwischen 4,1 und 4,4) sind sauer, rufen aber keine Erosionen hervor. Cynar, ein italienischer Likör, weist ebenfalls einen tiefen pH-Wert von 4 auf, verursacht aber keine erosive Veränderung der Zahnhartsubstanz. Beide zuletzt genannten Getränke haben weder einen hohen Kalzium- noch einen hohen Phosphatgehalt. Es müssen also andere Faktoren, höchstwahrscheinlich Proteine, eine wichtige schützende Wirkung aufweisen, indem sie zum Beispiel die Pellikel modifizieren.
Eine Fluoridanreicherung von Speisen und Getränken zur Vermeidung von Zahnerosionen erscheint hingegen aufgrund der möglichen Nebenwirkungen von Fluorid bei der für einen Schutz benötigten hohen Konzentration als nicht sinnvoll [Lussi et al., 2019]. Die Verdünnung mit Wasser reduziert die H+-Konzentration und damit das erosive Potenzial.
Neben dem Sättigungsgrad gibt es noch weitere die Erosion beeinflussende Faktoren. Besitzt eine Substanz beispielsweise eine hohe Pufferkapazität, dauert es länger, bis sie durch den Speichel neutralisiert werden kann [Shellis et al., 2013]. Die Adhäsionseigenschaften beeinflussen die Erosivität insofern, als dass stärker adhärierende Substanzen eine längere Kontaktzeit an den Zähnen haben und dadurch länger erosiv wirken können. Mehrere Untersuchungen [Jager et al., 2012; Aykut-Yetkiner et al., 2013; Aykut-Yetkiner et al., 2014] zeigen, dass eine hohe Viskosität schützend wirkt, weil der Nachschub von H+-Ionen an der Grenzfläche zum Zahn beeinträchtigt ist (siehe Tabelle, zum Beispiel Hannah Brain Licker, ein süß-saurer Zungenroller zum Lutschen). Diese Eigenschaft muss in Zusammenhang mit anderen die Erosion fördernden Parametern wie dem pH-Wert oder der Pufferkapazität gesehen werden [Carvalho et al., 2017]. Auch die Temperatur von Getränken und Speisen muss beachtet werden, da sie sowohl einen Einfluss auf den Sättigungsgrad als auch generell auf die chemische Reaktionsgeschwindigkeit hat, was bei höheren Temperaturen zu einer schnelleren erosiven Auflösung der Zähne führen kann [West et al., 2000; Eisenburger und Addy, 2003; Barbour et al., 2006].
Ebenfalls nicht zu unterschätzen ist die Kontaktzeit der erosionsfördernden Substanz mit der Zahnoberfläche sowie die Trinkweise (schluckweise versus in einem Zug) und die generelle Anfälligkeit auf Erosionen. Der Unterschied in der Anfälligkeit auf erosiven Zahnhartsubstanzverlust kann nach unseren Untersuchungen eine genetische Komponente aufweisen [Alaraudanjoki et al., 2019], aber auch mit der Speichelzusammensetzung (zum Beispiel Proteingehalt) zusammenhängen. Beispielsweise ist die genaue Zusammensetzung von Mineralionen und Proteinen im Speichel entscheidend für den Schutz vor Erosionen [Baumann et al., 2016], außerdem wurden klare Unterschiede des Erosionsschutzes zwischen Kinder- und Erwachsenenspeichel gezeigt [Carvalho et al., 2016a]. In einer weiteren Studie erreichte bei Patienten ohne Erosionen der pH-Wert an den Zahnoberflächen drei bis fünf Minuten nach dem Konsum von Orangensaft wieder unbedenkliche Werte, während bei Patienten mit Erosionen dies erst nach fünf bis sieben Minuten der Fall war [Lussi et al., 2012b]. In dieser Untersuchung haben alle Probanden unter Aufsicht auf die gleiche Art und Weise getrunken und es bestanden keine wesentlichen Unterschiede in den gemessenen Speichelparametern (Fließrate, Pufferkapazität bis pH 7). Das Proteom und der Proteingehalt wurden leider nicht gemessen. Diese Arbeit zeigt auch, dass Spülen nach Konsum von Saurem ein gutes Mittel ist, um den pH-Wert auf der Zahnoberfläche zu erhöhen. Eine übersättigte Substanz kann, wie oben erwähnt, nie Erosionen verursachen, deutlich untersättigte immer. Substanzen wie beispielsweise Joghurt mit Waldbeeren (Tabelle 1), die nur leicht untersättigt sind, verursachen klinisch keine messbare Erosion, da sie an der Grenze zur Zahnoberfläche durch den lokalen Demineralisationsprozess neutralisiert und mit Kalzium vom Zahn lokal angereichert werden. Dies ist beim Umspülen der Zähne mit erosiven Getränken nicht der Fall. Insofern kann auch erklärt werden, warum bestimmte Trinkgewohnheiten, wie zum Beispiel das Umspülen der Zähne, erosionsfördernd sind [Johansson et al., 2004; Attin et al., 2013].
Patientenseitige Faktoren, die die Erosion beeinflussen
Neben den erwähnten Faktoren auf der Ernährungsseite sind Faktoren auf der Patientenseite im Entstehungsprozess der Zahnerosion von Bedeutung (Abbildung 1). Ess- und Trinkgewohnheiten, die Zusammensetzung des Speichels, dessen Fließrate und Pufferkapazität, die Pellikelbildung sowie eine diese Faktoren beeinflussende Medikamenteneinnahme sind im Zusammenhang mit Zahnerosionen wichtig. Medikamente können entweder durch ihren niedrigen pH-Wert direkt erosionsauslösend sein, oder auch indirekt durch ihre nicht immer gewollte Wirkung auf die Speichelfließrate und Zusammensetzung. Zu erwähnen sind insbesondere Beruhigungsmittel, Antiemetika, Antihistaminika und Anti-Parkinson-Medikamente [Lussi et al., 2012a] sowie Brausetabletten mit niedrigem pH-Wert [Wegehaupt et al., 2016]. Andererseits gibt es auch saure Brausetabletten (Berocca, siehe Tabelle), die wegen ihres hohen Kalziumgehalts keine Erosionen verursachen.
Anamnestisch manchmal schwierig, aber für die Diagnostik wichtig, ist auch die Abklärung bezüglich eines möglichen Alkoholmissbrauchs, der häufig mit Reflux vergesellschaftet ist. Weitere zu beachtende Einflüsse sind ein vorhandener gastro-ösophagealer Reflux sowie psychische Erkrankungen wie Bulimie und Anorexie [Lussi et al., 2009].
Man sollte beachten, dass Patienten mit schon vorhandenen erosiv-abrasiven Zahnhartsubstanzdefekten anfälliger für weitere Erosionsprozesse sind [Carvalho et al., 2016b]. Dies gilt auch für Kinder, denn schon vorhandene erosiv-abrasive Veränderungen auf den Milchzähnen sind ein guter Indikator für diese Zahnhartsubstanzdefekte an bleibenden Zähnen [Ganß et al., 2001; Harding et al., 2010]. Wie üblich sollte auch hier frühzeitig eine individuell professionelle Beratung stattfinden und nach einer für die jeweiligen Patienten optimierten Prophylaxemöglichkeit gesucht werden. Hilfreich für eine systematische Analyse ist die Abklärung der in der Abbildung 1 dargestellten Einflussfaktoren.
Zusammenfassung
Zahnerosionen weisen eine steigende Prävalenz auf. Irreversible Zerstörungen und eine voranschreitende Progression können die Lebensqualität betroffener Personen beeinflussen und Restaurationen erforderlich werden lassen. Frühprophylaxe ist daher wichtig. In die Patientenberatung eingebunden werden sollten daher Informationen über die Erosivität verschiedener Getränke und Speisen – und damit die Rolle des Patienten bei der Entstehung der Erosionen.
Im erosiven Potenzial der getesteten Substanzen bestehen beträchtliche Unterschiede. So gibt es saure Produkte, die keine Erosionen verursachen, und solche mit einem höheren pH-Wert, die ein größeres erosives Potenzial aufweisen. Die Erosivität der aufgeführten Substanzen stellt nur einen Faktor in einem multifaktoriellen Geschehen dar. Aus diesem Grund sind die hier präsentierten Tabellen lediglich ein Hilfsmittel auf dem manchmal schwierigen Weg zu einer korrekten Diagnose.
Prof. em. Dr. med. dent. Adrian Lussi
Universität Bern, Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin
Freiburgstr. 7, 3010 Bern
Tel. 079 272 80 71
adrian.lussi@zmk.unibe.ch
Samira H. João-Souza
Brigitte Megert
Thiago S. Carvalho
Tommy Baumann
Universität Bern, Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin
Freiburgstr. 7, 3010 Bern
Diese Arbeit ist auch im Swiss Dental Journal (SDJ) der Schweizerischen Zahnärztegesellschaft, Bern (SSO), erschienen, Swiss Dent J. 2019 Jun 17;129(6):479–487.
Prof. em. Dr. med. dent. Adrian Lussi
1974–1979: Studium an der Abteilung für Chemie der ETH Zürich, Diplom in Chemie, Patent als Gymnasiallehrer
1978–1983: Studium der Zahnmedizin an den Universitäten Zürich und Bern, Staatsexamen
1984–1986: Zahnarzt an der Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin, Universität Bern
1987–1993: Oberarzt an der Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin, Universität Bern
1995: Abteilungsleiter an der Klinik für Zahnerhaltung
2006: Ordentlicher Professor und Direktor der Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin
2011–2015: Geschäftsführender Direktor der zmk bern
2015–2017: Stellvertretender Geschäftsführender Direktor der zmk bern
seit 2017: Teilpensum in Lehre und Forschung an der Klinik für Zahnerhaltung, Präventiv- und Kinderzahnmedizin
Literaturliste
Alaraudanjoki V K, Koivisto S, Pesonen P, Mannikko M, Leinonen J, Tjaderhane L, Laitala M L, Lussi A, Anttonen V A (2019): Genome-Wide Association Study of Erosive Tooth Wear in a Finnish Cohort, in: Caries Res, 53, 1, 49-59.
Attin T, Becker K, Wiegand A, Taubock T T, Wegehaupt F J (2013): Impact of laminar flow velocity of different acids on enamel calcium loss, in: Clin Oral Investig, 17, 2, 595-600.
Aykut-Yetkiner A, Wiegand A, Bollhalder A, Becker K, Attin T (2013): Effect of acidic solution viscosity on enamel erosion, in: J Dent Res, 92, 3, 289-294.
Aykut-Yetkiner A, Wiegand A, Ronay V, Attin R, Becker K, Attin T (2014): In vitro evaluation of the erosive potential of viscosity-modified soft acidic drinks on enamel, in: Clin Oral Investig, 18, 3, 769-773.
Barbour M E, Finke M, Parker D M, Hughes J A, Allen G C, Addy M (2006): The relationship between enamel softening and erosion caused by soft drinks at a range of temperatures, in: J Dent, 34, 3, 207-213.
Bartlett D W, Lussi A, West N X, Bouchard P, Sanz M, Bourgeois D (2013): Prevalence of tooth wear on buccal and lingual surfaces and possible risk factors in young European adults, in: J Dent, 41, 11, 1007-1013.
Baumann T, Kozik J, Lussi A, Carvalho T S (2016): Erosion protection conferred by whole human saliva, dialysed saliva, and artificial saliva, in: Sci Rep, 6, 34760.
Carvalho T S, Lussi A, Jaeggi T, Gambon D L (2014): Erosive tooth wear in children, in: Monogr Oral Sci, 25, 262-278.
Carvalho T S, Baumann T, Lussi A (2016a): In vitro salivary pellicles from adults and children have different protective effects against erosion, in: Clin Oral Investig, 20, 8, 1973-1979.
Carvalho T S, Baumann T, Lussi A (2016b): Does erosion progress differently on teeth already presenting clinical signs of erosive tooth wear than on sound teeth? An in vitro pilot trial, in: BMC Oral Health, 17, 1, 14.
Carvalho T S, Schmid T M, Baumann T, Lussi A (2017): Erosive effect of different dietary substances on deciduous and permanent teeth, in: Clin Oral Investig, 21, 5, 1519-1526.
Eisenburger M, Addy M (2003): Influence of liquid temperature and flow rate on enamel erosion and surface softening, in: J Oral Rehabil, 30, 11, 1076-1080.
Ganss C, Klimek J, Giese K (2001): Dental erosion in children and adolescents--a cross-sectional and longitudinal investigation using study models, in: Community Dent Oral Epidemiol, 29, 4, 264-271.
Harding M A, Whelton H P, Shirodaria S C, O'Mullane D M, Cronin M S (2010): Is tooth wear in the primary dentition predictive of tooth wear in the permanent dentition? Report from a longitudinal study, in: Community Dent Health, 27, 1, 41-45.
Hughes J A, West N X, Parker D M, Newcombe R G, Addy M (1999): Development and evaluation of a low erosive blackcurrant juice drink. 3. Final drink and concentrate, formulae comparisons in situ and overview of the concept, in: J Dent, 27, 5, 345-350.
Jager D H, Vieira A M, Ruben J L, Huysmans M C (2012): Estimated erosive potential depends on exposure time, in: J Dent, 40, 12, 1103-1108.
Johansson A K, Lingstrom P, Imfeld T, Birkhed D (2004): Influence of drinking method on tooth-surface pH in relation to dental erosion, in: Eur J Oral Sci, 112, 6, 484-489.
Lussi A, Schaffner M, Jaeggi T, Grüninger A (2005): Erosionen. Befund – Diagnose – Risikofaktoren – Prävention – Therapie, in: Schweiz Monatsschr Zahnmed, 115, 10, 3-31.
Lussi A, Hellwig E, Ganss C, Jaeggi T (2009): Buonocore Memorial Lecture. Dental erosion, in: Oper Dent, 34, 3, 251-262.
Lussi A, Megert B, Shellis R P, Wang X (2012a): Analysis of the erosive effect of different dietary substances and medications, in: Br J Nutr, 107, 2, 252-262.
Lussi A, von Salis-Marincek M, Ganss C, Hellwig E, Cheaib Z, Jaeggi T (2012b): Clinical study monitoring the pH on tooth surfaces in patients with and without erosion, in: Caries Res, 46, 6, 507-512.
Lussi A, Carvalho T S (2014): Erosive tooth wear: a multifactorial condition of growing concern and increasing knowledge, in: Monogr Oral Sci, 25, 1-15.
Lussi A, Lussi J, Carvalho T S, Cvikl B (2014): Toothbrushing after an erosive attack: will waiting avoid tooth wear?, in: Eur J Oral Sci, 122, 5, 353-359.
Lussi A, Carvalho T S (2015): Analyses of the Erosive Effect of Dietary Substances and Medications on Deciduous Teeth, in: PLoS One, 10, 12, e0143957.
Lussi A, Buzalaf M A R, Duangthip D, Anttonen V, Ganss C, Joao-Souza S H, Baumann T, Carvalho T S (2019): The use of fluoride for the prevention of dental erosion and erosive tooth wear in children and adolescents, in: Eur Arch Paediatr Dent,
O'Toole S, Bernabe E, Moazzez R, Bartlett D (2017): Timing of dietary acid intake and erosive tooth wear: A case-control study, in: J Dent, 56, 99-104.
Pindborg J J (1970): Pathology of the Dental Hard Tissues, Copenhagen.
Schlueter N, Tveit A B (2014): Prevalence of erosive tooth wear in risk groups, in: Monogr Oral Sci, 25, 74-98.
Schlueter N, Luka B (2018): Erosive tooth wear - a review on global prevalence and on its prevalence in risk groups, in: Br Dent J, 224, 5, 364-370.
Shellis R P, Ganss C, Ren Y, Zero D T, Lussi A (2011): Methodology and models in erosion research: discussion and conclusions, in: Caries Res, 45 Suppl 1, 69-77.
Shellis R P, Barbour M E, Jesani A, Lussi A (2013): Effects of buffering properties and undissociated acid concentration on dissolution of dental enamel in relation to pH and acid type, in: Caries Res, 47, 6, 601-611.
Shellis R P, Featherstone J D, Lussi A (2014): Understanding the chemistry of dental erosion, in: Monogr Oral Sci, 25, 163-179.
Steiger-Ronay V, Tektas S, Attin T, Lussi A, Becker K, Wiedemeier D B, Beyeler B, Carvalho T S (2018): Comparison of Profilometric and Microindentation Analyses for Determining the Impact of Saliva on the Abrasion of Initially Eroded Enamel, in: Caries Res, 53, 1, 33-40.
Wegehaupt F, Gunthart N, Sener B, Attin T (2011): Prevention of erosive/abrasive enamel wear due to orange juice modified with dietary supplements, in: Oral Dis, 17, 5, 508-514.
Wegehaupt F J, Lunghi N, Hogger V M, Attin T (2016): Erosive potential of vitamin and vitamin+mineral effervescent tablets, in: Swiss Dent J, 126, 5, 457-465.
West N X, Hughes J A, Addy M (2000): Erosion of dentine and enamel in vitro by dietary acids: the effect of temperature, acid character, concentration and exposure time, in: J Oral Rehabil, 27, 10, 875-880.