Zahnärztliche Pharmakotherapie in der Schwangerschaft
Knapp 800.000 Kinder wurden 2021 in Deutschland geboren [Statistisches Bundesamt, 2023]. Damit ist die Behandlung schwangerer Patientinnen in allgemeinzahnärztlichen Praxen zwar kein tägliches, aber doch ein wiederkehrend herausforderndes Ereignis. Aufgrund zahlreicher Informationsquellen sind nicht wenige schwangere Patientinnen heute „überinformiert“ und begegnen vielen ärztlichen und zahnärztlichen Behandlungen eher mit Skepsis. Dies gilt insbesondere für jede Art der Arzneimitteltherapie. Umso wichtiger ist es, eine (zahn)medizinisch notwendige Pharmakotherapie auf der Basis gesicherter Daten und Fakten durchzuführen. Ein solides pharmakologisches Hintergrundwissen ermöglicht erst die sachorientierte Zahnarzt-Patienten-Kommunikation und erlaubt der Patientin letztlich die gleichberechtigte Mitsprache bei der Therapieentscheidung im Sinne eines „shared decision making“ [Ernst et al., 2014].
Obwohl laut einer kürzlich publizierten französischen Studie etwa 90 Prozent aller Schwangeren Arzneimittel verschrieben werden [Berard et al., 2019], verursacht dieses Thema sowohl in der Ärzteschaft als auch bei den Patientinnen Unsicherheit und Unbehagen [Cengiz 2007; Brauer et al., 2017]. Immerhin gibt es für die meisten Indikationen ausreichend erprobte Arzneimittel. Einschränkend ist zu erwähnen, dass für Schwangere aus ethischen Gründen keine randomisierten Studien vorliegen. Gleichwohl steigt die Zahl von Studien bei Schwangeren unter Medikation [Endicott und Haas, 2012]. Die Erkenntnisse zu Arzneimitteln in der Schwangerschaft haben in den vergangenen Jahrzehnten zwar ständig zugenommen, sind aber für die grundsätzliche Beurteilung der Sicherheit vieler Medikamente immer noch unzureichend. Somit ist ein „off label use“ in diesem Bereich relativ häufig [Kayser und Schäfer, 2017]. In einer Studie von Fisk und Atun wurde ermittelt, dass sich bis 2007 weltweit nur 17 Medikamente für werdende Mütter in der Entwicklung befanden [Fisk und Atun, 2008].
Neben der Möglichkeit, den behandelnden Gynäkologen zu kontaktieren, stehen den Zahnärzten außer Fachbüchern [Mörike et al., 2021; Schäfer et al., 2015] mittlerweile auch viele kostenlose und frei zugängliche internetbasierte Datenbanken zur Verfügung, die seriöse Informationsquellen darstellen. In erster Linie ist hier die von der Berliner Charité betriebene Webseite www.embryotox.de (im Folgenden: Embryotox) zu nennen, die auch zahnmedizinisch relevante Arzneimittel farbkodiert nach ihrer Sicherheit in der Schwangerschaft einordnet. Zusätzlich sind die Daten in einer App verfügbar. Inzwischen hat sich Embryotox zum größten europäischen Referenzzentrum für Arzneimitteltherapiesicherheit in der Schwangerschaft entwickelt [Dathe und Schäfer, 2019].
Medikationsrisiken in der Schwangerschaft
Prinzipiell ist eine Schwangerschaft ein normaler und physiologischer Zustand, in dem keiner Patientin eine (zahn)ärztliche oder medikamentöse Therapie vorenthalten werden sollte, die sie benötigt [Giglio et al., 2009; Ouanounou und Haas, 2016]. Jedoch sollte wegen der potenziellen Gefahren jede Medikamentengabe bei Schwangeren einer strengen Indikationsprüfung unterliegen [Kiefer et al., 2019]. Es muss davon ausgegangen werden, dass fast alle Medikamente, die in der Schwangerschaft eingenommen werden, über die Plazenta auch den Embryo beziehungsweise Fetus erreichen [Schindler et al., 2010]. Die Plazenta stellt im Prinzip keine Schranke dar [Balogh, 2010].
Durch den Contergan-Skandal (Wirkstoff Thalidomid — ein Schlafmittel) wurde in den 1960er-Jahren in erschreckender Weise belegt, dass auch scheinbar harmlose Medikamente teratogen wirken können, das heißt von exogen die intrauterine Entwicklung beeinflussen, so dass Fehlbildungen oder bleibende funktionelle Anomalien des Kindes entstehen können [Paulus, 2011]. Im Hinblick auf Arzneimittelrisiken in der Schwangerschaft müssen die bekannten Hintergrundrisiken angesprochen werden: 2,6 Prozent aller Feten/Neugeborenen weisen eine sogenannte grobstrukturelle („große“) Fehlbildung auf [European platform on rare disease registration, 2023]. Aber nur ein kleiner Teil (zwei bis vier Prozent) aller angeborenen Fehlbildungen kann eindeutig einer chemischen oder physikalischen Ursache zugeschrieben werden, wozu auch die Einnahme von Medikamenten in der Schwangerschaft gehört [Rösch und Steinbicker, 2003].
Die Empfindlichkeit des menschlichen Embryos/Fetus auf Noxen hängt sehr stark vom kindlichen Entwicklungsstadium ab. Üblicherweise werden folgende Abschnitte unterschieden [Paulus, 2011] (Abbildung 1):
1. Präimplantationsphase: Die ersten sechs Tage nach der Befruchtung, während derer die menschliche Anlage durch die Tuba uterina transportiert und nicht direkt von Substanzen im mütterlichen Blut erreicht wird, sind durch das „Alles-oder-nichts“-Prinzip gekennzeichnet, das heißt erfolgte Schäden werden entweder repariert oder die Frucht wird abgestoßen.
Das Fehlbildungsrisiko ist in diesem Stadium extrem gering, jedoch können Medikamente gegebenenfalls auf die Nidation (Einnistung) und die Plazentation (Ausbildung der frühen Plazenta) Einfluss nehmen und Störungen im mittleren und im letzten Trimenon bewirken.2. Embryonalzeit (2. Woche bis 10. Woche nach der Befruchtung): In dieser Phase der Organogenese ist die Sensibilität gegenüber exogenen Noxen am größten und es werden die meisten Fehlbildungen und Aborte ausgelöst.
3. Fetalperiode (ab 11. Woche nach der Befruchtung oder 13. Woche nach der letzten Menstruation): In dieser Zeit nimmt die Empfindlichkeit der Frucht gegenüber exogenen Noxen langsam ab. Schwerwiegende Funktionsstörungen der kindlichen Gewebe sind trotzdem möglich (zum Beispiel Störung der Dentition und des Knochenwachstums beim Einsatz von Tetrazyklinen [Rendle-Short, 1962]).
Arzneimittelbedingte Schäden in der Frühphase der Schwangerschaft sind weder für die Patientin noch für den behandelnden Zahnarzt vorhersehbar. Somit gilt weiterhin die Sichtweise erfahrener Gynäkologen: Eine Frau im reproduktionsfähigen Alter ohne Einnahme von Antikonzeptiva ist immer potenziell schwanger [Balogh, 2010].
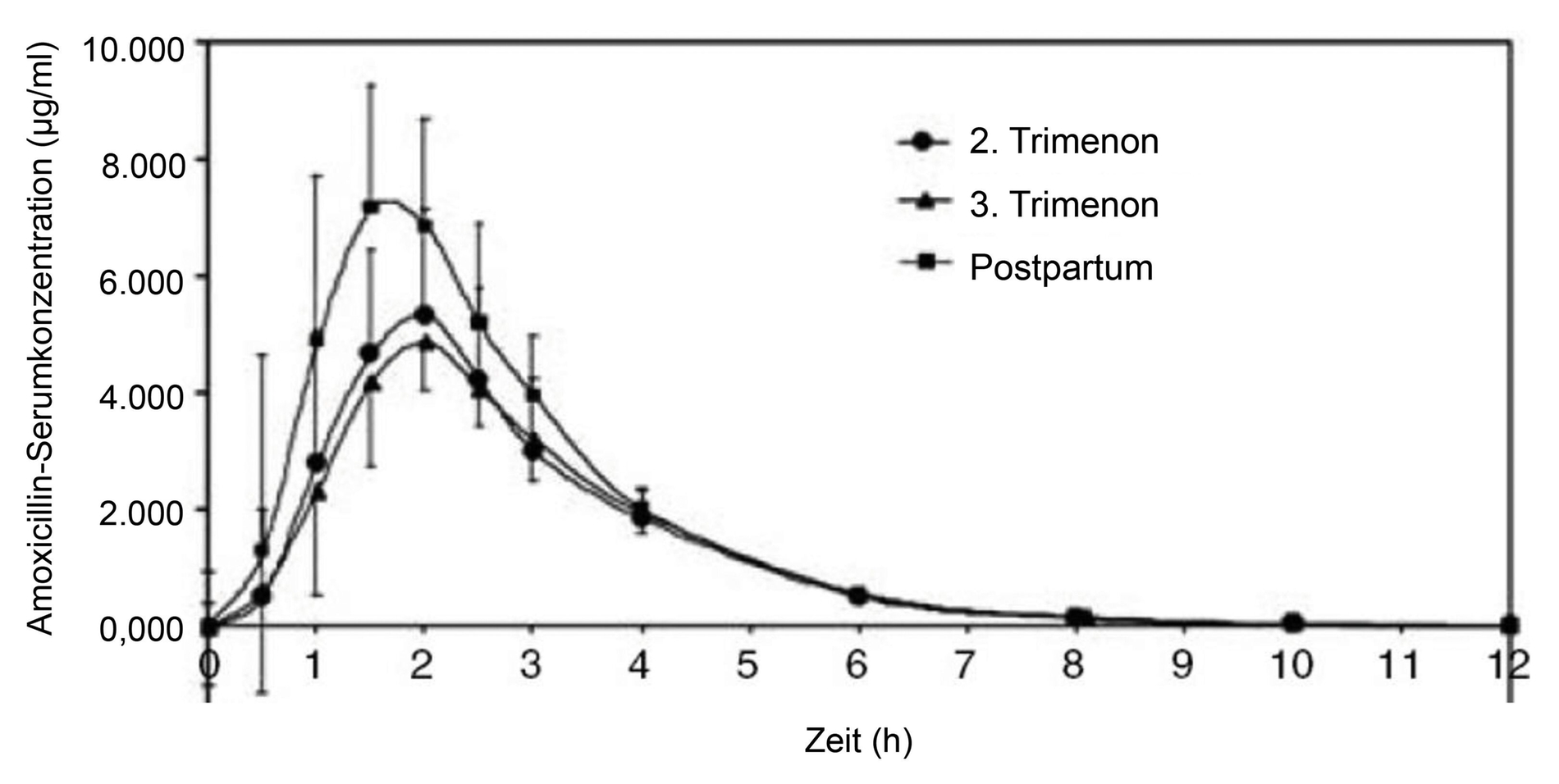
Die gravierendsten Veränderungen des mütterlichen Organismus betreffen das Herz-Kreislauf-System und die Niere und werden damit auch für den Zahnarzt relevant. Die Blutmenge steigt im Verlauf der Schwangerschaft an und das Herz vergrößert sich. Herzschlagvolumen sowie Puls nehmen zu und lassen die Herzleistung ab der 11. SSW (Schwangerschaftswoche) um mehr als 50 Prozent steigen [Giglio et al., 2009]. Diese kardiovaskulären Anpassungsvorgänge bedingen eine veränderte Pharmakokinetik: Durch die steigende Blutmenge, den erhöhten Kapillardruck und den um bis zu 35 Prozent höheren Wasseranteil im Körper werden hydrophile Medikamente (zum Beispiel Amoxicillin) schneller im Gewebe verteilt und damit verdünnt. Dieser Effekt wird durch die Erhöhung des renalen Blutflusses und der glomerulären Filtrationsrate um circa 50 Prozent noch erhöht [Andrew et al., 2007; Hebert, 2013; Nauheimer, 2012] (Abbildung 2).
Um die passende Plasmakonzentration bei einer erhöhten Clearance zu erreichen, sind damit vor allem in der Spätschwangerschaft Unterdosierungen zu vermeiden, indem Korrekturen der Dosis oder des Dosisintervalls vorgenommen werden [Constantine, 2014; Mylonas et al., 2011].
Im Gegensatz dazu sollten Medikamente, die sich an Plasmaproteine binden und dadurch pharmakologisch inaktiv werden (zum Beispiel Lokalanästhetika), durch die reduzierte Konzentration von Serumalbumin und anderer wirkstoffbindender Proteine bei den Patientinnen in geringerer Dosis eingesetzt werden [Constantine, 2014; Oanounou und Haas, 2016].
Antibiotika
Neben chromosomalen Anomalien und immunologischen Erkrankungen gehören Infektionen besonders in der Frühschwangerschaft zu den häufigsten Gründen für Fehlgeburten [Mylonas, 2011]. Bei Schwangeren stellt eine Infektion im Kiefer- und Gesichtsbereich stets eine ernst zu nehmende Situation dar, die adäquat behandelt werden muss. In einem aktuellen Review zu schweren odontogenen Infektionen und deren Verlauf wurden 69 Fälle mit einem Durchschnittsalter der Patientinnen von knapp 28 Jahren eingehend analysiert [Pucci et al., 2021] (Tabelle 1).
Vor dem Hintergrund dieser Daten ist die wahrscheinlich beste Strategie die rechtzeitige zahnärztliche Behandlung und eine korrekte Antibiotikatherapie. Viele sichere Antibiotika können während der Schwangerschaft nach dem Beginn des zweiten Trimesters angewendet werden, wobei Betalaktamantibiotika „first-line“ Antibiotika darstellen [Mylonas 2011]. Die meisten Daten liegen zu Penicillinen und Cephalosporinen der ersten und zweiten Generation (Cefaclor, Cefalexin, Cefuroxim) vor [Kiefer et al., 2019]. Es konnten keine embryotoxischen Wirkungen festgestellt werden und auch die Kombination mit Betalaktamaseinhibitoren (zum Beispiel Amoxicillin und Clavulansäure) ist in der Schwangerschaft unbedenklich [Meyer-Wübbold und Günay, 2021]. Speziell für Amoxicillin und Cephalosporine wurde in einer Fall-Kontroll-Studie kein erhöhtes Abortrisiko in der Frühschwangerschaft festgestellt [Muanda et al., 2017a].
Bei den Makroliden ergibt sich ein inhomogeneres Bild. Während die Arzneimittelkommission Zahnärzte (AKZ) 2010 vom Einsatz von Makroliden bei Schwangeren abriet [Schindler et al., 2010], wird in der jüngsten Veröffentlichung der AKZ die zahnärztliche Anwendung von Makroliden nur bei strenger Indikationsstellung und unter sorgfältiger Nutzen/Risiko-Abwägung empfohlen [Arzneimittelkommission Zahnärzte, 2022]. Hingegen wird in einem Kompendium der Kassenärztlichen Vereinigung Baden-Württemberg darauf verwiesen, dass „Makrolid-Antibiotika […] in der Schwangerschaft gegeben werden [können]“ [KVBW, 2018].
Auch in der aktuellen internationalen Literatur sind die Ergebnisse widersprüchlich. Während sich in großen nationalen Kohortenstudien aus Israel mit über 100.000 Schwangeren und jüngst aus Dänemark mit knapp 1,2 Millionen Schwangeren bei Patientinnen mit Makrolidbehandlungen kein erhöhtes kindliches Missbildungsrisiko zeigte [Andersson et al., 2021; Dinur et al., 2013], wurden in einer englischen Studie bei Makroliden gegenüber Penicillin in der Frühschwangerschaft erhöhte Raten an kardiovaskulären Fehlbildungen und insgesamt vermehrt genitale Fehlbildungen beobachtet. Die Autoren empfehlen, alternative Antibiotika zu verordnen, bis weitere Studienergebnisse vorliegen [Fan et al., 2020]. Somit sollten Makrolide zumindest bei Patientinnen mit nachgewiesener Penicillinallergie als eine der wenigen möglichen Alternativen angesehen werden [Kiefer et al., 2019].
In einer großen kanadischen. populationsbezogenen Kohortenstudie fand sich für das Lincosamid Clindamycin ein erhöhtes Risiko für muskuloskelettale Fehlbildungen und ventrikuläre beziehungsweise atriale Septumdefekte [Muanda et al., 2017b]. Es wird empfohlen, Clindamycin nur zu benutzen, wenn Penicilline, Cephalosporine und Makrolide zur Infektionsbekämpfung (zum Beispiel Anaerobier-Infektionen) nicht ausreichen und die Indikation sehr streng zu stellen ist [Mylonas, 2011; Schindler et al., 2010]. Die Datenlage zu Clindamycin in der Schwangerschaft ist allerdings insgesamt recht spärlich [Meyer-Wübbold et al., 2020].
Die Gabe von Tetracyclinen ist in der Schwangerschaft absolut kontraindiziert, da es zu einer irreversiblen Einlagerung von Chelatkomplexen aus Tetracyclinen und Calcium in Knochen und Zähne kommen kann [Pertl, 2000]. Pasten, die in der Endodontie angewendet werden (zum Beispiel Ledermix®, Riemser Greifswald), enthalten Wirkstoffe aus der Gruppe der Tetracycline und Kortikosteroide. Sie stellen aufgrund der systemischen Resorption zumindest ein potenzielles Risiko für den Fetus dar [Ibing und Schäfer, 2022; Patcas et al., 2013].
Bei Metronidazol, einem Antibiotikum mit breitem Wirkspektrum im anaeroben Bereich, hat sich die Einschätzung gewandelt. Während einige Autoren in älteren Publikationen die Anwendung in der Schwangerschaft sehr kritisch sehen [Balogh, 2010; Pertl et al., 2000], ergaben sich in einem aktuellen Review keine Hinweise auf Fehlgeburten oder fetale Fehlbildungen bei pränataler Metronidazolgabe [Aliabadi et al., 2022]. Laut Embryotox kann Metronidazol bei kritisch geprüfter Indikation in der gesamten Schwangerschaft eingesetzt werden.
Zusammenfassend besteht Konsens, dass eine unbehandelte mütterliche odontogene Infektion ein größeres Risiko für den Fetus darstellt als eine gezielte antibiotische Therapie mit dem passenden Präparat [Giglio et al., 2009; Ouanou und Haas, 2016; Patcas et al., 2012]. Allerdings sollte die Schwangere darauf hingewiesen werden, dass jede Antibiotikagabe in der Schwangerschaft die Vaginalflora beeinflussen und die Besiedlung mit Lactobacteriacea schwächen oder verändern kann. Da daraus gegebenenfalls ein Frühgeburtsrisiko resultiert, sollte die Schwangere ihren Frauenarzt über eine Antibiotikatherapie informieren, damit bei einer pH-Verschiebung gegengesteuert werden kann [Stokholm et al., 2014].
Analgetika
Auch werdende Mütter leiden gelegentlich unter behandlungsbedürftigen Schmerzen im Kiefer- und Gesichtsbereich. Starke, unbehandelte Schmerzen können ungünstige Wirkungen auf das ungeborene Kind haben. Durch Schmerz verengte Blutgefäße können zu einer verminderten Blut- und Sauerstoffversorgung des Kindes führen [Leopoldt, 2019]. Wenn der Schmerz andauert oder zu stark ist und mit nicht-medikamentösen Methoden keine ausreichende Linderung erreicht werden kann, sollten geeignete Arzneimittel in einer ausreichend hohen Dosierung angewendet werden.
Wie die meisten anderen Medikamente ist auch Paracetamol plazentagängig. Nach heutigem Wissen erhöht Paracetamol laut der Embryotox-Datenbank das Fehlbildungsrisiko nicht. Paracetamol als Monotherapie gilt demnach auch für die Frühschwangerschaft als sicher. Im Gegensatz zu Ibuprofen wirkt dieses jedoch nicht antiphlogistisch. Verschiedenste Studien (vor allem Kohortenstudien) haben in den vergangenen Jahren eine Assoziation zwischen einer Paracetamoleinnahme während der Schwangerschaft und verschiedenen Entwicklungsstörungen beim Kind (zum Beispiel ADHS, Autismus, Schlafprobleme, Sprachentwicklungsstörungen) angedeutet [Alemany, 2021; Bauer, 2021; Sznajder et al., 2022]. Dabei handelt es sich in einigen Studien oft nur um schwach signifikante Assoziationen. Eine Kausalbeziehung zur Paracetamol-Exposition kann derzeit daraus nicht abgeleitet werden. Auch die Datenbank Embryotox verweist auf die lange Erfahrung, die kein erhöhtes Risiko für Fehlbildungen annehmen lässt. Paracetamol sollte in der Schwangerschaft auf jeden Fall in der geringsten wirksamen Dosis und so kurz wie möglich eingenommen werden. Allerdings ist auch bekannt, dass die Einzelhöchstdosis von 1.000 mg Paracetamol oft nicht für die gewünschte Analgesie ausreicht. Von einer Dosiserhöhung ist wegen der steigenden Lebertoxizität abzuraten [Yoon et al., 2016]. Zu bedenken ist ferner, dass es insbesondere im dritten Trimenon keine medikamentösen Alternativen gibt – außer den Opioiden, die sehr starken Schmerzen vorbehalten sind.
Die NSAR (nichtsteroidale Antirheumatika) wie Ibuprofen, Acetylsalicylsäure (ASS) und Diclofenac sind im ersten und im zweiten Trimenon in bestimmungsgemäßer Anwendung über einen begrenzten Zeitraum offenbar sicher; es gibt keine Hinweise auf Teratogenität [Ouanounou und Haas, 2016]. Diclofenac wirkt im Vergleich zu Ibuprofen in vergleichbarer Dosierung stärker analgetisch, wird bei Zahnschmerzen aber seltener eingesetzt. Besser erprobt ist jedoch Ibuprofen. Bei gelegentlicher Einnahme oder kurzfristiger Therapie ist laut Embryotox jedoch auch Diclofenac akzeptabel. Im dritten Trimenon nach der 28. SSW sind die NSAR allerdings kontraindiziert, da sie aufgrund der Prostaglandin-Synthesehemmung zu einem frühzeitigen Verschluss beziehungsweise einer Verengung des Ductus arteriosus Botalli mit pulmonaler Hypertonie führen [Mayrhofer et al., 2021; Nauheimer, 2021]. Je reifer der Fetus ist, desto größer ist die Wahrscheinlichkeit eines vorzeitigen Verschlusses unter NSAR-Therapie. Eine Einnahme im letzten Schwangerschaftsdrittel kann zudem fetale Nierenfunktionsstörungen hervorrufen beziehungsweise bis in die Neonatalphase nachwirkend zu Oligurie oder Anurie führen [Black et al., 2019]. Ein weiterer Grund, NSAR zum Ende der Schwangerschaft zu meiden, ist das erhöhte Risiko einer Frühgeburt [Li et al, 2003].
ASS wird in subanalgetischer Dosierung von 100-150 mg/Tag prophylaktisch und therapeutisch bei spezifischen schwangerschaftsassoziierten und -komplizierenden Erkrankungen (zum Beispiel Risiko für eine Präeklampsie) während der gesamten Schwangerschaft eingesetzt [Rolnik et al., 2017]. In analgetischer Dosierung (≥ 500 mg) kann ASS unter strenger Indikationsstellung in den ersten beiden Trimena zur Anwendung kommen [Mayrhofer et al., 2021; Schindler et al., 2010]. Zusätzlich zum Risiko eines vorzeitigen Verschlusses des Ductus arteriosus und einer Wehen-hemmenden Wirkung im letzten Schwangerschaftsdrittel kann der mütterliche Blutverlust durch die Thrombozyten-Aggregations-Hemmung bei der Geburt nach ASS-Einnahme erhöht sein [Black et al., 2019; Meyer-Wübbold et al., 2020; Schindler et al., 2010]. Für die selektiven Cyclooxygenase-2(COX-2)-Inhibitoren („Coxibe“) sind die Erfahrungen in der Schwangerschaft unzureichend. Sie sollen daher nicht verwendet werden.
Erst Ende März 2019 ist vom Bundesinstitut für Arzneimittel (BfArM) ein Durchführungsbeschluss der europäischen Kommission zur Änderung der Fach- und Gebrauchsinformationen Metamizol-haltiger Arzneimittel (zum Beispiel Novalgin®) umgesetzt worden [BfArM, 2019]. Unter anderem wurden die Anwendungsempfehlungen für Schwangere und Stillende angepasst. Da es bislang keine Hinweise gibt, dass eine Anwendung von Metamizol in der Frühschwangerschaft problematisch ist, sind Einzelgaben innerhalb der ersten sechs Schwangerschaftsmonate unter Vorbehalt akzeptabel, sofern andere Schmerzmittel nicht eingenommen werden können. Aufgrund der Prostaglandinsynthesehemmung kann die Anwendung von Metamizol im dritten Trimenon wie bei den NSAR zu einem frühzeitigen Verschluss des Ductus arteriosus führen. Daher darf der Wirkstoff im letzten Trimenon ebenfalls nicht eingesetzt werden [Mayrhofer et al., 2021].
Bei sehr starken Schmerzen wie etwa nach einer ausgedehnten Osteotomie oder einem Unfall ist eine Anwendung von Opioiden vertretbar. Derzeit gibt es keine Hinweise auf ein erhöhtes Fehlbildungsrisiko. Opioide, wie zum Beispiel Tramadol, können prinzipiell in allen Phasen der Schwangerschaft eingesetzt werden [Wunsch et al., 2003]. Allerdings sollte die Verordnung nur nach strenger Indikationsstellung erfolgen [Schindler et al., 2010]. Zu beachten ist, dass bei Neugeborenen, deren Mütter über längere Zeit vor der Entbindung Codein eingenommen haben, Opioid-Entzugssymptome und neonatale Atemdepression auftreten können [Balogh, 2010; Schindler et al., 2010]. In Tabelle 2 sind alle wesentlichen Aspekte der zahnärztlichen Analgetikatherapie bei Schwangeren zusammengefasst.
Zahnärztliche Analgetikatherapie bei Schwangeren | ||||
|---|---|---|---|---|
Wirkstoff | 1. Trimenon | 2. Trimenon | 3. Trimenon | Bemerkungen |
Ibuprofen | +++ | +++ | - | sicheres Analgetikum / Antiphlogistikum im ersten und zweiten Trimenon |
Paracetamol | +++ | +++ | +++ | sicheres Analgetikum / Antipyretikum während der gesamten Schwangerschaft |
Acetylsalicylsäure | + | + | - | nur in Einzeldosen im ersten und zweiten Trimenon akzeptabel |
Metamizol | + | + | - | Reserve-Analgetikum, insbesondere bei krampfartigen Schmerzen |
Diclofenac | ++ | ++ | - | starkes und sicheres Analgetikum / Antiphlogistikum im ersten und zweiten Trimenon |
Coxibe(z. B. Celecoxib, Etoricoxib) | - | - | - | kaum Erfahrungswerte |
Opioide (Codein oder Tramadol) | ++ | ++ | ++ | bei strenger Indikationsstellung; Atemdepression und Entzugserscheinungen beim Neugeborenen möglich |
Tab. 2: Handlungsempfehlungen für die zahnärztliche Analgetikatherapie bei schwangeren Patientinnen (Erklärung der Symbole: +++: unproblematisch; ++: Anwendung akzeptabel; +: kurzfristige Anwendung/Einzelgaben akzeptabel; -: kontraindiziert), Quelle: Frank Halling |
Lokalanästhetika
Ist eine Anästhesie für eine Behandlung einer schwangeren Patientin notwendig, sollte — wenn möglich — immer auf ein regionales Verfahren zurückgegriffen werden, um eine systemische Gabe von Medikamenten zu vermeiden und das erhöhte Aspirationsrisiko im Zuge einer Vollnarkose während einer Schwangerschaft zu reduzieren [Mayrhofer et al., 2021]. Nach Malamed sind Lokalanästhetika aufgrund ihrer Omnipräsenz die wichtigsten Wirkstoffe in der Zahnmedizin [Malamed, 2006]. Im Allgemeinen sind die direkten Auswirkungen von Lokalanästhetika auf das ungeborene Kind, auch in höheren Konzentrationen, minimal [Turner und Aziz, 2002]. Negative Auswirkungen auf die Neurophysiologie des Neugeborenen oder teratogene Schäden sind bisher nicht beobachtet worden.
Lokalanästhetika weisen eine unterschiedliche Lipophilie und Proteinbindung auf (Tabelle 3). Eine Plazentapassage in den fetalen Kreislauf ist leicht möglich [Schäfer und Peters, 2015]. Das Risiko eines zu raschen Übergangs auf den Fetus ist bei Wirkstoffen mit hoher Plasma-Eiweiß-Bindung geringer als bei solchen mit geringerer Proteinbindung [Pertl et al., 2000]. Da die Plasma-Eiweiß-Bindung bei Feten gegenüber Erwachsenen zusätzlich um etwa 50 Prozent reduziert ist, kann der gesteigerte Anteil des aktiven, ungebundenen Wirkstoffs beim Fetus leichter zu Intoxikationen führen [Daubländer und Kämmerer, 2011]. Dieser Effekt tritt vor allem bei einer fetalen Azidose (zum Beispiel bei eingeschränkter utero-plazentarer Perfusion) auf und kann dann aufgrund der reduzierten Rückverteilung des Lokalanästhetikums zur Kumulation führen und kardiotoxische Nebenwirkungen beim ungeborenen Kind auslösen [Nauheimer, 2012]. Von allen zahnärztlichen Lokalanästhetika hat Articain mit 94 Prozent die höchste Plasma-Eiweiß-Bindung und stellt damit eine sehr sichere Substanz in der Schwangerschaft dar (Tabelle 3).
Charakteristika der wichtigsten zahnärztlichen Lokalanästhetika | |||||
|---|---|---|---|---|---|
Substanz | Relative Wirksamkeit | Relative Toxizität | Proteinbindung (%) | Verteilungskoeffizient | Eliminationshalbwertszeit (min) |
Erläuterung | hoch = geringe fetale Konzentration | gering = geringe Toxizität | kurz = geringe Toxizität | ||
Procain | 1 | 1 | 5,8 | 2,0 | 5 |
Mepivacain | 4 | 2 | 78 | 19,3 | 114 |
Lidocain | 4 | 2 | 77 | 46,4 | 96 |
Bupivacain | 16 | 8 | 95 | 28 | 162 |
Articain | 5 | 1,5 | 94 | 17 | 20 |
Tab. 3: Charakteristika der wichtigsten zahnärztlichen Lokalanästhetika, Quelle: Frank Halling |
Die Wirksamkeit von Lokalanästhetika wird auch maßgeblich durch die Lipidlöslichkeit beeinflusst. Je größer die Lipophilie, desto eher findet eine Anreicherung in den entsprechenden kindlichen Geweben (zum Beispiel Gehirn) statt. Als Maß für die Lipophilie lässt sich der Verteilungskoeffizient verwenden. Hierbei zeigt sich, dass Articain, Mepivacain und Bupivacian gegenüber Lidocain deutlich geringere Verteilungskoeffizienten aufweisen (Tabelle 3). Somit kann bei Articain durch eine hohe Proteinbindung und eine geringere Lipidlöslichkeit eine hohe Sicherheit für den Fetus erwartet werden. Durch die geringe Eliminationshalbwertszeit von circa 20 Minuten wird es im Vergleich zu anderen Lokalanästhetika sehr schnell metabolisiert [Oertel et al., 1997]. Der fetale Blutspiegel liegt bei etwa 25 bis 30 Prozent der mütterlichen Werte [Strasser et al., 1977]. Die vergleichbaren Werte betragen für Lidocain etwa 50 Prozent und für Mepivacain sogar 70 Prozent [Nau, 1985]. In diesem Zusammenhang weist auch Embryotox darauf hin, dass Articain gegenüber Lidocain die besser geeignete Alternative bei der Anwendung in der Schwangerschaft darstellt und auch Mepivacain nur angewendet werden sollte, wenn andere Lokalanästhetika nicht infrage kommen. Aufgrund von Berichten über ausgeprägte kindliche Methämoglobinbildung sollte laut Embryotox Prilocain im Rahmen der Lokalanästhesie vermieden werden [Erol et al., 2017].
Bei Adrenalin (Epinephrin), das weltweit am häufigsten als vasokonstriktorischer Zusatz verwendet wird [Halling et al., 2021], sollte auf eine möglichst geringe Konzentration (maximal 1:200.000) geachtet werden. Dies gilt vor allem im ersten Trimenon, da hier eine erhöhte exogene Adrenalinzufuhr das Risiko für Uteruskontraktionen und Abort birgt [Daubländer und Kämmerer, 2011; Schindler et al., 2010]. Auf die unbedingte Notwendigkeit, intravasale Injektionen durch eine sorgfältige Aspiration zu vermeiden, weisen verschiedene Autoren hin [Gilglio et al., 2009; Ouanounou und Haas, 2016; Schindler et al. 2010]. Das gilt insbesondere für Patientinnen, die an Herz-Kreislauf-Problemen oder einem Schwangerschaftsdiabetes leiden. Die geringen Adrenalinkonzentrationen bei zahnärztlichen Behandlungen reichen aber im Allgemeinen nicht aus, um den utero-plazentaren Blutfluss wesentlich zu beeinflussen [Turner und Aziz, 2002]. Andere vasokonstringierende Zusätze wie Noradrenalin oder Oktapressin sind in der Schwangerschaft kontraindiziert.
Fazit
Für fast alle Erkrankungen in der Schwangerschaft gibt es hinreichend untersuchte Arzneimittel. Allerdings ermöglichen die Hinweise in den Produktinformationen meist keine ausreichende Risikobewertung bei der medikamentösen Therapieplanung. Vor dem Hintergrund der überschaubaren Studienlage und den verfügbaren Erfahrungen sind die Analgetika Paracetamol beziehungsweise Ibuprofen (im ersten und im zweiten Trimenon) sowie die Aminopenicilline sichere zahnärztliche Medikamente. Für die Lokalanästhesie ist Articain mit einem möglichst geringen Adrenalinzusatz besonders geeignet. Bei allen Medikationsfragen bietet die Datenbank Embryotox eine gute und schnelle Hilfestellung.
Literaturliste
Aliabadi, T., E. A. Saberi, et al. (2022). Antibiotic use in endodontic treatment during pregnancy: A narrative review. Eur J Transl Myol 32(4):10813. Doi: 10.4081/ejtm.2022.10813
Alemany, S., C. Avella-García, et al. (2021). Prenatal and postnatal exposure to acetaminophen in relation to autism spectrum and attention-deficit and hyperactivity symptoms in childhood: Meta-analysis in six European population-based cohorts. Eur J Epidemiol 36(10): 993-1004. Doi: 10.1007/s10654-021-00754-4
Andersson N. W., R. H. Olsen, et al. (2021) Association between use of macrolides in pregnancy and risk of major birth defects: nationwide, register based cohort study. BMJ 372:n107. Doi: 10.1136/bmj.n107.
Andrew, M. A., T. R. Easterling, et al. (2007). Amoxicillin pharmacokinetics in pregnant women: modeling and simulations of dosage strategies. Clin Pharmacol Ther 81(4): 547-556.
Arzneimittelkommission Zahnärzte (2022). Informationen Zahnärztliche Arzneimittel (IZA). www.bzaek.de/fuer-zahnaerzte/arzneimittelkommission/information-zahnaerztliche-arzneimittel-iza.html. (Zugriff 9.2.2023)
Balogh, A. Arzneimittel in der Schwangerschaft. In: A. Balogh und E. Haen (Hrsg.): Klinische Pharmakologie in der zahnärztlichen Praxis. Stuttgart, Wissenschaftliche Verlagsgesellschaft, 2010.
Bauer, A. Z., S. H. Swan, et al. (2021). Paracetamol use during pregnancy - a call for precautionary action. Nat Rev Endocrinol 17(12):757-766. Doi: 10.1038/s41574-021-00553-7.
Bérard, A., F. Abbas-Chorfa, et al. (2019). The French pregnancy cohort: medication use during pregnancy in the French population. PLoS One 14(7): e0219095. Doi: 10.1371/journal.pone.0219095.
Black, R. E., K. E. Khor, et al. (2019) Use and pain management in pregnangcy: a critical review. PainPract 19(8):875–899.
Brauer, H. U., G. Manegold-Brauer, et al. (2017). Zahnärztliche Medikation während der Schwangerschaft und Stillzeit. Quintessenz 68 (7): 815-822.
Bundesinstitut für Arzneimittel (BfArm) (2019). Metamizol: Uneinheitliche Angaben zu Dosierung und Kontraindikationen. www.bfarm.de/SharedDocs/Risikoinformationen/Pharmakovigilanz/DE/RV_STP/m-r/metamizol (Zugriff am 10.2.2023).
Cengiz, S. B. (2007). The pregnant patient. Considerations for dental management and drug use. Quintessence Int 38: 133-142.
Constantine, M. M. (2014). Physiologic and pharmacokinetic changes in pregnancy. Front Pharmacol 5: 1–5.
Dathe, K. und C. Schäfer (2019). The use of medication in pregnancy. Dtsch Arztebl Int 116: 783–90. DOI: 10.3238/arztebl.2019.0783.
Daubländer, M. und P. W. Kämmerer. Lokalanästhesie in der Zahnmedizin. Berlin, Sanofi, 2011.
Dinur B. A., G. Koren, et al. (2013). Fetal safety of macrolides. Antimicrob Agents Chemother 57(7):3307-3311. Doi: 10.1128/AAC.01691-12.
Endicott, S. und D. M. Haas (2012). The current state of therapeutic drug trials in pregnancy. Clin Pharmacol Ther 92(2): 149-150.
Ernst, J., E. Brähler, et al. (2014). Beteiligung von Patienten an medizinischen Entscheidungen - ein Überblick zu Patientenpräferenzen und Einflussfaktoren. Das Gesundheitswesen 76 (4): 187-192.
Erol, S., Z. Arslan, et al. (2017). Transient Methemoglobinemia in three Neonates due to Maternal Pudendal Anesthesia. J Coll Physicians Surg Pak 27(12):783-784.
European platform on rare disease registration (2023). Prevalence per 10 000 births. All anomalies – 2005-2020 – All full registries – include genetic anomalies. htpps://www.eurocat-network.eu/accessprevalencedata/prevalencetables (Zugriff am 6.2.23)
Fan, H., R. Gilbert, et al. (2020). Associations between macrolide antibiotics prescribing during pregnancy and adverse child outcomes in the UK: population based cohort study. BMJ 368: m331. Doi: 10.1136/bmj.m331.
Fisk, N. M. und R. Atun (2008). Market failure and the poverty of new drugs in maternal health. PLoS Med. 5(1): e22. Doi: 10.1371/journal.pmed.0050022.
Giglio, J. A., S. M. Lanni, et al. (2009). Oral health care for the pregnant patient. J Can Dent Assoc. 75(1): 43-48.
Halling, F., A. Neff, et al. (2021). Local anesthetic usage among dentists: German and international data. Anesth Prog 68(1): 19-25. Doi: 10.2344/anpr-67-03-12.
Hebert, M. F. (2013). Impact of pregnancy on pharmacokinetics on medication. J Popul Ther Clin Pharmacol 20(3): e350-e357.
Ibing, M. und Schäfer, E. (2022). Antibiotika in der Endodontie. Zahnärztl Mitt 112(10): 958-965.
Kassenärztliche Vereinigung Baden-Württemberg (2018). Arzneimittel in Schwangerschaft und Stillzeit - Verordnungsforum 32. KVBW (Hrsg.), 3. Aufl. www.kvbawue.de/presse/publikationen/verordnungsforum
Kayser, A. und C. Schäfer (2017). Medikamentöse Therapie bei Schwangerschaft oder Kinderwunsch. Gynäkologische Endokrinologie 15: 53-64.
Kiefer, H., K. Mörike, et al. (2019) Pharmakotherapie in der Schwangerschaft und Stillzeit. MKG-Chirurg 12(3): 164-167.
Leopoldt, D. (2019). Was geht in der Schwangerschaft? DAZ online. https://www.deutsche-apotheker-zeitung.de/daz-az/2019/daz-31-2019/was-geht-in-der-schwangerschaft (Zugriff am 10.2.2023)
Li, D. K., L. Liu, et al. (2003). Exposure to non-steroidal anti-inflammatory drugs during pregnancy and risk of miscarriage: a population based cohort study. BMJ 327: 368.
Malamed, S. F. (2006). Local anesthetics: dentistry’s most important drugs, clinical update. J Calif Dent Assoc 34:971–976.
Mayrhofer, D., W. Jaksch, et al. (2021). Schmerztherapie in der Schwangerschaft: Eine expertInnenbasierte interdisziplinäre Konsensus-Empfehlung, Schmerz 35(6):382-390. Doi: 10.1007/s00482-021-00571-4.
Meyer-Wübbold, K., E. Hellwig, et al. (2021). Zahnärztliche Diagnostik und Therapie schwangerer Patientinnen. Zahnärztl Mitt 110(6): 558-566.
Mörike, K., K. Friese, et al. (2021). Arzneimittel in der Schwangerschaft und Stillzeit. 9. Aufl. Stuttgart, Wissenschaftliche Verlagsgesellschaft, 2021.
Muanda, F. T., O. Sheehy, et al., (2017a). Use of antibiotics during pregnancy and risk of spontaneous abortion. CMAJ 189(17): E625-E633. Doi: 10.1503/cmaj.161020.
Muanda, F. T., O. Sheehy, et al. (2017b). Use of antibiotics during pregnancy and the risk of major congenital malformations: a population based cohort study. Br J Clin Pharmacol 83(11): 2557-2571. Doi: 10.1111/bcp.13364.
Mylonas, I (2011). Antibiotic chemotherapy during pregnancy and lactation period: aspects for consideration. Arch Gynecol Obstet 283(1): 7-18. Doi: 10.1007/s00404-010-1646-3.
Nau, H. (1985). Clinical pharmacokinetics in pregnancy and perinatology. I. Placental transfer and fetal side effects of local anaesthetic agents. Dev Pharmacol Ther 8(3): 149-81. Doi: 10.1159/000457034.
Nauheimer, D. (2012). Medikamente in der Schwangerschaft – Welche Substanzen eignen sich im Akutfall? Lege artis – Das Magazin zur ärztlichen Weiterbildung 2(05): 312 – 319. DOI: 10.1055/s-0032-1330932
Oertel, R., R. Rahn, et al. (1997). Clinical pharmacokinetics of articaine. Clin Pharmacokinet 33(6): 417–425.
Ouanounou, A., D. A. Haas (2016). Drug therapy during pregnancy: implications for dental practice. Br Dent J 220(8): 413-417. Doi: 10.1038/sj.bdj.2016.299.
Patcas, R., P. R. Schmidlin, et al. (2012). Die zahnärztliche Betreuung von Schwangeren. Schweiz Monatschr Zahnmed 122: 729-734.
Paulus, W. E. Pharmakotherapie in der Schwangerschaft. In: M. Wehling (Hrsg.): Klinische Pharmakologie. 2. Aufl. Stuttgart, Georg Thieme Verlag, 2011.
Pertl, C. H., A. Heinemann, et al. (2000). Die schwangere Patientin in zahnärztlicher Behandlung – Umfrageergebnisse und therapeutische Richtlinien. Schweiz Monatschr Zahnmed 110:37 – 41.
Pucci, R., A. Cassoni, et al. (2021). Severe odontogenic infections during pregnancy and related adverse outcomes. Case report and systematic literature review. Trop Med Infect Dis 6(2):106. Doi: 10.3390/tropicalmed6020106.
Rath, W. und K. Friese. Erkrankungen in der Schwangerschaft. Stuttgart, Georg Thieme Verlag, 2005.
Rendle-Short, T. (1962) Tetracycline in teeth and bone. Lancet 279: 1188.
Rösch, C. und V. Steinbicker (2003). Aetiology of congenital malformations-analysis of malformation registry data compared with the Kalter & Warkany-study (Abstract). Reprod Toxicol 17: 503–504.
Schaefer, C., P. Peters, et al. Drugs during pregnancy and lactation. 3rd. Eds. New York, Elsevier, 2015.
Schindler, C., R. Stahlmann, et al. (2010). Zahnärztliche Arzneiverordnung in Schwangerschaft und Stillzeit. Zahnärztl Mitt 100(1): 26-32.
Statistisches Bundesamt: Bevölkerung-Geburten. www.destatis.de/DE/Themen/Gesellschaft-Umwelt/Bevoelkerung/Geburten/_inhalt.html (Zugriff am 6.2.2023)
Strasser, K., A. Huch, et al. (1977). Placenta-Passage von Carticain (Ultracain), einem neuen Lokalanästhetikum. Z Geburtsh Perinat 181: 118-120.
Sznajder, K. K., D. M. Teti, et al. (2022). Maternal use of acetaminophen during pregnancy and neurobehavioral problems in offspring at 3 years: A prospective cohort study. PLoS One 17(9): e0272593. Doi: 10.1371/journal.pone.0272593.
Turner, M. und S. R. Aziz (2002). Management of the pregnant oral and maxillofacial surgery patient. J Oral Maxillofac Surg 60(12): 1479-1488. Doi: 10.1053/joms.2002.36132.
Wunsch, M. J., V. Stanard, et al. (2003). Treatment of pain in pregnancy. Clin J Pain 19:148–155.
Yoon, E., A. Babar, et al. (2016). Acetaminophen-Induced Hepatotoxicity: a Comprehensive Update. J Clin Transl Hepatol 4(2): 131-42. Doi: 10.14218/JCTH.2015.00052.