3-D-gedruckte, biodegradierbare Knochentransplantate für Kieferspaltdefekte
Die Methodik des 3-D-Drucks von patientenindividuellen, defektangepassten Implantaten aus einem biodegradierbaren Kompositmaterial stellt einen neuen wissenschaftlichen Ansatz dar, um die knöcherne Heilung in einem „critical size“, das heißt einem nicht von allein heilenden Knochendefekt, zu fördern.
Ein klinisches Beispiel ist die Kieferspalte, die bei 70 Prozent aller Patienten mit angeborener Lippen-, Kiefer-, Gaumenspalte (LKGS) auftritt. Die LKGS ist mit einer Prävalenz von etwa 1 pro 700 Geburten die häufigste angeborene craniofaziale Anomalie des Menschen [Gundlach und Maus, 2006]. Gegenwärtig wird die Kieferspalte zumeist im Wechselgebiss im Alter von neun bis elf Jahren mit patienteneigenem Knochen aus dem Becken verschlossen (Abbildung 1), ein Eingriff, der als sekundäre Kieferspaltosteoplastik bezeichnet wird.
Ziele der Operation sind die Schaffung eines knöchernen Lagers für den Zahndurchbruch, die Stabilisierung des Alveolar-/Zahnbogens durch eine maxilläre Kontinuität, der Verschluss persistierender oronasaler Fisteln, die Unterstützung der Nasenflügelbasis und die Ermöglichung eines symmetrischen Gesichtswachstums [Horswell und Henderson, 2003].
Die Knochenentnahme an einem zweiten Eingriffsort (wie dem Becken) kann mit Komplikationen verbunden sein [Boehm et al., 2019]. Daher ist die Entwicklung eines alternativen, biodegradierbaren und osteoinduktiven Knochentransplantats klinisch relevant und bedarf der translationalen Forschung durch die interdisziplinäre Kooperation von Klinikern und Materialwissenschaftlern (Abbildung 2). Eine solche existiert beispielsweise zwischen der Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie und dem Zentrum für Translationale Knochen-, Gelenk- und Weichgewebeforschung der Medizinischen Fakultät Carl Gustav Carus der TU Dresden.
Tissue Engineering mit 3-D-Technologie
In der Vergangenheit wurden bereits Ansätze des Tissue Engineering, das heißt einer zellbasierten Therapie, zur Herstellung von Knochentransplantaten für die Kieferspaltosteoplastik evaluiert, wobei die variable Morphologie der Spalten eine Herausforderung für die Gestaltung der Gerüststruktur (Scaffold) darstellt [Pradel und Lauer, 2012; Korn et al., 2014; Korn et al., 2017]. Mit dem 3-D-Druck ist eine Weiterentwicklung des Tissue Engineerings möglich, weil basierend auf dreidimensionalen Bilddatensätzen patienten- und defektspezifische Gerüste gedruckt werden können [Pfister et al., 2004].
In einem ersten Ansatz wurden dafür Scaffolds aus einer in Dresden entwickelten, unter physiologischen Bedingungen druckfähigen Calciumphosphatzementpaste (CPC) hergestellt und in vivo charakterisiert [Korn et al., 2020]. Auf dem Weg in die klinische Anwendung leisten präklinische In-vivo-Studien in geeigneten Modellen einen wichtigen Beitrag und liefern Informationen hinsichtlich der knöchernen Heilung der Defekte. Für die 3-D-gedruckten Konstrukte konnte in einem Kieferspaltmodell in vivo gezeigt werden, dass diese sich zwar sehr einfach inserieren ließen und kaum Materialdislokationen auftraten, aber das Resorptionsverhalten und der Umbau in ortsständigen Knochen einer Verbesserung bedurften. Die Materialresorption ist für die Anwendung im wachsenden Organismus und in Anbetracht des gewünschten Zahndurchbruchs in die vormalige Spalte essenziell.
Ein möglicher Ansatz ist die Verwendung eines am Zentrum für Translationale Knochen-, Gelenk- und Weichgewebeforschung entwickelten neuartigen Kompositmaterials, welches, ähnlich einem Baukasten, an die unterschiedlichsten Anforderungen angepasst werden kann (Abbildung 3). Es basiert auf zwei Grundkomponenten, dem klinisch zugelassenen, pastenartigen Calciumphosphatzement (CPC; INNOTERE GmbH, Radebeul, Deutschland) und einem mesoporösen bioaktiven Glaspulver (MBG). Beide Materialien sind etablierte Knochenersatzmaterialien, in Kombination ergibt sich jedoch ein hochflexibles Materialsystem.
Der pastöse Charakter des CPC ermöglicht es, selbst komplizierteste Defektgeometrien auszufüllen, entweder durch direktes Injizieren in den Knochendefekt oder durch Verwendung von Implantaten, die durch 3-D-Drucktechniken patientenindividuell angefertigt werden. Nachteilig ist die eingeschränkte Resorbierbarkeit des CPCs in vivo. Das mesoporöse bioaktive Glas, ein amorpher Feststoff aus SiO2, CaO und P2O5 mit einer Porengröße von circa zehn Nanometern, wird durch die Bildung von Hydroxylapatitkristallen auf der Oberfläche zunächst ossär integriert und anschließend relativ rasch degradiert. Es unterstützt somit bei der Resorption des eingebrachten Knochentransplantats und fördert dadurch die Geweberegeneration. Zugleich kann es durch seine poröse Struktur als Trägermaterial für Medikamente oder Wachstumsfaktoren dienen, die bei der Degradation der Glasstruktur zielgerichtet im Defekt freigesetzt werden und lokal langanhaltend ihre Wirkung entfalten können.
Dieser innovative Ansatz der 3-D-gedruckten Kompositknochentransplantate wurde erst kürzlich in einer von der Schweizer AO-Foundation geförderten Studie untersucht und in der Fachzeitschrift „Bioactive Materials“ publiziert [Richter et al., 2023]. Für die Arbeit wurde MBG mit einem komplexen Wachstumsfaktorgemisch (HCM) beladen, das aus unter Hypoxie kultivierten mesenchymalen Stammzellen gewonnen wurde.
Hypoxie (Sauerstoffmangel) ahmt den Zustand mangelnder Vaskularisierung und damit mangelnder Sauerstoffversorgung nach. Das veranlasst Zellen entsprechende Botenstoffe mit chemotaktischem und proangiogenem Potenzial zu sezernieren. Nach der Implantation synthetischer Biomaterialkonstrukte liegt ein vergleichbarer Zustand mangelnder Vaskularisierung vor und gefährdet die ordnungsgemäße Resorption und Gewebeneubildung. Die Freisetzung dieser Wirkstoffe fördert hingegen die Bildung neuer Blutgefäße in der Defektregion und unterstützt damit unmittelbar die Bildung und Erhaltung von neuem Knochengewebe. Anhand eines kritischen Kieferspaltdefekts im präklinischen Modell sollte analysiert werden, ob die Verwendung des CPC-MBG-Komposits zu einer verbesserten Implantatresorption führt und zusammen mit dem freigesetzten HCM eine verbesserte Knochenneubildung nach sich zieht (Abbildung 4).
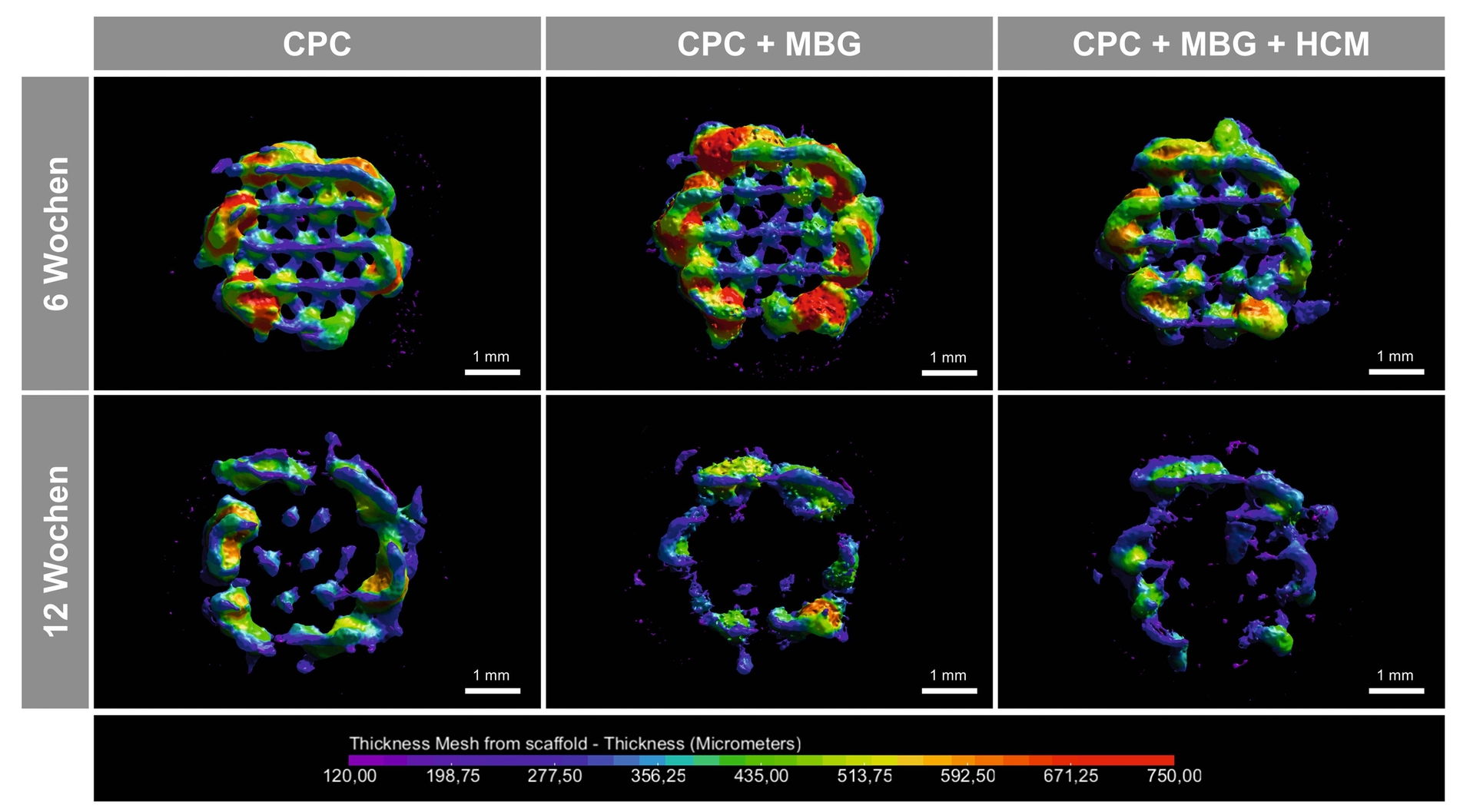
Nach entsprechender Materialcharakterisierung in vitro, zu der beispielsweise Degradations- und mechanische Belastungsversuche gehörten, schloss sich eine präklinische In-vivo-Studie an. Dazu wurde im Oberkiefer von Ratten je ein artifizieller „critical size“-Knochendefekt geschaffen und je ein Scaffold implantiert. Drei verschiedene Arten der 3-D-gedruckten Scaffolds kamen zur Anwendung (1. CPC, 2. CPC-MBG-Komposit, 3. zusätzlich mit HCM funktionalisiertes CPC-MBG-Komposit). Die Scaffolddegradation und Knochenneubildung wurde anschließend nach sechs und nach zwölf Wochen mittels µCT und Histomorphologie/-morphometrie untersucht.
Nach sechs Wochen zeigte sich für alle gedruckten Implantate eine suffiziente Lage im Defekt und die Scaffoldstruktur war in allen Fällen noch deutlich erkennbar. Nach zwölf Wochen traten klare Degradationserscheinungen auf, besonders ausgeprägt war dies für die MBG-haltigen Gruppen. Die Visualisierung und Quantifizierung des verbliebenen Scaffoldvolumens bestätigte die signifikant schnellere Degradation der CPC-MBG-Komposite (Abbildung 5).
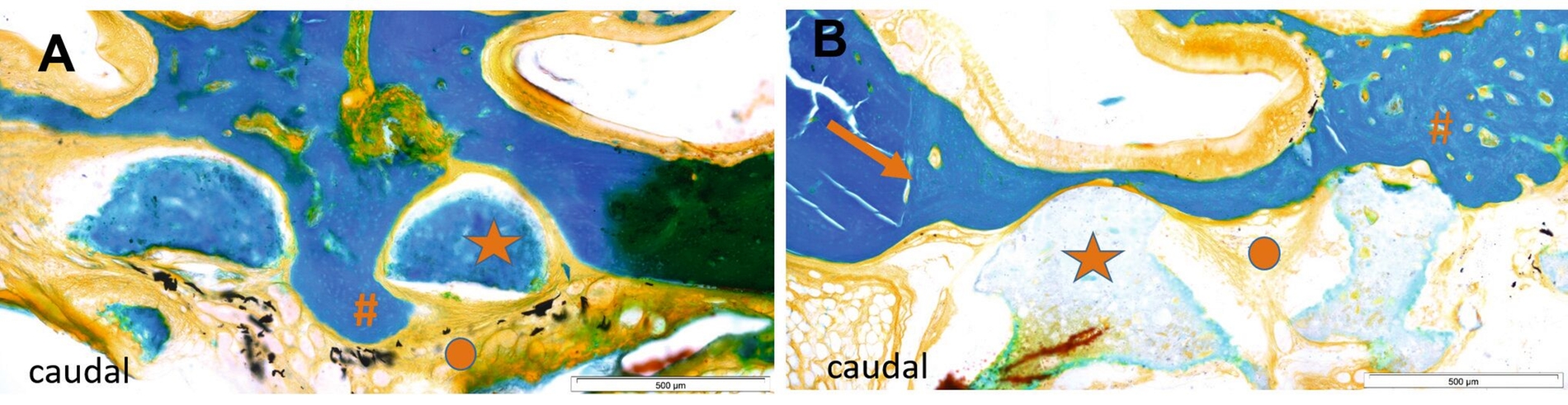
Dennoch trat weiterhin keinerlei Dislokation der Scaffolds oder kleinerer Partikel auf. Histologisch zeigte sich eine Osteogenese ausgehend vom Defektrand und die Transplantate wiesen eine osteokonduktive Charakteristik auf. Die Knochenneubildung trat sowohl entlang als durch die Scaffoldporen hindurch auf (Abbildung 6). Nach zwölf Wochen wiesen beide MBG-haltigen Versuchsgruppen einen signifikant kleineren verbliebenen Defekt auf als die mit den reinen CPC-Scaffolds.
Zusammenfassung
Mittels 3-D-Druck können defektspezifische Knochentransplantate für die präklinische Anwendung im Kieferspaltmodell hergestellt werden. Dabei wurde erstmalig ein Kompositmaterial aus Calciumphosphatzement und mesoporöse bioaktivem Glas im lebenden Organismus evaluiert. Die Funktionalisierung führte zu einer verbesserten Transplantatdegradation und zu einer gesteigerten Knochenneubildung im Defekt.
In künftigen Studien soll das Potenzial dieses Kompositmaterials weiter untersucht werden, mit dem Ziel, es in den klinischen Alltag zu überführen und eine suffiziente Alternative zum autologen Beckenknochentransplantat zu entwickeln. Damit könnten im Fall der Kieferspaltosteoplastik die zumeist jungen Patienten durch die Vermeidung eines Zweiteingriffs zur Knochenentnahme perspektivisch geschont werden. Weiterhin ist die Verwendung dieser Transplantate auch für andere Kieferknochendefekte denkbar.
Literaturliste
Boehm K S, Al-Taha M, Morzycki A, Samargandi O A, Al-Youha S, Leblanc M R (2019) Donor Site Morbidities of Iliac Crest Bone Graft in Craniofacial Surgery: A Systematic Review. Ann Plast Surg 83(3), 352-358. doi.org/10.1097/sap.0000000000001682.
Gundlach K K, Maus C (2006) Epidemiological studies on the frequency of clefts in Europe and world-wide. J Craniomaxillofac Surg 34 Suppl 2(1-2. doi.org/10.1016/s1010-5182(06)60001-2.
Horswell B B, Henderson J M (2003) Secondary osteoplasty of the alveolar cleft defect. J Oral Maxillofac Surg 61(9), 1082-90. doi.org/10.1016/s0278-2391(03)00322-7.
Korn P, Ahlfeld T, Lahmeyer F, Kilian D, Sembdner P, Stelzer R, Pradel W, Franke A, Rauner M, Range U, Stadlinger B, Lode A, Lauer G, Gelinsky M (2020) 3D Printing of Bone Grafts for Cleft Alveolar Osteoplasty - In vivo Evaluation in a Preclinical Model. Front Bioeng Biotechnol 8(217. doi.org/10.3389/fbioe.2020.00217.
Korn P, Hauptstock M, Range U, Kunert-Keil C, Pradel W, Lauer G, Schulz M C (2017) Application of tissue-engineered bone grafts for alveolar cleft osteoplasty in a rodent model. Clin Oral Investig 21(8), 2521-2534. doi.org/10.1007/s00784-017-2050-1.
Korn P, Schulz M C, Range U, Lauer G, Pradel W (2014) Efficacy of tissue engineered bone grafts containing mesenchymal stromal cells for cleft alveolar osteoplasty in a rat model. J Craniomaxillofac Surg 42(7), 1277-85. doi.org/10.1016/j.jcms.2014.03.010.
Pfister A, Landers R, Laib A, Hübner U, Schmelzeisen R, Mülhaupt R (2004) Biofunctional Rapid Prototyping for Tissue-Engineering Applications: 3D Bioplotting versus 3D Printing. Journal of Polymer Science Part A: Polymer Chemistry 42(3), 624-638. doi.orghttps://doi.org/10.1002/pola.10807.
Pradel W, Lauer G (2012) Tissue-engineered bone grafts for osteoplasty in patients with cleft alveolus. Ann Anat 194(6), 545-8. doi.org/10.1016/j.aanat.2012.06.002.
Richter R F, Vater C, Korn M, Ahlfeld T, Rauner M, Pradel W, Stadlinger B, Gelinsky M, Lode A, Korn P (2023) Treatment of critical bone defects using calcium phosphate cement and mesoporous bioactive glass providing spatiotemporal drug delivery. Bioact Mater 28(402-419. doi.org/10.1016/j.bioactmat.2023.06.001.









