Auf außergewöhnliche Erstsymptome achten
Das Parkinson-Syndrom (PS) gehört zu den häufigen neurologischen Krankheitsbildern in unseren Breitengraden. Das Krankheits- risiko steigt mit dem Lebensalter, so dass aufgrund der demografischen Entwicklung mit einer weiter zunehmenden Zahl an Patienten hierzulande zu rechnen ist. Die Erkrankung beginnt meist zwischen dem 50. und dem 80. Lebensjahr, kann sich in seltenen Fällen aber auch bereits vor dem 40. Lebensjahr manifestieren. Die Prävalenz liegt bei etwa einem Prozent der über 60-Jährigen, wobei Männer etwas häufiger betroffen sind.
Namensgeber der Parkinson-Krankheit ist der Londoner Arzt und Apotheker James Parkinson (1755–1824), der das Krankheits bild als erster als sogenannte „shaking palsy“ – also als Schüttellähmung – beschrieben hat.
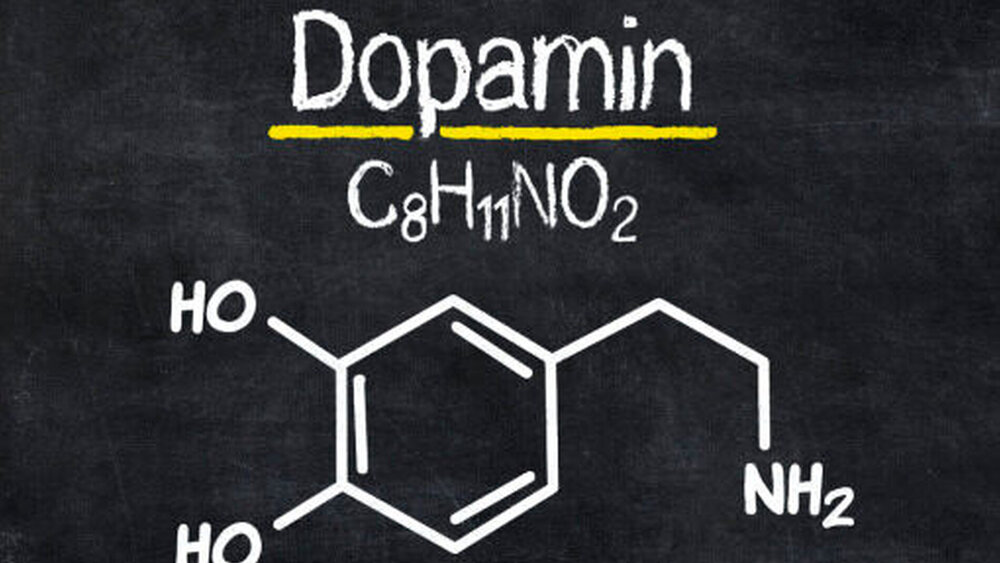
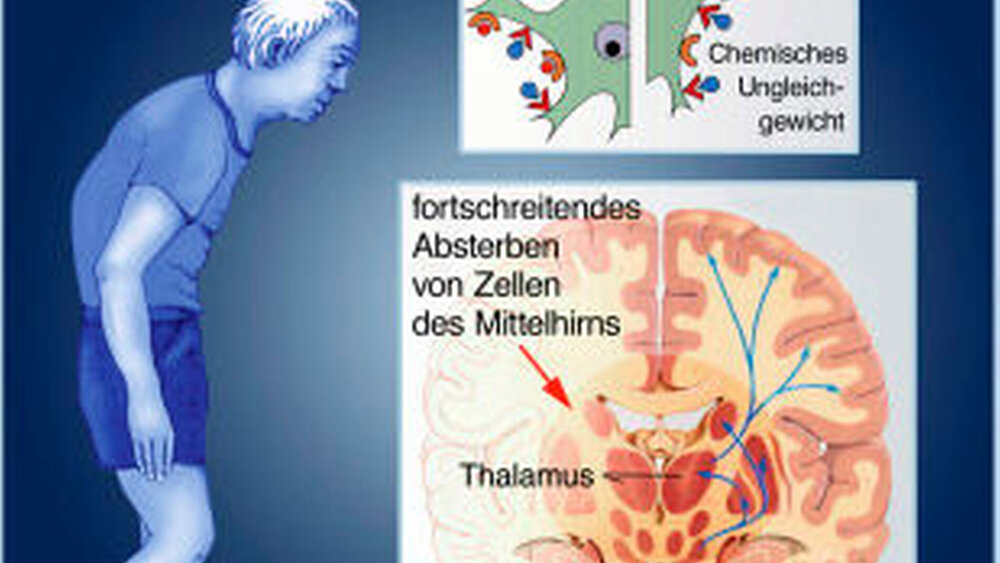
Das Parkinson-Syndrom basiert auf einer degenerativen Veränderung im extrapyramidal-motorischen System (EPMS) im Gehirn. Es kommt dabei zum Absterben der Dopamin produzierenden Zellen in der Substantia nigra, wobei das PS im Allgemeinen erst symptomatisch wird, wenn bereits rund zwei Drittel der dopaminergen Zellen zugrunde gegangen sind. Die Erkrankung entwickelt sich entsprechend langsam schleichend und nimmt einen progredienten Verlauf.
Kardinalsymptome sind Akinese, Rigor und Tremor
Leitsymptom des PS ist die Bradykinese bis hin zur Akinese, also eine Bewegungs- armut bis zur völligen Unbeweglichkeit. Betroffen ist meist der gesamte Organismus, was die vielfältige Symptomatik erklärt. So zeigen die Patienten in aller Regel ein reduziertes Muskelspiel im Gesicht, was zum sogenannten Maskengesicht (Hypo-mimie) führt. Die Stimme wird leiser und undeutlich (Mikrophonie), das Schlucken verzögert sich, was sich in einem scheinbar vermehrten Speichelfluss bemerkbar macht. Die Geschicklichkeit der Hände lässt nach, das Schriftbild wird kleiner (Mikrographie), die Rumpfbewegungen sind erschwert und das Gangbild wird kleinschrittig und schlurfend.
Von einem Parkinson-Syndrom ist auszu- gehen, wenn zusätzlich zur Akinese ein Rigor und/oder Ruhetremor und/oder eine posturale Instabilität, also eine Störung der aufrechten Körperhaltung besteht. Der Rigor ist bedingt durch eine unwillkürliche Anspannung der gesamten quer gestreiften Muskulatur, was oft Muskel-schmerzen zur Folge hat. Die Störung kann sich durch das sogenannte Zahnradphänomen zeigen, ein ruckartiges Nachgeben des Muskeltonus bei passiver Bewegung einer Extremität. Es kommt dadurch zum Bild einer abgehackten Bewegung gegen einen erhöhten Widerstand, so als würde die Extremität über ein Zahnrad gezogen.
Die posturale Instabilität basiert auf einer Störung der Stellreflexe, wobei vor allem die kleinen, raschen reflektorischen Ausgleichsbewegungen beeinträchtigt sind. Es resultiert eine Gang- und Standunsicherheit mit erhöhter Sturzneigung. Die Patienten werden unsicher und beginnen zu trippeln.
Warnsignale und Frühsymptome
Bevor solche Kardinalsymptome auftreten, manifestieren sich oftmals Frühsymptome, die auf eine Parkinson-Erkrankung hin- deuten können. Manche Patienten fühlen sich zunächst müde oder abgeschlagen, andere zittrig oder vergesslich. Oftmals fällt vor allem den Angehörigen auf, dass die Betreffenden leise sprechen oder aus nichtigen Anlässen gereizt oder depressiv reagieren.
Ein sehr häufiges Frühsymptom des PS sind dabei Riechstörungen. So leiden letztlich rund 95 Prozent der Parkinson-Patienten unter einer olfaktorischen Störung. Diese tritt oft Jahre vor den übrigen Krankheits-zeichen auf. Neben einem veränderten Geruchssinn und depressiven Verstimmungen können außerdem Störungen des REM-Schlafs auf die Entwicklung eines PS hinweisen. Bei der oft im Vorfeld des manifesten PS auftretenden REM-Schlaf-Verhaltensstörung kommt es zu besonders lebhaften, oft erschreckenden Träumen, die in Bewegungen umgesetzt werden, was unter Umständen eine Selbst- oder eine Fremdgefährdung zur Folge haben kann.
Häufige Begleitsymptome
Begleitend zu den Kardinalsymptomen treten oft weitere Störungen auf. Hierzu gehören sensorische Symptome wie beispielsweise Dysästhesien, Schmerzen und, oben schon erwähnt, ein vermindertes Geruchs-empfinden (Hyposmie) sowie vegetative Symptome wie Störungen der Blutdruck- und der Temperaturregulation, Blasen- und Darmfunktionsstörungen und Störungen der sexuellen Funktionen.
Nicht selten liegen zugleich eine depressive Verstimmung sowie Schlafstörungen vor und es können sich kognitive Beeinträchtigungen bis hin zu dementiellen Syndromen im fortgeschrittenen Krankheitsstadium entwickeln. Häufige Begleitsymptome sind ferner Störungen der Schweißsekretion sowie Hautprobleme mit vermehrter Talgproduktion (Salbengesicht).
Krankheitsformen
Das PS stellt kein homogenes Krankheitsbild dar. Vielmehr werden unter dem Oberbegriff
des Parkinson-Syndroms verschiedene Krankheitsformen unterschiedlicher Ätiologie zusammengefasst. Zu differenzieren sind das idiopathische Parkinson-Syndrom, das rund 75 Prozent der Krankheitsfälle ausmacht, das genetisch bedingte, familiäre PS und atypische Parkinson-Syndrome.
Es handelt sich hierbei um seltene neuro- degenerative Erkrankungen, die oft schwer von einem PS abzugrenzen und zudem therapeutisch schwer zugänglich sind. Beispiele sind die Multisystematrophie (MSA) vom Parkinson-Typ (MSA-P) oder vom zerebellären Typ (MSA-C), die Demenz vom Lewy-Körper-Typ (DLK) sowie die progressive supranukleäre Blickparese (PSP) und die kortikobasale Degeneration (CBD). Hinweisend auf ein atypisches PS ist insbesondere ein schlechtes Ansprechen auf eine L-Dopa-Therapie.
Das PS kann ferner als sekundäres Parkinson-Syndrom auftreten, beispielsweise induziert durch Medikamente wie etwa Neuroleptika, Antiemetika, Lithium, Kalziumantagonisten und Valproinsäure sowie tumorbedingt, posttraumatisch oder als Folge einer Intoxikation zum Beispiel durch Kohlenmonoxid oder Mangan. Ein sekundäres PS kann sich ferner aufgrund einer Enzephalopathie entwickeln oder im Zusammenhang mit anderen Erkrankungen wie einem Morbus Wilson oder einem Hypoparathyreoidismus.
Diagnostik des PS
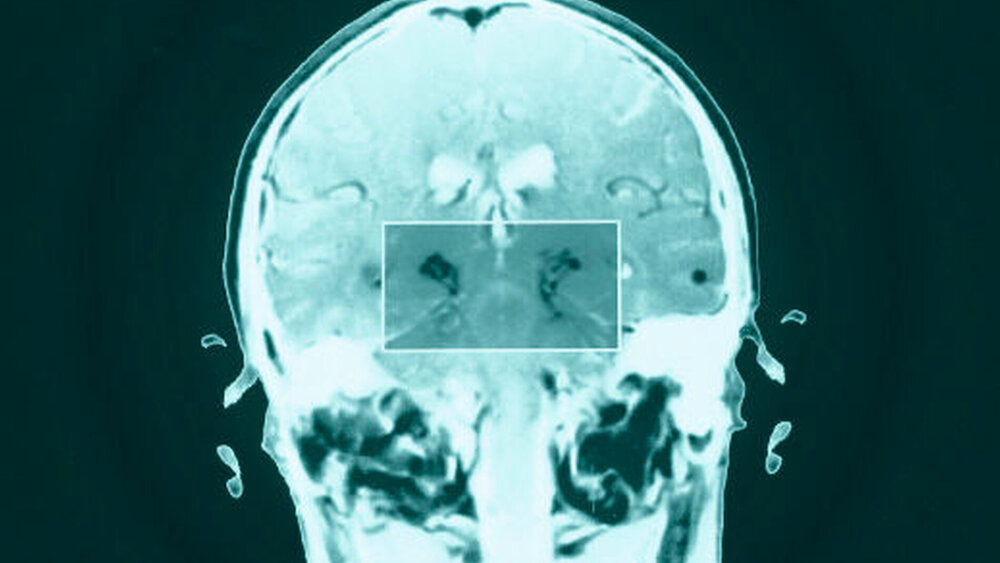
Die Diagnose der Parkinson-Krankheit wird primär klinisch gestellt. Oft fällt den Betroffenen oder Angehörigen ein vermindertes Mitschwingen eines Armes als eines der ersten Zeichen auf oder auch eine Verlangsamung beim Gehen oder eine Veränderung des Gesichtsausdrucks. Gesichert wird die Diagnose durch bildgebende Verfahren wie eine kraniale Computertomografie oder eine Kernspintomografie sowie durch eine Ultraschalluntersuchung der Substantianigra zur Differenzierung zwischen einem PS und einem atypischen Parkinson-Syndrom.
Ein weiteres diagnostisches Verfahren ist der sogenannte DaTSCAN (Dopamin-Transporter-Szintigrafie). Dabei wird über die Bindung einer radioaktivmarkierten Substanz an den Dopamin-Transporter indirekt der Verlust Dopamin produzierender Nervenzellen im Gehirn dargestellt.
Da Patienten mit PS gut auf L-Dopa an- sprechen, hat auch der sogenannte L-Dopa-Test diagnostische Bedeutung. Der Test wird als spezieller pharmakologischer Funktionstest bei Parkinson-Patienten eingesetzt, um festzustellen, ob die Symptomatik L-Dopa-sensitiv ist, also auf eine nigrostriatale Funktionsstörung zurückgeht. Es gibt weitere Verfahren, etwa den quantitativen Riechtest, der sich infolge der meist vorliegenden Riechstörung beim PS ebenfalls zur diagnostischen Abklärung eignet.
Früh mit der Therapie beginnen
Die Behandlung des idiopathischen Parkinson-Syndroms (IPS) erfolgt symptomatisch, eine kurative Therapie und auch neuroprotektive Ansätze zur Hemmung der Krankheits- progression sind bislang nicht verfügbar. Dabei sollte frühzeitig, also direkt nach der Diagnosestellung, eine pharmakologische Therapie des IPS eingeleitet werden. Denn ein frühzeitiger Therapiebeginn scheint nach Angaben der Deutschen Gesellschaft für Neurologie (DGN) den Langzeitverlauf günstig zu beeinflussen. Zudem gibt es, so die DGN in ihren Leitlinien, keine zuverlässigen Daten, die beweisen, dass ein späterer Behandlungsbeginn die Entwicklung von Therapiekomplikationen hinauszögert.
Initial wird üblicherweise mit L-Dopa, einer Vorstufe des Neurotransmitters Dopamin, oder Dopaminagonisten behandelt, wobei die Dopaminagonisten laut DGN zumindest in den ersten drei bis fünf Jahren der Behandlung seltener als L-Dopa zum Auftreten von Dyskinesien führen. Dafür besitzt jedoch L-Dopa eine bessere symptomatische Wirkung sowie das geringere Potenzial an nicht motorischen Nebenwirkungen bei gleichwertigem Effekt auf die Lebensqualität, heißt es in den Leitlinien der Fachgesellschaft.
Die medikamentöse Therapie wird durch allgemeine Therapiemaßnahmen ergänzt. Hierzu gehören insbesondere die Krankengymnastik und die Logopädie.
L-Dopa-Therapie
L-Dopa wird in allen Stadien der Erkrankung (frühe Monotherapie, bei nicht fluktuierenden und fluktuierenden Patienten ohne und mit Dyskinesien, bei Patienten mit motorischen Komplikationen und mit nicht motorischen Symptomen) eingesetzt. Es wird im Gehirn zu Dopamin umgewandelt. Der Wirkstoff kann Symptome der Parkinson-Krankheit ausgleichen, verzögert nach heutigem Kenntnisstand laut DGN aber nicht die Krankheitsprogression. Andererseits ist durch die Einführung der L-Dopa-Therapie die Lebenserwartung von Parkinson-Patienten deutlich gestiegen.
Dabei wirkt L-Dopa rasch, bereits innerhalb von 20 bis 30 Minuten nach der Einnahme bessern sich üblicherweise die Akinese, der Rigor und der Tremor, aber auch die depressive Verstimmung, die Schmerzen und das verlangsamte Gehen.
Die Behandlung kann allerdings erhebliche Therapiekomplikationen – insbesondere Dyskinesien – hervorrufen. Es kann zu Fluktuationen der Beweglichkeit, den sogenannten On-Off-Phänomenen kommen, also zu einem plötzlichen Wechsel von einer guten Beweglichkeit hin zur Unbeweglichkeit. Die Schwankungen können zum Teil mehrmals täglich auftreten und sind abhängig von der Tabletteneinnahme.
Ob die Behandlung des PS mit L-Dopa oder Dopaminagonisten begonnen werden sollte, hängt nicht zuletzt vom Alter der Patienten bei der Krankheitsmanifestation ab:
• Bei Parkinson-Patienten mit spätem Erkrankungsbeginn raten die Neurologen initial zur Gabe eines gut verträglichen L-Dopa-Präparats. Denn ältere Patienten entwickeln seltener motorische Komplikationen als Patienten mit frühem Krankheitsbeginn. Solange keine Wirkungsfluktuationen oder andere Therapiekomplikationen auftreten, sollte die L-Dopa-Therapie fort-gesetzt werden, da Dopaminagonisten insbesondere bei älteren und multimorbiden Patienten ein ungünstigeres Nebenwirkungsprofil besitzen.
• Parkinson-Patienten mit frühem Krankheitsbeginn haben dagegen laut DGN ein höheres Risiko, Dyskinesien unter einer L-Dopa-Therapie zu entwickeln. Dem stehen allerdings aktuelle Beobachtungen entgegen, wonach zumindest unter höheren Dosierungen ein erhöhtes Risiko für das Auftreten von Impulskontrollstörungen und einer pathologischen Tagesmüdigkeit unter Dopaminagonisten besteht. Bei früh erkrankten Patienten ohne wesentliche Komorbidität empfehlen die Leitlinien zunächst eine medikamentöse Therapie mit einem Non-Ergot-Dopaminagonisten. Bei unzureichender Wirkung einer Monotherapie oder der Unverträglichkeit von Dopaminagonisten ist eine Kombinationstherapie mit Dopaminagonisten und L-Dopa indiziert.
Tiefe Hirnstimulation steht heute im Fokus
Viel diskutiert werden Nutzen und Risiken der tiefen Hirnstimulation bei der Behandlung der Parkinson-Krankheit. Entsprechend der DGN-Leitlinie ist das Verfahren inzwischen ein fester Bestandteil der Therapie. Bei der tiefen Hirnstimulation werden Elektroden stereotaktisch implantiert. Sie sind mit einem unter dem Schlüsselbein implantierten Stimulator zur reversiblen und individuell anpassbaren elektrischen Stimulation verbunden. Stimulationsort ist meist der Nucleus subthalamicus. Gut zu beeinflussen sind durch diese Maßnahme vor allem die drei motorischen Kernsymptome Akinese, Rigor und Tremor.
Die tiefe Hirnstimulation gilt laut DGN als potente Behandlungsmethode eines PS im fortgeschrittenen Stadium mit Dopa-sensitiven Fluktuationen. So wurde mittlerweile in drei randomisierten Studien nachgewiesen, dass bei medikamentös schwer einzustellendem IPS mit motorischen Fluktuationen und Dyskinesien die Stimulation des Nucleus subthalamicus der oralen medikamentösen Therapie in puncto Lebensqualität und auch hinsichtlich der Besserung der Krankheitssymptome sowie der Alltagsaktivitäten signifikant überlegen ist. Erste Verlaufsbeobachtungen über acht Jahre bestätigen diese Ergebnisse. Zum Nutzen der tiefen Hirn- stimulation in frühen oder mittleren Krankheitsstadien gibt es derzeit jedoch keine hinreichenden Daten, gibt die Fachgesellschaft zu bedenken.
Das Verfahren ist zudem nicht ohne Risiken. So werden die Letalität und das Auftreten schwerer Operationskomplikationen mit 0,5 bis 3 Prozent angegeben. Es kann ferner zu psychiatrischen Auffälligkeiten und psychosozialen Anpassungsstörungen als Folge des Eingriffs kommen.
Christine Vetter
Merkenicher Str. 224
50735 Köln
info@christine-vetter.de