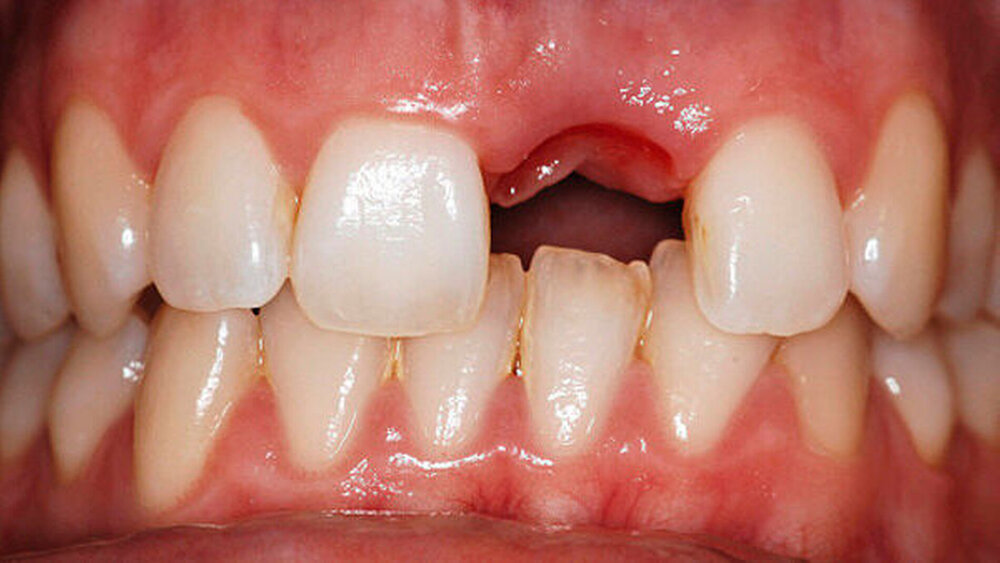
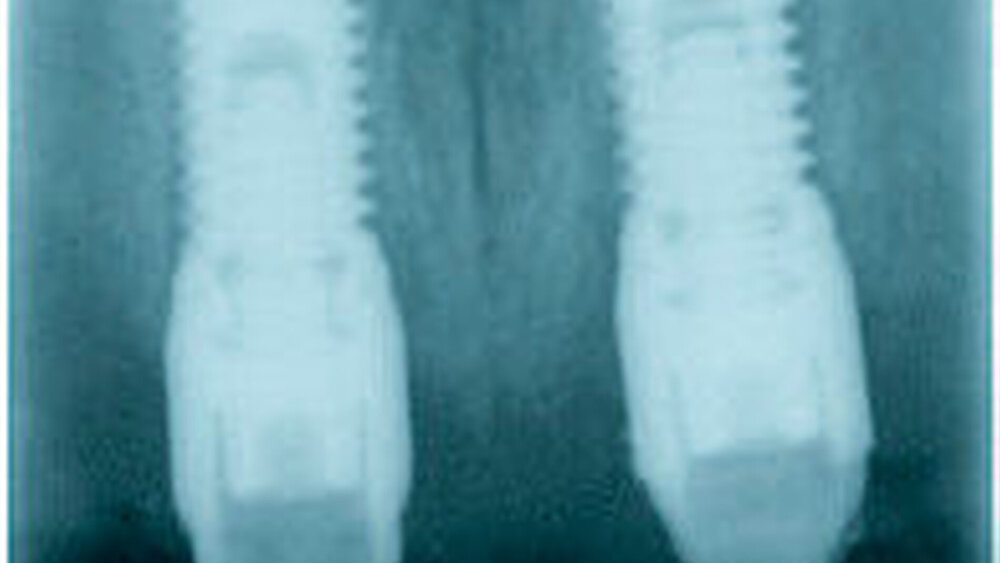
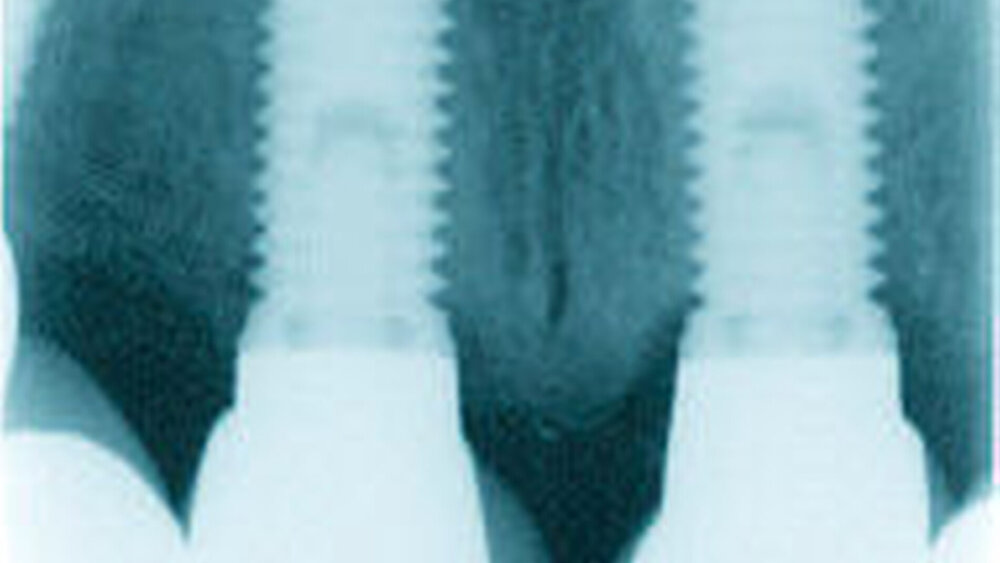
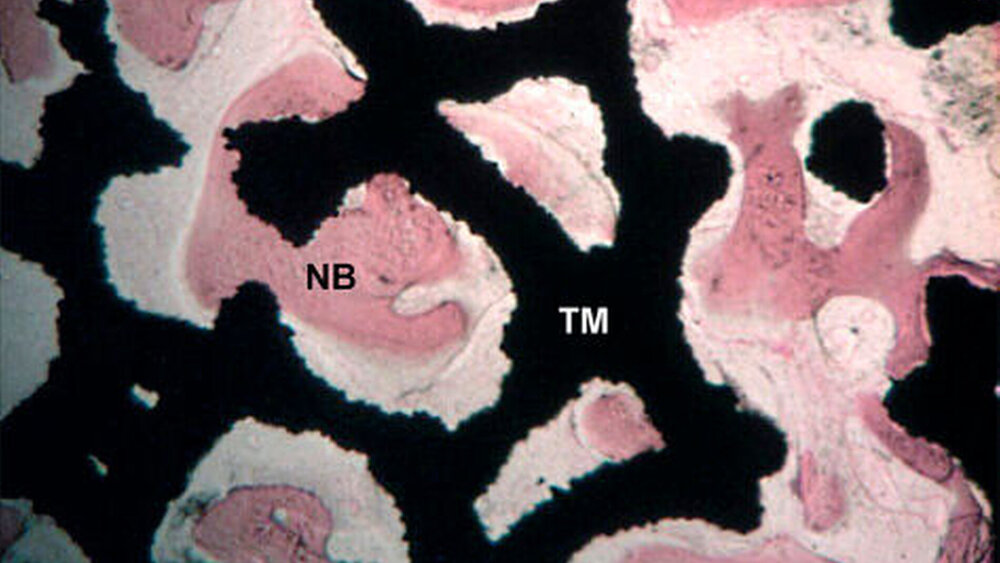
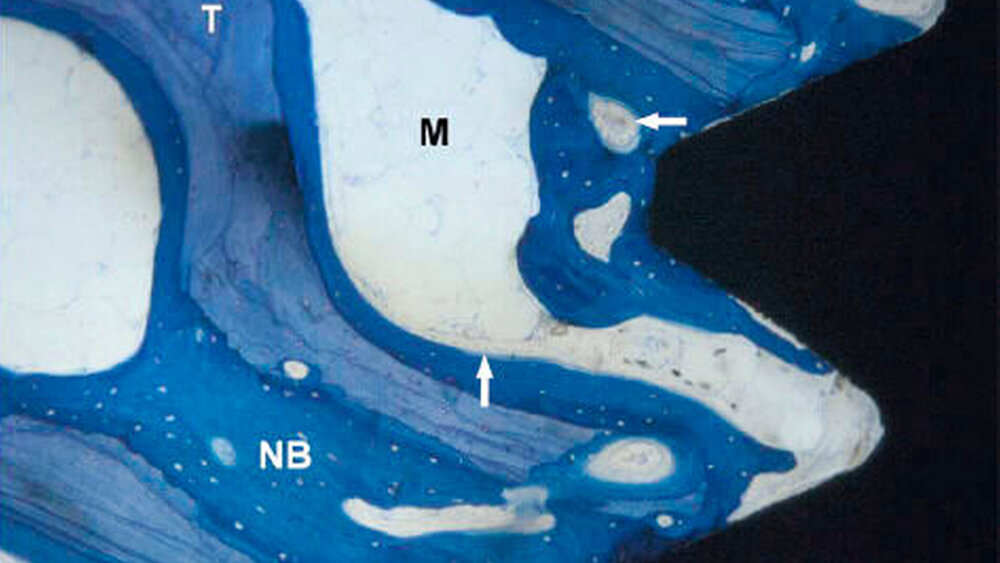
Rauigkeit und Topografie sind entscheidend
Für die Oberflächenstrukturierung stehen verschiedene Techniken zur Verfügung. Das Spektrum reicht von additiven Verfahren (Titanplasmabeschichtung, Hydroxylapatit) über subtraktive Techniken (Sandstrahlung, Ätzung, spezielle Laserbehandlung) bis hin zu mikrostrukturierten Oberflächen.
Implantatoberflächen
Strahlen und anschließendes Ätzen führt zu einer mikrorauen Oberfläche. Und diese Oberfläche ist derzeit en vogue. „Im Vergleich zu einer maschinierten Oberfläche besitzt die mikroraue eine deutlich vergrößerte Anlagerungsfläche“, wie Dr. Volker Biehl, Director Research Development bei Dentsply Implants, erklärt. Als Beispiel führt er die Friadent-plus-Oberfläche und die mikroraue OsseoSpeed-Oberfläche an, deren „Benetzungseigenschaften für die initiale Phase der Knochenheilung maßgeschneidert“ seien. Auch der Bremer Implantathersteller Bego Implant Systems schwört auf gestrahlt-geätzte Implantatoberflächen, „die sich sehr gut universell einsetzen“ ließen.
„Doch unabhängig von der Art der Bearbeitung kommt es auch auf die Reinheit der Implantatoberfläche an“, betont der Leiter Oberflächentechnik, Dr.-Ing. Marzellus große Holthaus. Rückstände der Fertigungsprozesse, beispielsweise Strahlmittel oder Säure, – das dürfe nicht sein. Bego Implant Systems ätzt Implantatoberflächen deshalb mit hochreiner Säure und wendet in seiner validierten Prozesskette ein mehrstufiges automatisiertes Reinigungsverfahren an. Das löse Restanteile des Strahlmittels aus der Oberfläche heraus, Ergebnis laut große Holthaus: „mindestens 98 Prozent Titan an der Oberfläche“.
Beschichtung: Pro und Contra
Für eine Synergie verschiedener Oberflächenbehandlungsmethoden plädiert Biomet 3i Deutschland. Geschäftsführerin Krista Strauß: „Biomet 3i bevorzugt die Kombination von Abstrahlen mit Calciumphosphatpartikeln, doppelter Säureätzung und der Auflagerung von Hydroxylapatit-Kristallen. Hiermit rauen wir die Implantatoberfläche in drei verschiedenen Stufen auf.“ Die Firma habe 1996 die erste aufgeraute Implantatoberfläche auf den Markt gebracht, „die mit einer subtraktiven Methode, also der doppelten Säureätzung, erzielt wurde“. Diese Oberfläche biete eine Rauigkeit zwischen 1 und 3 µm.
Straumann setzt ebenfalls aufs Ätzen und Strahlen, vom Beschichten hält man im Baseler Hauptquartier aber wenig. „Jede Beschichtung weist eine zusätzliche Schwachstelle an der Grenzfläche auf. Wir bieten deshalb zwei Varianten rauer Oberflächen an“, erläutert Dr. Christoph Appert, Head of Research im Institut Straumann. Das heißt für die Straumann-SLA-Oberfläche: Durch eine grobe Sandstrahlung wird eine Makrorauheit auf der Implantatoberfläche generiert. Darauf folgt eine Säureätzung, die eine Mikrorauheit erzeugt.
Die aktuelle Oberflächengeneration von Straumann, die SLActive-Oberfläche, zeichnet sich durch eine chemisch aktive und hydrophile Oberfläche aus. Es wird ebenfalls sandgestrahlt und mit Säure geätzt. Allerdings wird die Aufarbeitung unter Schutzgas vorgenommen und das Implantat in Flüssigkeit gelagert. Für SLA-Implantate gibt es Zehnjahresdaten mit sehr guten Erfolgs- und Überlebensraten, für SLActive stehen Fünfjahresdaten zur Verfügung.
„Anodische Oxidation“, „Titanoxid“ – das sind die Stichworte für die Nobel-Biocare-Oberfläche. Favorisiert wird das den additiven Verfahren zuzurechnende TiUnite, ein Titanoxid, das sich mittels Anodisierung durch Funkenentladung in einem phosphathaltigen Elektrolyt zu einem osseokonduktiven keramischen Biomaterial als poröse Oberfläche mittlerer Rauigkeit entwickelt. „Die klinische Wirksamkeit und Sicherheit wurde bisher in mehr als 275 wissenschaftlichen Publikationen mit mehr als 42.000 Implantaten und 13.000 Patienten in allen Indikationen und Belastungsprotokollen belegt. Zudem sind mehr als 900 internationale peer-reviewed Publikationen zu unserer Oberfläche veröffentlicht worden“, sagt Dr. Stefan Holst, Global Head Research Science bei Nobel Biocare.
Nobel Biocare setzt seit 2000 auf die TiUnite-Oberfläche. Sie ist in klinischen Studien dokumentiert. Neben einer Vielzahl von Studien, die den erfolgreichen klinischen Einsatz über fünf Jahre und mehr dokumentieren, beträgt das längste klinisch kontrollierte Follow-up zwölf Jahre. Die Überlebensraten sind mit bis zu 100 Prozent hoch, und der marginale Knochen verbleibt nach einer initialen Umbauphase stabil.
Osseoinkorporation statt Osseointegration
Eine ganz andere Richtung hat Zimmer Dental eingeschlagen. Von Osseointegration allein spricht hier niemand mehr, Osseoinkorporation lautet stattdessen das Zauberwort. Darunter versteht man eine Kombination aus Osseointegration und Einwachsen von Knochen in ein hoch poröses Biomaterial. Das Trabecular-Metal-Zahn implantat besitzt ein massives, konisches Schraubendesign mit einer Oberfläche aus mäßig aufgerautem Titan, geschaffen durch Abstrahlen mit Hydroxylapatit(HA)-Partikeln, und einen mittleren Abschnitt aus hochporösem, auf Tantal basierendem Material.
Im Osseoinkorporationsmodell wachse vaskularisierter Knochen in die dreidimensionale poröse Struktur des Implantats ein, zusätzlich zur Osseointegration mit den Implantatoberflächen, wie Michael Collins, Vizepräsident Development and Education bei Zimmer Dental, erklärt. Der Elastizitätsmodul von Trabecular Metal Material (~3 GPa) liege näher bei dem des kortikalen (~15 GPa) und des trabekulären Knochens (~0,1 GPa) als das von Titan (~110 GPa). 26 Studien untersuchten derzeit, wie diese Unterschiede in der sekundären Stabilität die langfristige Knochenreaktion beeinflussen.
Lernen aus der Orthopädie?
Das Trabecular-Metal-Material wird schon seit Jahren zur zementlosen Verankerung von orthopädischen Implantaten – etwa künstlichen Hüftgelenken – verwendet. Collins: „Es hat sich mit seiner ausgedehnten Oberflächen-Mikrotextur für den Knochen-Implantat-Kontakt und mit seiner dreidimensionalen, interkonnektierten Porosität für das Einwachsen von vaskularisiertem Knochen in der Praxis bewährt, besonders bei schlechter Knochenqualität, also in Situationen, in denen eine verbesserte Sekundärstabilität notwendig ist.
In einer internationalen Proof-of-Principle-Studie erreichten Trabecular-Metal-Zahnimplantate bei Sofortbelastung außer Okklusion innerhalb von 48 Stunden nach Insertion und definitiver Belastung in Okklusion sieben bis 14 Tage später eine Überlebensrate von 97,3 Prozent, und nach einem Jahr in klinischer Funktion kam es zu einem Knochenverlust von 0,43 ± 0,41 mm, berechnet ab dem Tag der Insertion.“
Zusätzlich zu gesunden Patienten beurteilt die Studie auch Implantatinsertionen bei Patienten mit Osteoporose, Parodontitis, dentalen Infektionen, Knochen vom Typ IV, bei Rauchern, bei Knirschern und bei augmentiertem Knochen. Zwei-Jahres-Zwischenergebnisse wurden jüngst beim Kongress der Academy of Osseointegration vorgestellt.
Einfluss der Oberfläche auf die Sekundärstabilität
Die Oberflächenstruktur des Implantats wirkt sich auch auf die Dynamik der Knochenneubildung aus. Bei der Osseointegration spielen zwei Faktoren eine wichtige Rolle:
• die Primärstabilität, also die mechanische Stabilität, und
• die Sekundärstabilität, also die biologische
Stabilität nach dem Knochenumbau des Implantats im Knochen.
Bei herkömmlichen Oberflächen seien Implantate wegen des Nachlassens der Gesamtstabilität zwischen Woche zwei und vier einem höheren Versagensrisiko ausgesetzt, wie Appert von Straumann hervorhebt. Bei der mikrorauen, hydrophilen Oberfläche SLActive reduziere sich das Risiko bereits während der kritischen Einheilphase, betont der Wissenschaftler aus Basel. Konsequenz: Die Implantatintegration verbessert sich. Appert: „Da die Knochenbildung früher einsetzt, kommt es zu einer erheblich verbesserten Implantatstabilität während des Zeitraums der kritischen Stabilitätslücke zwischen Woche zwei und vier.“
Als Beleg führt Appert wissenschaftliche Studien an, die im vergangenen Jahr veröffentlicht wurden. Danach wurden die Vorteile nachgewiesen: Sowohl für SLA als auch für SLActive-Implantate ließen sich ähnliche Einheilmuster beobachten. Aber: Der Knochen-Implantat-Kontakt (BIC) bei SLActive war nach 14 Tagen größer und nach 28 Tagen signifikant größer. Appert: „Dieser deutlich höhere BIC-Wert führt zu einer verbesserten Vorhersagbarkeit der Behandlung und trägt dazu bei, die Gefahr eines frühen Implantatmisserfolgs zu minimieren.“
Dass die Oberflächenbeschaffenheit den Knochenheilungsprozess beeinflusst, unterstreicht auch Biehl von Dentsply Implants. „Mikroraue Oberflächen nehmen durch eine verstärkte Osteoblastendifferenzierung und durch eine Verbesserung der thrombogenen Eigenschaften Einfluss auf den Knochenheilungsprozess. Dies führt zu einer erhöhten Knochenbildungsrate und zu einer höheren Festigkeit der Implantat-Knochen-Verbindung.“ Belege dafür finden sich unter anderem in Langzeitstudien von Novaes et al. und Ellingsen et al.
Wissenschaftliche Studien
Alle Premiumhersteller haben den Erfolg ihrer Implantatoberflächen-Strukturen in unterschiedlichen wissenschaftlichen Studien nachgewiesen.
Bei Nobel Biocare zeigte sich zum Beispiel, dass nach den ersten Monaten der Einheilphase das marginale Knochenniveau stabil bleibt. In einer Elfjahresstudie über Implantate mit einer externen Sechskantverbindung und TiUnite-Oberfläche, die alle unter Sofortbelastung vornehmlich im anspruchsvollen weichen Knochen gesetzt wurden, bewegte sich der mittlere marginale Knochenumbau im ersten Jahr im normal üblichen Rahmen.
Jedoch dokumentierten nur wenige Studien den Knochenumbau direkt ab Insertion, zudem seien die Daten schwer vergleichbar, merkt Holst an. Der mittlere Knochenumbau zwischen dem Einjahreszeitpunkt nach Insertion und dem vorläufigen Studien-Cut-off betrug 0,47 mm, die Gesamtveränderung über den vollen Elfjahreszeitraum belief sich laut Holst auf 1,66 mm [Glauser et al., eingereicht] und der marginale Knochen verblieb nach dem ersten Jahr bei einer mittleren jährlichen Veränderung von weniger als 0,05 mm über den Zeitraum von zehn Jahren nahezu stabil. Das liege deutlich unter den in der Literatur akzeptierten jährlichen Umbauraten von 0,2 mm marginalem Knochenverlust.
Knochenabbau standardisiert messen
Als allgemein üblich gelten laut Appert Knochenverluste von bis zu 1 mm im ersten Jahr (bone remodeling). In den folgenden Jahren betrachte man Knochenverluste von bis zu 0,2 mm als klinisch unkritisch. Um Knochenabbau über einen längeren Zeitraum exakt und standardisiert zu messen, brauche es prospektive Untersuchungen. Für die TL-SLA-Implantate von Straumann wurden bislang drei Langzeitstudien publiziert, in denen auch das Knochenniveau bestimmt wurde:
• In der Studie von Fischer et al. [2012] wurde ein durchschnittlicher Knochenverlust nach zehn Jahren von 1 mm bei 102 Implantaten bestimmt. Dieser Wert liegt somit deutlich unter dem kritischen Wert. Viel aussagekräftiger als Durchschnittswerte ist die Bestimmung der Häufigkeitsverteilung des Knochenverlusts.
• Buser et al. [2012] bestimmten an 505 Implantaten den Anteil der Implantate, die mehr als 0,2 mm Knochenverlust pro Jahr über zehn Jahre hinweg aufwiesen. Nur 22 Implantate, also 4,4 Prozent, zeigten einen höheren Wert, wobei nur neun Implantate als klinisch auffällig bewertet wurden. Die übrigen 13 Implantate zeigten keinerlei Zeichen von periimplantären Infektionen.
• In der Studie von Roccuzzo et al. [2013] wurde der Knochenverlust von parodontal gesunden mit dem von parodontal beeinträchtigten Patienten verglichen. In der Gruppe der parodontal gesunden Patienten wurde bei keinem Implantat ein Knochenverlust von mehr als 3 Millimetern während der zehn Jahre bestimmt. Bei den parodontal beeinträchtigten Personen wiesen etwa zehn Prozent einen Knochenverlust von mehr als drei Millimetern auf.
Appert: „Aufgrund solcher Langzeitstudien können wir davon ausgehen, dass nur ein sehr geringer Anteil an Patienten einen klinisch relevanten Knochenverlust am Implantat erleidet. Und selbst bei den parodontal beeinträchtigten Patienten liegt dieser Wert nicht über zehn Prozent.“
Periimplantitisrisiko
Immer mehr Zahnärzte lehnen aus parodontologischen Aspekten eine moderat-raue Oberfläche bis zum Weichgewebe ab und entscheiden sich für den maschinierten Rand. Das wird auf unterschiedlichen Kongressen des Faches deutlich. Damit lasse sich sowohl eine epi- als auch eine subkrestale Positionierung vornehmen und so eine direkte Verbindung zwischen der plaque-anfälligeren Beschichtung und dem Weichgewebe vermeiden, wird argumentiert.
Kann die maschinierte Schulter das Periimplantitsrisiko tatsächlich senken? Ja, meint Biomet-3i-Geschäftsführerin Strauß. „Ihr“ Unternehmen beschäftige sich schon seit 1996 mit dieser Problematik. „Unsere Osseotite-Implantate verfügten bereits vor fast 20 Jahren über ein Hybriddesign, also einen rauen, säuregeätzten Implantatkörper mit einer maschinierten Schulter. Das Ziel: Minimierung des Risikos für Peri-implantitis. So bekamen die Implantate bereits damals eine FDA-Zulassung für das Verfahren der Frühbelastung (zwei Monate Einheilungszeit).“
„Auch die zusätzliche Auflagerung von Hydroxylapatitkristallen auf der Osseotiite-Oberfläche“, sagt Strauß, „sei ein Schritt in die richtige Richtung gewesen, um eine weitere Vergrößerung der Implantatober-fläche zu erzielen. Durch diesen Prozess der Einzelkristallauflagerung ermöglichte die Nanotite-Implantat-Oberfläche eine Verbesserung der Osseointegration in der frühen Einheilphase, kurz Bone Bonding, also die Verzahnung der Verbindung von der Knochenmatrix mit der Oberfläche des Implantats.
Diese Oberflächentechnologie wurde um den Prozess der Abstrahlung mit Calciumphosphat ergänzt. Das Ergebnis ist die 3i-T3-DCD Oberfläche, die seit Januar 2013 verfügbar ist und verschiedene Rauigkeiten kombiniert:
• eine Topografie im Submikronbereich ( 1 µ) durch die Einzelkristallauflagerung – Discrete Crystalline Deposition, DCD – von Calciumphosphat-Nanopartikeln,
• eine Topografie im Feinmikronbereich durch die doppelte Säureätzung (1–3 µ) und
• eine Topografie im Grob-Mikronbereich durch das Abstrahlen ( 10 µ).
Diese drei Rauigkeitslevel beeinflussen die Einheilung in der frühen Phase und können nach Mendes et al. und Davies et al. damit den gesamten Prozess der Osseointegration unterstützen.“
Knochenabbau
Implantatdesign und Knochenverlust – diese Parameter hängen eng zusammen, wie große Holthaus von Bego Implant Systems betont. Der Knochenabbau sei nicht nur von der Oberflächenbehandlung abhängig, sondern auch „von der Art der Belastung sowie von der prothetischen Konstruktion“. Unter Berücksichtigung bestimmter statischer Gesetzmäßigkeiten erfolge bei den Bego-Semados-Implantaten kaum Knochenabbau. Vorteilhaft sieht er die „bei unseren Implantaten verwendeten Mikrorillen/ Mikrogewinde zur Vergrößerung der Implantatoberfläche“. Diese sorgten für eine erhöhte Knochenbedeckungsrate im entscheidenden krestalen Knochen.
Die Primärstabilität des Implantats werde zum einen durch die Art und Technik der chirurgischen Aufbereitung der Kavität eingeleitet und zum anderen durch die Implantatform und das Gewindedesign. „Wir verwenden seit vielen Jahren eine gestrahlt-geätzte Oberfläche, TiPurePlus, mit einer mittleren Flächenrauheit von etwa 1,6 µm. Und: Eine homogen verteilte Flächenrauigkeit der Implantatoberfläche von 1 bis 2 µm ist vorteilhaft für eine gute Osseointegration“, so große Holthaus.
Mikrorillen werden kontrovers diskutiert
Mikrorillen werden seit 2005 auf den Gewinden der meisten Implantate von Nobel Biocare angebracht, da in präklinischen In-vivo-Untersuchungen gezeigt werden konnte, dass eine 110 Mikrometer messende Mikrorille statistisch signifikant zu einer verbesserten Osseointegration im Vergleich zu Implantaten ohne Rille oder mit einer anders dimensionierten/positionierten Rille führte. Der Knochen wächst vor allem entlang der Rille, was zusammen mit dem osteokonduktiven Effekt der TiUnite-Oberfläche zu einer schnelleren Einheilung führt.
Nobel Biocare bietet deshalb neben Schultern mit TiUnite-Oberfläche auch voll- und teilmaschinierte Schultern an, so dass je nach Gegebenheiten am Patienten und avisierter Insertionstiefe dem Behandler verschiedene Behandlungsoptionen zur Verfügung stehen, die auf die individuellen Bedürfnisse des Patienten angepasst werden können. Daneben gibt es ein Implantat mit einer drei Millimeter hohen, maschinierten Schulter, die für Stegprothesen und diverse Deckprothesenlösungen entwickelt wurde.
Dazu der Director Research Development, Biehl: „Beide zeigen eine sehr gute klinische Performance. Die Oberfläche bestimmt das frühe Stadium des Heilungsprozesses. Für den Erhalt des Gewebes sind andere Design-eigenschaften, wie beispielsweise das Gewindedesign oder die Implantat-Abutment-Verbindung, maßgeblich.“
Nach Appert können Mikrorillen aber auch zu ausgesprochen negativen Effekten führen. Falls sie freiliegen, könnten sie von Bakterien besiedelt werden. Eine Entfernung der bakteriellen Plaque sei kaum möglich, führe schließlich zu einem katastrophalen Implantatverlust. Holst von Nobel Biocare merkt an, dass solche Effekte bis dato von keiner klinischen Studie belegt worden seien. Im Gegenteil beschreibe eine kürzlich erschienene Studie eine kumulative Überlebensrate von 96,6 Prozent nach fünf Jahren [Lopes et al., 2014], vergleichbar mit früher publizierten Studien für Implantate mit Mikrorillen.
Bei einer guten Oberfläche im Hartgewebeteil sind laut Appert Mikrorillen ohnehin von sekundärer Bedeutung. Maschinierte Implantatschultern neigten dagegen zu geringer Plaqueanlagerung und störten somit die Weichgewebeanlagerung nicht, führt Appert an. Das Weichgewebe an Implantatschultern sei zwar anders strukturiert als am lebenden Zahn mit parodontalem Ligament und Sharpey-Fasern, er könne sich aber gut vorstellen, dass sich Oberflächen entwickeln ließen, „die zu einem zahnähnlichen Abschluss des Weichgewebes führen könnten“. Ziel müsse sein, die Gefahr von Periimplantitis weiter zu reduzieren. Appert: „Diese Entwicklungen sind aber noch im Forschungsstadium.“
Tipps für den Praktiker
Die Ursachen von krestalem Knochenverlust sind oft komplex. Zu den zahlreichen in der Fachliteratur berichteten Risikofaktoren für periimplantären krestalen Knochenverlust gehören unter anderem Operationstraumata, Komorbiditäten wie etwa Parodontitis, Periimplantitis und Osteoporose, zu niedrige Östrogenwerte, Rauchen, Bruxismus sowie die okklusale Überlastung. Neben der Qualität des Implantats und der Oberfläche sind ein engmaschiges Recallprogramm und eine gute Compliance des Patienten ein Schlüsselfaktor für stabile Langzeitergebnisse. Auch das Plat-form-Switching gilt als wichtiger Parameter.
Anne Barfuß
Fachjournalistin Deutscher Ärzte-Verlag
barfuss@aerzteverlag.de