Leberabszess nach PZR
In den folgenden vier Wochen traten drei Episoden mit Schüttelfrost und Schwäche auf, in deren Verlauf er 10 Kilogramm an Gewicht verlor. Nach der ersten Episode verordnete sein Hausarzt eine Antibiotikatherapie mit Doxycyclin. Da das Krankheitsbild progredient war, wies er den Patienten zur stationären Behandlung ein. Dabei fiel ein deutlich erhöhtes C-reaktives Protein (CRP) von 6,93 mg/ml (normal < 0,5) auf. Bei der Abdomensonografie und -computertomografie fanden sich keine richtungsweisenden Befunde, in der CT des Thorax stellten sich multiple pulmonale arteriovenöse Malformationen dar. Der Patient wurde daher nach zehn Tagen entlassen.
Bei schlechtem Allgemeinzustand kam es zu einem weiteren Gewichtsverlust von 5 Kilogramm. Vier Monate nach der Zahnreinigung wurde bei einer ambulanten Kontrolle ein weiterer Anstieg des CRP festgestellt (19,7 mg/dl), zudem eine erhöhte GGT (Gamma-Glutamyltransferase) (712 U/l, normal bis 55) und GPT (Glutamat-Pyruvat-Transaminase) (80 U/l, normal bis 45). Daraufhin wurde er zum Ausschluss einer Endokarditis stationär aufgenommen. Bei einer erneuten Abdomensonografie wurde dabei der Verdacht auf einen Leberabszess geäußert.
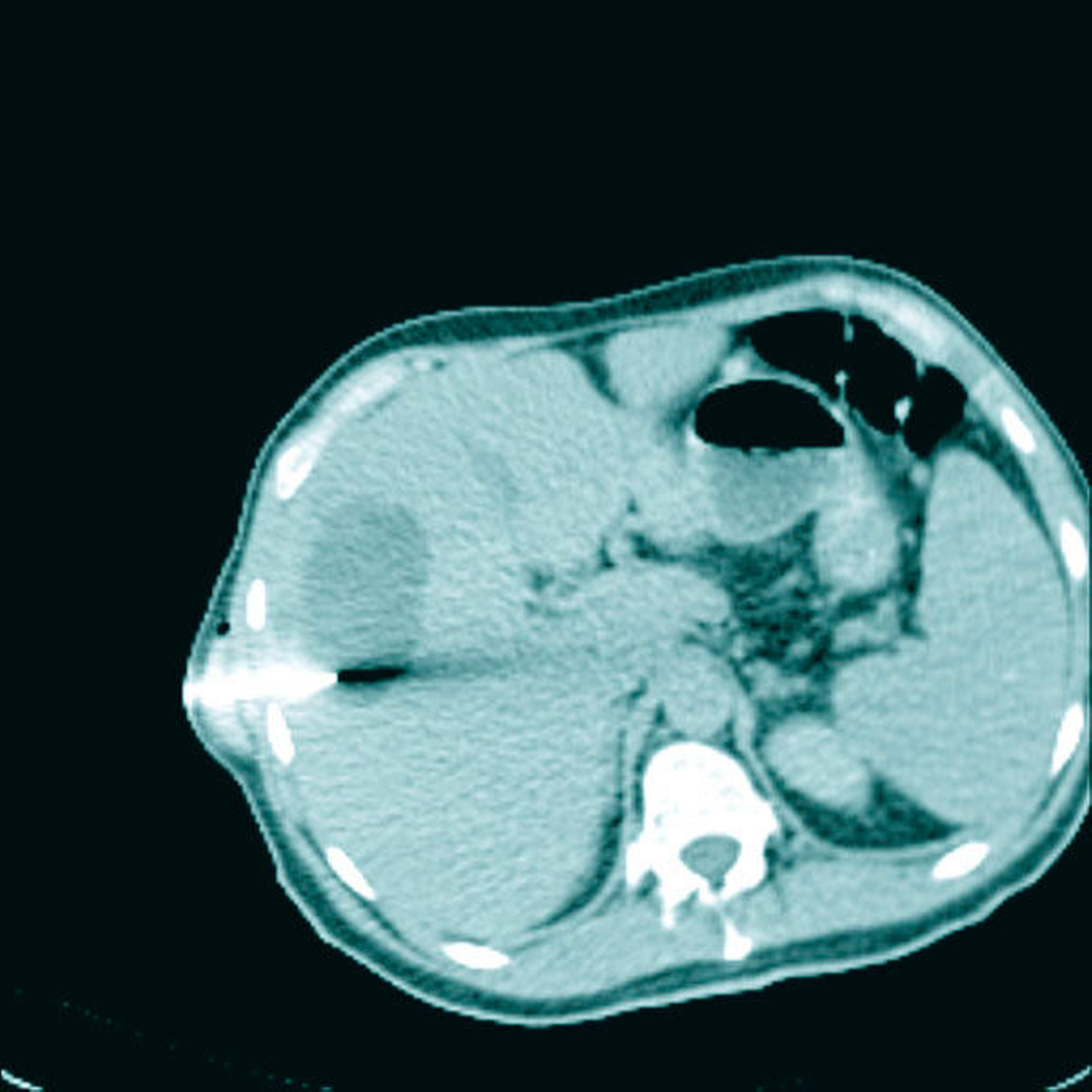
Eine Blutkultur war negativ, er hatte kein Fieber, im Orthopantomogramm fand sich kein Anhalt für Karies. Eine diagnostische CT des Abdomens bestätigte den Abszess, der im Anschluss unter CT-Durchleuchtung drainiert wurde (Abbildung 2). Bei der Punktion des Leberabszesses wurde ein Abstrich entnommen, der reichlich Propionibacteriurm propionicum und Porphyromonas gingivalis (Bacteroides gingivalis) zeigte. Auf eine Antibiotikatherapie mit Metronidazol, später Clindamycin und tägliche Spülungen der Abszesshöhle kam es zu einer raschen Befundbesserung. Nach einer Woche konnte die Drainage entfernt werden. Die Antibiotikatherapie wurde für vier Wochen fortgesetzt. Der Patient war danach beschwerdefrei. Im weiteren Verlauf erfolgte eine Embolisation der pulmonalen arteriovenösen Malformationen.
Diskussion: Morbus Osler
Der Morbus Osler ist eine autosomal-dominant vererbte Erkrankung, bei der es zur Erweiterung von Gefäßen kommt. Sie wird auch als hereditäre hämorrhagische Teleangiektasie (HHT) bezeichnet. Dieser Terminus beschreibt das Spektrum treffend, da er bereits drei der vier klinischen Kriterien umfasst. Diese sogenannten Curaçao-Kriterien [Shovlin, 2010] sind:
1. Heredität / Vererbbarkeit:
Dieses Kriterium ist erfüllt, wenn es wenigstens einen Verwandten ersten Grades mit gesicherter Diagnose gibt.
2. Hämorrhagie / Nasenbluten:
Bedingung für dieses Kriterium ist rezidivierendes, spontanes Nasenbluten des Patienten.
3. Teleangiektasien:
Derartige rote, kleine Gefäßveränderungen in Prädilektionsbereichen wie der Mundschleimhaut, Lippe, Gesicht, Finger, Nasenschleimhaut stellen ein weiteres Kriterium dar.
4. Viszerale Beteiligung:
Dieses Kriterium wird im Terminus HHT nicht erfasst. Es beinhaltet zerebrale und hepatische vaskuläre Malformationen, pulmonale arteriovenöse Malformationen sowie eine mögliche gastrointestinale Beteiligung.
Bei zwei erfüllten Kriterien wird die Verdachtsdiagnose gestellt, bei dreien und mehr gilt die Diagnose als gesichert. Da sich die fazialen, labialen und oralen Teleangiektasien im Blickfeld des Zahnarztes befinden, kann er durch eine einfache Frage („Haben Sie oder jemand in Ihrer Verwandtschaft häufiges Nasenbluten?“) bei Vorliegen derartiger Gefäßveränderungen bereits eine Verdachtsdiagnose stellen. Zur Diagnosesicherung ist es sinnvoll, über die Selbsthilfegruppe (www.morbus-osler.de) den Kontakt zu Zentren oder Ärzten mit Expertise auf diesem Gebiet zu suchen.
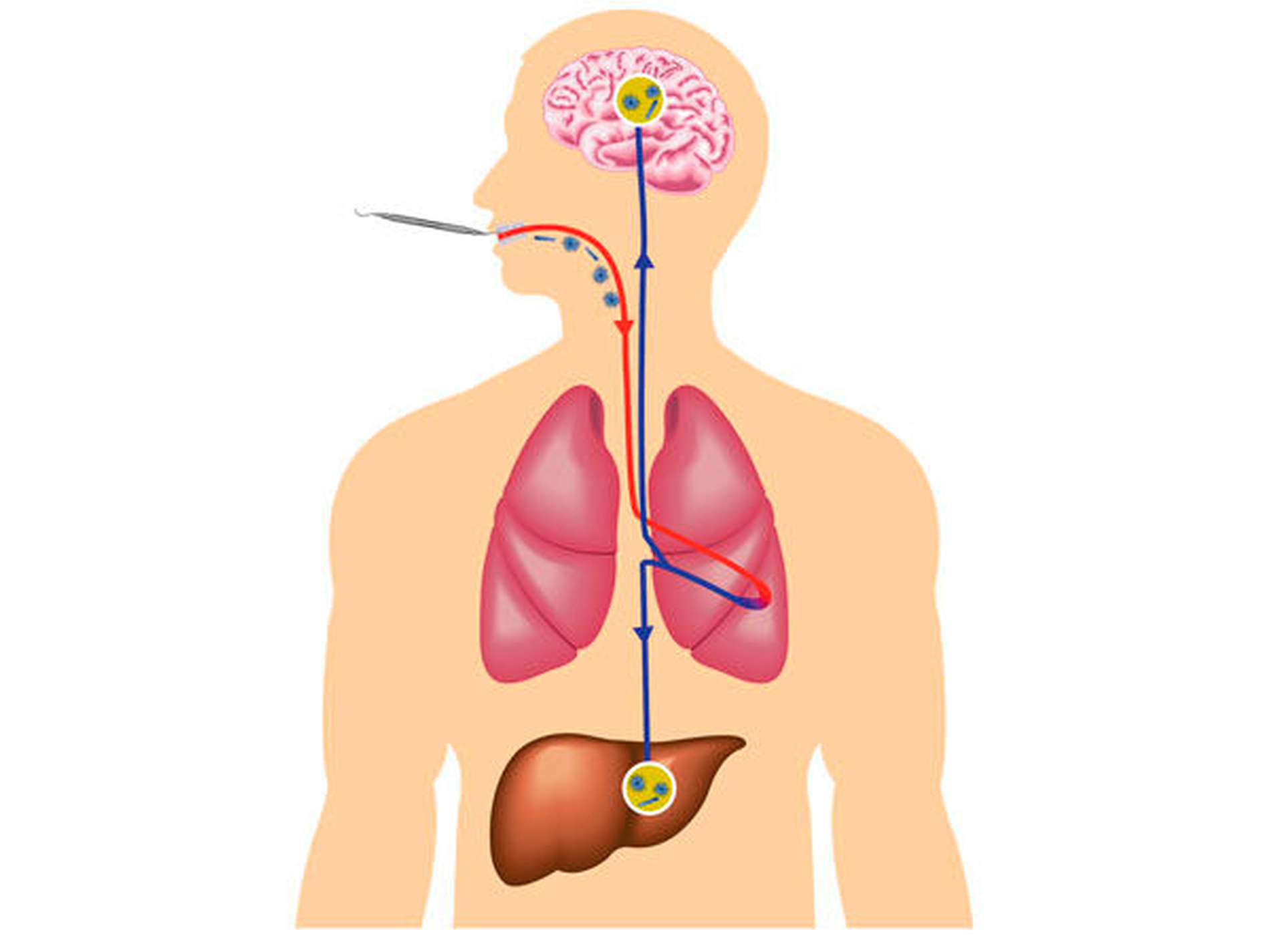
Seit 1991 ist bekannt, dass es durch die Bakteriämie im Rahmen von Zahnbehandlungen beim Morbus Osler zu Abszessen kommen kann [Mohler, 1991]. Der wesentliche Grund hierfür ist wahrscheinlich das Vorliegen von pulmonalen arteriovenösen Malformationen (PAVM). Diese finden sich bei 15 bis 50 Prozent der Betroffenen mit M. Osler [Faughnan, 2011]. Es handelt sich um einen zentralen Shunt ähnlich den kardialen Shunts. Im Gegensatz zu den meisten kardialen Shunts werden bei PAVM Bakterien oder Thromben jedoch entlang des Druckgradienten vom kleinen in den großen Kreislauf verschleppt. Wahrscheinlich ist dadurch die Gefahr von paradoxen Embolien deutlich erhöht.
In der Folge treten besonders Hirninfarkte, Hirnabszesse und extra-kranielle Infektionen auf – wie in diesem Fall die Leberabszesse [Musso, 2014] (Abbildungen 2 und 3). Diese entzündlichen Komplikationen treten auch mit einer zeitlichen Latenz von mehreren Wochen auf [Mohler, 1991]. Da Lungengefäßmissbildungen ansonsten oft asymptomatisch sind, werden sie auch als „tickende Zeitbomben“ bezeichnet, die sich meist einfach mittels perkutaner Katheterembolisation „entschärfen“ lassen. Ein Screening auf Lungengefäßmissbildungen (PAVM) wird deshalb international bei allen Patienten mit gesichertem oder möglichem Morbus Osler empfohlen.
Außerdem empfehlen die internationalen Richtlinien eine antibiotische Prophylaxe bei allen Eingriffen mit potenzieller Bakteriämie entsprechend den aktuellen Empfehlungen zur Endokarditisprophylaxe bei allen M.-Osler-Patienten, bei denen PAVM bisher nicht ausgeschlossen wurden [Faughnan et al., 2011]. Der hier dargestellte Fall verdeutlicht die Bedeutung dieser Maßnahme, die die aufgetretene Komplikation wahrscheinlich hätte verhindern können.
Vonseiten der Morbus-Osler-Selbsthilfe werden Ausweise zu diesem Sachverhalt kostenlos zur Verfügung gestellt.
Fazit für die Praxis
Die Verdachtsdiagnose eines Morbus Osler kann durch einen Zahnarzt bei Vorliegen von typischen Teleangiektasien im Mund-, Lippen-, Gesichtsbereich und Nasenbluten beim Patienten selbst oder in der Familie gestellt werden. Zur weiteren Abklärung sollte dem Patienten die Kontaktaufnahme mit spezialisierten Zentren/Ärzten empfohlen werden.
Wenn Lungengefäßmissbildungen nicht ausgeschlossen wurden, sollte eine Antibiotikaprophylaxe bei allen Eingriffen mit potenzieller Bakteriämie entsprechend den aktuellen Empfehlungen zur Prophylaxe der infektiösen Endokarditis gegeben werden.
Zusammenfassung
Zahnärztliche Eingriffe gehen oft mit einer Bakteriämie einher, die bei einem zentralen Shunt eine viszerale Abszedierung bedingen kann. Bei diesem 50-jährigen Mann mit M. Osler und pulmonalen arteriovenösen Malformationen trat nach einer professionellen Zahnreinigung ein Leberabszess auf. Da beim Morbus Osler Lungengefäßmissbildungen gehäuft vorkommen, wird eine Antibiotikaprophylaxe bei allen Eingriffen mit potenzieller Bakteriämie entsprechend der aktuellen Empfehlungen zur Prophylaxe der infektiösen Endokarditis empfohlen, solange Lungengefäßmissbildungen nicht eindeutig ausgeschlossen wurden. Falls möglich, sollten diese nach der Diagnose embolisiert werden.
Prof. Dr. Urban Geisthoff und
Prof. Dr. Boris A. Stuck
Klinik für Hals-, Nasen- und Ohrenheilkunde
Universitätsklinikum Gießen und Marburg GmbH
Baldingerstr., 35043 Marburg
Prof Dr. Dr. Frank Hölzle
MKG-Chirurgie des Universitätsklinikums Aachen der RWTH Aachen
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie
Pauwelsstr. 30, 52074 Aachen
Dr. Freya Dröge
Klinik für Hals-, Nasen- und Ohrenheilkunde
Universitätsklinikum Essen
Hufelandstr. 55, 45147 Essen
Christina Grabowski
Beisitzerin des Vorstands der Morbus Osler-Selbsthilfe e.V. – bundesweit
Grasdiek 4, 21220 Seevetal
Kontakt:
Prof. Dr. Urban Geisthoff
Univ.-HNO-Klinik Marburg
Tel.: 06421/58–66478 (Sekr.)
Helfen Sie mit!
Der Morbus Osler ist eine seltene Erkrankung. Eine hohe Dunkelziffer an unerkannten Morbus-Osler-Patienten wird vermutet. Der Zahnarzt kann als erster eine Verdachtsdiagnose stellen und dadurch Patienten vor lebensbedrohlichen Komplikationen (wie im beschriebenen Fall) bewahren. Tragen Sie bitte im Sinne der Patienten mit dazu bei: Haben Sie einen offenen Blick für Teleangiektasien. Wenn Sie diese sehen, fragen Sie nach Nasenbluten beim Patienten oder in der Familie. Im Verdachtsfall geben Sie bei invasiven zahnmedizinischen Eingriffen eine Antibiotikaprophylaxe und empfehlen Sie die Abklärung an einem Zentrum. Für den Kontakt hierzu bietet sich die Selbsthilfe an:
Kontakt:
Morbus Osler-Selbsthilfe e.V.
Günter Dobrzewski, 1. Vorsitzender
Kammerlandstr. 3, 89264 Weißenhorn
0800/7236044 oder 07309/9297831
info@morbus-osler.de oder mo.dob@t-online.de
www.morbus-osler.de
Literatur
Faughnan ME, Palda VA, Garcia-Tsao G, Geisthoff UW, McDonald J, Proctor DD, Spears J, Brown DH, Buscarini E, Chesnutt MS, Cottin V, Ganguly A, Gossage JR, Guttmacher AE, Hyland RH, Kennedy SJ, Korzenik J, Mager JJ, Ozanne AP, Piccirillo JF, Picus D, Plauchu H, Porteous ME, Pyeritz RE, Ross DA, Sabba C, Swanson K, Terry P, Wallace MC, Westermann CJ, White RI, Young LH, Zarrabeitia R. International Guidelines for the Diagnosis and Management of Hereditary Hemorrhagic Telangiectasia. J Med Genet. 2011 Feb;48(2):73-87
Shovlin CL, Guttmacher AE, Buscarini E, Faughnan ME, Hyland RH, Westermann CJ, Kjeldsen AD, Plauchu H. Diagnostic criteria for hereditary hemorrhagic telangiectasia (Rendu-Osler-Weber syndrome). Am J Med Genet. 2000 Mar 6;91(1):66-7
Mohler ER, Monahan B, Canty MD, Flockhart DA. Cerebral abscess associated with dental procedure in hereditary haemorrhagic telangiectasia. Lancet. 1991 Aug 24;338(8765):508-9
Musso M, Capone A, Chinello P, Di Bella S, Galati V, Noto P, Taglietti F, Topino S, Petrosillo N. Extra-cerebral severe infections associated with haemorrhagic hereditary telangiectasia (Rendu-Osler-Weber Disease): five cases and a review of the literature. Infez Med. 2014 Mar;22(1):50-6









