Ausgedehnte fibröse Dysplasie des linken Oberkiefers
Ein 15-jähriger Patient wurde mit einer schmerzlosen Auftreibung des linken Oberkiefers erstmals im November 2020 in der Klinik für Mund-, Kiefer- und Gesichtschirurgie des Klinikums Vest, Knappschaftskrankenhaus Recklinghausen, vorstellig.
Die allgemeine Anamnese ergab keine Auffälligkeiten, Vorerkrankungen oder zuvorige operative Eingriffe. In der speziellen Anamnese gab der Patient eine mehrjährige kieferorthopädische Behandlung an. Im Verlauf der vergangenen zwei Jahre sei eine zunehmende, nicht druckdolente Schwellung des linken Oberkiefers aufgefallen, die nunmehr auch äußerlich sichtbar war. Ebenfalls hatte der Patient ein im Vergleich zur Gegenseite leicht hervorstehendes linkes Auge bemerkt. Erst kürzlich seien im linken oberen Seitenzahnbereich teilweise auch schmerzhafte Sensationen mit Projektion auf die Zähne, aber auch auf das linke Ohr aufgetreten. Weitere Beschwerden bestanden zum Zeitpunkt der Vorstellung nicht.
Im Orthopantomogramm (OPG) von 2020 (Abbildung 1) zeigte sich eine Divergenz zwischen den Zahnwurzeln 25 und 26 bei interdentaler homogener Verschattung mit Ausdehnung innerhalb des Processus alveolaris der Maxilla in Höhe 25 bis 27 sowie Fortsetzung nach kranial mit Projektion auf den Sinus maxillaris links. Nebenbefundlich waren die Weisheitszähne 28, 38 und 48 raumbeengt angelegt. Im OPG von 2017 (Abbildung 2) hatte schon eine angedeutete Divergenz der Wurzeln 25 und 26 ohne weitere Hinweise auf das sich später entwickelnde Bild bestanden, möglicherweise der Punkt, von dem die Erkrankung ihren Ausgang nahm. Hauszahnärztlich waren Erkrankungen der Zähne und des Parodonts im Vorfeld ausgeschlossen worden.
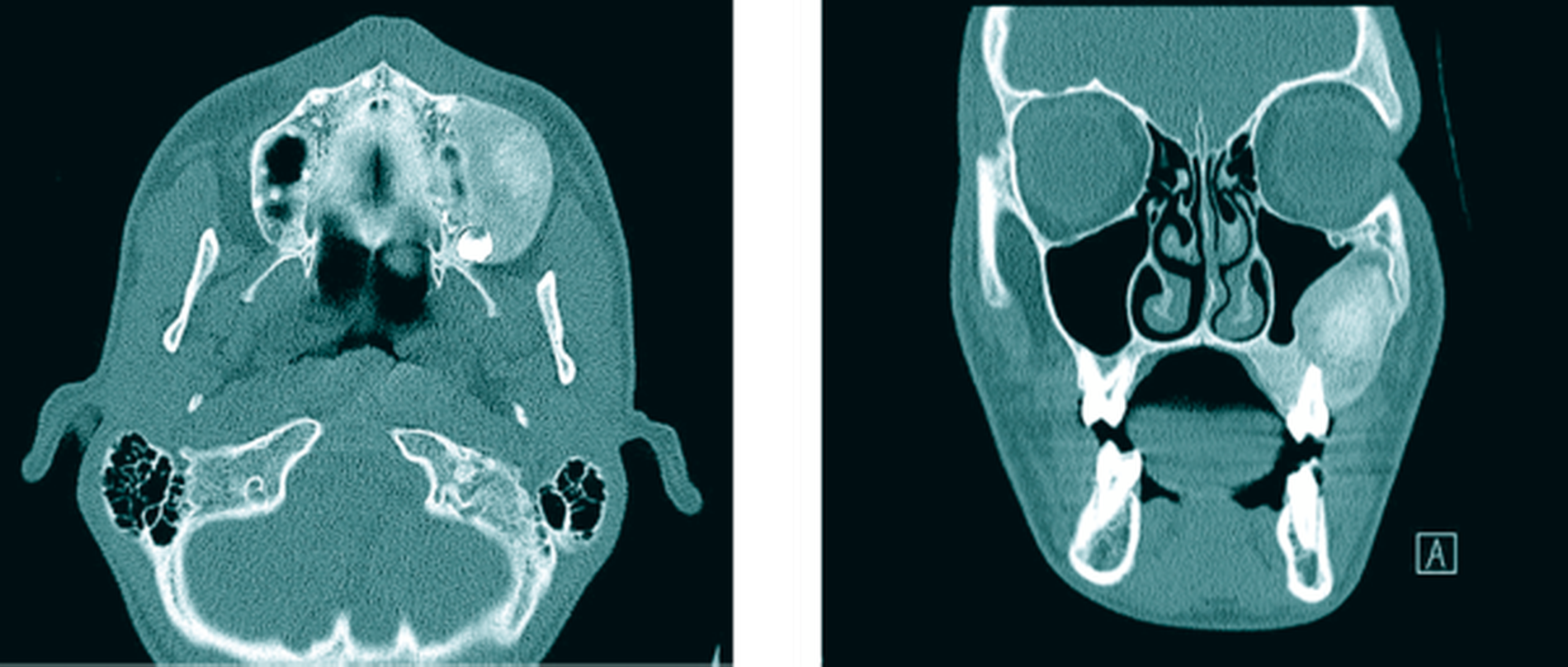
Die zur weiteren dreidimensionalen Ausbreitungsdiagnostik, einschließlich des Bezugs zur Orbita, sowie zur Beurteilung des extrakraniellen knöchernen Verlaufs des zweiten Trigeminusastes und des Canalis opticus durchgeführte native Computertomografie (CT) des Gesichtsschädels (Abbildung 3) zeigte eine homogene und scharf begrenzte ossäre Raumforderung der linken Maxilla mit milchglasartiger Matrix unter Beteiligung des Processus alveolaris, des Processus zygomaticus und der lateralen Kieferhöhlenwand sowie einer Beteiligung der kaudolateralen Anteile des Orbitabodens und einer geringen Auftreibung der rostralen Anteile des Canalis infraorbitalis. Konsekutiv war der Sinus maxillaris bei regelrechter Belüftung von lateral pelottiert. Die Orbita zeigte ansonsten eine symmetrische Darstellung einschließlich der retrobulbären Strukturen und des Canalis opticus ohne CT-grafisch erkennbaren Exophthalmus. Die Läsion zeigte weder eine Kortikalisdestruktion noch eine Periostreaktion oder eine suspekte Weichteilkomponente. Die augenärztliche Untersuchung blieb ohne weiteren pathologischen Befund. Die Zusammenschau der bildgebenden und der klinischen Befunde führte zur Arbeitsdiagnose einer fibrösen Dysplasie der Maxilla.
Aufgrund der bestehenden Symptomatik des Patienten wurde die Indikation für ein operatives Vorgehen in oraler Intubationsnarkose gestellt. Gleichzeitig sollten die Weisheitszähne 28, 38, 48 entfernt werden. Nach Narkoseeinleitung wurde ein Lokalanästhetikum mit Adrenalinzusatz 1:200.000 injiziert (Abbildung 4a).
Anschließend folgte die marginale Schnittführung von 27 bis 23 mit jeweils zwei vertikalen Entlastungsschnitten. Nach Bildung des Mukoperiostlappens und Darstellung des Nervus infraorbitalis erfolgte die Abtragung der fibrösen Dysplasie unter Schonung der Zahnwurzeln und des Nervus infraorbitalis (Abbildungen 4b und 4c). Die Weisheitszähne 28, 38 und 48 wurden ebenfalls entfernt. Bei Zahn 28 kam es dabei zu einer Mund-Antrum-Verbindung, die plastisch gedeckt wurde. Das entnommene Hartgewebe wurde zur histopathologischen Beurteilung ins Knochentumor-Referenzzentrum und DÖSAK-Referenzregister nach Basel (Prof. Dr. Baumhoer) geschickt.
Histologisch (Abbildung 5) zeigte sich eine monomorphe fibro-ossäre Läsion bestehend aus einem reifen und fibroblastären Spindelzellstroma und neu gebildeten Geflechtknochenbälkchen. Die Matrix zeigte Zeichen der lamellären Ausreifung und stellenweise Osteoblasten auf ihrer Oberfläche als Zeichen eines bereits begonnenen reaktiven Remodellings. Im Kontext der Bildgebung wurde die Diagnose einer kraniofazialen fibrösen Dysplasie gestellt.
Der postoperative Verlauf gestaltete sich komplikationslos: Motorik und Sensibilität im Operationsfeld waren intakt, die Durchblutung und die Wundheilung ungestört. Nach der Abschwellung war eine Asymmetrie der Gesichtskonturen nicht mehr auffällig. Es wurden regelmäßige Kontrolluntersuchungen in unserer Ambulanz sowie ein augenärztlicher und radiologischer Recall empfohlen.
Diskussion
Die fibröse Dysplasie ist eine gutartige, selbstlimitierende Knochenveränderung, die erstmals durch Lichtenstein 1938 beschrieben wurde [Lichtenstein, 1938]. Es handelt sich nicht um eine Neoplasie, sondern vielmehr um eine Entwicklungsstörung. Pathogenetisch liegt eine Mutation im GNAS1-Gen vor. Diese führt zu einer Steigerung der c-AMP-Synthese, die die Differenzierung und Proliferation der Osteoblasten beeinflusst. Unreifer Faserknochen ersetzt dadurch den Lamellenknochen und bildet feinschichtiges Osteoid [Weinstein, 2006]. Betroffen sind vorwiegend Kinder und junge Erwachsene (Diagnose in 75 Prozent der Fälle vor dem 30. Lebensjahr, höchste Inzidenz zwischen dem 3. und dem 15. Lebensjahr, Prävalenz circa 1:30.000). Es liegt keine Prädilektion bezüglich des Geschlechts vor [Hart et al., 2007].
Grundsätzlich kann eine monostotische Form, die einen Knochen befällt, von einer polyostotischen Form, die mehrere Knochen befällt, unterschieden werden. Während sich die monostotische Form eher in gehobenen Altersgruppen findet, wird die polyostotische Form häufiger bereits bei Kindern unter zehn Jahren diagnostiziert [White und Pharoah, 2009]. Typische Lokalisationen sind in erster Linie die Rippen, das Becken, der Femur und der Gesichtsschädel [Anitha et al., 2015]. Die monostotische Form kommt annähernd zweimal häufiger im hinteren Oberkiefer als im Unterkiefer vor [Menon et al., 2013].
Auch wenn die fibröse Dysplasie üblicherweise sporadisch ist, sind Assoziationen mit dem McCune-Albright-Syndrom (insbesondere bei der polyostotischen Form in fünf Prozent der Fälle) bekannt [Leschka et al., 2013]. Bei diesen Patienten liegen zusätzlich Café-au-lait-Flecken der Haut, eine Pubertas praecox und weitere Endokrinopathien vor. Der Cherubismus beim Kleinkind mit beidseitigem Befall von Ober- und Unterkiefer ist eine weitere Entität aus dieser Erkrankungsgruppe.
Die fibröse Dysplasie ist häufig ein Zufallsbefund. Bei asymptomatischen lokalisierten Manifestationen ist für gewöhnlich keine Therapie erforderlich, da die fibröse Dysplasie nach der Pubertät üblicherweise selbstlimitierend ist und kein weiterer Befundprogress auftritt [Kuznetsov et al., 2008]. Insbesondere bei der kraniofazialen Lokalisation können sich jedoch Symptome wie Schwellungen, Gesichtsdeformationen, Augenmotilitätsstörungen, Seh- und Hörminderungen, Störungen des Geruchssinns oder Atemwegseinschränkungen ergeben [Lee et al., 2012]. Eine maligne Entartung (Osteosarkom, Fibrosarkom, malignes fibröses Histiozytom) ist in seltenen Fällen (< 1 Prozent) möglich [Oh et al., 2020; Yabut et al., 1988]. Aus zahnärztlicher Sicht kann die fibröse Dysplasie im Ober- und im Unterkiefer zur Verdrängung von Zähnen, zu einem verzögerten oder behinderten Zahndurchbruch und zu Malokklusionen führen [Alves et al., 2016]. Aus kieferorthopädischer Sicht muss mit einer verlängerten Behandlungszeit und mit einer höheren Rezidivrate gerechnet werden [Lee et al., 2012].
Zahnbewegungen innerhalb der fibrösen Dysplasie scheinen schneller möglich zu sein [Burke et al., 2017].
In vielen Fällen kann eine Verdachtsdiagnose initial durch auffällige Gesichtsasymmetrien und Deformationen bereits klinisch gestellt werden [Menon et al., 2013]. Bildmorphologisch typisch ist projektionsradiografisch sowie in der CT – wie im vorliegenden Fall – eine homogene, milchglasartige Verschattung des betroffenen Knochens mit ausgedünnter, aber intakter Kortikalis sowie scharfer Begrenzung [Fitzpatrick et al., 2004]. Im Schädelskelett findet sich außerdem häufig eine kontinuierliche Ausbreitung über verschiedene Schädelknochen hinweg, die es in dieser Form eigentlich nur bei der fibrösen Dysplasie gibt (= kraniofaziale fibröse Dysplasie). Lytische oder sklerotische Veränderungen der Spongiosa können jedoch ebenfalls regelmäßig beobachtet werden. Eine Magnetresonanztomografie (MRT) liefert meist keine zusätzlichen Informationen, kann jedoch bei differenzialdiagnostischen Problemen helfen. Differenzialdiagnostisch ist je nach bildmorphologischem Befund insbesondere an einen Morbus Paget, an aneurysmatische oder juvenile Knochenzysten oder an Osteome zu denken [Lisle et al., 2008; Neville et al., 2009]; üblicherweise bereitet die Differenzialdiagnostik unter Berücksichtigung von Anamnese und Klinik jedoch keine Schwierigkeiten.
Histologisch findet sich ein charakteristisches, reifes Spindelzellstroma, das unreife Geflechtknochenformationen einschließt. Die neu gebildete Matrix kann an chinesische Schriftzeichen erinnern und bildet häufig unvollständige Spangen aus. In der Bindegewebsfärbung (zum Beispiel van Gieson) lassen sich radiär aus den Bälkchen ins Stroma ausstrahlende Sharpey’sche Fasern nachvollziehen, typischerweise fehlen auf der Bälkchenoberfläche kubische Osteoblastensäume. Über die Zeit kommt es aber zu regressiven Veränderungen des Befunds und Remodellierungsprozesse setzen ein, bei denen die läsionalen Bälkchen lamellär umgebaut werden und auf ihrer Oberfläche Osteoblasten erkennen lassen. Genetisch liegt der fibrösen Dysplasie eine postzygotische Mutation im GNAS-Gen zugrunde, deren Nachweis in diagnostisch schwierigen Fällen hilfreich sein kann.
Die Therapie ist abhängig von Ausmaß und Lokalisation der Erkrankung. Abhängig vom Leidensdruck ist sowohl eine abwartende Haltung als auch eine operative Versorgung möglich. Ziele der operativen Versorgung sind die Verminderung von Schmerzen, die ästhetische Rehabilitation sowie das Vermeiden von Nervenkompressionen und entsprechenden Funktionsausfällen [Menon et al., 2013]. Der Einsatz von Antiresorptiva zur Behandlung der fibrösen Dysplasie wird derzeit kontrovers diskutiert. Insbesondere bei ausgeprägten, polyostotischen Verläufen und bei Schmerzpersistenz werden Antiresorptiva eingesetzt, um eine Progression zu verhindern [Anitha et al., 2015].
Dr. med. dent. Malte Masthoff, M.Sc.
Klinik für Mund-, Kiefer- und Gesichtschirurgie – Plastische Operationen,
Klinikum Vest, Knappschaftskrankenhaus Recklinghausen
Dorstener Str. 151, 45657 Recklinghausen
malte.masthoff@klinikum-vest.de
Dr. med. Max Masthoff, MBA
Klinik für Radiologie, Universitätsklinikum Münster
Albert-Schweitzer Campus 1A, 48149 Münster
Prof. Dr. med. Daniel Baumhoer
Knochentumor-Referenzzentrum und DÖSAK Referenzregister am Institut für Medizinische Genetik und Pathologie,
Universitätsspital Basel
Schönbeinstr. 40, CH-4031 Basel
Prof. Dr. med. Dr. med. dent. Harald Eufinger
Klinik für Mund-, Kiefer- und Gesichtschirurgie – Plastische Operationen,
Klinikum Vest, Knappschaftskrankenhaus Recklinghausen
Dorstener Str. 151, 45657 Recklinghausen
Fazit für die Praxis
Erste Symptome einer fibrösen Dysplasie können schmerzlose Auftreibungen des Alveolarfortsatzes sein.
Aufgrund des selbstlimitierenden Wachstums wird die Indikation zur chirurgischen Therapie zurückhaltend und nur bei Beschwerdesymptomatik gestellt.
Sollten Antiresorptiva zur Therapie der fibrösen Dysplasie der Kieferknochen oder anderer Lokalisationen eingesetzt werden, müssen für die zahnärztliche Wertung vor Therapiebeginn und für zahnärztlich-chirurgische Maßnahmen nach erfolgter Applikation die gleichen Kriterien wie bei allen Patienten mit antiresorptiver Therapie angewandt werden.
Bei einer KFO-Behandlung muss mit einer verlängerten Behandlungsdauer und mit einer höheren Rezidivrate gerechnet werden.
Literaturliste
1. Alves, N., de Oliveira, R.J., Takehana, D. & Deana, N.F. 2016, 'Recurrent monostotic fibrous dysplasia in the mandible', Case Rep Dent, vol. 2016, p. 3920850.
2. Anitha, N., Sankari, S.L., Malathi, L. & Karthick, R. 2015, 'Fibrous dysplasia - recent concepts', J Pharm Bioallied Sci, vol. 7, suppl 1, pp. S171-2.
3. Burke, A.B., Collins, M.T. & Boyce, A.M. 2017, 'Fibrous dysplasia of bone: craniofacial and dental implications', Oral Dis, vol. 23, no. 6, pp. 697-708.
4. Fitzpatrick, K.A., Taljanovic, M.S., Speer, D.P., Graham, A.R., Jacobson, J.A., Barnes, G.R. & Hunter, T.B. 2004, 'Imaging findings of fibrous dysplasia with histopathologic and intraoperative correlation', AJR Am J Roentgenol, vol. 182, no. 6, pp. 1389-98.
5. Hart, E.S., Kelly, M.H., Brillante, B., Chen, C.C., Ziran, N., Lee, J.S., Feuillan, P., Leet, A.I., Kushner, H., Robey, P.G. & Collins, M.T. 2007, 'Onset, progression, and plateau of skeletal lesions in fibrous dysplasia and the relationship to functional outcome', J Bone Miner Res, vol. 22, no. 9, pp. 1468-74.
6. Kuznetsov, S.A., Cherman, N., Riminucci, M., Collins, M.T., Robey, P.G. & Bianco, P. 2008, 'Age-dependent demise of GNAS-mutated skeletal stem cells and „normalization“ of fibrous dysplasia of bone', J Bone Miner Res, vol. 23, no. 11, pp. 1731-40.
7. Lee, J.S., FitzGibbon, E.J., Chen, Y.R., Kim, H.J., Lustig, L.R., Akintoye, S.O., Collins, M.T. & Kaban, L.B. 2012, 'Clinical guidelines for the management of craniofacial fibrous dysplasia', Orphanet J Rare Dis, vol. 7, suppl 1, p. S2.
8. Leschka, S.C., Arndt, S. & Meckel, S. 2013, '[Polyostotic Fibrous dysplasia of the clivus: atypical CT and MRI imaging]', Rofo, vol. 185, no. 1, pp. 77-9.
9. Lichtenstein, L. 1938, 'Polyostotic fibrous dysplasia ', Arch Surg, vol. 36, no. 5, pp. 874-98.
10. Lisle, D.A., Monsour, P.A. & Maskiell, C.D. 2008, 'Imaging of craniofacial fibrous dysplasia', J Med Imaging Radiat Oncol, vol. 52, no. 4, pp. 325-32.
11. Menon, S., Venkatswamy, S., Ramu, V., Banu, K., Ehtaih, S. & Kashyap, V.M. 2013, 'Craniofacial fibrous dysplasia: surgery and literature review', Ann Maxillofac Surg, vol. 3, no. 1, pp. 66-71.
12. Neville, B.W., Damm, D.D., Allen, C.M. & Bouquot, J.E. 2009, 'Oral and maxillofacial pathology'. Saunders/Elsevier, Philadelphia.
13. Oh, S.H., Kang, J.H., Seo, Y.K., Kim, J.H., Choi, Y.S. & Hwang, E.H. 2020, 'Malignant transformation of fibrous dysplasia into angiosarcoma', Oral Radiol, vol. 36, no. 1, pp. 116-20.
14. Weinstein, L.S. 2006, 'G(s)alpha mutations in fibrous dysplasia and McCune-Albright syndrome', J Bone Miner Res, vol. 21 suppl 2, pp. P120-4.
15. White, S.C. & Pharoah, M.J. 2009, Oral radiology: principles and interpretation, Mosby/Elsevier, St. Louis.
16. Yabut, S.M., Jr., Kenan, S., Sissons, H.A. & Lewis, M.M. 1988, 'Malignant transformation of fibrous dysplasia. A case report and review of the literature', Clin Orthop Relat Res, no. 228, pp. 281-9.









