Klinische Empfehlungen zur zweiten Therapiestufe – subgingivale Instrumentierung
Nach der ersten Therapiestufe in der zm 6 folgt nun in der zweiten Stufe die subgingivale Instrumentierung, gegebenenfalls ergänzt um adjuvante Maßnahmen. Ziel ist die Reduktion beziehungsweise die Beseitigung der parodontalen Entzündung – klinisch erfasst durch den Rückgang der Taschensondierungstiefen und der Blutung auf Sondierung.
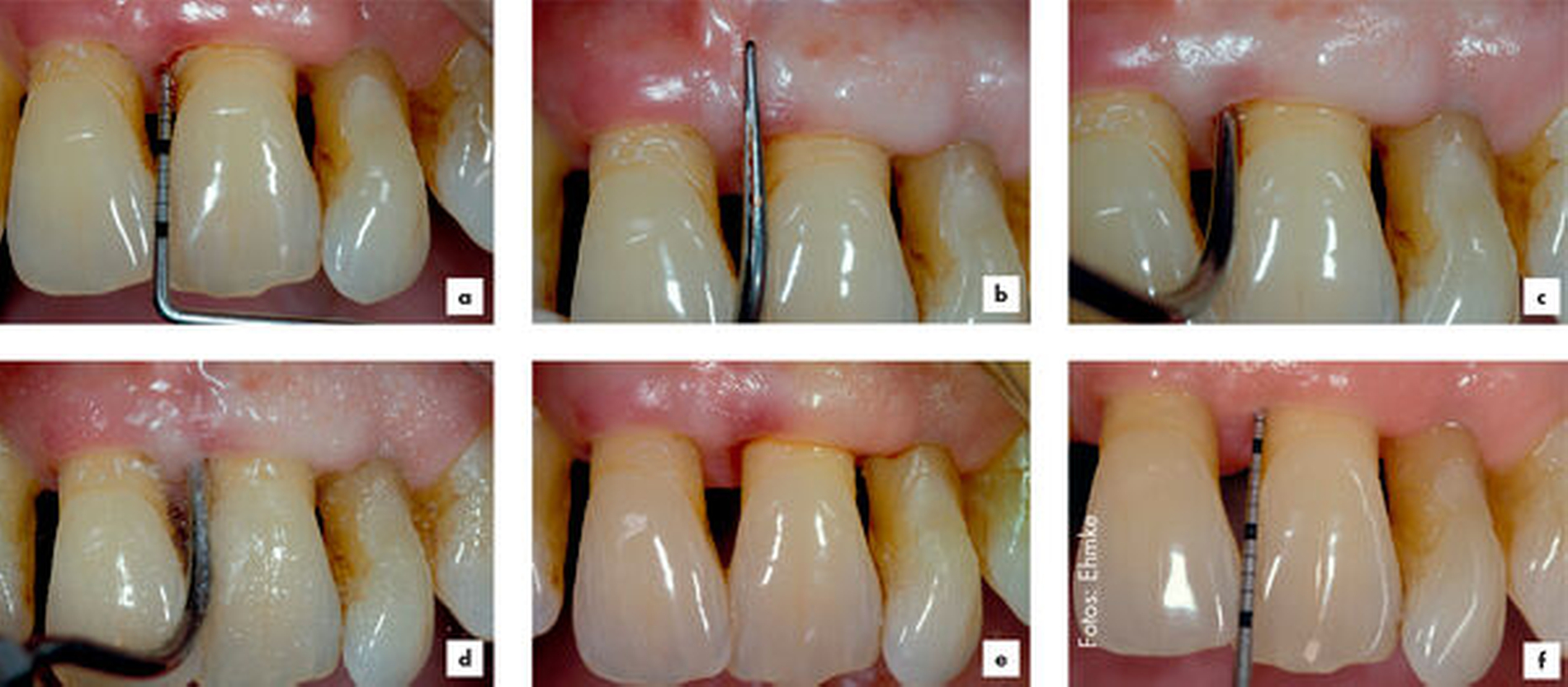
Die zweite Therapiestufe (auch als ursachengerichtete Therapie bekannt) zielt auf die Beseitigung (Reduktion) von subgingivalem Biofilm sowie subgingivalem Zahnstein und kann mit der Entfernung von Anteilen der Wurzeloberfläche (Wurzelzement) einhergehen. Diese Intervention hat in der Literatur verschiedene Namen: subgingivales Debridement, subgingivales Scaling, Root Planing et cetera [Kieser, 1994]. In der Leitlinie wurde vereinbart, den Begriff „subgingivale Instrumentierung“ für alle nicht-chirurgischen Interventionen zu verwenden, die entweder mit Küretten oder mit maschinell betriebenen Instrumenten (Schall/Ultraschall) durchgeführt werden. Diese Instrumente wurden konzipiert, um den Zugang zur Wurzeloberfläche im subgingivalen Bereich zu erleichtern und um effektiv subgingivalen Biofilm und subgingivalen Zahnstein zu entfernen (Abbildung 1).
Diese zweite Therapiestufe erfordert die erfolgreiche Implementierung der ersten Therapiestufe. Zusätzlich kann die subgingivale Instrumentierung durch folgende Maßnahmen ergänzt werden:
Einsatz von adjuvanten physikalischen oder chemischen Mitteln,
Einsatz von adjuvanten immunmodulatorischen Mitteln (lokal oder systemisch),
Einsatz von adjuvanten subgingival lokal applizierten, antimikrobiellen Substanzen,
Einsatz von adjuvanten systemischen Antibiotika.
Als patientenrelevanter primärer Endpunkt wurde in den diesen Empfehlungen zugrunde liegenden Systematic Reviews die Reduktion der Taschensondierungstiefen nach sechs Monaten untersucht [Loos und Needleman, 2020].
1. Intervention: subgingivale Instrumentierung
In einer systematischen Übersichtsarbeit für den European Workshop haben Suvan et al. [2020] drei relevante Fragen zur subgingivalen Instrumentierung adressiert:
Hat die subgingivale Instrumentierung einen positiven Effekt auf die Behandlung einer Parodontitis?
Die subgingivale Instrumentierung hat zum Ziel, durch die Entfernung harter und weicher Beläge von der Wurzeloberfläche die Weichgewebsentzündung zu reduzieren. Eine Zielgröße der Behandlung ist „Pocket Closure“ (geschlossene Taschen), was als Taschensondierungstiefe (TST) ≤ 4 mm und Abwesenheit von Bluten auf Sondieren (BOP) definiert ist. Ein RCT mit 169 Patienten mit einem dreimonatigem Follow-up und weitere elf prospektive Studien (n = 258) mit einem sechsmonatigem Follow-up wurden analysiert. Erfasst wurden die postoperative Reduktion der TST (primäre Zielgröße) und der prozentuale Anteil von geschlossenen Taschen (sekundäre Zielgröße). Die Evidenz zeigte eine durchschnittliche Reduktion der TST von 1,7 mm nach sechs Monaten, einen mittleren Anteil an geschlossenen Taschen von 74 Prozent und eine durchschnittliche Reduktion des BOP um 63 Prozent. Tiefere Taschen (> 6 mm) zeigten eine größere mittlere Reduktion der Taschensondierungstiefe von 2,6 mm (Abbildung 2).
Die Evidenz war in allen elf Studien, die in die Prä- und Post-Behandlungs-Analyse eingeschlossen waren, konsistent und wurde deshalb als hoch bewertet. Die meisten Studien wurden im gut kontrollierten wissenschaftlichen Umfeld durchgeführt und schlossen nur Patienten ohne systemische Erkrankungen ein. Obwohl Ergebnisse aus Studien mit systemisch erkrankten Patienten nicht in dieses systematische Review eingeschlossen wurden, gibt es einen Konsens, dass subgingivale Instrumentierung auch in diesen Patientengruppen effektiv ist [Sanz et al, 2018; 2020], aber für die Bestimmung der Effektgröße bedarf es weiterer Studien.
Sind die Therapieergebnisse besser nach der Anwendung von Handinstrumenten, von maschinell betriebenen Instrumenten (Schall/Ultraschall) oder deren Kombination?
Es gibt eine Vielzahl an Instrumenten für die subgingivale Instrumentierung (Abbildung 3). Es wurden vier RCTs (n = 132) identifiziert. Die Ergebnisse wurden nach 6/8 Monaten für TST-Reduktion (primärer Endpunkt) und Gewinn an klinischem Attachmentniveau (CAL, sekundärer Endpunkt) bewertet. Die Evidenz zeigte keine klinisch relevanten oder statistisch signifikanten Unterschiede zwischen der Instrumentierung mit verschiedenen Instrumenten. Die Ergebnisse wurden als stark und konsistent bewertet.
Die Anwendung aller Instrumententypen ist techniksensitiv und bedarf deshalb eines speziellen Trainings. Falls berichtet, wurden keine offensichtlichen Unterschiede zwischen manuellen und maschinellen Instrumenten in Bezug auf postoperative Sensitivität gefunden. Auch existiert keine Evidenz dafür, dass ein Instrumententyp bezüglich der benötigten Behandlungszeit überlegen ist. Die Patientenpräferenz in Bezug auf die Wahl des Instrumentariums ist zu berücksichtigen. Kosteneffektivität wurde in diesen Studien nicht bewertet. Die meisten Studien wurden in gut kontrollierten Forschungsumfeldern an spezifisch ausgewählten Patientengruppen und unter Lokalanästhesie durchgeführt.
Die Behandler sollten sich darüber im Klaren sein, dass neue Instrumente (zum Beispiel Mini-Instrumente) in den verfügbaren Studien nicht untersucht wurden. Die Wahl des Instruments sollte auf der Erfahrung, den Fertigkeiten und den Präferenzen des Behandlers zusammen mit der Patientenpräferenz beruhen.
Sind die Therapieergebnisse bei quadrantenweisem Vorgehen über mehrere Termine oder im Full-Mouth-Ansatz (innerhalb von 24 Stunden) besser?
Die subgingivale Instrumentierung wurde traditionell in mehreren Sitzungen (das heißt quadrantenweise) durchgeführt. Alternativ wurden sogenannte „Full-Mouth“-Protokolle vorgestellt. Diese beinhalteten ein- und zweizeitige Therapien innerhalb von 24 Stunden. Diesem Ansatz liegt die Überlegung zugrunde, dass bei einer zeitlich komprimierten Vorgehensweise das Risiko einer Reinfektion der instrumentierten Taschen durch parodontalpathogene Mikroorganismen aus den noch nicht instrumentierten Taschen vermindert werden könnte (Abbildung 4). Protokolle, die Antiseptika beinhalteten (Full-Mouth-Disinfection), wurden in der Analyse von Suvan et al. [2020] nicht berücksichtigt. Eingeschlossen wurden acht RCTs (n = 212) mit einem Follow-up von ≥ 6 Monaten. Die Zielgrößen waren TST-Reduktion (primärer Endpunkt), Gewinn an klinischem Attachment (CAL), BOP-Reduktion und Pocket Closure (sekundäre Endpunkte). Es wurden keine deutlichen Unterschiede zwischen beiden Therapiemodalitäten festgestellt. Die Evidenz wurde als stark und konsistent bewertet. Die Ergebnisse bestätigen eine aktuelle Cochrane-Übersicht [Eberhard et al., 2015].
Behandler sollten wissen, dass es Hinweise für systemische Auswirkungen (zum Beispiel akute systemische Entzündungsreaktionen) bei Anwendung der Full-Mouth-Protokolle gibt [Graziani et al., 2015]. Deshalb sollte solch einem Therapieansatz immer eine sorgfältige Beurteilung des allgemeinen Gesundheitszustands des Patienten vorausgehen [Sanz et al., 2020]. Die Patientenpräferenz bezüglich des therapeutischen Vorgehens ist zu berücksichtigen. Es liegt nur eine begrenzte Evidenz bezüglich der Kosteneffektivität der verschiedenen Behandlungsansätze vor.
2. Intervention: adjuvante physikalische Ansätze
In einer systematischen Übersichtsarbeit haben Salvi et al. [2020] zwei relevante Fragen zu adjuvanten physikalischen Ansätzen bei der subgingivalen Instrumentierung adressiert:
Sind die Therapieergebnisse bei zusätzlicher Laserapplikation der alleinigen subgingivalen Instrumentierung überlegen?
Laser könnten eventuell die Ergebnisse der subgingivalen Instrumentierung verbessern, wenn sie ergänzend zur traditionellen Wurzeloberflächenbearbeitung verwendet werden. Abhängig von Wellenlänge und Einstellungen können manche Laser subgingivalen Zahnstein entfernen und üben antimikrobielle Effekte aus. Salvi et al. [2020] haben die Laser abhängig von ihren Wellenlängen in zwei Kategorien unterteilt: Laser mit einem Wellenlängenbereich von 2.780 bis 2.940 nm und von 810 bis 980 nm. Es war Evidenz aus fünf RCTs (n = 147) mit einem Follow-up von ≥ 6 Monaten und einer einmaligen Laserapplikation verfügbar. Berücksichtigt wurden nur RCTs mit der Angabe von mittleren TST-Änderungen. Die Studien unterschieden sich in Bezug auf Lasertyp, Spitzendurchmesser, Wellenlänge, Art der Parodontaltherapie, Anzahl der behandelten Flächen, Population und der Kombination dieser Parameter. Alles in allem liegt unzureichende Evidenz vor, um eine adjuvante Applikation dieser Laser zur subgingivalen Instrumentierung zu empfehlen. Die mit der adjuvanten Lasertherapie verbundenen zusätzlichen Kosten können nicht gerechtfertigt werden.
Sind die Therapieergebnisse bei adjuvanter antimikrobieller photodynamischer Therapie der alleinigen subgingivalen Instrumentierung überlegen?
Die adjuvante antimikrobiell, photodynamische Therapie (aPDT) wird eingesetzt, um die traditionelle Wurzeloberflächen-Dekontamination zu verbessern. Ein photosensibilisierender Farbstoff heftet sich an die normalerweise undurchlässige äußere Zellmembran gramnegativer Bakterien an. Dann wird Laserlicht genutzt, um sogenannte reaktive Sauerstoffspezies aus dem membrangebundenen Farbstoff zu aktivieren, was die Bakterien lokal zerstört. Es lag Evidenz aus fünf RCTs (n = 121) mit einem Follow-up von ≥ 6 Monaten und einer einmaligen aPDT-Applikation vor. In der Metaanalyse wurden nur RCTs mit Angaben zu mittleren TST-Änderungen berücksichtigt. Vorteile durch die adjuvante aPDT-Applikation wurden nicht beobachtet. Es wurde eine beträchtliche Heterogenität der Studien in Bezug auf Lasertyp, Photosensibilisator, Wellenlänge, Zeitpunkt der Anwendung, Art der Parodontaltherapie, Anzahl der behandelten Flächen, Population und die mögliche Kombination dieser Parameter identifiziert.
Es bestand Konsens darüber, dass die mit der adjuvanten aPDT-Therapie verbundenen, zusätzlichen Kosten nicht gerechtfertigt werden können. Die Leitliniengruppe in Deutschland sieht allerdings weiteren Forschungsbedarf, um das Potenzial einer adjuvanten aPDT in der Parodontaltherapie durch gut konzipierte, randomisierte klinische Studien systematisch zu evaluieren. Zugleich wurde festgestellt, dass der Zulassungsstatus der bei der aPDT verwendeten Farbstoffe/Photosensitizer unklar ist.
3. Intervention: immunmodulatorische Adjuvanzien
In einer systematischen Übersichtsarbeit haben Donos et al. [2020] Fragen zu lokalen beziehungsweise systemischen immunmodulatorischen Adjuvanzien bei der subgingivalen Instrumentierung adressiert. Da die meisten dieser Adjuvanzien in Deutschland nicht zugelassen sind, beschränkt sich diese Übersicht auf die aktuelle Bewertung von zwei potenziell interessanten Ansätzen: Probiotika und mehrfach ungesättigte Omega-3-Fettsäuren.
Verbessert die zusätzliche systemische (orale) Verwendung von Probiotika das klinische Ergebnis?
Probiotika sind „lebende Mikroorganismen, die – wenn in adäquaten Mengen verabreicht – dem Wirt gesundheitlichen Nutzen verschaffen“ [FAO/WHO, 2002]. Angenommen wurde, dass Probiotika die Ökologie von Mikro-Umweltnischen ändern und so eine etablierte Dysbiose disruptiv beeinflussen können. Dadurch könnte sich wieder eine symbiotische Mikroflora etablieren und positive Interaktionen mit dem Wirt durch eine Vielzahl an Mechanismen (zum Beispiel Modulation der immuninflammatorischen Antwort, Regulation von antibakteriellen Substanzen und Verdrängung von potenziell parodontalen Pathogenen durch Nahrungs- und Raumwettkampf) unterstützen [Gatej et al., 2017]. Fünf placebokontrollierte RCTs (n = 176), die den zusätzlichen Effekt der Probiotika bei der subgingivalen Instrumentierung untersuchten, wurden eingeschlossen. Die Metaanalyse zeigte, dass die Behandlung mit Probiotika im Vergleich zu Placebo zu einer größeren TST-Reduktion von 0,38 mm nach sechs Monaten führte. Der mittlere geschätzte Unterschied der TST-Reduktion zwischen Probiotika und Placebo war statistisch nicht signifikant und nicht von klinischer Relevanz. Durch den Einsatz von Probiotika entstehen dem Patienten Zusatzkosten.
Verbessert die zusätzliche Verwendung von mehrfach ungesättigten Omega-3-Fettsäuren das klinische Ergebnis?
Die aktuelle Entdeckung von entzündungsauflösenden Lipidmediatoren [Serhan, 2017], von denen einige durch Metabolisierung der beiden mehrfach ungesättigten Omega-3-Fettsäuren (Omega-3 Polyunsaturated Fatty Acids, PUFAs) – namentlich Eicosapentaensäure (EPA) und Docosahexaensäure (DHA) – zu E- beziehungsweise D-Resolvinen entstehen, weist auf das Potenzial essenzieller Nahrungsergänzungsmittel mit PUFAs hin. Dies könnte ein adjuvantes, immunmodulatorisches Therapiekonzept für die nichtchirurgische Parodontaltherapie sein. Es gibt jedoch nur wenige Studien, die deren Effektivität in Studien am Menschen untersucht haben.
Ausgewertet wurden drei placebokontrollierte RCTs (n = 160) mit sechsmonatiger Einnahme von Omega-3-PUFAs. Die Heterogenität im Studiendesign ließ keine Metaanalyse zu. Ein RCT untersuchte die Gabe von niedrigdosierten Omega-3-PUFAs zweimal täglich für sechs Monate; eine zweite Studie hochdosierte Omega-3-PUFAs in Kombination mit Aspirin täglich für sechs Monate; in der dritten Studie wurde Omega-3-PUFAs zweimal täglich für sechs Monate verabreicht. Alle Studien dokumentierten die TST-Reduktion sechs Monate nach subgingivaler Instrumentierung. Die getesteten Präparate waren sicher und es wurden keine Nebenwirkungen dokumentiert. Durch den Einsatz von Omega-3-PUFA-Präparaten entstehen dem Patienten Zusatzkosten. Zum aktuellen Zeitpunkt verfügen wir nicht über genügend Daten, um die Nutzung von Omega-3-PUFAs adjuvant zur subgingivalen Instrumentierung zu stützen oder zu widerlegen.
4. Intervention: adjuvante Antiseptika
Verbessert die adjuvante Nutzung von Antiseptika das klinische Ergebnis?
Um die gingivale Entzündung während der Parodontaltherapie unter Kontrolle zu halten, wurde der adjuvante Gebrauch von einigen Produkten vorgeschlagen. Chlorhexidin-Mundspülungen wurden in diesem Zusammenhang häufig getestet und werden häufig in verschiedenen klinischen Szenarien eingesetzt. In den systematischen Übersichtsarbeiten des European Workshops wurde die Rolle von Antiseptika in der aktiven Parodontaltherapie nicht direkt adressiert. Jedoch gibt es einige Hinweise zur Rolle von Chlorhexidin nach subgingivaler Instrumentierung [da Costa et al., 2017]. Es wurde deshalb eine konsensbasierte Empfehlung formuliert.
5. Intervention: adjuvante lokal applizierte Antiseptika
Verbessern adjuvante lokal verabreichte Antiseptika das klinische Ergebnis?
In einer systematischen Übersichtsarbeit haben Herrera et al. [2020] die Evidenz hinsichtlich des Nutzens von lokal applizierten Antiseptika mit Retard-Formulierung zusätzlich zur subgingivalen Instrumentierung aufgearbeitet. Sie betrachteten die Ergebnisse von Studien zu Chlorhexidin-Produkten. Dabei zeigte ein Produkt (PerioChip®) eine geringfügige, aber statistisch signifikant größere TST-Reduktion nach ein- oder mehrmaliger Applikation zusätzlich zur subgingivalen Instrumentierung. Es wurden keine signifikanten Unterschiede beim CAL-Gewinn beobachtet. Die Daten bezüglich BOP waren unzureichend und es wurden keine Angaben über Pocket Closure oder die Anzahl der benötigten Behandlungen gemacht. Eine geschätzte Effektgröße für alle TST-Kategorien zeigt eine zusätzliche TST-Reduktion um zehn Prozent. Die Kosten für das Produkt müssen berücksichtigt werden. Insgesamt existiert nicht genug Evidenz hinsichtlich des Nutzens von lokal applizierten Antiseptika mit Retard-Formulierung zusätzlich zur subgingivalen Instrumentierung bei Patienten mit Parodontitis.
6. Intervention: adjuvante lokal applizierte Antibiotika
Verbessern adjuvante, lokal verabreichte Antibiotika das klinische Ergebnis?
Das systematische Review von Herrera et al. [2020] zeigte für lokal applizierte Antibiotika, die auf dem europäischen Markt verfügbar sind, eine statistisch signifikant bessere TST-Reduktion von 0,3 bis 0,8 mm als Adjuvans zur subgingivalen Instrumentierung bei einem Follow-up von sechs bis neun Monaten. Statistisch signifikante Verbesserungen der CAL-Veränderung von 0,4 bis 0,5 mm wurden ebenfalls festgestellt. Es lagen keine Daten bezüglich BOP und Pocket Closure vor. Die geschätzte Effektgröße war um 10 bis 30 Prozent größer als bei ausschließlich mechanischer Instrumentierung bezüglich der TST-Reduktion. Nutzen-Risiko-Überlegungen bezüglich des Gebrauchs von Antibiotika müssen berücksichtigt werden. Die hohen Kosten und die limitierte Verfügbarkeit der Produkte in Deutschland müssen ebenfalls berücksichtigt werden.
7. Intervention: adjuvante systemische Antibiotika
Verbessern adjuvante systemisch verabreichte Antibiotika das klinische Ergebnis?
Die Metaanalyse [Teughels et al., 2020] zeigt statistisch signifikant verbesserte Resultate für systemisch verabreichte Antibiotika zusätzlich zur subgingivalen Instrumentierung. Dieser Effekt war nur bei einer begrenzten Anzahl von Antibiotika nachweisbar. Eine signifikante Verbesserung der TST-Reduktion wurde zum Sechs-Monats-Follow-up für Metronidazol (MET) und Amoxicillin (AMOX) beobachtet. Die adjuvante Gabe von MET+AMOX und MET resultierte in einem statistisch signifikant höheren prozentualen Anteil von „Pocket Closure“ nach sechs und zwölf Monaten. Statistisch signifikant höhere CAL-Gewinne und BOP-Reduktionen konnten ebenfalls nachgewiesen werden. Der zusätzliche Effekt von MET+AMOX auf TST-Reduktion und CAL-Gewinn war bei initial tiefen Taschen ausgeprägter als bei moderat tiefen Taschen. Es gibt keine relevanten Daten zum Langzeiteffekt (> 12 Monate) der systemischen Antibiotikagabe zusätzlich zur subgingivalen Instrumentierung.
Der adjuvante Einsatz systemischer Antibiotika im Vergleich zur alleinigen subgingivalen Instrumentierung zeigt einen geschätzten vergrößerten Effekt von etwa 40 bis 50 Prozent hinsichtlich TST-Reduktion. Während die Kombination MET+AMOX die größten Effekte auf die klinischen Ergebnisse aufwies, war diese Kombination auch mit den häufigsten Nebenwirkungen verbunden. Globale Bedenken bezüglich der übermäßigen Anwendung von Antibiotika und der Entwicklung von Antibiotikaresistenzen müssen in die Abwägung des Einsatzes einbezogen werden. Nutzen-Risiko-Analysen beinhalten Überlegungen bezüglich des allgemeinen Antibiotikagebrauchs für den einzelnen Patienten und die öffentliche Gesundheit. Systemische Antibiotikagaben haben lang andauernde Auswirkungen auf das fäkale Mikrobiom gezeigt – einschließlich einer vermehrten Expression von Genen, die mit Antibiotikaresistenz assoziiert sind [Jepsen und Jepsen, 2016; Cassini et al., 2019]. Aufgrund von Bedenken bezüglich der Patientengesundheit und den Auswirkungen systemischer Antibiotikagabe auf die öffentliche Gesundheit wird die routinemäßige Gabe als Zusatz zur subgingivalen Instrumentierung nicht empfohlen. Basierend auf der verfügbaren Evidenz kann der adjuvante Einsatz in speziellen Patientengruppen (zum Beispiel generalisiertes Stadium III/IV der Parodontitis bei jungen Erwachsenen) erwogen werden (Abbildung 5).
Die Leitliniengruppe betont, dass die für eine adjuvante Antibiotikatherapie infrage kommenden Patientenfälle in der Regel durch eine rasche Progressionsrate – oft in Abwesenheit von modifizierbaren Risikofaktoren – gekennzeichnet sind. Deshalb sollte die Behandlung dieser Hochrisikopatienten durch spezifisch fort- und weitergebildete Zahnärzte durchgeführt werden. Die Zugänglichkeit zu dieser Versorgung sollte für die Patienten verbessert werden. Mit der Wahl der Antibiotikasubstanzen, der begrenzten Dauer und der Limitation auf eine Hochrisikogruppe jüngeren Alters sind wichtige Prinzipien von Antibiotic Stewardship berücksichtigt, wie sie in den aktuellen internationalen und nationalen Leitlinien und Empfehlungen der WHO, des ECDC (European Centre for Disease Prevention and Control), der Kommission ART (Antiinfektiva, Resistenz und Therapie) beim Robert Koch-Institut (RKI) einschließlich der deutschen S3-Leitlinie „Strategien zur Sicherung rationaler Antibiotika-Anwendung im Krankenhaus“ (AWMF-Register Nr. 092–001) beschrieben sind.
Univ.-Prof. Dr. Med. Dent. Dr. Med. SØren Jepsen, M.S.
Zentrum für Zahn-, Mund- und Kieferheilkunde, Universitätsklinikum Bonn,
Direktor der Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde
Welschnonnenstr.17, 53111 Bonn
sjepsen@uni-bonn.de
Univ.-Prof. Dr. Med. Dent. Benjamin Ehmke
Direktor der Poliklinik für Parodontologie und Zahnerhaltung am Universitätsklinikum Münster
Waldeyerstr. 30, 48149 Münster
Foto: UKM (RS)
Porf. Dr. Med. Dent. Thomas Kocher
Direktor der Poliklinik für Zahnerhaltung,
Parodontologie, Endodontologie, Kinderzahnheilkunde und präventive Zahnmedizin
Zentrum Zahn-, Mund- und Kieferheilkunde,
Universitätsmedizin Greifswald
Fleischmannstr. 42, 17475 Greifswald
Literaturliste
da Costa, L., Amaral, C., Barbirato, D. D. S., Leao, A. T. T., & Fogacci, M. F. (2017). Chlorhexidine mouthwash as an adjunct to mechanical therapy in chronic periodontitis: A meta-analysis. J Am Dent Assoc, 148(5), 308-318. https://www.sciencedirect.com/science/article/abs/pii/S000281771730082X
Donos, N., Calciolari, E., Brusselaers, N., Goldoni, M., Bostanci, N., & Belibasakis, G. N. (2019). The adjunctive use of host modulators in non-surgical periodontal therapy. A systematic review of randomized, placebo-controlled clinical studies. J Clin Periodontol. https://onlinelibrary.wiley.com/doi/10.1111/jcpe.13232
Eberhard, J., Jepsen, S., Jervoe-Storm, P. M., Needleman, I., & Worthington, H. V. (2015). Full-mouth treatment modalities (within 24 hours) for chronic periodontitis in adults. Cochrane Database Syst Rev(4), CD004622. https://www.cochranelibrary.com/cdsr/doi/10.1002/14651858.CD004622.pub3/full
Joint FAO/WHO Working Group Report on Drafting Guidelines for the Evaluation of Probiotics in Food; London, Ontario, Canada, April 30 and May 1, 2002.
Gatej, S., Gully, N., Gibson, R., & Bartold, P. M. (2017). Probiotics and Periodontitis - A Literature Review. J Int Acad Periodontol, 19(2), 42-50.
Graziani, F., Cei, S., Orlandi, M., Gennai, S., Gabriele, M., Filice, N., Nisi, M., D'Aiuto, F. (2015). Acute-phase response following full-mouth versus quadrant non-surgical periodontal treatment: A randomized clinical trial. J Clin Periodontol. 42(9): 843-852.
Herrera, D., Matesanz, P., Martin, C., Oud, V., Feres, M., & Teughels, W. (2020). Adjunctive effect of locally delivered antimicrobials in periodontitis therapy. A systematic review and meta-analysis. J Clin Periodontol. https://onlinelibrary.wiley.com/doi/full/10.1111/jcpe.13230
Jepsen, S., Deschner, J., Braun, A., Schwarz, F., Eberhard, J. (2011). Calculus removal and the prevention of its formation. Periodontol 2000, 55(1):167-88.
Jepsen, K., Jepsen, S. (2026). Antibiotics/antimicrobials: systemic and local administration in the therapy of mild to moderately advanced periodontitis. Periodontol 2000, 71(1):82-112.
Kieser, J. B. (1994). Non-surgical periodontal therapy. In N. P. Lang & T. Karring (Eds.), Proceedings of the 1st European Workshop on Periodontology. Germany: Quintessence Publishing Co.
Loos, B. G., & Needleman, I. (2020). Endpoints of active periodontal therapy. J Clin Periodontol. https://onlinelibrary.wiley.com/doi/full/10.1111/jcpe.13253
Salvi, G. E., Stahli, A., Schmidt, J. C., Ramseier, C. A., Sculean, A., & Walter, C. (2019). Adjunctive laser or antimicrobial photodynamic therapy to non-surgical mechanical instrumentation in patients with untreated periodontitis. A systematic review and meta-analysis. J Clin Periodontol. https://onlinelibrary.wiley.com/doi/full/10.1111/jcpe.13236
Sanz, M., Ceriello, A., Buysschaert, M., Chapple, I., Demmer, R. T., Graziani, F., . . . Vegh, D. (2018). Scientific evidence on the links between periodontal diseases and diabetes: Consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the International Diabetes Federation and the European Federation of Periodontology. J Clin Periodontol, 45(2), 138-149. https://onlinelibrary.wiley.com/doi/abs/10.1111/jcpe.12808
Sanz, M., Marco Del Castillo, A., Jepsen, S., Gonzalez-Juanatey, J. R., D'Aiuto, F., Bouchard, P., . . . Wimmer, G. (2020). Periodontitis and cardiovascular diseases: Consensus report. J Clin Periodontol, 47(3), 268-288. https://onlinelibrary.wiley.com/doi/full/10.1111/jcpe.13189
Serhan, C. N. (2017). Discovery of specialized pro-resolving mediators marks the dawn of resolution physiology and pharmacology. Mol Aspects Med, 58, 1-11. https://www.sciencedirect.com/science/article/abs/pii/S0098299717300183
Suvan, J., Leira, Y., Moreno, F., Graziani, F., Derks, J., & Tomasi, C. (2019). Subgingival Instrumentation for Treatment of Periodontitis. A Systematic Review. J Clin Periodontol. https://onlinelibrary.wiley.com/doi/full/10.1111/jcpe.13245
Teughels, W., Feres, M., Oud, V., Martin, C., Matesanz, P., & Herrera, D. (2020). Adjunctive effect of systemic antimicrobials in periodontitis therapy. A systematic review and meta-analysis. J Clin Periodontol. https://onlinelibrary.wiley.com/doi/10.1111/jcpe.13264


















