Biologische und klinische Assoziationen von oraler Gesundheit und Diabetes
Die weitverbreiteten oralen Erkrankungen Karies und Parodontitis sind multifaktorieller Genese – wenngleich für beide Krankheitsbilder eine primäre Assoziation zu einem potenziell pathogenen Biofilm besteht, beeinflussen lokale und systemische, angeborene sowie erworbene Faktoren deren Entstehung und Progression [Pitts et al., 2017; Kinane et al., 2017]. Insbesondere Parodontalerkrankungen treten hierbei mit einer Vielzahl an systemischen Erkrankungen in Wechselwirkung, wobei jedoch insgesamt schwierig zu bewerten bleibt, ob hier eine Kausalität oder eine Koinzidenz besteht [Winning und Linden, 2017]. Die bidirektionale Beziehung zum Diabetes mellitus stellt in diesem Kontext das wohl am besten untersuchte Beispiel dar, das im Dialog von Parodontologen und Diabetologen bereits umfangreich diskutiert und beschrieben wurde [Sanz et al., 2017].
Beim Diabetes mellitus können verschiedene Typen unterschieden werden, wobei Typ I und Typ II die größte praktische Relevanz für den Zahnarzt aufweisen (Tabelle 1). Grundsätzlich zeichnet sich eine Diabeteserkrankung durch einen dauerhaft erhöhten Blutglukosespiegel aus (Tabelle 2). Der Typ-I-Diabetes stellt eine Erkrankung mit angeborener Genese dar, bei der es aufgrund der auto-immunen Destruktion von Pankreaszellen zum Insulinmangel und dadurch zu einer Hyperglykämie kommt [Atkinson et al., 2014]. Im Gegensatz hierzu stellt der Typ-II-Diabetes eine erworbene Insulinresistenz dar, die sich primär als Konsequenz der Lebensgewohnheiten (Übergewicht, Ernährungsweise, Rauchen, mangelnde Bewegung) entwickelt [Chatterjee et al., 2017].
Beide Typen weisen ein relevantes Risiko für die Entwicklung von Parodontalerkrankungen auf und sind deshalb für die zahnmedizinische Betreuung von besonderer Bedeutsamkeit [Lalla und Papapanou, 2011]. Dabei existieren hinsichtlich Mundgesundheitsaspekten und Diabetes mellitus diverse immunologische und klinische Ähnlichkeiten sowie ein gemeinsamer Risikokomplex [Lalla und Papapanou, 2011; Preshaw et al., 2012]. Darüber hinaus sind die oralen Auswirkungen des Diabetes keineswegs auf die Parodontalerkrankungen limitiert; vielmehr bestehen mögliche Assoziationen mit verschiedenen Erkrankungen der Mundhöhle – einschließlich Karies, Mundschleimhautveränderungen oder endodontischen Krankheitsbildern [Mauri-Obradors et al., 2017].
Eine besondere Relevanz für die zahnärztliche Praxis gewinnt das Thema durch einige nationale und globale Entwicklungen. Zum einen existiert ein demografischer Wandel, bei dem die Zahl der alternden, alten sowie damit einhergehend multimorbiden (und multi-medizierten) Individuen in der Bevölkerung und somit auch in der Zahnarztpraxis ansteigt. Darüber hinaus bleiben zahlreiche Diabetesfälle lange unerkannt, was eine hohe Dunkelziffer an unentdecktem und damit nicht therapiertem Diabetes im Patientengut bedeutet [Kolb und Martin, 2017; Cho et al., 2018]. Hinzu kommt die hohe Prävalenz oraler Erkrankungen; so sind dentale und parodontale Erkrankungen ein enormes weltweites Gesundheitsproblem [Peres et al., 2019]. Selbst in Deutschland zeigen die Daten der Fünften Deutschen Mundgesundheitsstudie, dass immer noch drei Viertel der jüngeren Senioren parodontal behandlungsbedürftig sind [Jordan und Micheelis, 2016].
In diesem Gesamtkontext sieht sich das zahnärztliche Team mit einer Vielzahl an Herausforderungen konfrontiert, die bei der Betreuung von (un-)bekannten Diabetespatienten in der Praxis berücksichtigt werden müssen. Dieser Beitrag – bestehend aus zwei Teilen – soll dabei helfen, eine sichere und strukturierte Betreuung von Diabetikern in der Praxis zu ermöglichen. Hierfür werden im ersten Teil Grundlagen der Interaktion zwischen oralen Erkrankungen (besonders Parodontitis) und Diabetes dargestellt. Darauf aufbauend werden im zweiten Teil klinische Herausforderungen und Konzepte dargestellt, sowie die Möglichkeit der Diabetesfrüherkennung in der Zahnarztpraxis illustriert. Insgesamt soll so ein möglichst vollständiges Bild dieser Patientengruppe gezeichnet werden, um zukünftig den Anforderungen dieser Patienten in der zahnärztlichen Betreuung möglichst vollumfänglich gerecht zu werden.
Von Der Vermutung zur Bidirektionalität
Das Thema Mundgesundheit, insbesondere Parodontitis und Diabetes ist keineswegs neu. Eine der ersten, im PubMed auffindbaren Arbeiten hierzu stammt aus dem Jahr 1946, wo Glickman erstmalig im Journal of Dental Research einen Zusammenhang zwischen Parodontium und dem Blutzucker in einem experimentellen Diabetesmodell aufzeigte [Glickman, 1946]. In den darauffolgenden Jahren wurde das Thema mehrfach aus unterschiedlichen Gesichtspunkten aufgegriffen: So erfolgten unter anderem erste Untersuchungen zum Glykogengehalt der Gingiva bei Diabetes [Cohen und Fosdick, 1950] und ebenso die Evaluation röntgenologischer und mikrobiologischer Aspekte [Stahl, 1948]. Zudem gab es eine intensive Auseinandersetzung mit einem möglichen Zusammenspiel zwischen der damals so ausgewiesenen juvenilen Parodontitis und Diabetes [de Naranjo und Pierangeli, 1951]. Auch im deutschsprachigen Raum wurde das Thema bereits 1951 adressiert, wobei eine Arbeit von Focke mit dem Titel „Parodontosis in Diabetes“ mögliche Zusammenhänge beider Erkrankungen in der Deutschen Zahnärztlichen Zeitschrift diskutierte [Focke, 1951]. Wenngleich die ersten Studien methodisch noch limitiert waren, ist das Thema seit mehr als 70 Jahren in der nationalen und internationalen Literatur präsent.
Während es zwischen 1946 und 1956 erst 19 Arbeiten zu möglichen Zusammenhängen zwischen Parodontitis und Diabetes gab, waren es bis 1976 bereits 186 und bis 1996 dann 615 registrierte Arbeiten. Auch inhaltlich ergab sich eine Weiterentwicklung: So wurde vonseiten der Parodontologen das Vorliegen eines Diabetes zunehmend als Prädispositionsfaktor für eine Parodontitis bewertet [Pennel und Keagle, 1977]. Auch in der allgemeinen Beschreibung von Parodontalerkrankungen begann der Diabetes als systemischer Faktor an Bedeutung zu gewinnen [Ruben, 1979]. Erstaunlicherweise zeigt eine Arbeit aus dem Jahr 1985, dass sich die wissenschaftliche Betrachtung nicht ausschließlich auf Parodontitis und Diabetes beschränkte. Vielmehr wurde ein Zusammenhang zwischen Diabetes und der gesamten Mundhöhle beschrieben und dies als bedeutsames Forschungsfeld identifiziert [Murrah, 1985].
Mit der Jahrtausendwende kam es aufgrund methodischer Weiterentwicklungen, zunehmendem Forschungsinteresse und der Zunahme möglicher Publikationsorgane zu einer regelrechten Explosion der Arbeiten zum Zusammenhang zwischen Diabetes und Parodontitis. Noch Ende der 1990er-Jahre beschrieb die Arbeitsgruppe um Kinane ausführlich klinische, immunologische und molekularbiologische Aspekte, die der Thematik inhaltlich eine neue Tiefe verliehen [Kinane und Chestnutt, 1997; Kinane, 1999]. Ebenfalls unter Mitwirkung von Kinane wurde im Jahr 2008 im Rahmen des sechsten europäischen Workshops der Parodontologie erstmals die Evidenzlage zur Assoziation von Parodontitis und Diabetes beschrieben [Kinane et al., 2008]. Hier wurde zudem die Bidirektionalität beider Erkrankungen ausgewiesen, wobei eine erhöhte Parodontitisschwere bei schlecht eingestelltem Diabetes sowie eine verbesserte glykämische Kontrolle nach Parodontaltherapie beschrieben wurden [Kinane et al., 2008]. Inzwischen ist die Thematik vielfältig untersucht und ein bidirektionaler Zusammenhang gilt als gesichert. Entsprechend wurde in der aktuellen Klassifikation der Parodontalerkrankungen der Diabetes mellitus als modifizierender Faktor für das Grading (= Erkrankungsprogression) berücksichtigt [Jepsen et al., 2018]. Auch aufseiten der Diabetologen ist das Thema präsent; so gilt Parodontitis inzwischen als anerkannte Folgeerkrankung des Diabetes [Adda et al., 2021].
Insgesamt zeigt dieser kurze historische Abriss, dass Zusammenhänge zwischen Parodontitis und Diabetes mellitus grundsätzlich seit vielen Jahrzehnten vermutet werden beziehungsweise bekannt sind. Es dauerte jedoch verhältnismäßig lange – und dieser Prozess ist noch nicht abgeschlossen –, ehe sich aus den ersten Erkenntnissen Veränderungen für die Betreuung der Patienten in der zahnärztlichen Praxis ergaben.
Bidirektionalität: immunologische Aspekte
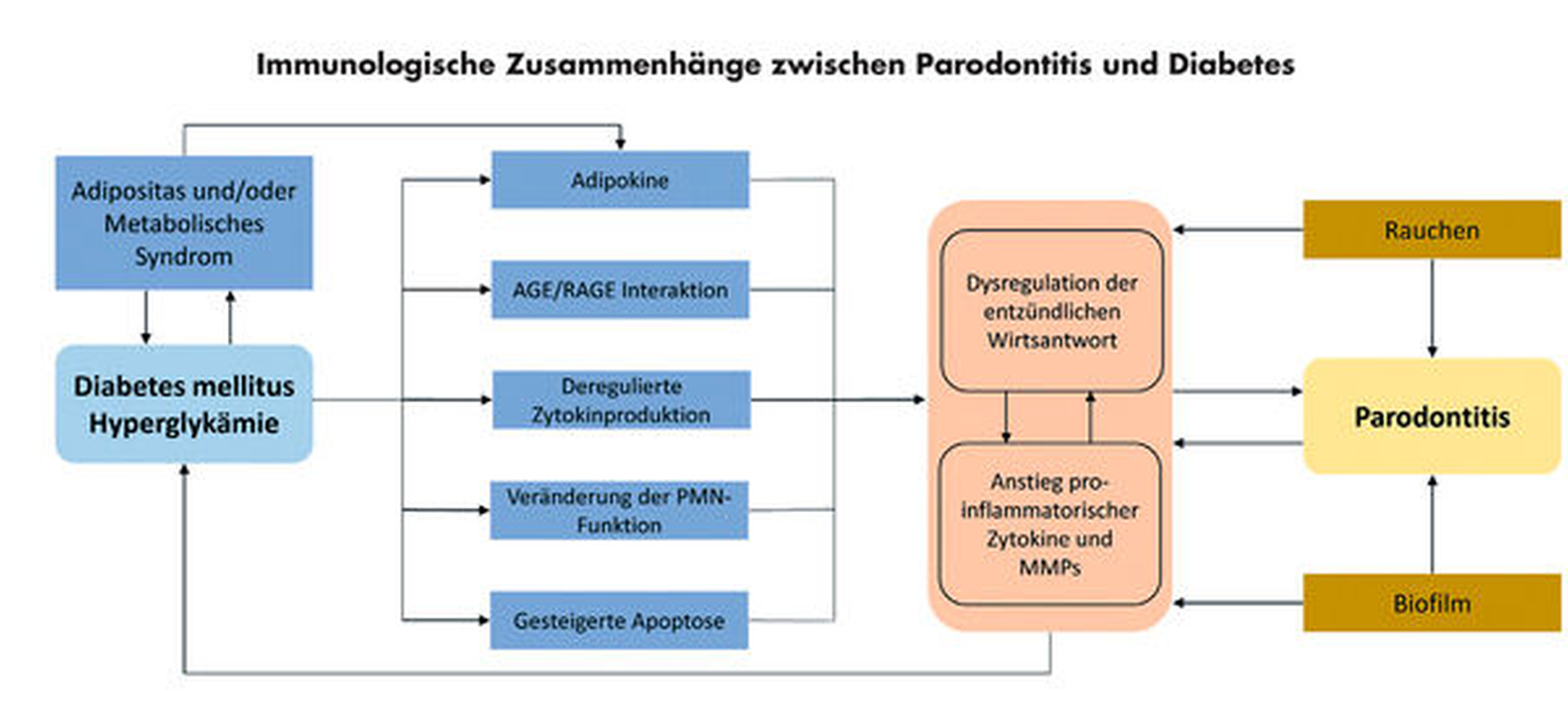
Aufgrund der hohen Komplexität immunologischer und molekularbiologischer Prozesse sind die Grundlagen der Bidirektionalität von Parodontitis und Diabetes noch immer nicht vollständig erforscht und verstanden [Liccardo et al., 2019]. Insgesamt sind jedoch verschiedene pathophysiologische Mechanismen beschrieben, die die gegenseitige Beeinflussung von Parodontitis und Diabetes näher charakterisieren können (Abbildung 1). Eine mögliche Beeinflussung des subgingivalen Mikrobioms durch den Diabetes ist vorstellbar [Salvi et al., 2005; Engebretson et al., 2007], jedoch offenbar letztlich ohne kausale Relevanz für die Bidirektionalität beider Erkrankungen – kurzum: Es gibt kein einheitliches/spezifisches Diabetes-Mikrobiom [Polak und Shapira, 2018]. Vielmehr scheint die (systemische und lokale) Inflammation beide Erkrankungen in der Konsequenz zu verknüpfen [Preshaw et al., 2012]. In diesem Kontext muss man zunächst zugrunde legen, dass die Diabetes-assoziierte Hyperglykämie zur Steigerung der systemischen und lokalen Inflammation, zu oxidativem Stress und zur Apoptose führt [Brownlee, 2005]. Im Detail scheinen Interleukin 6 (IL-6), Tumornekrosefaktor alpha (TNF-α) und das durch diese induzierte akute-Phase-Protein c-reaktives Protein (CRP) von Bedeutung. Diese Entzündungsmarker sind bei Diabetes [Hotamisligil, 2000; Rotter et al., 2003], insbesondere im Zusammenhang mit Adipositas [Dandona et al., 2004], wie auch bei Parodontitis relevant [Loos, 2005; Paraskevas et al., 2008]. Folglich scheint die systemische Inflammation, die mit Parodontalerkrankungen in Verbindung steht, einen Einfluss auf den Diabetes zu nehmen.
Hierbei sind einige weitere Faktoren zu bedenken: Bei ausgeprägter parodontaler Inflammation kommt es zu einer transienten (also stetig im Zusammenhang mit alltäglichen Aktivitäten wie Nahrungsaufnahme oder Mundhygiene auftretenden) Bakteriämie. Potenziell pathogene Bakterien und deren Stoffwechselprodukte (zum Beispiel Lipopolysaccharide) führen hierbei zu einer verstärkten Exprimierung von Entzündungsbotenstoffen. Über subepitheliale Blutgefäße gelangen diese Entzündungsmediatoren aus dem parodontalen Gewebe in den Blutkreislauf und somit in alle Körperbereiche. Diese können in der Folge hemmend auf Insulinrezeptoren verschiedener Zellen einwirken, indem sie direkt an Insulinrezeptoren binden und damit die Aufnahme von Glukose in die Zellen negativ beeinflussen. Ein erhöhter Blutglukosespiegel und damit eine Verschlechterung des Diabetes ist die Folge [Lalla und Papapanou, 2011; Mealey und Ocampo, 2007]. Allerdings können systemische Auswirkungen von parodontaler Inflammation, zumindest beim Gesunden, kontrovers diskutiert werden [Schmalz et al., 2019], was die Bedeutung der systemischen Inflammation im Zusammenhang mit Parodontalerkrankungen etwas unklar erscheinen lässt.
Des Weiteren wurde nachgewiesen, dass das Vorliegen eines Diabetes einen Einfluss auf die Inflammation im parodontalen Gewebe haben kann; so sind beispielsweise bei schlechter glykämischer Einstellung die Konzentrationen von Interleukin-1-beta (IL-1β) in der Sulkusflüssigkeit erhöht [Engebretson et al., 2004]. Weiterhin werden polymorphkernige Granulozyten (PMN) durch das Vorliegen eines Diabetes in ihrer Funktion beeinträchtigt, insbesondere in Bezug auf eine eingeschränkte Chemotaxis und Phagozytose [Alba-Loureiro et al., 2007]. In diesem Zusammenhang konnte gezeigt werden, dass die Chemotaxis der PMN bei Diabetikern mit schwerer Parodontitis verringert sowie die Apoptose der PMN bei diesen Patienten verstärkt gestört ist [Manouchehr-Pour et al., 1981; Graves et al., 2006]. Dies scheint zu verstärkter parodontaler Gewebezerstörung über die Bildung reaktiver Sauerstoffspezies und die Freisetzung/Aktivierung von Matrix-Metalloproteinasen (MMPs) zu führen [Preshaw et al., 2012].
Durch den erhöhten Glukoseanteil im Blut bei einem insuffizient eingestellten Diabetiker, kommt es zur nichtenzymatischen Glykosylierung (Anbindung von Zucker an Nicht-Zucker-Verbindungen) von Proteinen, was zur Bildung von sogenannten Advanced Glycation End Products (AGE) führt. Binden diese AGE an ihren RAGE-Rezeptor auf Monozyten, kommt es zur verstärkten Produktion und Ausschüttung inflammatorischer Mediatoren, insbesondere IL-1β, TNF-α und IL-6 [Lalla et al., 2001]. Zudem sind die AGE an der Entstehung von oxidativem Stress in Endothelzellen und PMN beteiligt [Vlassara, 2001; Wong et al., 2003]. Weiterhin haben AGE einen Effekt auf den Knochenstoffwechsel, insbesondere auf eine verschlechterte ossäre Heilung und Störung der extrazellulären Matrix [Santana et al., 2003; Cortizo et al., 2003]. Insgesamt kommt es durch die Bildung von AGE zur verstärkten Inflammation, zu oxidativem Stress, zur Störung der Vaskularisation (Mikroangiopathien) sowie zur Beeinflussung des Knochenstoffwechsels, was sich in der Summe auf die Schwere und die Ausprägung parodontaler Erkrankungen auswirkt. Darüber hinaus beschreiben aktuelle Studien weitere Aspekte, wie die mögliche Rolle einer mitochondrialen Dysfunktion, einer Autophagie sowie den Cross-talk zwischen Adenosin Monophosphat-aktivierter Proteinkinase (AMPK) und dem Renin-Angiotensin System (RAS) [Portes et al., 2021]. Hier ergibt sich eine spannende Perspektive für die weitere Untersuchung der Kausalzusammenhänge beider Krankheitsbilder.
Gemeinsamer Risikokomplex
Chronische Erkrankungen der Zähne und des Zahnhalteapparats haben auf Patientenebene einige Gemeinsamkeiten zum Diabetes mellitus: So handelt es sich um Zivilisationserkrankungen, die durch zahlreiche erworbene Faktoren beeinflusst werden können. Es ist daher nicht verwunderlich, dass Patienten mit einer Parodontitis und/oder einer Diabeteserkrankung einen gemeinsamen Risikokomplex aufweisen. Grundsätzlich sind sowohl Diabetes (Typ II) als auch Parodontitis überwiegend Lebensstil-assoziierte Erkrankungen. Hierbei spielen unter anderem eine ungesunde Ernährung und damit einhergehend Adipositas eine bedeutende Rolle. Aber auch ein erhöhter Alkoholkonsum, Rauchen und verminderte Bewegung stellen mögliche Risikofaktoren dar. Zudem sind häufiger Patienten im fortgeschrittenen Alter von einer oder beiden Erkrankungen betroffen [Borgnakke, 2016; Negrato et al., 2013]. Auf der anderen Seite weisen Patienten mit diesen Erkrankungen oftmals eine mangelnde Compliance und/oder Adhärenz auf [Kneckt et al., 2000; Kim et al., 2013].
Insgesamt lohnt es sich, die gemeinsamen Risikofaktoren detailliert zu betrachten. Rauchen ist ein bedeutender Risikofaktor für Diabetes [Pan et al., 2015] sowie für Parodontitis [Leite et al., 2018], was sich primär durch Auswirkungen auf die Inflammation, die Regeneration und im Fall der Parodontitis auch auf den Biofilm erklären lässt [Pan et al., 2015; Leite et al., 2018]. Ein additiver Effekt, beispielsweise von Diabetes und Rauchen auf den subgingivalen Biofilm und die Schwere der Parodontitis wird jedoch kontrovers diskutiert [Rimachi Hidalgo et al., 2021; Joaquim et al., 2018]. In ähnlicher Art und Weise wirkt sich auch Adipositas aus; es ist ausführlich beschrieben, dass adipöse Patienten verstärkt sowohl an Diabetes als auch an Parodontitis erkranken [Martinez-Herrera et al., 2017; Uusitupa et al., 2019]. Bei einem gemeinsamen Vorliegen von Diabetes und Adipositas kommt es zudem zu einer weiter erhöhten parodontalen Erkrankungsschwere als bei Diabetes allein, was primär mit einer gesteigerten Inflammation im Kontext der Adipositas (unter anderem als Auswirkung von Adipokinen) begründet zu sein scheint [Zhu et al., 2014].
Auch bei Ernährungsaspekten ergeben sich gemeinsame Risikofaktoren zwischen Diabetes und Parodontitis. Insbesondere im Zusammenhang zur gesteigerten Inflammation und Geweberegeneration existieren einige Gemeinsamkeiten, so sind zum Beispiel die Nitrat- sowie die Vitamin-D-Zufuhr bei beiden Erkrankungen relevant, da diese direkt die Funktion des Immunsystems als auch den (Knochen-)Stoffwechsel beeinflussen [Bahadoran et al., 2021; Zuk et al., 2018]. Nicht zuletzt sind sowohl Diabetes (Typ II) als auch Parodontitis im Regelfall Erkrankungen, deren Inzidenz mit steigendem Lebensalter zunimmt; auch hier spielen Aspekte wie Inflammation, Regeneration und mikrobiologische Aspekte eine mögliche Rolle [Feres et al., 2016]. Ergänzend sind alle oben genannten Parameter – Alter, Rauchverhalten, Ernährung und Adipositas – auch mögliche Indikatoren für die Compliance der Patienten, so dass sich auch hier ein gemeinsames Risikopotenzial verbergen kann. Eine Zusammenstellung der möglichen gemeinsamen Risikofaktoren und deren Interaktion zeigt Abbildung 2.
Klinische Zusammenhänge
Gegenwärtig gelten Gingivitis und Parodontitis als anerkannte Folgeerkrankung des Diabetes mellitus [Lalla und Papapanou, 2011; Jepsen et al., 2018; Mealey und Ocampo, 2007; Deschner et al., 2011]. Hieraus ergibt sich, dass jeder Diabetespatient einer gesteigerten Aufmerksamkeit in der zahnärztlich-parodontologischen Betreuung bedarf.
Beide Erkrankungen stehen in einer bidirektionalen, also sich gegenseitig beeinflussenden Beziehung zueinander [Wu et al., 2020]. Patienten mit einem (unentdeckten und/oder insuffizient eingestellten) Diabetes weisen dadurch ein erhöhtes Risiko für eine parodontale Erkrankung auf und umgekehrt gilt dasselbe [Lalla und Papapanou, 2011; Jepsen et al., 2018; Nascimento et al., 2018]. Auf Grundlage einer Metaanalyse ist das Risiko für das Entstehen beziehungsweise Voranschreiten einer Parodontitis für einen Diabetiker gegenüber einem Nicht-Diabetiker um 86 Prozent höher [Nascimento et al., 2018]. Andersherum ist bei einer schweren Parodontitis das Risiko für die Entstehung eines Diabetes um 53 Prozent erhöht [Wu et al., 2020]. Insgesamt weisen dabei Patienten mit einem Diabetes eine schwerere, rascher fortschreitende parodontale Inflammation und Destruktion auf (erhöhter Attachmentverlust, Sondierungstiefen, Risiko für Zahnverlust), während eine gesteigerte parodontale Entzündung zu einer erschwerten glykämischen Einstellung des Diabetikers führen kann [Kocher et al., 2018]. Hieraus ergibt sich ein circulus vitiosus.
Essenziell beim Einfluss des Diabetes auf die Parodontitis ist die Einstellgüte, das heißt die Einstellung des HbA1c-Werts beim Diabetiker [Mealey und Ocampo, 2007]. Dieser bezeichnet den Anteil von glykosyliertem Hämoglobin im Blut und ist ein Maß für die langfristige glykämische Kontrolle (vergangene vier bis sechs Wochen) einer Diabeteserkrankung. Ein HbA1c über 5,7 Prozent gilt als diabetologisch auffällig, ab 6,5 Prozent wird von einem manifesten Diabetes ausgegangen [Gillet, 2009]. Ein HbA1c-Wert von mehr als 7,0 Prozent wird mit einem hohen Risiko für eine Parodontitis(-progression) in Verbindung gebracht, wobei diese Patienten entsprechend der aktuellen Klassifikation als Grad C definiert werden [Jepsen et al., 2018].
Wie angedeutet hat das Vorliegen einer Parodontitis möglicherweise ebenfalls negative Auswirkungen auf den Verlauf der Diabetes-Erkrankung [Grossi und Genco, 1998; Genco und Bognakke, 2020]. Neben der erwähnten schwierigeren glykämischen Einstellbarkeit der Diabetespatienten ist durch das Vorliegen von (schwerer) Parodontitis auch das Risiko für Folgeerkrankungen des Diabetes erhöht; dies betrifft diabetische Retinopathie, Neuropathie, Nephropathie, kardiovaskuläre Komplikationen wie auch die Sterblichkeit [Nguyen et al., 2020].
Aus diesen klinischen Zusammenhängen und Einflüssen ergeben sich einige praktische Implikationen für Diagnostik, Therapie und Prävention in der zahnärztlichen Praxis. (Dieses Thema wird in Teil 2 dieses Beitrags in der zm 14/2022 näher beleuchtet und dargestellt.)
Diabetes und weitere orale Besonderheiten
Aufgrund der komplexen Einflüsse, die eine diabetische Grunderkrankung auf den Gesamtorganismus sowie die Mundhöhle haben kann, ergeben sich jedoch darüber hinausgehende orale Erkrankungsrisiken (Abbildung 3). In diesem Zusammenhang ist insbesondere der reduzierte Speichelfluss von Diabetikern bedeutsam, der aus einer Diabetes-assoziierten Polyurie und damit verbunden Dehydrierung resultiert [Lopez-Pintor et al., 2016]. Die Veränderung des Speichelflusses wird zudem durch das gemeinsame Auftreten von Diabetes und weiteren Erkrankungen wie beispielsweise Niereninsuffizienz mit Dialysepflichtigkeit verstärkt [Schmalz et al., 2017]. Die Diabetes-assoziierte Xerostomie führt wiederum in Kombination mit einem erhöhten Glukosespiegel im Speichel sowie einem verstärkten Vorkommen exponierter Wurzeloberflächen infolge von Parodontalerkrankungen zu einem erhöhten Kariesrisiko, vornehmlich im Wurzelbereich [Beheshti et al., 2021]. Weiterhin führen eine verstärkte Kariesprogression auf der einen und eine Durchblutungsverminderung der pulpalen und periapikalen Gewebe auf der anderen Seite zum verstärkten Auftreten endodontischer Krankheitsbilder [Segura-Egea et al., 2012]. Ein weiterer wesentlicher Aspekt ist das Auftreten von Mundschleimhauterkrankungen; bedingt durch Xerostomie, Immunkompromittierung und Durchblutungsverringerung kommt es unter anderem häufiger zu Candida-Infektionen, Wundheilungsstörungen und lichenoiden Veränderungen [Guggenheimer et al., 2000; Petrou-Amerikanou et al., 1998].

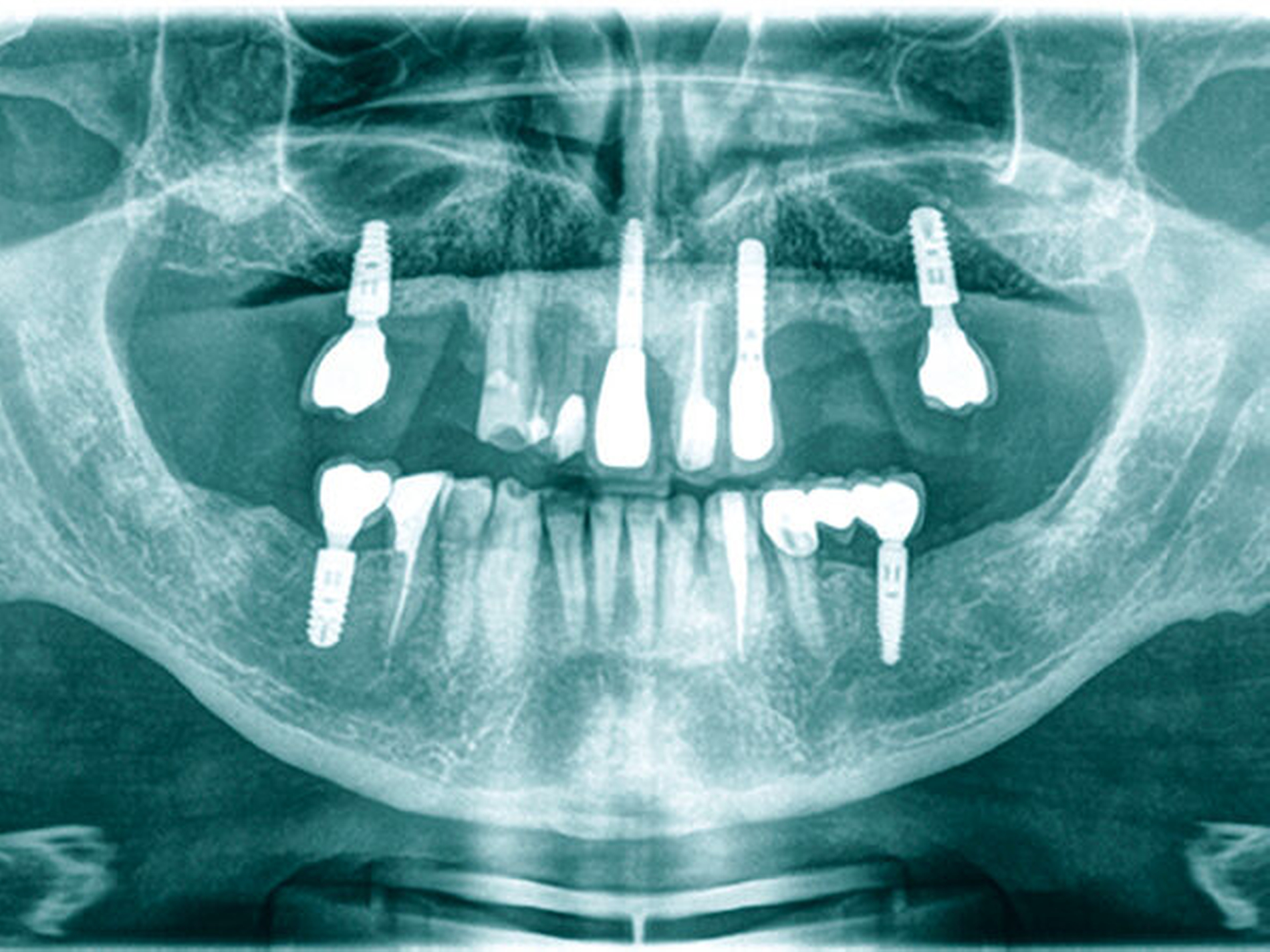
Weiterhin ist beschrieben, dass es im Zusammenhang mit Diabetes mellitus zu Missempfindungen im Mundbereich kommen kann, wobei vorrangig das Burning-Mouth-Syndrom sowie Geschmacksirritationen beobachtet wurden [Mauri-Obradors et al., 2017]. Ein weiteres orales Erkrankungsbild, das in Verbindung mit Diabetes stehen kann, stellen periimplantäre Erkrankungen dar; wenngleich die Datenlage insgesamt noch unzureichend erscheint, existieren hier ebenfalls mögliche Zusammenhänge – auch in Abhängigkeit von der Einstellgüte des Diabetes [Monje et al., 2017]. Klinisch ergeben sich oftmals komplexe Auswirkungen, die zusätzlich durch das Vorliegen parodontaler Vorerkrankungen und implantatspezifischer Aspekte beeinflusst werden können (Abbildung 4). In der Summe illustriert diese Darstellung, dass die oralen Probleme bei Diabetespatienten deutlich über Parodontitis hinausgehen, woraus sich die Notwendigkeit umfassender Betreuungsansätze in der zahnärztlichen Praxis ergibt.
Einordnung in ein Risikoprofil
Parodontitis und Diabetes sind über immunologische und klinische Zusammenhänge sowie einen gemeinsamen Risikokomplex eng miteinander verzahnt. Das erlaubt die Diskussion dahingehend, ob nicht beides Symptome eines übergeordneten Erkrankungsgeschehens sind. Hier kann die Hypothese eines chronischen, systemischen inflammatorischen Syndroms aufgegriffen werden, die beschreibt, dass chronisch entzündliche Zivilisationserkrankungen wie etwa beim Metabolischen Syndrom allesamt in einem Krankheitsgeschehen vereint vorliegen können [Fabbri et al., 2007]. Folglich ist es nicht möglich, die Mundhöhle und den Diabetes losgelöst voneinander und von anderen Komorbiditäten zu betrachten. Besonders relevant ist zudem, dass Diabetes mellitus nicht nur einen Einfluss auf das Parodontium nimmt, sondern auch die meisten anderen zahnmedizinisch relevanten oralen Veränderungen bedingen kann.
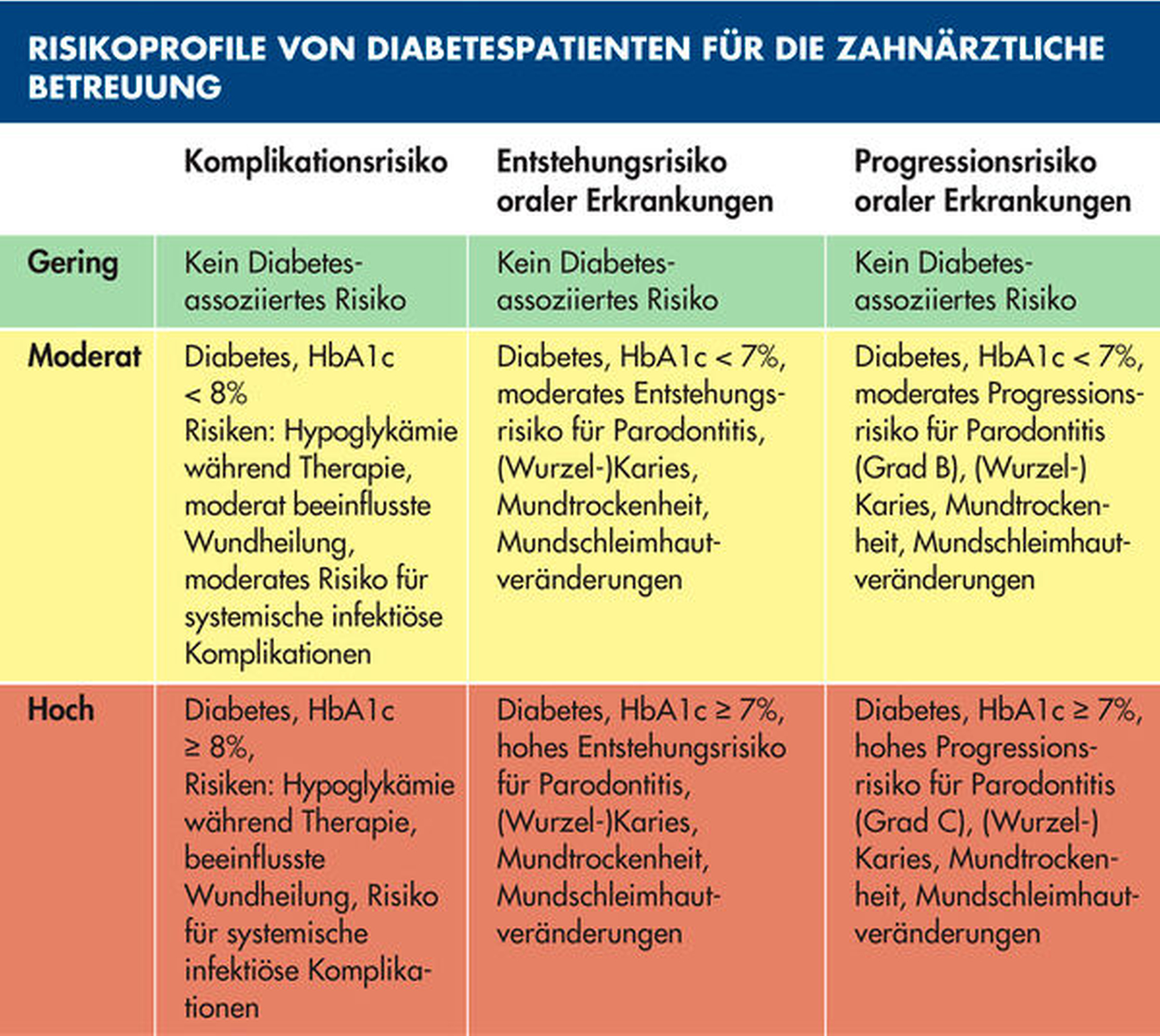
Um klinische Konsequenzen im Rahmen eines patientenorientierten Betreuungskonzepts für diese komplexen Patientenfälle zu erarbeiten, soll abschließend kurz das spezifische Risikoprofil von Diabetespatienten zusammengefasst werden: Entsprechend des Konzepts der individualisierten Prävention müssen hierfür Komplikations- und Erkrankungsrisiken bewertet werden [Schmalz und Ziebolz, 2020]. Ein Komplikationsrisiko besteht dann, wenn aufgrund der zahnärztlichen Behandlung ein Gesundheitsschaden für den Patienten entstehen kann. Dies liegt beim Diabetes dann vor, wenn Patienten (lang andauernd) schlecht eingestellt sind (HbA1c > 8,0 Prozent) und beinhaltet insbesondere das Risiko systemisch infektiöser Komplikationen. Erkrankungsrisiken sind wiederum Prädispositionen für das Auftreten (Entstehungsrisiko) oder Voranschreiten (Progressionsrisiko) von oralen Erkrankungen [Schmalz und Ziebolz, 2020]. Im konkreten Fall haben Diabetiker (wie beschrieben) ein erhöhtes Erkrankungsrisiko für Karies und/oder Parodontitis, das ebenfalls von der glykämischen Einstellgüte abhängig ist (Tabelle 3). Da sich bei Diabetespatienten oftmals verschiedene Risiken akkumulieren, ist die detaillierte Betrachtung und Bewertung aller Risikofaktoren bedeutsam, um auch komplexe Patientenfälle adäquat auflösen zu können (Abbildung 5).
In Teil 2 dieses Beitrags im nächsten Heft werden die klinischen Konsequenzen sowie konkrete Konzeptideen für die zahnmedizinische Versorgung dargestellt. Dabei wird ein Schwerpunkt auf die Möglichkeit der Diabetesfrüherkennung in der Praxis gelegt.
Literaturliste
Adda G, Aimetti M, Citterio F, Consoli A, Di Bartolo P, Landi L, Lione L, Luzi L. Consensus report of the joint workshop of the Italian Society of Diabetology, Italian Society of Periodontology and Implantology, Italian Association of Clinical Diabetologists (SID-SIdP-AMD). Nutr Metab Cardiovasc Dis. 2021;31(9):2515-2525. doi: 10.1016/j.numecd.2021.03.015.
Alba-Loureiro TC, Munhoz CD, Martins JO, Cerchiaro GA, Scavone C, Curi R, Sannomiya P. Neutrophil function and metabolism in individuals with diabetes mellitus. Braz J Med Biol Res. 2007;40(8):1037-44. doi: 10.1590/s0100-879x2006005000143.
Atkinson MA, Eisenbarth GS, Michels AW. Type 1 diabetes. Lancet. 2014;383(9911):69-82. doi: 10.1016/S0140-6736(13)60591-7.
Bahadoran Z, Mirmiran P, Carlström M, Ghasemi A. Inorganic nitrate: A potential prebiotic for oral microbiota dysbiosis associated with type 2 diabetes. Nitric Oxide. 2021;116:38-46. doi: 10.1016/j.niox.2021.09.001.
Beheshti M, Badner V, Shah P, Margulis KS, Yeroshalmi F. Association of Diabetes and Dental Caries Among U.S. Adolescents in the NHANES Dataset. Pediatr Dent. 2021;43(2):123-128. PMID: 33892837.
Brownlee M. The pathobiology of diabetic complications: a unifying mechanism. Diabetes. 2005;54(6):1615-25. doi: 10.2337/diabetes.54.6.1615.
Borgnakke WS. “Non-modifiable” Risk Factors for Periodontitis and Diabetes. Curr Oral Health Rep. 2016;3:270–281. doi.org/10.1007/s40496-016-0098-7
Chatterjee S, Khunti K, Davies MJ. Type 2 diabetes. Lancet. 2017;389(10085):2239-2251. doi: 10.1016/S0140-6736(17)30058-2.
Cho NH, Shaw JE, Karuranga S et al. IDF Diabetes Atlas: Global estimates of diabetes prevalence for 2017 and projections for 2045. Diabetes Res Clin Pract 2018;138:271-281.
Cohen B, Fosdick LS. Chemical studies in periodontal disease; the glycogen content of gingival tissue in alloxan diabetes. J Dent Res. 1950;29(1):48-54. doi: 10.1177/00220345500290010901.
Cortizo AM, Lettieri MG, Barrio DA, Mercer N, Etcheverry SB, McCarthy AD. Advanced glycation end-products (AGEs) induce concerted changes in the osteoblastic expression of their receptor RAGE and in the activation of extracellular signal-regulated kinases (ERK). Mol Cell Biochem. 2003;250(1-2):1-10. doi: 10.1023/a:1024934008982.
Dandona P, Aljada A, Bandyopadhyay A. Inflammation: the link between insulin resistance, obesity and diabetes. Trends Immunol. 2004;25(1):4-7. doi: 10.1016/j.it.2003.10.013.
Deschner J, Haak T, Jepsen S, Kocher T, Mehnert H, Meyle J, Schumm-Draeger PM, Tschöpe D. Diabetes mellitus und Parodontitis. Wechselbeziehung und klinische Implikationen. Ein Konsensuspapier [Diabetes mellitus and periodontitis. Bidirectional relationship and clinical implications. A consensus document]. Internist (Berl). 2011;52(4):466-77. German. doi: 10.1007/s00108-011-2835-2
de Naranjo CM, Pierangeli RE. La paradentosis juvenil de lbs diabéticos [Juvenile paradentosis in diabetes]. Sem Med. 1951;98(24):913-21. Undetermined Language. PMID: 14866405.
Engebretson SP, Hey-Hadavi J, Ehrhardt FJ, Hsu D, Celenti RS, Grbic JT, Lamster IB. Gingival crevicular fluid levels of interleukin-1beta and glycemic control in patients with chronic periodontitis and type 2 diabetes. J Periodontol. 2004;75(9):1203-8. doi: 10.1902/jop.2004.75.9.1203.
Engebretson S, Chertog R, Nichols A, Hey-Hadavi J, Celenti R, Grbic J. Plasma levels of tumour necrosis factor-alpha in patients with chronic periodontitis and type 2 diabetes. J Clin Periodontol. 2007;34(1):18-24. doi: 10.1111/j.1600-051X.2006.01017.x.
Fabbri LM, Rabe KF. From COPD to chronic systemic inflammatory syndrome? Lancet. 2007;370(9589):797-9. doi: 10.1016/S0140-6736(07)61383-X.
Feres M, Teles F, Teles R, Figueiredo LC, Faveri M. The subgingival periodontal microbiota of the aging mouth. Periodontol 2000. 2016;72(1):30-53. doi: 10.1111/prd.12136.
Focke B. Parodontose bei Diabetes [Parodontosis in diabetes]. Dtsch Zahnarztl Z. 1951;6(7):349-55. Undetermined Language. PMID: 14831439.
Genco RJ, Borgnakke WS. Diabetes as a potential risk for periodontitis: association studies. Periodontol 2000. 2020;83(1):40-45. doi: 10.1111/prd.12270.
Gillett MJ. International Expert Committee report on the role of the A1c assay in the diagnosis of diabetes. Diabetes Care 2009;32:1327-1334
Glickman I. The periodontium, pancreas and blood sugar levels in experimental diabetes. J Dent Res. 1946;25:169. PMID: 21064808.
Graves DT, Liu R, Alikhani M, Al-Mashat H, Trackman PC. Diabetes-enhanced inflammation and apoptosis--impact on periodontal pathology. J Dent Res. 2006;85(1):15-21. doi: 10.1177/154405910608500103.
Grossi SG, Genco RJ. Periodontal disease and diabetes mellitus: a two-way relationship. Ann Periodontol. 1998;3(1):51-61. doi: 10.1902/annals.1998.3.1.51.
Guggenheimer J, Moore PA, Rossie K, Myers D, Mongelluzzo MB, Block HM, Weyant R, Orchard T. Insulin-dependent diabetes mellitus and oral soft tissue pathologies: II. Prevalence and characteristics of Candida and Candidal lesions. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 2000;89(5):570-6. doi: 10.1067/moe.2000.104477.
Hotamisligil GS. Molecular mechanisms of insulin resistance and the role of the adipocyte. Int J Obes Relat Metab Disord. 2000;24 Suppl 4:S23-7. doi: 10.1038/sj.ijo.0801497.
Jepsen S, Caton JG, Albandar JM, Bissada NF, Bouchard P, Cortellini P, Demirel K, de Sanctis M, Ercoli C, Fan J, Geurs NC, Hughes FJ, Jin L, Kantarci A, Lalla E, Madianos PN, Matthews D, McGuire MK, Mills MP, Preshaw PM, Reynolds MA, Sculean A, Susin C, West NX, Yamazaki K. Periodontal manifestations of systemic diseases and developmental and acquired conditions: Consensus report of workgroup 3 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Periodontol. 2018;89 Suppl 1:S237-S248. doi: 10.1002/JPER.17-0733.
Joaquim CR, Miranda TS, Marins LM, Silva HDP, Feres M, Figueiredo LC, Duarte PM. The combined and individual impact of diabetes and smoking on key subgingival periodontal pathogens in patients with chronic periodontitis. J Periodontal Res. 2018;53(3):315-323. doi: 10.1111/jre.12516.
Jordan RA, Micheelis W. The Fifth German Oral Health Study (DMS V). Institut der Deutschen Zahnärzte (Hrsg.); (IDZ Materialienreihe Band 35). Deutscher Zahnärzte Verlag DÄV, Köln 2016. [in German]
Kim EK, Lee SG, Choi YH, Won KC, Moon JS, Merchant AT, Lee HK. Association between diabetes-related factors and clinical periodontal parameters in type-2 diabetes mellitus. BMC Oral Health. 2013;13:64. doi: 10.1186/1472-6831-13-64.
Kinane DF, Chestnutt IG. Relationship of diabetes to periodontitis. Curr Opin Periodontol. 1997;4:29-34. PMID: 9655018.
Kinane DF. Periodontitis modified by systemic factors. Ann Periodontol. 1999;4(1):54-64. doi: 10.1902/annals.1999.4.1.54.
Kinane D, Bouchard P; Group E of European Workshop on Periodontology. Periodontal diseases and health: Consensus Report of the Sixth European Workshop on Periodontology. J Clin Periodontol. 2008;35(8 Suppl):333-7. doi: 10.1111/j.1600-051X.2008.01278.x.
Kinane DF, Stathopoulou PG, Papapanou PN. Periodontal diseases. Nat Rev Dis Primers. 2017;3:17038. doi: 10.1038/nrdp.2017.38.
Kneckt MC, Syrjälä AM, Knuuttila ML. Attributions to dental and diabetes health outcomes. J Clin Periodontol. 2000;27(3):205-11. doi: 10.1034/j.1600-051x.2000.027003205.x.
Kocher T, König J, Borgnakke WS, Pink C, Meisel P. Periodontal complications of hyperglycemia/diabetes mellitus: Epidemiologic complexity and clinical challenge. Periodontol 2000. 2018;78(1):59-97. doi: 10.1111/prd.12235.
Kolb H, Martin S. Environmental/lifestyle factors in the pathogenesis and prevention of type 2 diabetes. BMC Med. 2017;15(1):131. doi: 10.1186/s12916-017-0901-x.
Lalla E, Papapanou PN. Diabetes mellitus and periodontitis: a tale of two common interrelated diseases. Nat Rev Endocrinol. 2011;7(12):738-48. doi: 10.1038/nrendo.2011.106.
Lalla E, Lamster IB, Stern DM, Schmidt AM. Receptor for advanced glycation end products, inflammation, and accelerated periodontal disease in diabetes: mechanisms and insights into therapeutic modalities. Ann Periodontol. 2001;6(1):113-8. doi: 10.1902/annals.2001.6.1.113.
Leite FRM, Nascimento GG, Scheutz F, López R. Effect of Smoking on Periodontitis: A Systematic Review and Meta-regression. Am J Prev Med. 2018;54(6):831-841. doi: 10.1016/j.amepre.2018.02.014. Epub 2018 Apr 12.
Liccardo D, Cannavo A, Spagnuolo G, Ferrara N, Cittadini A, Rengo C, Rengo G. Periodontal Disease: A Risk Factor for Diabetes and Cardiovascular Disease. Int J Mol Sci. 2019;20(6):1414. doi: 10.3390/ijms20061414.
López-Pintor RM, Casañas E, González-Serrano J, Serrano J, Ramírez L, de Arriba L, Hernández G. Xerostomia, Hyposalivation, and Salivary Flow in Diabetes Patients. J Diabetes Res. 2016;2016:4372852. doi: 10.1155/2016/4372852.
Loos BG. Systemic markers of inflammation in periodontitis. J Periodontol. 2005;76(11 Suppl):2106-15. doi: 10.1902/jop.2005.76.11-S.2106.
Manouchehr-Pour M, Spagnuolo PJ, Rodman HM, Bissada NF. Impaired neutrophil chemotaxis in diabetic patients with severe periodontitis. J Dent Res. 1981;60(3):729-30. doi: 10.1177/00220345810600031101.
Martinez-Herrera M, Silvestre-Rangil J, Silvestre FJ. Association between obesity and periodontal disease. A systematic review of epidemiological studies and controlled clinical trials. Med Oral Patol Oral Cir Bucal. 2017;22(6):e708-e715. doi: 10.4317/medoral.21786.
Mauri-Obradors E, Estrugo-Devesa A, Jané-Salas E, Viñas M, López-López J. Oral manifestations of Diabetes Mellitus. A systematic review. Med Oral Patol Oral Cir Bucal. 2017;22(5):e586-e594. doi: 10.4317/medoral.21655..
Mealey BL, Ocampo GL. Diabetes mellitus and periodontal disease. Periodontol 2000. 2007;44:127-53.
Monje A, Catena A, Borgnakke WS. Association between diabetes mellitus/hyperglycaemia and peri-implant diseases: Systematic review and meta-analysis. J Clin Periodontol. 2017;44(6):636-648. doi: 10.1111/jcpe.12724.
Murrah VA. Diabetes mellitus and associated oral manifestations: a review. J Oral Pathol. 1985;14(4):271-81. doi: 10.1111/j.1600-0714.1985.tb00494.x.
Nascimento GG, Leite FRM, Vestergaard P, Scheutz F, López R. Does diabetes increase the risk of periodontitis? A systematic review and meta-regression analysis of longitudinal prospective studies. Acta Diabetol. 2018;55(7):653-667. doi: 10.1007/s00592-018-1120-4..
Negrato CA, Tarzia O, Jovanovič L, Chinellato LE. Periodontal disease and diabetes mellitus. J Appl Oral Sci. 2013;21(1):1-12. doi: 10.1590/1678-7757201302106.
Nguyen ATM, Akhter R, Garde S, Scott C, Twigg SM, Colagiuri S, Ajwani S, Eberhard J. The association of periodontal disease with the complications of diabetes mellitus. A systematic review. Diabetes Res Clin Pract. 2020;165:108244. doi: 10.1016/j.diabres.2020.108244.
Pan A, Wang Y, Talaei M, Hu FB, Wu T. Relation of active, passive, and quitting smoking with incident type 2 diabetes: a systematic review and meta-analysis. Lancet Diabetes Endocrinol. 2015;3(12):958-67. doi: 10.1016/S2213-8587(15)00316-2..
Paraskevas S, Huizinga JD, Loos BG. A systematic review and meta-analyses on C-reactive protein in relation to periodontitis. J Clin Periodontol. 2008;35(4):277-90. doi: 10.1111/j.1600-051X.2007.01173.x.
Pennel BM, Keagle JG. Predisposing factors in the etiology of chronic inflammatory periodontal disease. J Periodontol. 1977;48(9):517-32. doi: 10.1902/jop.1977.48.9.517.
Peres MA, Macpherson LMD, Weyant RJ, Daly B, Venturelli R, Mathur MR, Listl S, Celeste RK, Guarnizo-Herreño CC, Kearns C, Benzian H, Allison P, Watt RG. Oral diseases: a global public health challenge. Lancet. 2019;394:249-60.
Petrou-Amerikanou C, Markopoulos AK, Belazi M, Karamitsos D, Papanayotou P. Prevalence of oral lichen planus in diabetes mellitus according to the type of diabetes. Oral Dis. 1998;4(1):37-40. doi: 10.1111/j.1601-0825.1998.tb00253.x.
Pitts NB, Zero DT, Marsh PD, Ekstrand K, Weintraub JA, Ramos-Gomez F, Tagami J, Twetman S, Tsakos G, Ismail A. Dental caries. Nat Rev Dis Primers. 2017;3:17030. doi: 10.1038/nrdp.2017.30.
Polak D, Shapira L. An update on the evidence for pathogenic mechanisms that may link periodontitis and diabetes. J Clin Periodontol. 2018;45(2):150-166. doi: 10.1111/jcpe.12803.
Portes J, Bullón B, Quiles JL, Battino M, Bullón P. Diabetes Mellitus and Periodontitis Share Intracellular Disorders as the Main Meeting Point. Cells. 2021;10(9):2411. doi: 10.3390/cells10092411.
Preshaw PM, Alba AL, Herrera D, Jepsen S, Konstantinidis A, Makrilakis K, Taylor R. Periodontitis and diabetes: a two-way relationship. Diabetologia. 2012;55(1):21-31. doi: 10.1007/s00125-011-2342-y.
Rimachi Hidalgo MA, Cirelli T, da Silva BR, Nicchio IG, Nepomuceno R, Orrico SRP, Cirelli JA, Theodoro LH, Barros SP, Scarel-Caminaga RM. Polymorphisms and haplotypes in the Interleukin 17 Alfa gene: potential effect of smoking habits in the association with periodontitis and type 2 diabetes mellitus. Mol Biol Rep. 2021;48(2):1103-1114. doi: 10.1007/s11033-021-06172-9
Rotter V, Nagaev I, Smith U. Interleukin-6 (IL-6) induces insulin resistance in 3T3-L1 adipocytes and is, like IL-8 and tumor necrosis factor-alpha, overexpressed in human fat cells from insulin-resistant subjects. J Biol Chem. 2003;278(46):45777-84. doi: 10.1074/jbc.M301977200.
Ruben MP. Periodontosis. An analysis and clarification of its status as a disease entity. J Periodontol. 1979;50(6):311-5. doi: 10.1902/jop.1979.50.6.311.
Salvi GE, Kandylaki M, Troendle A, Persson GR, Lang NP. Experimental gingivitis in type 1 diabetics: a controlled clinical and microbiological study. J Clin Periodontol. 2005;32(3):310-6. doi: 10.1111/j.1600-051X.2005.00682.x.
Santana RB, Xu L, Chase HB, Amar S, Graves DT, Trackman PC. A role for advanced glycation end products in diminished bone healing in type 1 diabetes. Diabetes. 2003;52(6):1502-10. doi: 10.2337/diabetes.52.6.1502.
Sanz M, Ceriello A, Buysschaert M, Chapple I, Demmer RT, Graziani F, Herrera D, Jepsen S, Lione L, Madianos P, Mathur M, Montanya E, Shapira L, Tonetti M, Vegh D. Scientific evidence on the links between periodontal diseases and diabetes: Consensus report and guidelines of the joint workshop on periodontal diseases and diabetes by the International Diabetes Federation and the European Federation of Periodontology. J Clin Periodontol. 2018;45(2):138-149. doi: 10.1111/jcpe.12808.
Schmalz G, Schiffers N, Schwabe S, Vasko R, Müller GA, Haak R, Mausberg RF, Ziebolz D. Dental and periodontal health, and microbiological and salivary conditions in patients with or without diabetes undergoing haemodialysis. Int Dent J. 2017;67(3):186-193. doi: 10.1111/idj.12282.
Schmalz G, Hübscher AE, Angermann H, Schmidt J, Schmickler J, Legler TJ, Ziebolz D. High prevalence of periodontitis in blood donors and the possibility of questionnaire-based screening - results of a cross-sectional study. Transfus Med. 2019;29(6):394-400. doi: 10.1111/tme.12633..
Schmalz G, Ziebolz D. Changing the Focus to the Whole Patient instead of One Oral Disease: The Concept of Individualized Prevention. Adv Prev Med. 2020 May 20;2020:6752342. doi: 10.1155/2020/6752342.
Segura-Egea JJ, Castellanos-Cosano L, Machuca G, López-López J, Martín-González J, Velasco-Ortega E, Sánchez-Domínguez B, López-Frías FJ. Diabetes mellitus, periapical inflammation and endodontic treatment outcome. Med Oral Patol Oral Cir Bucal. 2012;17(2):e356-61. doi: 10.4317/medoral.17452.
Stahl SS. Roentgenographic and bacteriologic aspects of periodontal changes in diabetics. J Periodontol. 1948;19(4):130-2. doi: 10.1902/jop.1948.19.4.130.
Uusitupa M, Khan TA, Viguiliouk E, Kahleova H, Rivellese AA, Hermansen K, Pfeiffer A, Thanopoulou A, Salas-Salvadó J, Schwab U, Sievenpiper JL. Prevention of Type 2 Diabetes by Lifestyle Changes: A Systematic Review and Meta-Analysis. Nutrients. 2019;11(11):2611. doi: 10.3390/nu11112611.
Vlassara H. The AGE-receptor in the pathogenesis of diabetic complications. Diabetes Metab Res Rev. 2001;17(6):436-43. doi: 10.1002/dmrr.233. PMID: 11757079.
Winning L, Linden GJ. Periodontitis and Systemic Disease: Association or Causality? Curr Oral Health Rep. 2017;4(1):1-7.
Wong RK, Pettit AI, Quinn PA, Jennings SC, Davies JE, Ng LL. Advanced glycation end products stimulate an enhanced neutrophil respiratory burst mediated through the activation of cytosolic phospholipase A2 and generation of arachidonic Acid. Circulation. 2003;108(15):1858-64. doi: 10.1161/01.CIR.0000089372.64585.3B.
World Health Organisation. What diagnostic tests should be used to define glycaemic status? Report of a WHO/IDF consultation: Definition and Diagnosis of Diabetes Mellitus and Intermediate Hyperglycemia. WHO 2006; Seite 29-34, Geneva, Switzerland
Wu CZ, Yuan YH, Liu HH, Li SS, Zhang BW, Chen W, An ZJ, Chen SY, Wu YZ, Han B, Li CJ, Li LJ. Epidemiologic relationship between periodontitis and type 2 diabetes mellitus. BMC Oral Health. 2020;20(1):204. doi: 10.1186/s12903-020-01180-w.
Zhu M, Nikolajczyk BS. Immune cells link obesity-associated type 2 diabetes and periodontitis. J Dent Res. 2014;93(4):346-52. doi: 10.1177/0022034513518943.
Zuk AM, Quiñonez CR, Saarela O, Demmer RT, Rosella LC. Joint effects of serum vitamin D insufficiency and periodontitis on insulin resistance, pre-diabetes, and type 2 diabetes: results from the National Health and Nutrition Examination Survey (NHANES) 2009-2010. BMJ Open Diabetes Res Care. 2018;6(1):e000535. doi: 10.1136/bmjdrc-2018-000535.