Die Versorgung von ausgedehnten Oberkieferdefekten
Circa 10.000 Mundhöhlenkarzinome werden jährlich in Deutschland diagnostiziert [Leitlinienprogramm Onkologie, 2021]. Dies entspricht etwa fünf Prozent aller malignen Tumor-Neuerkrankungen pro Jahr [Howaldt et al., 2000]. Dazu zählen die mit 95 Prozent am häufigsten vorkommenden Plattenepithelkarzinome [Talamini et al., 2002], Tumoren der kleinen Speicheldrüsen (Mukoepidermoidkarzinome, polymorphe Adenokarzinome, adenoidzystische Karzinome), maligne Lymphome und andere seltene Malignome wie orale Metastasen, orale Melanome, Ameloblastome [Gill et al., 2018; Rotzinger et al., 2020; Singh et al., 2010; Strick et al., 2004; Triantafillidou et al., 2006].
Weniger als fünf Prozent der Plattenepithelkarzinome treten in der Maxilla auf [Berger et al., 2015]. Die malignen Tumoren der kleinen Speicheldrüsen hingegen kommen am häufigsten im Bereich des harten und des weichen Gaumens vor [Eveson und Cawson, 1985; Lopes et al., 1998; Strick et al., 2004]. Die Tumorresektion eines Malignoms im Oberkiefer resultiert oft in einer Oberkieferteilresektion oder sogar einer (Hemi-)Maxillektomie [Goiato et al., 2011; Strick et al., 2004; Triantafillidou et al., 2006]. Dies führt zu komplexen Defekten des Weichgewebes mit Knochen- und oft auch Zahnverlust. Bei der Resektion von Knochen kommt es zu einer oro-nasalen Verbindung, die für den Patienten im Alltag zu Problemen beim Kauen, Sprechen und Schlucken führt [Rogers et al., 2003].
Um diese lebensnotwendigen Fähigkeiten und die Lebensqualität des Patienten so gut wie möglich wiederherzustellen, bieten sich zwei Optionen an: die chirurgische Rekonstruktion oder ein Verschluss mittels prothetischem, herausnehmbarem Defektverschluss. In diesem Beitrag möchten wir die Vor- und Nachteile der beiden Behandlungsoptionen diskutieren sowie mögliche Therapieoptionen des prothetischen Verschlusses aufzeigen, um eine patientenindividuelle Entscheidungshilfe zu geben.
Chirurgische Rekonstruktion
Wenn möglich und vom Patienten gewünscht, wird eine chirurgische Rekonstruktion gewählt. Hier wird beispielsweise mit mikrovaskulär anastomosierten Fibula- oder Beckenkammtransplantaten nach erfolgter Oberkiefer(teil-)resektion der vollständige Verschluss der oro-nasalen Verbindung angestrebt [Dos Santos et al., 2018]. Durch den Verschluss wird die Sprechfunktion wiederhergestellt. Die knöcherne Rekonstruktion ermöglicht die Insertion von Implantaten in den knöchernen Anteil des Transplantats [Wijbenga et al., 2016], wodurch die Möglichkeit für einen implantatgetragenen Zahnersatz geschaffen wird.
Die Risiken der chirurgischen Methode liegen in der Notwendigkeit einer großen Operation, die insbesondere bei gesundheitlich kompromittierten Patienten sorgfältig abgewogen werden muss [Moreno et al., 2010]. Zusätzlich kann es zu einer Transplantatnekrose mit vollständigem Transplantatverlust kommen. Mikrovaskuläre Fibulatransplantate zeigen ein sehr hohes Erfolgsergebnis mit 95 bis 100 Prozent Überlebensrate [Cordeiro und Santamaria, 2000; Rothweiler et al., 2022; Wijbenga et al., 2016]. Ein weiterer Nachteil des Defektverschlusses ist die erschwerte Tumornachsorge, die nur über eine dreidimensionale Bildgebung (MRT, CT) und in Einzelfällen über eine Sonografie erfolgen kann. Aus diesem Grund ist ein chirurgischer Defektverschluss gerade bei Tumoren mit hohem Rezidivrisiko erst ab zwei Jahren nach Erstdiagnose und bei Rezidivfreiheit empfehlenswert.
Prothetischer Defektverschluss
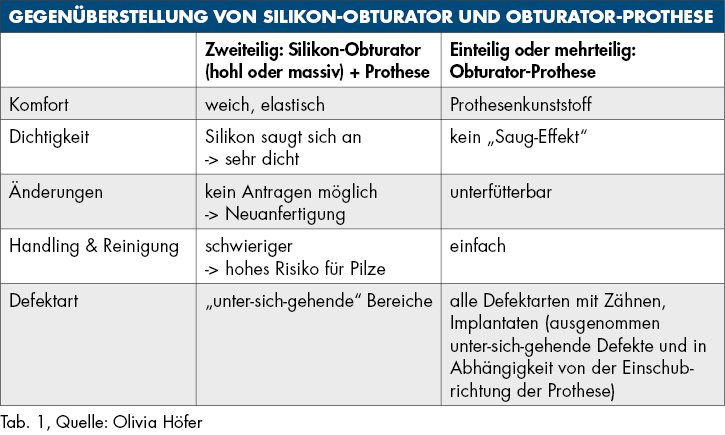
Bei der Tumornachsorge zeigt sich ein großer Vorteil des prothetischen Defektverschlusses: Zusätzlich zur Bildgebung kann mithilfe klinischer Inspektion frühzeitig ein Rezidiv entdeckt werden [Ali et al., 1995; Moreno et al., 2010]. Beim prothetischen Defektverschluss kann eine Acrylat-Obturator-Prothese gewählt werden, die je nach Mundöffnung ein- oder mehrteilig gestaltet ist und die auch verlorengegangene Zähne ersetzt. Alternativ gibt es die zwingend zweiteilige Möglichkeit eines Defektverschlusses über einen Silikon-Obturator mit einer darauf sitzenden Prothese zum Ersatz von Zähnen.
Sowohl ein Silikon-Obturator als auch eine Obturator-Prothese müssen nach der Tumoroperation häufig angepasst werden, um einen nasalen Reflux zu vermeiden, da sich der Defekt mit eintretender Wundheilung gerade in den ersten Monaten sehr stark verändern kann [Moreno et al., 2010]. Beide Alternativen geben die Möglichkeit, Weichgewebedefekte aufzufüllen und die fazialen Anteile wiederherzustellen [Ali et al., 1995]. Nachteilig ist dagegen eine oft (schmerzhafte) Krustenbildung im Bereich des Defekts.
Silikon-Obturator
Ein Silikon-Obturator (Abbildung 1) wird über „unter-sich-gehende“ Bereiche im Defekt verankert, kann hohl oder massiv gestaltet sein und sollte im Mund über einen fein auslaufenden Rand (Federrand) am restlichen Weichgewebe enden. Durch diesen feinen Rand ist die Abdichtung zur Nase wie mit einem Saugstopfen sehr gut. Bei fehlendem Vestibulum ist ein fein auslaufender Rand technisch nicht möglich, weshalb durch einen Silikon-Obturator hier nur in seltenen Fällen ein zufriedenstellender Halt erreicht wird. Optimalerweise sollte der Silikon-Obturator täglich vom Patienten entfernt und gereinigt werden können, um die Ansiedlung von Pilzen zu vermeiden.
Ein Nachteil des Silikon-Obturators ist, dass das Ein- und Ausgliedern manuelles Geschick erfordert, was bei älteren Patienten nicht immer gegeben ist. Ebenso kann bei Veränderungen am Defekt, zum Beispiel durch Abheilen, kein Material angetragen werden, so dass meist ein neuer Obturator benötigt wird. In der Übergangsphase bis zur Fertigstellung des neuen Obturators steht der alte dem Patienten aber selbstverständlich als Verschluss zur Verfügung. Nach Einsetzen des neuen Obturators muss im Anschluss oft auch der Zahnersatz angepasst werden (Unterfütterung im Übergangsbereich Obturator–Prothese), was einen zusätzlichen Behandlungsschritt bedeutet.
Obturator-Prothese
Bei einer Obturator-Prothese (Abbildung 2) erfolgt der Defektverschluss mittels hartem Acrylat-Prothesenkunststoff. Sie kann im Zenit offen oder geschlossen gestaltet sein. Der Halt wird über Klammern, Teleskope oder eine implantatgetragene Verankerung erzielt. Bei vollständiger Zahnlosigkeit ist eine Obturator-Prothese nicht zu empfehlen, da der gewöhnlich genutzte Saugeffekt nicht hergestellt werden kann. Bei zahnlosen Patienten, die keine Implantate erhalten können oder sollen, ist es sogar empfehlenswert, den Defekt nicht zu rekonstruieren, damit Unterschnitte für einen Silikon-Obturator genutzt werden können.
Die Handhabung und Reinigung einer Obturator-Prothese ist selbst bei kompromittiertem Geschick einfach und eine Unterfütterung ist wie bei einer herkömmlichen Prothese gut durchzuführen. Zu bedenken ist hier, dass der Patient funktionell stark eingeschränkt wird, wenn die Prothese im zahntechnischen Labor angepasst werden muss. Bei ausgedehnten Defekten kann eine Obturator-Prothese sehr groß werden. Dies erschwert bei eingeschränkter Mundöffnung oft die Eingliederung, weshalb hier gegebenenfalls geteilt werden muss. Eine Verbindung der Einzelteile kann über Riegel, Zapfen oder Magnete erfolgen. Bei bestrahlten Tumorpatienten ist das Entstehen von Druckstellen durch die Nutzung eines harten Prothesenkunstoffs ein Risiko, das beachtet werden muss.
Die technischen Schritte der Abformung sind für eine Obturator-Prothese und einen Silikon-Obturator gleich. Als Zeitpunkt für die Abformung ist der Zeitraum von vier bis sechs Wochen nach der Tumoroperation zu empfehlen, da sich der Defekt in den ersten Wochen am meisten verändert.
Mit Einbringen eines Wendel-Tubus zur Sicherung der Atemwege, lässt sich der Defekt ohne Probleme abformen (Abbildung 3). Jener verhindert auch, dass der spätere Silikon-Obturator die Atemwege nicht verlegt. Speziell visköses Silikon-Abformmaterial („Laborsilikon Orange“, 12 Shore A, Institut für Anaplastologie Schilling, Würzburg, Deutschland) verhindert ebenfalls, dass die Abformmasse in Richtung des Pharynx fließt. Nach der Defektabformung können die herkömmlichen Arbeitsschritte für einen Zahnersatz (als Zusatz zum Silikon-Obturator oder zur Herstellung einer Obturator-Prothese) erfolgen.
Fazit
Zusammenfassend ist die Herstellung eines Silikon-Obturators oder einer Obturator-Prothese seitens der zahnärztlichen Arbeitsschritte grundsätzlich nicht sehr komplex. Die Defektabformung erfordert etwas Übung und das Wissen zur Vermeidung von Aspiration. Für die anfängliche Behandlung nach der Tumoroperation empfiehlt sich eher die Behandlung in einer spezialisierten Klinik.
Die Klinik für Zahnärztliche Prothetik des Universitätsklinikums Freiburg hat für betroffene Patienten eine Sprechstunde zur prothetischen Tumorrehabilitation eingerichtet, in der die interdisziplinären Behandlungsschritte mit dem Patienten besprochen, koordiniert und durchgeführt werden.
Die weitere Nachsorge nach Herstellung des Obturators sollte nach Möglichkeit im niedergelassenen Bereich beim Hauszahnarzt erfolgen, um gegebenenfalls weite Anfahrtswege der Patienten zu reduzieren. Sie sollte im Rahmen eines regelmäßigen und anfangs sehr engmaschigen Recalls stattfinden. Besonderes Augenmerk ist auf Druckstellen, besonders bei bestrahlten Patienten, und eine gute Mundhygiene zu richten. Bei Komplikationen und Schwierigkeiten im Hinblick auf die Dichtigkeit sollte die Überweisung zurück in die spezialisierte Klinik erfolgen. Die Entscheidung für oder gegen eine Variante muss patientenindividuell anhand der Defektkonstellation und der vorhandenen Dentition getroffen werden.
Literatur
Ali, A., Fardy, M.J., Patton, D.W., 1995. Maxillectomy--to reconstruct or obturate? Results of a UK survey of oral and maxillofacial surgeons. Br. J. Oral Maxillofac. Surg. 33, 207–210. doi.org/10.1016/0266-4356(95)90001-2
Berger, M., Grau, E., Saure, D., Ristow, O., Thiele, O., Hofele, C., Hoffmann, J., Seeberger, R., Freier, K., 2015. Occurrence of cervical lymph node metastasis of maxillary squamous cell carcinoma - A monocentric study of 171 patients. J. Cranio-Maxillo-fac. Surg. Off. Publ. Eur. Assoc. Cranio-Maxillo-fac. Surg. 43, 2195–2199. doi.org/10.1016/j.jcms.2015.09.009
Cordeiro, P.G., Santamaria, E., 2000. A classification system and algorithm for reconstruction of maxillectomy and midfacial defects. Plast. Reconstr. Surg. 105, 2331–2346; discussion 2347-2348. doi.org/10.1097/00006534-200006000-00004
Dos Santos, D.M., de Caxias, F.P., Bitencourt, S.B., Turcio, K.H., Pesqueira, A.A., Goiato, M.C., 2018. Oral rehabilitation of patients after maxillectomy. A systematic review. Br. J. Oral Maxillofac. Surg. 56, 256–266. doi.org/10.1016/j.bjoms.2018.03.001
Eveson, J.W., Cawson, R.A., 1985. Tumours of the minor (oropharyngeal) salivary glands: a demographic study of 336 cases. J. Oral Pathol. 14, 500–509. doi.org/10.1111/j.1600-0714.1985.tb00522.x
Gill, S., Mohan, A., Aggarwal, S., Varshney, A., 2018. Mucoepidermoid carcinoma of hard palate. Indian J. Pathol. Microbiol. 61, 397–398. doi.org/10.4103/IJPM.IJPM_617_17
Goiato, M.C., Tamae, A.C., Silva, P.I.S., dos Santos, D.M., Iyda, M.G., Moreno, A., Magro-Filho, O., Bertoz, A.P.M., 2011. Oral rehabilitation after surgical removal of pleomorphic adenoma. J. Craniofac. Surg. 22, 1996–1999. doi.org/10.1097/SCS.0b013e31823195fb
Howaldt, H.P., Vorast, H., Blecher, J.C., Reicherts, M., Kainz, M., 2000. Ergebnisse aus dem DÖSAK-Tumorregister. Mund. Kiefer. Gesichtschir. 4, S216–S225. doi.org/10.1007/PL00014543
Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF), 2021. S3-Leitlinie Diagnostik und Therapie des Mundhöhlenkarzinoms, Langversion 3.0, 2021.
Lopes, M.A., Santos, G.C., Kowalski, L.P., 1998. Multivariate survival analysis of 128 cases of oral cavity minor salivary gland carcinomas. Head Neck 20, 699–706. https://doi.org/10.1002/(sici)1097-0347(199812)20:8<699::aid-hed7>3.0.co;2-p
Moreno, M.A., Skoracki, R.J., Hanna, E.Y., Hanasono, M.M., 2010. Microvascular free flap reconstruction versus palatal obturation for maxillectomy defects. Head Neck 32, 860–868. doi.org/10.1002/hed.21264
Rogers, S.N., Lowe, D., McNally, D., Brown, J.S., Vaughan, E.D., 2003. Health-related quality of life after maxillectomy: a comparison between prosthetic obturation and free flap. J. Oral Maxillofac. Surg. Off. J. Am. Assoc. Oral Maxillofac. Surg. 61, 174–181. doi.org/10.1053/joms.2003.50044
Rothweiler, R., Gerlach, V., Voss, P., Poxleitner, P., Ermer, M., Gross, C., Schwer, C., Vach, K., Kalbhenn, J., Metzger, M., 2022. Aspirin, heparin and ischemia time in microvascular free flap surgery - their influence and an optimal anticoagulation protocol. J. Stomatol. Oral Maxillofac. Surg. 123, e556–e562. doi.org/10.1016/j.jormas.2022.03.001
Rotzinger, R., Bachtiary, B., Pica, A., Weber, D.C., Ahlhelm, F., 2020. Tumoren der Mundhöhle. Radiol. 60, 1038–1046. doi.org/10.1007/s00117-020-00756-5
Singh, S., Gokkulakrishnan, null, Jain, J., Pathak, S., Singh, K.T., 2010. Adenoid cystic carcinoma of buccal mucosa. J. Maxillofac. Oral Surg. 9, 273–276. doi.org/10.1007/s12663-010-0086-8
Strick, M.J., Kelly, C., Soames, J.V., McLean, N.R., 2004. Malignant tumours of the minor salivary glands--a 20 year review. Br. J. Plast. Surg. 57, 624–631. doi.org/10.1016/j.bjps.2004.04.017
Talamini, R., Bosetti, C., La Vecchia, C., Dal Maso, L., Levi, F., Bidoli, E., Negri, E., Pasche, C., Vaccarella, S., Barzan, L., Franceschi, S., 2002. Combined effect of tobacco and alcohol on laryngeal cancer risk: a case-control study. Cancer Causes Control CCC 13, 957–964. doi.org/10.1023/a:1021944123914
Triantafillidou, K., Dimitrakopoulos, J., Iordanidis, F., Koufogiannis, D., 2006. Mucoepidermoid carcinoma of minor salivary glands: a clinical study of 16 cases and review of the literature. Oral Dis. 12, 364–370. doi.org/10.1111/j.1601-0825.2005.01166.x
Wijbenga, J.G., Schepers, R.H., Werker, P.M.N., Witjes, M.J.H., Dijkstra, P.U., 2016. A systematic review of functional outcome and quality of life following reconstruction of maxillofacial defects using vascularized free fibula flaps and dental rehabilitation reveals poor data quality. J. Plast. Reconstr. Aesthetic Surg. JPRAS 69, 1024–1036. doi.org/10.1016/j.bjps.2016.05.003















