Benigne nicht-odontogene Kieferhöhlenzysten
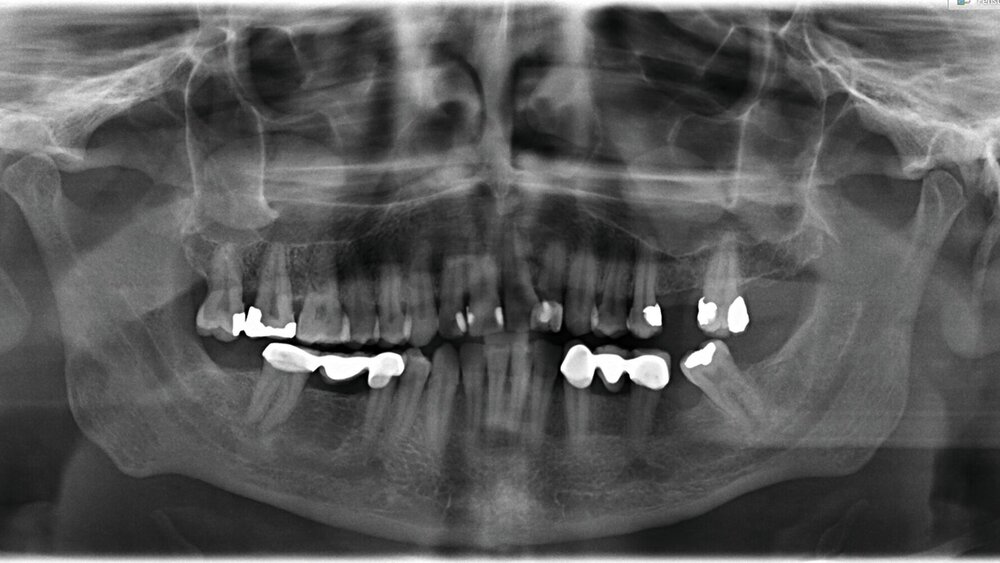
Ein 40-jähriger Patient wurde zur Extraktion der Zähne 17 und 18 überwiesen. Aus dem Jahr 2018 lag eine Panoramaschichtaufnahme vor, auf der zystische Veränderungen in beiden Kieferhöhlen (Regio 17 sowie 26) sichtbar waren (Abbildung 1). Als Verdachtsdiagnose wurde „Schleimretentionszysten" in der Patientenakte eingetragen, bevor ein aktuelles OPG angefertigt wurde.
Dort wurde eine ausgedehnte apikale Läsion an Zahn 17 sowie eine kleinere Läsion an 24 festgestellt (Abbildung 2). Beide waren klinisch druckdolent. Der Patient wurde über deren notwendige Therapie aufgeklärt. Neben der Extraktion der Zähne 18 und 17 wurden die Therapieoptionen des Zahnes 24 (Revision, Wurzelspitzenresektion oder Extraktion) erläutert. Der Patient entschied sich für die Wurzelspitzenresektion und wollte den Eingriff zu einem späteren Zeitpunkt durchführen lassen. Außerdem zeigten sich im Jahr 2022 die beiden Kieferhöhlenzysten deutlich vergrößert im Vergleich zur Voraufnahme aus 2018 – eventuell als Reaktion auf die entstandene apikale Parodontitis der benachbarten Zähne. Aufgrund der infektionsabhängigen Größenveränderung wurde die Verdachtsdiagnose in „Pseudozyste" geändert. Dem Patienten wurde aufgrund der Größe die Entfernung beider Zysten zur histologischen Absicherung empfohlen. Das wollte er sich noch überlegen.
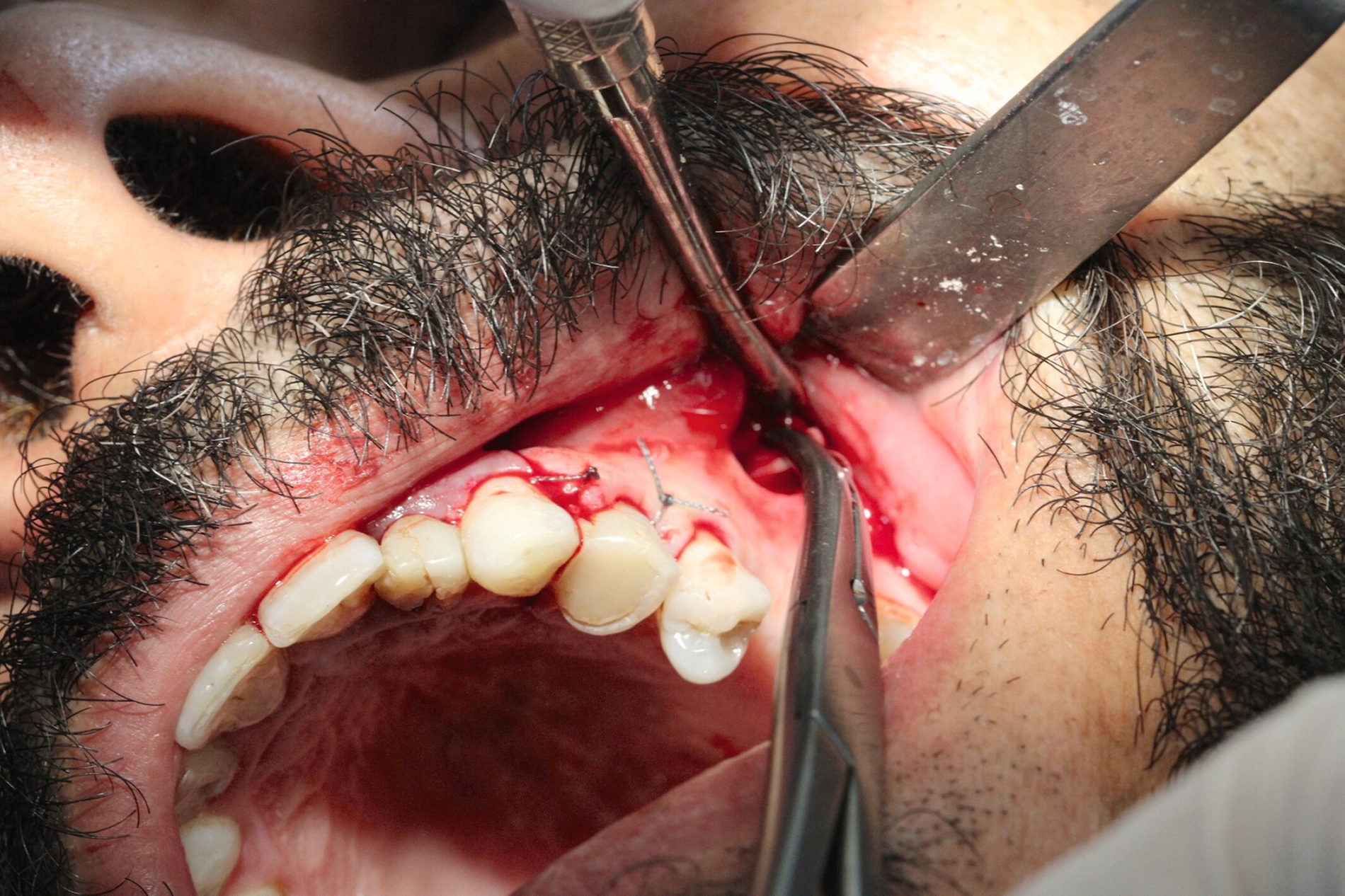
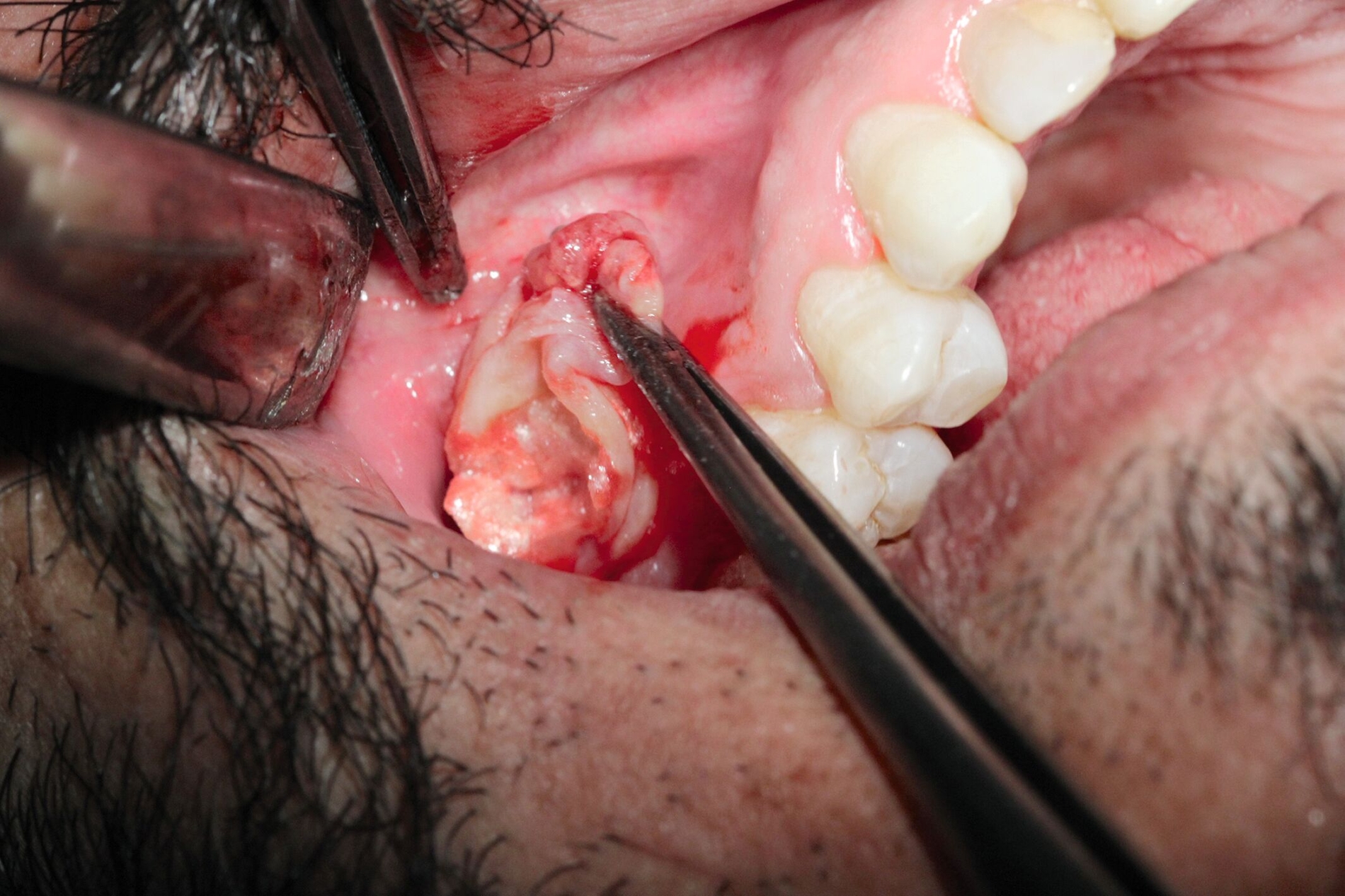
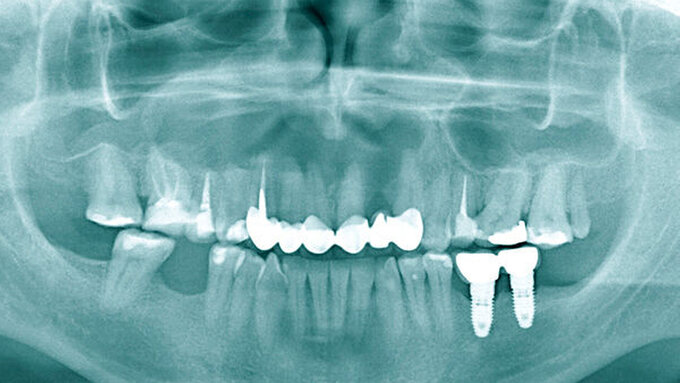
Die Zahnextraktion der Zähne 17 und 18 verlief komplikationslos. Drei Wochen später stellte sich der Patient zur Wurzelspitzenresektion an Zahn 24 vor. Nach schriftlicher Genehmigung des Patienten erfolgte eine Zystektomie in beiden Kieferhöhlen (Abbildungen 3 und 4). Auf der linken Seite wurden die Wurzelspitzenresektion und die Zystektomie zur Vermeidung eines Kontakts zwischen der infizierten Wurzelspitze und dem Sinus maxillaris dabei über verschiedene Zugänge durchgeführt. Beidseits zeigte sich intraoperativ eine Epithel-bekleidete Zyste, die von der Kieferhöhlenschleimhaut beziehungsweise der Schneider‘schen Membran gut abgrenzbar und trennbar war – was für eine Schleimretentionszyste spricht. Bei der Entfernung entleerte sich eine muköse Flüssigkeit.
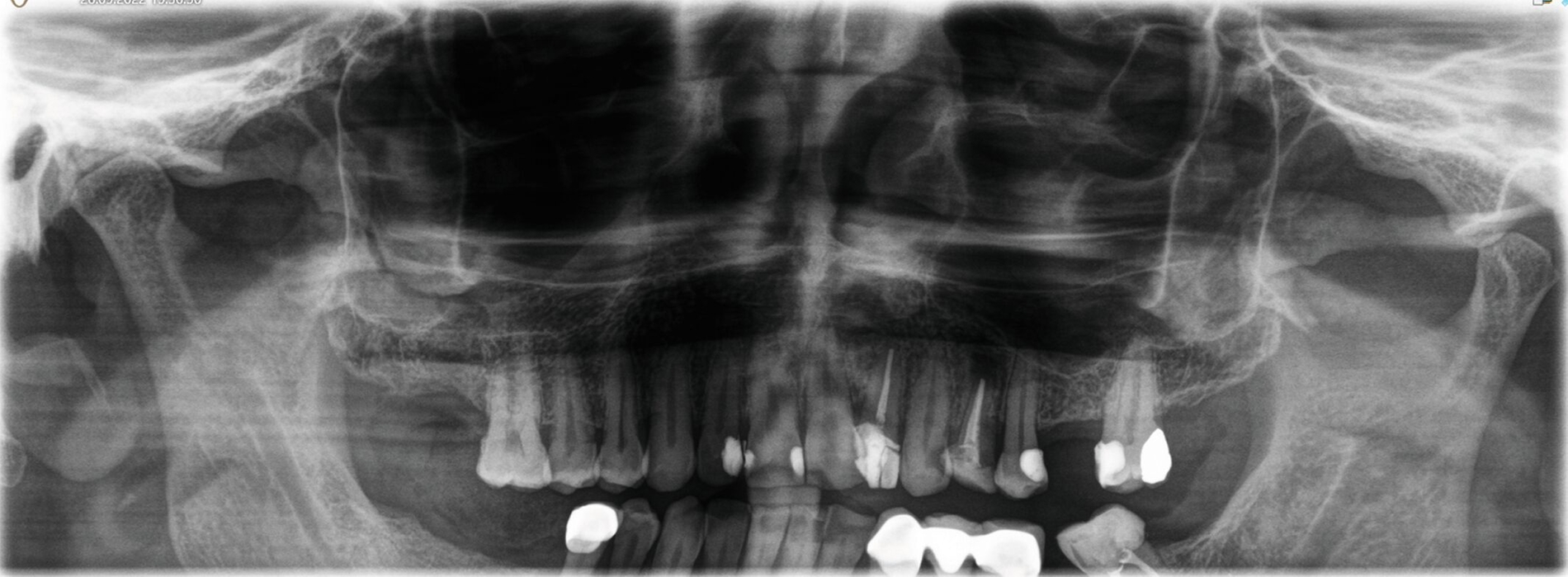
Die pathologische Untersuchung bestätigte die klinische Diagnose durch das Vorhandensein einer respiratorischen Schleimhaut beziehungsweise eines Epithels. Der Defekt wurde mit einer Membran gedeckt, die Wunde dicht vernäht. Zur Kontrolle nach der Wurzelresektion und den Zystektomien wurde ein OPG angefertigt (Abbildung 5). Der Patient erhielt für fünf Tage eine Antibiose. Darüber hinaus wurden Nasentropfen verschrieben und ein Schnäuzverbot erteilt.
Eine Woche später stellte sich der Patient zur Kontrolle und Nahtentfernung mit rückläufigen Schmerzen (Schwellung und Hämatom) vor. Er gab an, seit der Operation den Eindruck zu haben, dass seine Nasenatmung besser sei. Eine Panoramaaufnahme ab dem sechsten postoperativen Monat wurde zur Kontrolle empfohlen.
Diskussion
Die Kieferhöhle ist ein luftgefüllter Raum, der mit einer Membran beschichtet ist [Rodrigues et al., 2009]. Die Sinusmembran besteht von innen nach außen aus drei Schichten: dem respiratorischen Epithel, der Bindegewebsschicht und dem Periost [Chao et al., 2022]. Zu den benignen nicht-odontogenen Zysten, die am Boden der Kieferhöhle gefunden werden können, gehören unter anderem Mukozelen, Schleimretentionszysten und antrale Pseudozysten [Delilbasi et al., 2014].
Mukozele
Obwohl Mukozelen in den Nasennebenhöhlen – insbesondere Sinus frontalis und Sinus ethmoidalis – relativ häufig vorkommen, sind sie in der Kieferhöhle selten und machen weniger als zehn Prozent aller Mukozelen der Nasennebenhöhlen aus [Obeso et al., 2009]. Daher sind sie ein eher seltener Befund in der Zahnarztpraxis.
Die klinischen Anzeichen und Symptome von Mukozelen hängen hauptsächlich von deren Entwicklungsstadium ab. In frühen Stadien können die Patienten asymptomatisch sein. Manchmal klagen sie über Kopfschmerzen, eine verstopfte Nase, Schwellungen oder leichte intermittierende Schmerzen [Curtin und Rabinov, 1998]. Im Verlauf der weiteren Entwicklung der Läsion können Gesichtsschwellungen, Nasenausfluss und druckbedingte Zahnschmerzen auftreten. Aufgrund der anatomischen Nähe beeinflusst der pathologische Prozess der Mukozele im Sinus maxillaris die Orbitae. In Fällen, in denen die Mukozele in den Augenhöhlenboden eindringt, können eine Proptosis, periorbitale Schmerzen, Nervenkompressionen und Beeinträchtigungen der Augenbeweglichkeit entstehen. Auch verschwommenes Sehen ist möglich [Martin et al., 2000]. Bei den genannten begleitenden Komplikationen müssen bösartige Erkrankungen differenzialdiagnostisch unbedingt ausgeschlossen werden; dazu gehören das adenoidzystische Karzinom, das Plattenepithelkarzinom, das undifferenzierte Karzinom, das Plasmozytom sowie das Lymphom [Har-El, 2001]. Eine Infektion wird eine Mukozele in eine Pyozele umwandeln [Pierse und Stern, 2012].
Auf herkömmlichen Panoramaröntgenaufnahmen präsentiert sich die Mukozele als abgerundete, röntgendichte Masse, die den Sinusboden oder die gesamte Kieferhöhle umfasst. In der Regel ist sie invasiv und kann zu einer Knochenerosion mit medialer Ausbreitung in die Nasenhöhle führen. CT, DVT oder MRT können hilfreich sein, um die Läsion abzugrenzen und die möglicherweise beschädigten umgebenden Strukturen zu bewerten, was auch dazu beiträgt, den richtigen chirurgischen Ansatz zu bestimmen [Araujo et al., 2014]. Im Allgemeinen reicht ein CT beziehungsweise ein DVT zur Diagnostik und Therapieplanung von Kieferhöhlenzysten aus. Allerdings ist eine MRT-Aufnahme hilfreich bei der Beurteilung der orbitalen oder der intrakraniellen Ausdehnung und beim Ausschluss von Pilzerkrankungen oder Neoplasien [Chindasombatjaroen et al., 2009]. Zur Entfernung von Mukozelen wurden früher invasive intrakranielle Therapieansätze, beispielsweise nach Caldwell und Luc, verwendet. Aktuell wurde hingegen über erfolgreiche Ergebnisse mit endoskopischer enoraler/transnasaler Marsupialisation als Hauptbehandlungsmethode berichtet. Dies ist angesichts des einfachen Zugangs, der geringeren Morbidität und der Verringerung potenzieller Komplikationen deutlich minimalinvasiver [Matheny und Duncavage, 2003].
Schleimretentionszyste
Die Schleimretentionszyste ist eine gutartige selbstlimitierende Läsion, die aus einer „zystischen Erweiterung der Schleimdrüsen-Ausführungsgänge bei Verlegung mit Schleimpfröpfen" resultiert [Schwenzer und Ehrenfeld, 2011]. Die ätiologischen Faktoren hinter der Zystenbildung bleiben unbekannt. Schleimretentionszysten sind meistens unilateral, können aber in 10 bis 20 Prozent der Fälle bilateral sein. Retentionszysten in den Nasennebenhöhlen sind ein häufiger Zufallsbefund bei Röntgenuntersuchungen und treten bei 1,4 bis 9,6 Prozent der Allgemeinbevölkerung auf [Rodrigues et al., 2009]. Sie werden im DVT, im CT oder in der Panoramaschichtaufnahme normalerweise als homogene, kuppelförmige, trübe Verschattung auf dem Boden der Kieferhöhle beschrieben [Gendeh, 2014].
Eine Schleimretentionszyste der Kieferhöhle sollte generell nicht behandelt werden, insbesondere, wenn die Läsion klein und asymptomatisch ist. Mehrheitlich vergrößern diese Zysten sich langfristig nicht und können auch spontan schrumpfen. Wenn keine damit verbundenen Beschwerden vorliegen, kann „wait and see“ die geeignete Behandlungsstrategie sein. Nur bei größeren Zysten oder beim Auftreten von Symptomen wie Kopfschmerzen, Gesichts- oder periorbitalen Schmerzen, wiederholten Infektionen der Nasennebenhöhlen und/oder Nasenverstopfung sollte eine chirurgische Intervention erfolgen [Wang et al, 2007]. Die Differenzierung der Retentionszyste von der Pseudozyste ist radiologisch manchmal schwer bis unmöglich, insbesondere wenn diese auf dem Antrumsboden vorkommen – obgleich Retentionszysten weniger häufig sind als Pseudozysten [Araujo et al., 2014]. Wenn die Retentionszyste die Kieferhöhle vollständig ausfüllt, wird die röntgenologische Interpretation schwierig und die Verdachtsdiagnose einer Sinusitis liegt nahe [Parks, 2014]. Eine klare Korrelation zwischen infizierten Zähnen und der Größenänderung von Retentionszysten – wie im vorgestellten Fall – wurde in der Literatur nicht gefunden.
Antrale Pseudozysten
Pseudoantrale Zysten beziehungsweise antrale Pseudozysten werden als Ergebnis von bakteriellen Toxinen gebildet, die aus dem Infektionsbereich freigesetzt werden und die lokale kapillare Durchlässigkeit erhöhen, was zu einer Ansammlung von Serumexsudat im Gewebe und zum Abheben des Gewebes vom Knochen führt [Chao et al., 2022]. Mögliche Ursachen dafür sind: periapikale oder parodontale odontogene Infektion, Infektion der Nasennebenhöhlen oder eine allergische Sinusitis [Allard et al., 1981]. Eine kontrollierte Studie berichtet über die Entstehung von Pseudozysten beim Vorhandensein von Allergien, bei nasalen Krankheiten (Obstruktion, laufende Nase, dicker Nasenausfluss, Atrophie der Nasenmuscheln, Verstopfung des Ostiums) und bei der Verwendung topischer nasaler Medikamente oder Tropfen [Rodrigues et al., 2017]. Da Pseudozysten normalerweise asymptomatisch sind, werden sie – wie die Retentionszysten – häufig bei einer routinemäßigen Röntgenuntersuchung erkannt [Gardner, 1984]. Radiologisch ist diese Zyste eine kuppelförmige, gut abgegrenzte, leicht röntgendichte Läsion auf dem intakten Boden der Kieferhöhle. Bei der Feinnadelaspiration zeigt sich eine visköse gelbe Flüssigkeit. Eine Biopsie ist nur erforderlich, um andere Differenzialdiagnosen auszuschließen.
Zusammenfassend lässt sich sagen, dass die antrale Pseudozyste eine harmlose Läsion ist und keine Behandlung benötigt [Sette-Dias et al., 2013]. Ein aktueller systematischer Review hat zwischen den gesamten Eigenschaften der Pseudo- und der Retentionszyste nur durch die Epithelbekleidung unterschieden, zumal das radiologische Erscheinen der beiden Zysten laut dieser Studie gleich war [Anitua et al., 2020]. Nach einer Analyse von 19 Studien zwischen 2007 und 2019 wurde festgestellt, dass es keine klaren Unterschiede zwischen Pseudozyste, Retentionszyste und einer Schleimhautverdickung gibt und dass jeder Behandler diese Entitäten individuell unterscheidet oder manchmal sogar einen Sammelbegriff für verschiedene Entitäten verwendet. Daher kann die bereits erwähnte Beschreibung und Prävalenz der Retentionszyste auch auf die Pseudozyste zutreffen. In verschiedenen Literaturstellen wird der Ursprung der Pseudo- und der Retentionszyste klar beschrieben, jedoch die radiologischen Unterschiede nicht. Auf der anderen Seite kann die fortgeschrittene Mukozele durch ihre Invasivität und Knochenerosion von der Pseudozyste sowie der Schleimretentionszyste radiologisch gut differenziert werden [Anitua et al., 2020]. Bei fehlenden klinischen Symptomen kann die Pseudozyste belassen und beobachtet werden. Eine Indikation zur Therapie ist bei klinischen Symptomen unbedingt gegeben. Die Therapiemöglichkeiten bestehen aus Aspiration, chirurgischer Enukleation oder therapeutischer Endoskopie [Chao et al, 2022].
Okklusionszyste
Die Okklusionszyste ist eine seltene, allerdings typische Spätkomplikation operativer Eingriffe oder Traumata am Sinus maxillaris, die nach einigen Monaten, aber auch noch nach bis zu 30 Jahren auftreten kann. Als Vorgeschichte wird häufig ein früherer Caldwell-Luc-Eingriff oder eine andere Nasennebenhöhlenoperation berichtet [Ramakrishnan et al., 2020]. Mittlerweile werden die alten invasiven Interventionen in der Kieferhöhle dank der verbesserten medikamentösen und endoskopischen Therapieansätze nicht mehr häufig durchgeführt [Matheny and Duncavage, 2003]. Histopathologisch ähnelt die Okklusionszyste der Mukozele und kann in der Anfangsphase radiologisch ebenso schwer von der Pseudo- und der Retentionszyste differenziert werden [Araujo et al., 2014]. Eine Studie berichtet über die mögliche – aber sehr seltene – Entstehung einer Okklusionszyste nach Wurzelspitzenresektion oder schwieriger Zahnentfernung im Seitenzahnbereich des Oberkiefers [Redman und Rodrigues-Feo, 2020]. Wenn die Okklusionszyste nicht vollständig entfernt wird, ist ein Rezidiv zu erwarten.
Fazit
Mukozelen und Okklusionszysten sind seltene zystische Bildungen in der Kieferhöhle und dementsprechend auch selten in der Zahnarztpraxis; sie bedürfen jedoch einer chirurgischen Therapie.
Pseudozysten und Retentionszysten sind sehr schwer voneinander zu unterscheiden; allerdings ist die radiologische Beobachtung beim Fehlen klinischer Symptome zunächst ausreichend.
Die sicherste Diagnosestellung bei unklaren Entitäten kann nur durch eine histologische Untersuchung erfolgen.
Literaturliste
Aiuto R, Gucciardino F, Rapetti R, Siervo S, Bianchi AE. Management of symptomatic florid cemento-osseous dysplasia: Literature review and a case report. J Clin Exp Dent. 2018;10(3):e291-5.
B.W. Neville, D.D. Damm, C.M. Allen, J.E. Bouquot, Oral and maxillofacial pathology (3rd ed.), Saunders, Philadelphia (2009), 613–77, 701–40
Bansa lS, Shetty S, Bablani D, Kulkarni S, Kumar V, Desai R. Florid osseous dysplasia. J Oral Maxillofac Pathol. 2011;15:197–200
C.M. Resnick, R.A. Novelline. Cemento-osseous dysplasia, a radiological mimic of periapical dental abscess, Emerg Radiol, 15 (2008), pp. 367-374
Carulli C, Innocenti M, Brandi ML. Bone vascularization in normal and disease conditions. Front Endocrinol (Lausanne). 2013;4:106
Consolaro A, Paschoal SRB, Ponce JB, Miranda DAO. Florid cemento-osseous dysplasia: a contraindication to orthodontic treatment in compromised areas. Dental Press J Orthod. 2018;23(3):26-34. doi:10.1590/2177-6709.23.3.026-034.oin
Consolaro A, Hadaya O, Consolaro RB. A contraindication to orthodontic and endodontic treatment: periapical cemento-osseous dysplasia. Dental Press J Orthod. 2020;25(5):17-22. doi:10.1590/2177-6709.25.5.017-022.oin
Das BK, Das SN, Gupta A, Nayak S. Florid cemento-osseous dysplasia. J Oral Maxillofac Pathol. 2013;17(1):150. doi:10.4103/0973-029X.110735
Daviet-Noual, V., Ejeil, AL., Gossiome, C. et al. Differentiating early stage florid osseous dysplasia from periapical endodontic lesions: a radiological-based diagnostic algorithm. BMC Oral Health 17, 161 (2017). doi.org/10.1186/s12903-017-0455-5
El-Naggar AK, Chan JKC, Grandis JE, Takata T, Slootweg PJ: WHO classification of head and neck Tumours, 4th edn. Lyon; 2017
Eskandarloo A, Yousefi F. CBCT findings of periapical cemento-osseous dysplasia: a case report. Imaging Sci Dent 2013;43:215– 218
Heuberger B M, Bornstein M M, Reichart P A, Hurlimann S, Kuttenberger J J: Periapical osseous dysplasia of the anterior maxilla – A case presentation (in German). Schweiz Monatsschr Zahnmed 120: 1001–1006 (2010)
Kato, C.N.A.O., de Arruda, J.A.A., Mendes, P.A. et al. Infected Cemento-Osseous Dysplasia: Analysis of 66 Cases and Literature Review. Head and Neck Pathol 14, 173–182 (2020). doi.org/10.1007/s12105-019-01037-x
Kutluay Köklü H, Cankal DA, Bozkaya S, Ergün G, Bar E. Florid cemento-osseous dysplasia: Report of a case documented with clinical, radiographic, biochemical and histological findings. J Clin Exp Dent. 2013;5(1):e58-e61. Published 2013 Feb 1. doi:10.4317/jced.50854
Lin TM, Huang WH, Chiang CP, Lin HN, Liao YS, Chiang ML. Florid cemento-osseous dysplasia (FCOD): case report. J Dent Sci 2010;5:242–245
Marx RE, Stern D. Firo-osseous diseases and systemic diseases affecting bone. In: Bywaters LC, editor. Oral and maxillofacial pathology. Illinois, PA: Quintessence publishing Co. Inc; 2003. pp. 739–67.
Mangala M, Ramesh D, Surekha P, Santosh P. Florid cemento-osseous dysplasia : review and report of two cases. Indian J Dent Res 2006;17:131–134
Mehta RV, Khan S. Floridcement-osseousdysplasia: A case report. Indian Dent Res Rev. 2011;3:22–3
Minhas G, Hodge T, Gill DS (2008) Orthodontic treatment and cemento-osseous dysplasia: a case report. J Orthod 35:90–95Önder B, Kurşun S
Melrose RJ, Abrams AM, Mills BG. Florid osseous dysplasia. A clinical-pathologic study of thirty-four cases. Oral Surg Oral Med Oral Pathol. 1976;41(1):62–82
Özta B, Bariş E, Erdem E. Florid osseous dysplasia in a middle-aged Turkish woman: a case report. Imaging Sci Dent 2013;43:197–200
Raubenheimer EJ, Noffke CE, Boy SC. Osseous dysplasia with gross jaw expansion: a review of 18 lesions. Head Neck Pathol. 2016;10(4):437–43
Sarmento DJ, Monteiro BV, de Medeiros AM, da Silveira EJ. Severe florid cemento-osseous dysplasia: a case report treated conservatively and literature review. Oral Maxillofac Surg. 2013;17:43–6. Springer-Verlag
Sethusa MPS, Khan MI. The orthodontic management of a patient presenting with cemento-osseous dysplasia. SADJ. 2009;64(3):120-4
Waldron CA. Fibro-osseous lesions of the jaws. J Oral Maxillofac Surg. 1993;51(8):828–35