Methoden der Zytotoxizitätstestung
Adhäsive Füllungsmaterialien spielen eine wichtige Rolle in der klinischen Praxis. 2015 wurden weltweit schätzungsweise über 800 Millionen Kompositfüllungen im Frontzahn- und im Seitenzahnbereich gelegt [Tsujimoto et al., 2018]. Insgesamt zeichnen sich die Materialien durch eine gute klinische Erfolgsrate aus [Da Rosa Rodolpho et al., 2022]. Allerdings kommt es in bestimmten Situationen zu Misserfolgen, das heißt, die Restauration muss repariert oder erneuert werden – zum Beispiel aus materialbedingten oder patientenspezifischen Ursachen. Die häufigsten Folgen sind dabei Sekundärkaries und Füllungsfrakturen [Da Rosa Rodolpho et al., 2022; Opdam et al., 2010]. Bei vitalen Zähnen kann es außerdem zu einer Schädigung der Pulpa kommen, mit der Folge einer Pulpitis oder gar Nekrose [Schmalz und Arenholt-Bindslev, 2009].
Eine Nekrose kann verschiedene Gründe haben: Die Bakterienlast der kariösen Läsion war zu hoch, so dass sich eine irreversible Pulpitis entwickelt, oder es kam bei der Präparation zur Gewebedenaturation oder zu einer Odontoblastenverlagerung in die Dentintubuli durch unzureichende Wasserkühlung [Bergenholtz, 1991]. Doch auch die verwendeten Werkstoffe können zu einer Pulpaschädigung führen oder zumindest dazu beitragen. Im Fall von Kompositen spielen dabei freigesetzte Substanzen wie zum Beispiel Monomere, Katalysatoren oder sonstige Substanzen eine wesentliche Rolle.
Freigesetzte Substanzen
Dentale Komposite werden in der Regel mit einem Adhäsivsystem verwendet und bestehen aus drei verschiedenen Phasen: einer organischen, polymerisierbaren Matrix, anorganischen Füllpartikeln und einem Silan-Haftvermittler, der die anorganischen Füllstoffe mit der organischen Matrix verbindet. Übliche, enthaltene Monomere sind die zähflüssigen Bis-GMA (Bisphenol-A-Glycidylmethacrylat), Bis-EMA (Bisphenol-A-Glycidylmethacrylat Ethoxyliert) oder UDMA (Urethan-Dimethacrylat), sowie verdünnende Co-Monomere wie TEGDMA (Triethylenglycoldimethacrylat) oder HEMA (Hydroxyethylmethacrylat).
Die Konzentration dieser Monomere ist in Adhäsiven besonders hoch, da hier der Füllstoffanteil sehr gering ist oder gänzlich fehlt [Schmalz und Arenholt-Bindslev, 2009]. Das Vorhandensein dieser Substanzen in den Werkstoffen per se löst aber noch keine Pulpaschädigung aus. Vielmehr müssen diese Substanzen aus den Werkstoffen freigesetzt werden. Und ebendies ist der Fall. Es wurde nachgewiesen, dass kritische Bestandteile sowohl aus nicht vollständig ausgehärteten Kompositen [Durner et al., 2012] als auch aus angemessen polymerisierten Materialien durch Dentinliquor eluiert werden können [Shen et al., 2022]. Insbesondere HEMA und TEGDMA können in ausreichender Konzentration durch Dentin diffundieren und – unter bestimmten Bedingungen – toxische Zellschäden in der Pulpa verursachen [Bouillaguet et al., 1996; Gallorini et al., 2014; Schweikl et al., 2006].
Zelltoxizität
Der Begriff „Toxizität“ kann sich auf systemische oder lokale Wirkungen beziehen. Systemische, das heißt nicht die oralen Gewebe betreffende Effekte, sind bei dentalen Kompositen nach gegenwärtigem Stand selten [Schmalz und Arenholt-Bindslev, 2009]. Die Wirkung von freigesetztem Bisphenol A als eine endokrin aktive Substanz wird allerdings heute kritisch diskutiert [Schmalz und Widbiller, 2022]. Lokale Effekte können die Schleimhäute des Patienten oder auch die Dermis des zahnärztlichen Personals betreffen. In diesem Artikel soll jedoch speziell auf die Folgen für den Pulpa-Dentin-Komplex eingegangen werden.
Hinsichtlich einer Zelltoxizität zeigen viele verschiedene In-vitro-Studien, dass aus Kompositen und Adhäsiven freigesetzte Substanzen eine zellschädigende Wirkung haben. Durch eluierte Inhaltsstoffe werden Einschränkungen des Zellmetabolismus, Zerstörung von Zellmembranen und morphologische Veränderungen von Zellen beobachtet [Ohlsson et al., 2024] (Abbildung 1). In geringeren Konzentrationen können mutagene und genotoxische Veränderungen auftreten. Die Ursache dafür ist unter anderem eine erhöhte intrazelluläre Konzentration freier Sauerstoffradikale, die wiederum DNA-Schäden verursachen [Demirci et al., 2008; Krifka et al., 2013].
Des Weiteren kann gezeigt werden, dass Monomere wie HEMA oder TEGDMA die Immunabwehr von Makrophagen gegenüber Bakterien blockieren, was zu einer erhöhten Anfälligkeit der Pulpa für bakterielle Toxine führen kann [Eckhardt et al., 2009]. TEGDMA beeinträchtigt zudem in einem klinisch relevanten Konzentrationsbereich in Pulpazellen die Synthese von Signalmolekülen wie TGF-b (Transforming Growth Factor b), wodurch schlussendlich die Fähigkeit der Pulpa zur Tertiärdentinbildung eingeschränkt wird [Galler et al., 2011].
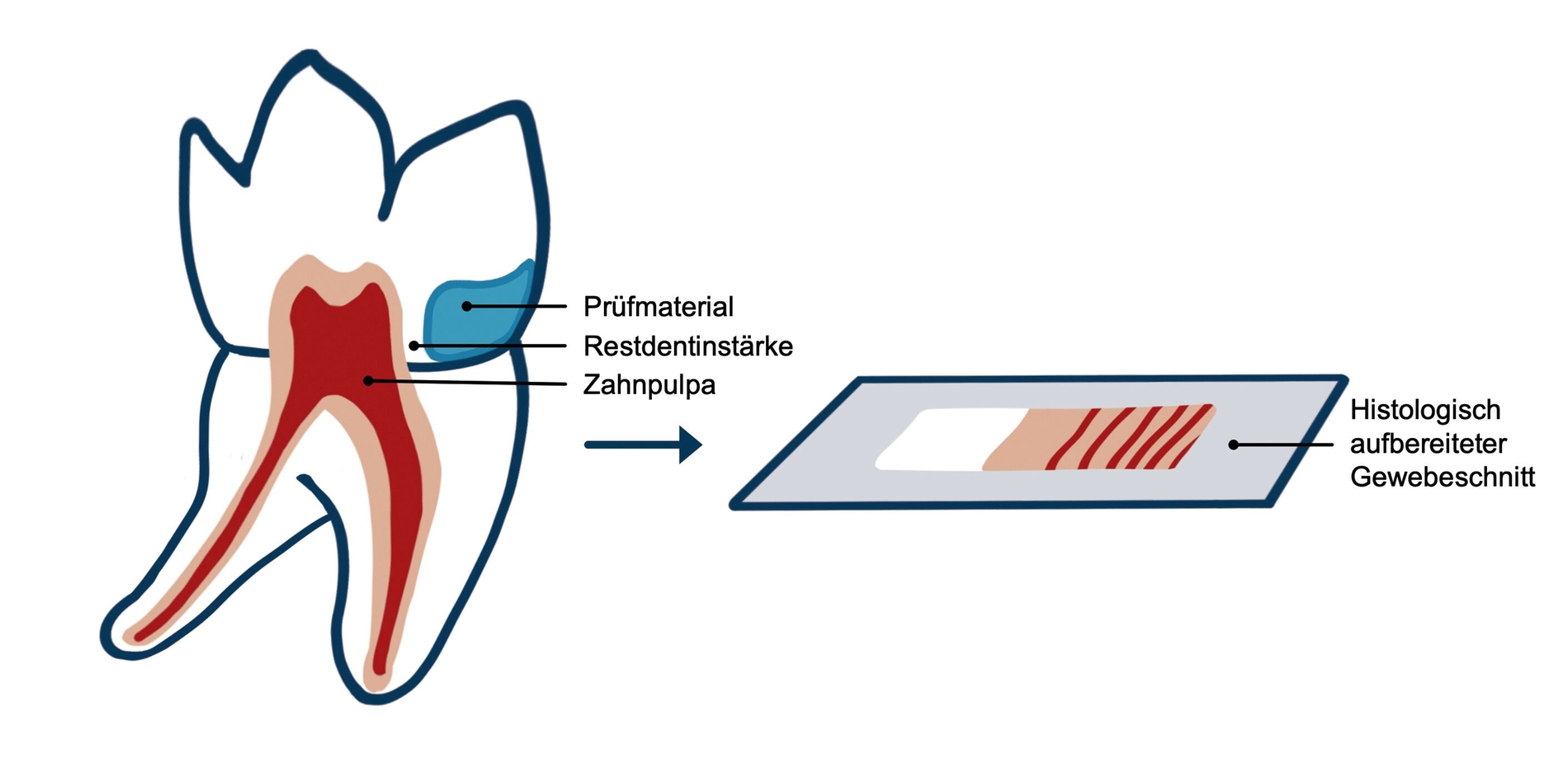
Untersuchungen an Versuchstieren oder an menschlichen Zähnen unterstützen teilweise die In-vitro-Ergebnisse. Während einige Autoren keine Pulpaschädigung fanden, wurde in anderen Untersuchungen über ausgeprägte Pulpaschädigungen nach Säureätzung und Applikation von Dentinadhäsiven berichtet [Gwinnett und Tay, 1998; Hebling et al., 1999]. Pulpaschäden treten oft ohne klinische Symptome auf, können aber histologisch nachgewiesen werden [Shen et al., 2022] (Abbildung 2).
Zytotoxizitätstestung
Obwohl ein Zahn auch ohne Pulpa nach erfolgreicher Wurzelkanalbehandlung in der Mundhöhle verbleiben kann, ist es immer erstrebenswert, die Pulpa zu erhalten [Caplan et al., 2005]. Deshalb müssen Hersteller dentaler Materialien für die Marktzulassung und den Erhalt des CE-Kennzeichens eine umfangreiche klinische Risikobewertung durchführen. Das gesamte Verfahren ist in der Medizinprodukte-Gesetzgebung der EU festgelegt, die Einzelheiten der Prüfungen und der Risikobewertung in entsprechenden ISO-Normen.
Die klinische Risikobewertung erfolgt nach ISO-14971 und muss die beabsichtigte Funktion des Materials im Mund, seine physikalischen und chemischen Eigenschaften, die Freisetzung von Substanzen durch das Material, den Ort und die Dauer der Exposition berücksichtigen. Das Ergebnis der klinischen Risikobewertung bestimmt die durchzuführenden Tests (Abbildung 3).
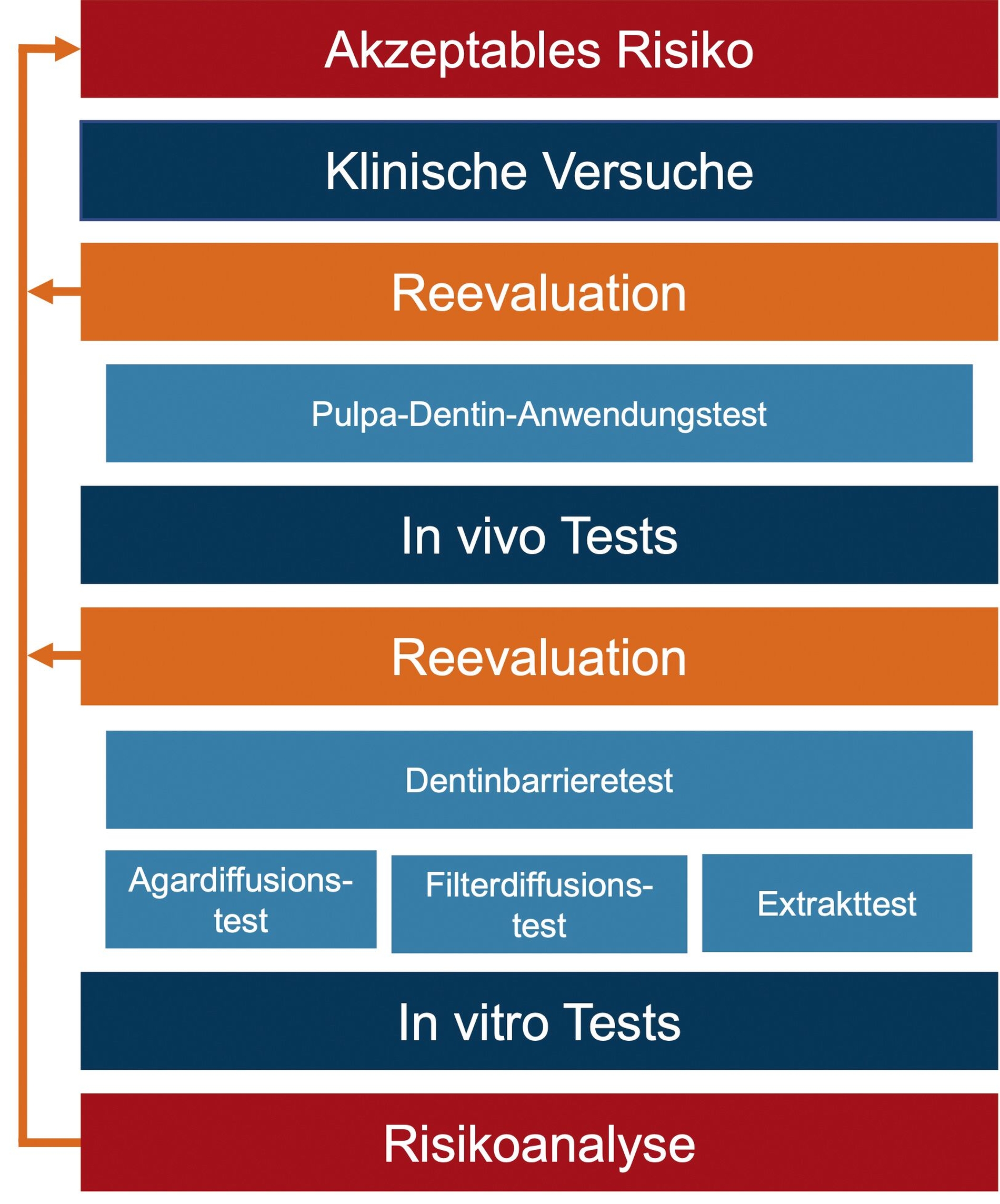
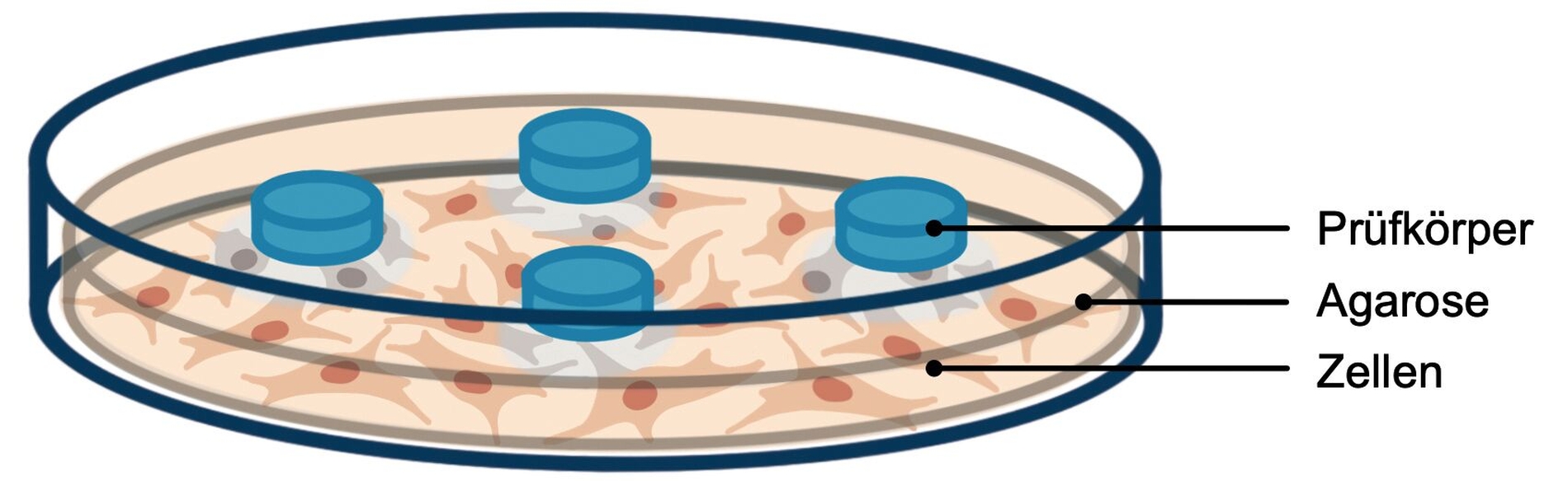
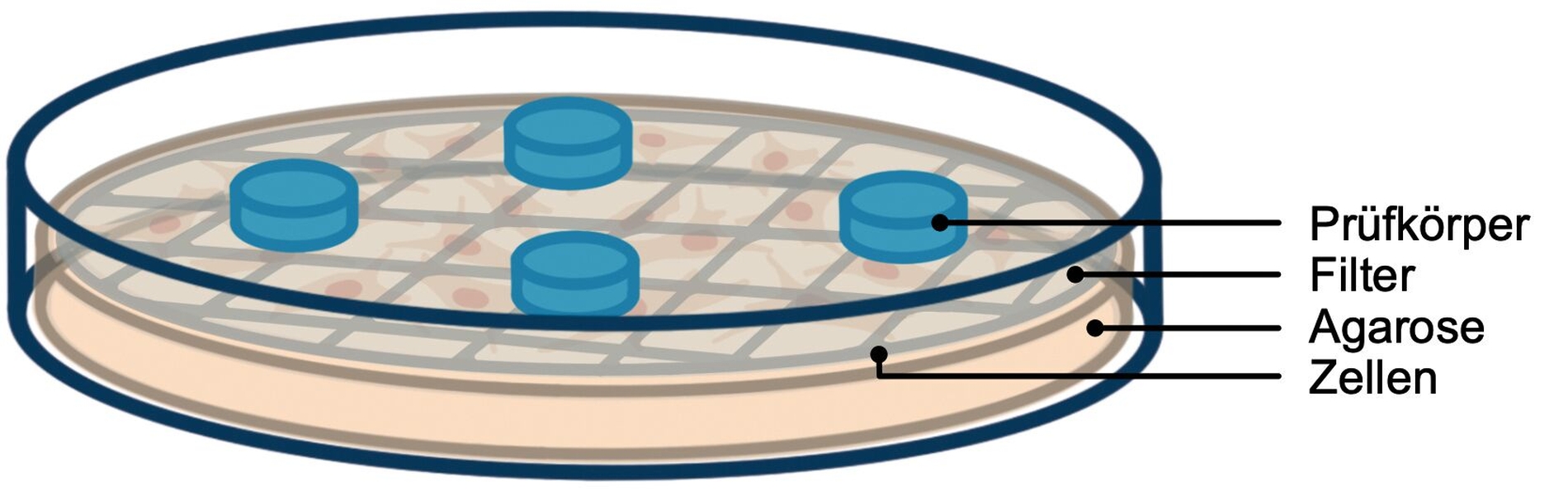
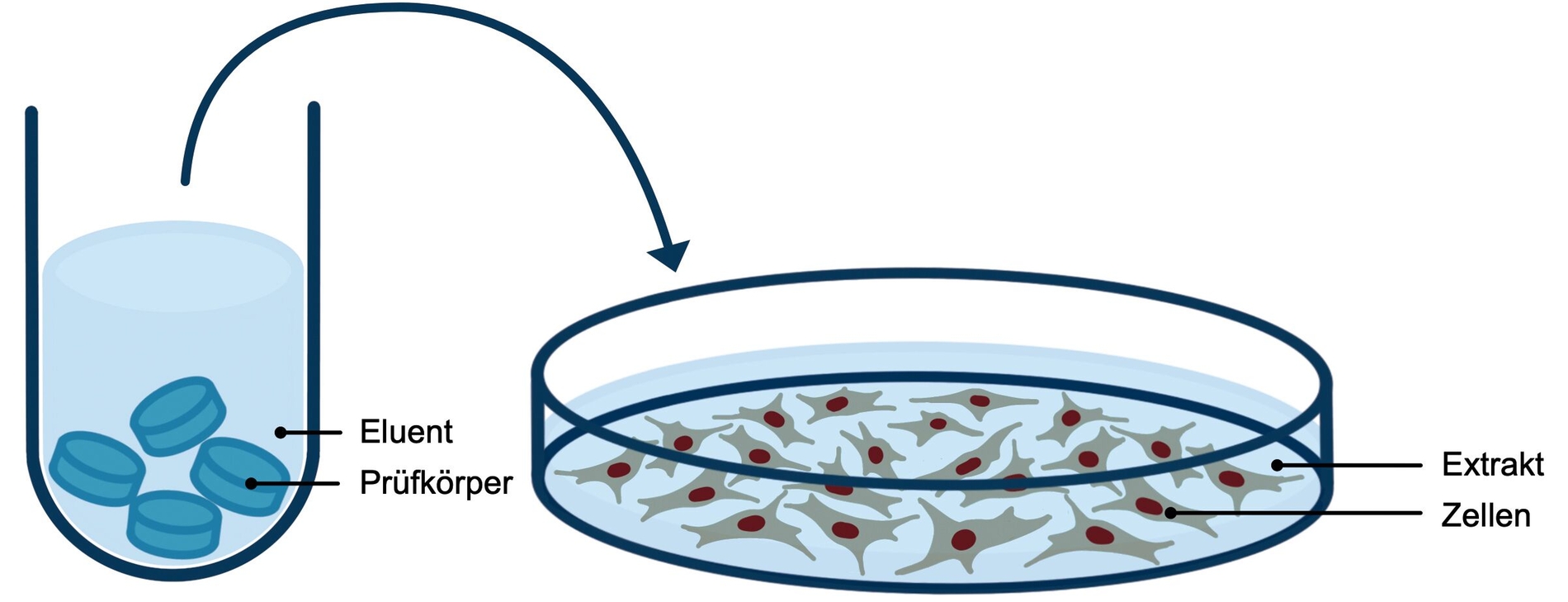
Während sich ISO-10993 auf die biologische Bewertung aller Medizinprodukte bezieht, beschreibt ISO-7405 spezielle Tests für die Untersuchung der Biokompatibilität dentaler Materialien. Zu den In-vitro-Tests, die in der ISO-Norm beschrieben werden, gehören unter anderem der Agardiffusionstest (Abbildung 4), der Filterdiffusionstest (Abbildung 5) und der Extrakttest (Abbildung 6). In diesem Zusammenhang können auch In-vitro-Tests zur Gentoxizität und Mutagenität erforderlich werden.
Als In-vivo-Test ist der Pulpa-Dentin-Anwendungstest beschrieben (Abbildung 7). Hier werden Materialien nach Herstellerangaben an Tierzähnen getestet. Als Versuchstiere eignen sich Affen, Hunde, Frettchen oder Minischweine. Auch die Verwendung von zur Extraktion freigegebenen menschlichen Zähnen wird dargestellt.
Obwohl dieser Pulpa-Dentin-Anwendungstest die Situation am Patienten besser simuliert als Zellkulturtests, haben auch diese Verfahren Limitationen. Bei In-vivo-Versuchen an Versuchstieren und auch an menschlichen Zähnen ist kritisch, dass dies meist Zähne mit einer gesunden, oftmals jungen und damit regenerationsfähigen Pulpa sind, wohingegen in der Praxis meist schon eine kariesbedingte Pulpavorschädigung vorliegt, wodurch die Heilungs- und Regenerationsfähigkeit der Pulpa eingeschränkt sein kann.
Zudem muss der Einsatz von Versuchstieren nach gegenwärtiger Gesetzeslage kritisch betrachtet werden und in jedem Fall durch den möglichen Erkenntnisgewinn gerechtfertigt sein. Tierversuche können also in besonderen Fällen nötig sein, beispielsweise bei vollständig neuer Chemie eines Produkts oder neuen Materialklassen [Schmalz und Arenholt-Bindslev, 2009]. In der Planung dieser Versuche sind stets die drei Rs zu beachten: Replace, Reduce, Refine. Das bedeutet, Tierversuche, wo möglich, durch Zellkultur oder Computersimulation zu ersetzen, die Anzahl der Versuchstiere zu reduzieren und die Methoden kontinuierlich zu verbessern [Ohlsson et al., 2022; Russell und Burch, 1992].
Der Dentinbarrieretest (ISO-7405 Annex B), wurde entwickelt, um den Einsatz von Tierversuchen zu senken und den Pulpa-Dentin-Komplex in vitro realistisch nachbilden zu können. Hier wird ein spezielles Zellkulturgefäß durch eine Scheibe aus humanem oder bovinem Dentin in zwei Kammern geteilt. In der unteren Kammer werden Zellen einschichtig oder mittels eines Netzes aus Polyamid als dreidimensionale Kultur gezüchtet. Perfusionspumpen sorgen für den steten Austausch von Zellkulturmedium. Im oberen Teil des Gefäßes können die Testmaterialien eingebracht werden. Die gesamte Einheit wird auf einer beheizten Plattform inkubiert (Abbildung 8).
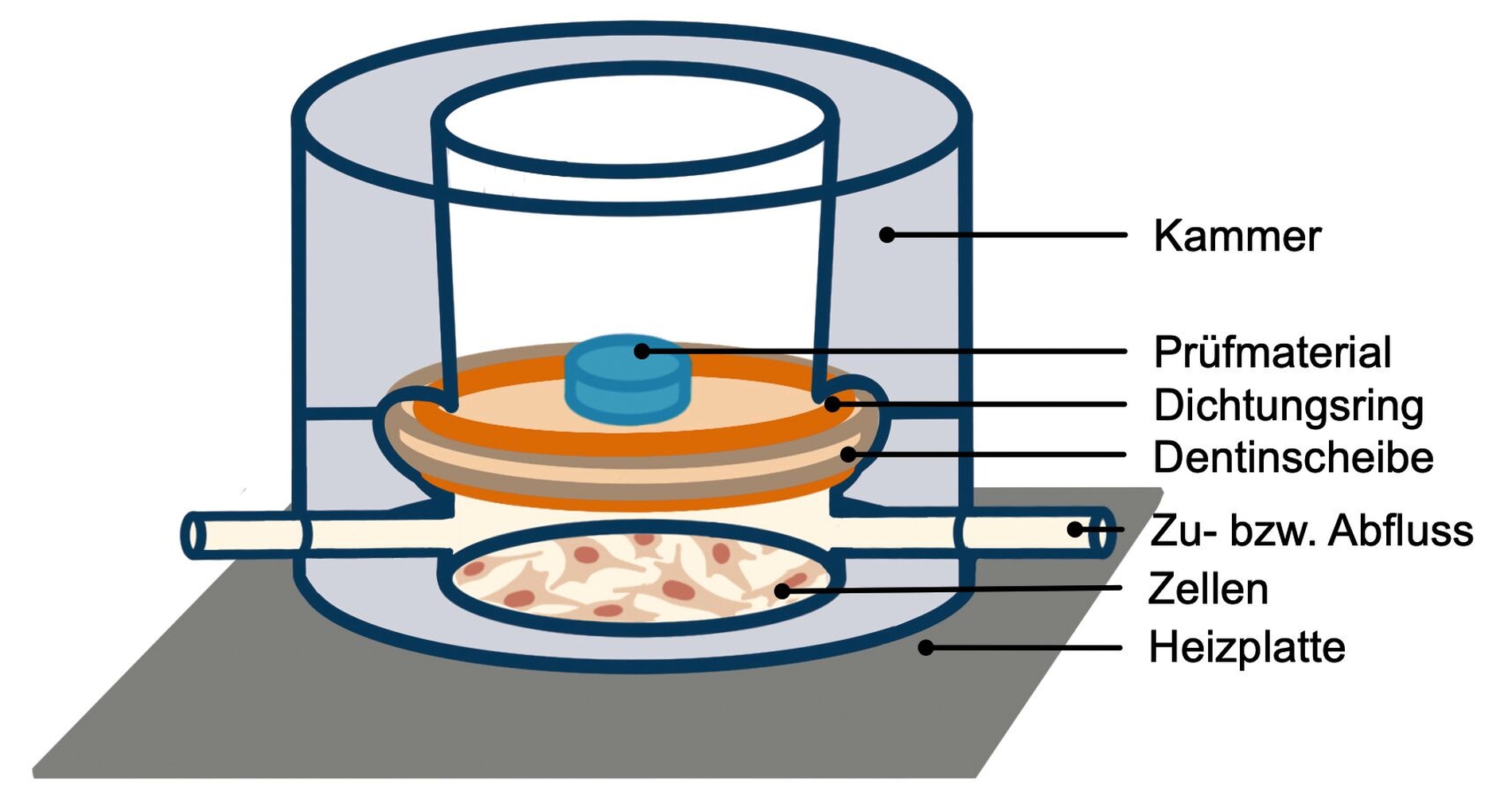
Da die Testanordnung vergleichsweise aufwendig ist, wird vielerorts an einer Weiterentwicklung des Dentinbarrieretests geforscht [Caldas et al., 2022; Imazato et al., 2000]. So wurden beispielsweise Pulp-on-a-chip-Anwendungen erarbeitet, die sogar um Biofilm erweitert worden sind [Rodrigues et al., 2021]. Auch 3-D-Organoid-Kulturen, die Pulpa im Reagenzglas, werden vereinzelt untersucht [Jeong et al., 2020]. Bisher wurde jedoch noch kein System etabliert, das in Kombination mit Standard-Zellkulturgeräten einfach, günstig und in hoher Replikationszahl verwendet werden kann.
Bedeutung für die Pulpa
Da sowohl In-vitro-Tests zur Zelltoxizität als auch Tierversuche Limitationen haben und nicht direkt auf die tatsächliche Situation übertragbar sind, müssen Ergebnisse verschiedener Tests im Sinne der Risikobewertung beurteilt werden. Dabei ist zu berücksichtigen, dass im weitesten Sinne toxische Reaktionen dosisabhängig verlaufen und dass Dentin eine Diffusionsbarriere darstellt [Schmalz et al., 2001]. Die Restdentinstärke ist hierbei relevant. Auch die indirekt toxische Wirkung einiger Komposite durch die Stimulation des Bakterienwachstums zwischen Werkstoff und Kavitätenboden und der erhöhten Anfälligkeit der Pulpa für bakterielle Toxine muss betrachtet werden [Bergenholtz, 2000; Schmalz und Arenholt-Bindslev, 2009].
Schutz der Pulpa
Von der European Society of Endodontology (ESE) werden in tiefen Kavitäten spezielle Maßnahmen zum Schutz der Pulpa empfohlen [Bjørndal et al., 2019]. Obwohl die Datenlage begrenzt ist [Schwendicke et al., 2015], erscheint in tiefen Kavitäten eine mechanische Barriere zwischen Kavitätenboden und dem Komposit sinnvoll. Auf dem Markt gibt es viele Materialien, deren Hersteller behaupten, dass sie biokompatibel oder sogar bioaktiv und für diesen Zweck geeignet seien. Der Begriff „Bioaktivität" ist bisher nicht geschützt und die FDI warnt vor der Verwendung dieses Begriffs als Marketinginstrument [Schmalz et al., 2023].
Historisch gesehen wurden Kalziumhydroxid-Suspensionen für die sogenannte indirekte Überkappung empfohlen. Studien zeigen zwar, dass Kalziumhydroxidpräparate einen geringfügig positiven Effekt haben [Franzon et al., 2007], sie sich aber in ihrer Wirksamkeit unterscheiden. Aushärtende Materialien (Pasten-Pasten-Systeme oder auch lichthärtend), stellen weniger oder sogar kein freies Kalziumhydroxid zur Verfügung [Arandi, 2017]. Kalziumhydroxid-Suspensionen sind jedoch schwierig in der Handhabung und es bedarf eines Abdeckungsmaterials, um anschließend adäquat eine Füllung legen zu können. Dabei darf das Abdeckungsmaterial nicht mit dem pH-Wert des Kalziumhydroxids interferieren.
In den letzten Jahren werden zunehmend hydraulische Trikalziumsilikatzemente wie MTA oder Biodentine nicht nur zur direkten Überkappung, sondern auch für die indirekte Überkappung empfohlen [Faraco und Holland, 2001; Nair, 2019; Petrou et al., 2014]. Auch in dem Fall, dass eine klinisch nicht diagnostizierbare Pulpaeröffnung vorliegt, bieten diese Materialien Vorteile. Hier sind die Kosten natürlich ein einschränkender Faktor.
Zahlreiche klinische Studien bestätigen jedoch, dass die Qualität des Verbunds zwischen Restaurationsmaterialien und Zahnhartsubstanz einer der wichtigsten Faktoren für den Erfolg einer indirekten Pulpaüberkappung ist. So sollte eine Unterfüllung nie die Suffizienz der Füllung herabsetzen und eine Bakterienpenetration erlauben [Bergenholtz, 2000; Kuzmanovic-Radman et al., 2014].
Was ist nun die klinische Konsequenz? In flachen und mittleren Kavitäten steht die Vermeidung von bakterieller Penetration zwischen Werkstoff und Kavitätenboden durch strikte Anwendung der Adhäsiv-Technik und einer suffizienten Abdichtung im Vordergrund. Zelltoxische Schäden sind eher unwahrscheinlich. In tiefen Kavitäten hingegen sollte ein zusätzlicher Pulpaschutz erfolgen.
Medizinprodukte-Gesetzgebung und Verantwortung des Zahnarztes
Für die Marktzulassung ist der Hersteller verantwortlich. Er schreibt die Indikation und die Art der Anwendung in den Gebrauchsinformationen – auch gemäß ISO-Normen – vor. Die Verantwortung der Zahnärztin und des Zahnarztes ist, diesen Vorgaben strikt zu folgen. Bei Abweichung (sogenanntem Off-Label-Use) wird die gesamte Verantwortlichkeit auf den Behandelnden übertragen. Eine weitere Aufgabe des Zahnarztes oder der Zahnärztin ist die Meldung von materialbedingten Zwischenfällen und Unverträglichkeiten im Sinne der „Post-Market Surveillance“. Dabei geht man davon aus, dass auch bei der zurzeit besten verfügbaren und gewissenhaftesten präklinischen Prüfung es später bei großflächigem Einsatz an vielen Patienten zu Problemen kommen kann. Der Zahnarzt muss daher derartige Nebenwirkungen den zuständigen Stellen mitteilen – in Deutschland der Bundeszahnärztekammer.

Fazit
Aus Kompositen freigesetzte Substanzen können auf verschiedene Weise Pulpazellen schädigen. In flachen oder mitteltiefen Kavitäten beispielsweise durch eine Förderung der Biofilmbildung am Kavitätenboden. Dies ist durch eine strikte Anwendung der Adhäsivtechnik zu vermeiden. In tiefen Kavitäten kann die Pulpa durch diffundierende Bestandteile auch direkt Schaden nehmen. Hier ist zusätzlich der Schutz der Pulpa ratsam. Bewährt haben sich Präparate, die Kalziumhydroxid freisetzen. In letzter Zeit werden vermehrt Trikalziumsilikat-Zemente empfohlen.
Komposite werden heute nach europäischer Medizinproduktegesetzgebung vor der Marktzulassung bewertet und gegebenenfalls getestet, dabei spielen ISO-Normen eine wichtige Rolle. Gängige In-vitro-Tests stellen die tatsächliche Situation in der Mundhöhle nur wenig nach. Tierversuche entsprechen weitgehend den Gegebenheiten in der Mundhöhle, die Ergebnisse sind jedoch nicht eins zu eins auf den Menschen übertragbar und müssen aus tierschutzrechtlichen Gründen in jedem Einzelfall kritisch bewertet werden. Der Dentinbarrieretest und moderne, dreidimensionale Zellkulturmethoden können hier einen guten Mittelweg darstellen, es bedarf jedoch einer Weiterentwicklung.
Am Ende liegt es in der Verantwortung der Zahnärztin und des Zahnarztes, den Vorgaben des Herstellers zur Indikation und Handhabung von Kompositen strikt zu folgen. Die Meldung von aufgetretenen Nebenwirkungen aus dem eigenen klinischen Alltag an die zuständigen Stellen ist ein wichtiger Bestandteil des Risikomanagements, wenn es um die Vermeidung von Schäden durch zahnärztliche Materialien geht.
Literaturliste
Arandi, N. [2017]. Calcium hydroxide liners: a literature review. Clinical, Cosmetic and Investigational Dentistry, Volume 9, 67–72. doi.org/10.2147/CCIDE.S141381.
Bergenholtz, G. [1991]. Iatrogenic injury to the pulp in dental procedures: aspects of pathogenesis, management and preventive measures. International Dental Journal, 41(2), 99–110.
Bergenholtz, G. [2000]. Evidence for Bacterial Causation of Adverse Pulpal Responses in Resin-Based Dental Restorations. Critical Reviews in Oral Biology & Medicine, 11(4), 467–480. doi.org/10.1177/10454411000110040501.
Bjørndal, L., Simon, S., Duncan, H. F., Galler, K. M., Tomson, P. L., El‐Karim, I., … Zehnder, M. [2019]. European Society of Endodontology position statement: Management of deep caries and the exposed pulp. International Endodontic Journal, 52(7), 923–934. doi.org/10.1111/iej.13080.
Bouillaguet, S., Wataha, J. C., Hanks, C. T., Ciucchi, B., und Holz, J. [1996]. In vitro cytotoxicity and dentin permeability of HEMA. Journal of Endodontics, 22(5), 244–248. doi.org/10.1016/S0099-2399(06)80141-X.
Caldas, I. P., da Silva, E. M., Lourenço, E. S., Martins do Nascimento, J. C., Leite, P. E. C., Leão, M. P., Alves, G., und Scelza, M. Z. [2022]. The influence of methodology on the comparison of cytotoxicity of total-etch and self-etch adhesive systems. Journal of Dentistry, 122, 104158. doi.org/10.1016/j.jdent.2022.104158.
Caplan, D. J., Cai, J., Yin, G., und White, B. A. [2005]. Root Canal Filled Versus Non-Root Canal Filled Teeth: A Retrospective Comparison of Survival Times. Journal of Public Health Dentistry, 65(2), 90–96. doi.org/10/bcf82h.
Da Rosa Rodolpho, P. A., Rodolfo, B., Collares, K., Correa, M. B., Demarco, F. F., Opdam, N. J. M., Cenci, M. S., und Moraes, R. R. [2022]. Clinical performance of posterior resin composite restorations after up to 33 years. Dental Materials, 38(4), 680–688. doi.org/10.1016/j.dental.2022.02.009.
Demirci, M., Hiller, K., Bosl, C., Galler, K., Schmalz, G., und Schweikl, H. [2008]. The induction of oxidative stress, cytotoxicity, and genotoxicity by dental adhesives. Dental Materials, 24(3), 362–371. doi.org/10.1016/j.dental.2007.06.009.
Durner, J., Obermaier, J., Draenert, M., und Ilie, N. [2012]. Correlation of the degree of conversion with the amount of elutable substances in nano-hybrid dental composites. Dental Materials: Official Publication of the Academy of Dental Materials, 28(11), 1146–1153. doi.org/10.1016/j.dental.2012.08.006.
Eckhardt, A., Harorli, T., Limtanyakul, J., Hiller, K.-A., Bosl, C., Bolay, C., Reichl, F.-X., Schmalz, G., und Schweikl, H. [2009]. Inhibition of cytokine and surface antigen expression in LPS-stimulated murine macrophages by triethylene glycol dimethacrylate. Biomaterials, 30(9), 1665–1674. doi.org/10/bx6mzp.
Faraco, I. M., und Holland, R. [2001]. Response of the pulp of dogs to capping with mineral trioxide aggregate or a calcium hydroxide cement. Dental Traumatology, 17(4), 163–166. doi.org/10.1034/j.1600-9657.2001.170405.x.
Franzon, R., Casagrande, L., Pinto, A. S., García-Godoy, F., Maltz, M., und de Araujo, F. B. [2007]. Clinical and radiographic evaluation of indirect pulp treatment in primary molars: 36 months follow-up. American Journal of Dentistry, 20(3), 189–192.
Galler, K. M., Schweikl, H., Hiller, K.-A., Cavender, A. C., Bolay, C., D’Souza, R. N., und Schmalz, G. [2011]. TEGDMA reduces mineralization in dental pulp cells. Journal of Dental Research, 90(2), 257–262. doi.org/10.1177/0022034510384618.
Gerzina, T. M., und Hume, W. R. [1996]. Diffusion of monomers from bonding resin-resin composite combinations through dentine in vitro. Journal of Dentistry, 24(1–2), 125–128. doi.org/10.1016/0300-5712(95)00036-4.
Gallorini, M., Cataldi, A., & Di Giacomo, V. (2014). HEMA ‐induced cytotoxicity: Oxidative stress, genotoxicity and apoptosis. International Endodontic Journal, 47(9), 813–818. doi.org/10.1111/iej.12232.
Gwinnett, A. J., und Tay, F. [1998]. Early and intermediate time response of the dental pulp to an acid etch technique in vivo. American Journal of Dentistry, 11 Spec No, S35-44.
Hebling, J., Giro, E. M. A., und Costa, C. A. S. [1999]. Human pulp response after an adhesive system application in deep cavities. Journal of Dentistry, 27(8), 557–564. doi.org/10.1016/S0300-5712(99)00034-2.
Imazato, S., Tarumi, H., Ebi, N., und Ebisu, S. [2000]. Cytotoxic effects of composite restorations employing self-etching primers or experimental antibacterial primers. Journal of Dentistry, 28(1), 61–67. doi.org/10/chjq37.
Jeong, S. Y., Lee, S., Choi, W. H., Jee, J. H., Kim, H.-R., und Yoo, J. [2020]. Fabrication of Dentin-Pulp-Like Organoids Using Dental-Pulp Stem Cells. Cells, 9(3), 642. doi.org/10/gm5ggx.
Krifka, S., Spagnuolo, G., Schmalz, G., und Schweikl, H. [2013]. A review of adaptive mechanisms in cell responses towards oxidative stress caused by dental resin monomers. Biomaterials, 34(19), 4555–4563. doi.org/10.1016/j.biomaterials.2013.03.019.
Kuzmanovic-Radman, I., Djeri, A., Arbutina, A., Jankovic, O., Josipovic, R., und Knezevic, N. [2014]. Indirect pulp capping using different calcium hydroxide products: A clinical study. Stomatoloski Glasnik Srbije, 61(1), 30–35. doi.org/10.2298/SGS1401030K.
Nair, M. [2019]. Clinical and Radiographic Outcomes of Calcium Hydroxide vs Other Agents in Indirect Pulp Capping of Primary Teeth: A Systematic Review. International Journal of Clinical Pediatric Dentistry, 12(5), 437–444. doi.org/10.5005/jp-journals-10005-1672.
Ohlsson, E., Bolay, C., Arabulan, S., Galler, K. M., Buchalla, W., Schmalz, G., und Widbiller, M. [2024]. In-vitro-cytotoxicity of self-adhesive dental restorative materials. Dental Materials, S0109564124000290. doi.org/10.1016/j.dental.2024.02.015.
Ohlsson, E., Galler, K. M., und Widbiller, M. [2022]. A Compilation of Study Models for Dental Pulp Regeneration. International Journal of Molecular Sciences, 23(22), 14361. doi.org/10.3390/ijms232214361.
Opdam, N. J. M., Bronkhorst, E. M., Loomans, B. A. C., und Huysmans, M.-C. D. N. J. M. [2010]. 12-year Survival of Composite vs . Amalgam Restorations. Journal of Dental Research, 89(10), 1063–1067. doi.org/10.1177/0022034510376071.
Petrou, M. A., Alhamoui, F. A., Welk, A., Altarabulsi, M. B., Alkilzy, M., und H. Splieth, C. [2014]. A randomized clinical trial on the use of medical Portland cement, MTA and calcium hydroxide in indirect pulp treatment. Clinical Oral Investigations, 18(5), 1383–1389. doi.org/10.1007/s00784-013-1107-z.
Rodrigues, N. S., França, C. M., Tahayeri, A., Ren, Z., Saboia, V. P. A., Smith, A. J., Ferracane, J. L., Koo, H., und Bertassoni, L. E. [2021]. Biomaterial and Biofilm Interactions with the Pulp-Dentin Complex-on-a-Chip. Journal of Dental Research, 100(10), 1136–1143. doi.org/10/gn4hpd.
Russell, W. M. S., und Burch, R. L. [1992]. The principles of humane experimental technique (Special ed., [Nachdr. der Ausg.] London 1959). Potters Bar, Herts: Universities Federation for Animal Welfare.
Schmalz, G, Hiller, K., Nunez, L., Stoll, J., und Weis, K. [2001]. Permeability Characteristics of Bovine and Human Dentin under Different Pretreatment Conditions. Journal of Endodontics, 27(1), 23–30. doi.org/10.1097/00004770-200101000-00007.
Schmalz, G., und Widbiller, M. [2022]. Biocompatibility of Amalgam vs Composite – A Review. Oral Health and Preventive Dentistry, 20(1), 149–156. doi.org/10.3290/j.ohpd.b2831749.
Schmalz, G. und Arenholt-Bindslev, D. [2009]. Biocompatibility of dental materials. Berlin Heidelberg: Springer.
Schmalz, G., Hickel, R., Price, R. B., und Platt, J. A. [2023]. Bioactivity of Dental Restorative Materials: FDI Policy Statement. International Dental Journal, 73(1), 21–27. doi.org/10.1016/j.identj.2022.11.012.
Schweikl, H., Spagnuolo, G., & Schmalz, G. (2006). Genetic and Cellular Toxicology of Dental Resin Monomers. Journal of Dental Research, 85(10), 870–877. doi.org/10.1177/154405910608501001.
Schwendicke, F., Göstemeyer, G., und Gluud, C. [2015]. Cavity lining after excavating caries lesions: Meta-analysis and trial sequential analysis of randomized clinical trials. Journal of Dentistry, 43(11), 1291–1297. doi.org/10.1016/j.jdent.2015.07.017.
Shen, C., Rawls, H. R., und Esquivel-Upshaw, J. F. [2022]. Phillips’ Science of Dental Materials.
Tsujimoto, A., Barkmeier, W. W., Fischer, N. G., Nojiri, K., Nagura, Y., Takamizawa, T., Latta, M. A., und Miazaki, M. [2018]. Wear of resin composites: Current insights into underlying mechanisms, evaluation methods and influential factors. Japanese Dental Science Review, 54(2), 76–87. doi.org/10.1016/j.jdsr.2017.11.002.







