Entzündungen der Mundschleimhaut
Ursachen für sogenannte Stomatitiden sind eine Fülle verschiedener Faktoren, zu denen virale, mykotische und bakterielle Infektionen, aber auch Autoimmunerkrankungen und Entzündungsreaktionen bei iatrogener Immunsuppression oder auch nur physika-lische Faktoren wie Druck und mehr zählen. Klinisch kann sich eine Stomatitis – je nach Erreger beziehungsweise Auslöser – erosiv, ulzerierend, nekrotisierend, vesikulär oder hyperkeratotisch darstellen. Zur genauen Beschreibung ist eine am Erreger orientierte Einteilung vorteilhaft.
Im Rahmen einer Infektion kommt es ent-weder zu einer manifesten Erkrankung oder lediglich zur Ausbreitung der Viren durch den Speichel. Das klinische Spektrum viraler Erkrankungen der Mundhöhle reicht von Ulzerationen bis hin zu hyperkeratotischen Veränderungen. Dies erschwert die klinische Diagnose. Eine genaue Diagnose viraler Erkrankungen ist in der Regel erst mithilfe von Laboruntersuchungen möglich (Tabelle).
Infektionen durch Humane Herpesviren (HHV)
Eine Reihe von bläschenförmigen Mundschleimhautveränderungen wird von Viren der Herpesgruppe hervorgerufen. Herpesviren führen häufig zu oralen Infektionen. Alle Herpesviren haben die Neigung zu subklinischen Infektionen, einer gewissen Latenzperiode nach der Erstinfektion und der Reaktivierung. Zu den für den Menschen wichtigsten Herpesviren zählen das Herpes-simplex-Virus Typ 1 und 2 (HSV-1, HSV-2), das Herpes-Zoster-Virus, das Epstein-Barr-Virus (EBV) und das Cytomegalie-Virus (CMV). Das letzte Virus aus der Herpesgruppe, das Humane Herpes-Virus 8 (HHV-8), wurde 1994 in Kaposi-Sarkomen HIV-Infizierter nachgewiesen [Chang et al., 1994]. Innerhalb der HHV-Gruppe bestehen zahlreiche Gemeinsamkeiten, was die Differenzialdiagnose erschweren kann.
Infektionen durch Enteroviren
Zu den klinischen Manifestationen von Enteroviren in der Mundschleimhaut gehören die Herpangina (aphthöse Pharyngitis) sowie die Hand-Fuß-Mundkrankheit (Abbildung 1).
Die Herpangina (Zahorsky-Syndrom) tritt meist bei Kleinkindern in den Sommer monaten auf, der Erreger ist das Coxsackie-Virus Typ A und andere Enteroviren [Zahorsky, 1920]. Die klinischen Manifestationen sind vergleichsweise mild und von kurzer Dauer. Intraoral lassen sich kleine Bläschen beziehungsweise Ulzerationen am weichen Gaumen, die mit Schluckbeschwerden einhergehen, diagnostizieren. Differenzial diagnostisch sollten Aphthen und eine HSV-Infektion ausgeschlossen werden.
Die Hand-Fuß-Mundkrankheit wird ebenfalls durch ein Coxsackie-Virus (Typ A16, auch A5 und A10) verursacht. Typisch für die Erkrankung ist die makulopapuläre Bläschenbildung an Händen und Füßen. Im Mund kommt es in 100 Prozent der Erkrankungen zu Aphthen-ähnlichen Veränderungen und Ulzera, die Nahrungsaufnahme ist erschwert [Ishimaru et al., 1980]. Differen-zialdiagnostisch müssen die Maul und Klauenseuche (Kontakte zu Endemieherden!) sowie Aphthen, HSV-Infektion und Varizellen ausgeschlossen werden.
Bakterielle Infektionen
Lues – Definition, Ätiologie und Pathogenese: Die durch Treponema pallidum verursachte Lues geht mit einer Vielzahl oraler Manifestationen einher. Nach einer Inkubationszeit von drei bis fünf Wochen entwickelt sich am Ort der Infektion die Primärmanifestation (Lues I), der schmerzlose harte Schanker (Ulcus durum), der in der Regel durch ebenfalls schmerzlose Lymphknotenschwellungen begleitet wird („Primärkomplex“). Etwa vier bis zwölf Prozent der Primäraffektionen finden sich extragenital, davon die Hälfte auf der Mundschleimhaut. Der syphilitische Primäraffekt ist hochkontagiös. Nach einigen Tagen bis wenigen Wochen heilt der Primäraffekt spontan ab. Die Erkrankung tritt bei circa 60 bis 90 Prozent der Betroffenen in ein sekundäres Stadium ein. Enoral können weiße Plaques mit erythematösem Randsaum, sogenannte Plaques muqueuses, beobachtet werden (Abbildung 2). Allerdings können die Enantheme und Exantheme unspezifisch sein und durch das Nachahmen anderer Erkrankungen zu Fehldiagnosen führen.
Das Palmoplantarsyphilid als Hand und Fußflächenbeteiligung ist jedoch recht spezifisch. Haut und Schleimhautläsionen der Lues II sind erregerhaltig, folglich infektiös und können rezidivierend auftreten. Etwa zwei von drei Infizierten zeigen anschließend eine Abwesenheit von Symptomen für einen variablen Zeitraum, das ist das sogenannte Latenzstadium. Bis einschließlich ein Jahr nach Remission des letzten Exanthems (Frühlatenz) gelten Betroffene als infektiös. In der sich anschließenden Spätlatenz bleibt lediglich eine Infektiosität für ungeborene Kinder seitens infizierter Mütter erhalten. Bei etwa einem Drittel der Patienten wird die Latenz durch eine tertiäre Syphilis abgelöst. Je nach betroffenem Organsystem existieren eine gummöse, eine kardio vaskuläre und eine neurologische Form. Der Begriff Gummae bezeichnet fokale Nekroseherde. Diese können intraoral auftreten und perforierende Läsionen verursachen. Effloreszenzen des tertiären Stadiums sind nicht infektiös. Die Lues III tritt in der heutigen Zeit in industrialisierten Ländern praktisch kaum noch in Erscheinung [Hagedorn et al., 2008].
Bei allen unklaren Schleimhautbefunden in der Mundhöhle sollte auch an eine Lues gedacht werden.
Tuberkulose – Definition, Ätiologie und Pathogenese: Tuberkulöse Veränderungen der Mundschleimhaut sind selten und meist Folge einer fortgeschrittenen Lungentuberkulose beziehungsweise einer hämatogenen Dissemination. Nach Literaturangaben variiert die Häufigkeit oraler Manifestationen von 0,05 bis 1,4 Prozent [Verma et al., 2013; Wang et al., 2009]. In seltenen Fällen dient ein tief zerstörter Zahn als Eintrittspforte, es können dann ein periapikales tuberkulöses Granulom oder eine tuberkulöse Osteo myelitis entstehen.
Die Prävalenz der Tuberkulose ist bei HIV seropositiven Individuen höher als bei HIV-negativen: Hochgerechnet beträgt die Prävalenz durchschnittlich 4,5 Prozent und ist somit deutlich höher als in der Allgemein-bevölkerung (< 0,1 Prozent) [Robert Koch-Institut, 2013].
Symptome einer oralen Manifestation sind intraorale, unscharf begrenzte Ulzerationen mit unterminierten Rändern, eine gelblich-graue Fibrinschicht und an der Haut-Schleimhaut-Grenze flache Ulzerationen mit Bildung von Granulationsgewebe in der Tiefe [Wang et al., 2009]. Die tuberkulöse Infektion der submandibulären Lymphknoten kann sich zu einem Abszess entwickeln oder als granulomatöse Erkrankung weiterbestehen. Die Tuberkulose in den Speicheldrüsen ist selten und stellt sich in Form einer soliden Masse dar, die einem neoplastischen Prozess ähneln kann. Verkalkte Lymphknoten als Zeichen einer latenten Tuberkulose sind gelegentlich ein Zufallsbefund bei röntgenologischen beziehungsweise computertomografischen Schädel aufnahmen. Eine Entfernung ist nicht notwendig.
Pilzinfektionen
Unter den Mykosen der Mundhöhle (siehe Tabelle) ist die Infektion mit Sprosspilzen, unter ihnen hauptsächlich Candida-Spezies, von zentraler Bedeutung. Pilzinfektionen wie Histoplasmose, Geotrichose, Mukormykose und Aspergillose sind selten. Candida zählt beim Gesunden zu den Kom-mensalen des Orogastrointestinaltrakts, ist Teil der physiologischen mikrobiellen Flora des Menschen und kommt häufig, jedoch nicht dauerhaft vor. Bei 20 bis 50 Prozent gesunder Individuen können Candida-Spezies in geringer Anzahl nachgewiesen werden [Odds, 1988]. Infektiologisch gesehen ist der Nachweis von Candida zunächst nur als Kolonisierung anzusehen. Dies ist nicht gleichbedeutend mit einer Infektion, was oft verwechselt wird [Bernhardt, 1996].
Während eine lokalisierte Candida-assoziierte Prothesenstomatitis beim älteren Patienten häufig ist, kann eine oropharyngeale Candidiasis Zeichen einer HIV-Infektion oder von AIDS sein (Abbildung 3), oder bei Patienten unter HIV-Medikation (antiretrovirale Therapie) ein Zeichen, dass die Therapie mög licherweise nicht mehr wirksam ist. Die Candidiasis ist immer Hinweis auf eine schwerwiegende Grunderkrankung. Mögliche medikamentöse Auslöser sind Antibiotika, Zytostatika, Glukokortikoide (speziell auch die inhalative Applikation) und andere Immunsuppressiva.
Sonstige entzündliche Veränderungen
Chronisch rezidivierende Aphthen: Aphthen zählen mit einer Prävalenzrate von zehn Prozent bis 30 Prozent in der normalen Bevölkerung zu den häufigsten Veränderungen der oralen Mukosa. Die Ätiologie ist nach wie vor ungeklärt, ursächlich können Veränderungen in der zellvermittelten Immunantwort und Kreuzreaktionen mit Streptococcus sanguis sein. Prädisponierende Faktoren sind Traumata, Allergien, genetische Dispositionen, endokrine Störungen, emotionaler Stress und HIV/AIDS. Klinisch unterscheidet man zwischen Minor-, Major und herpetiformen Aphthen.
Minoraphthen: Das klinische Bild der Minoraphthen ist gekennzeichnet durch Ulzera < 4 mm, umgeben von einem erythematösen Randsaum in der beweglichen Schleimhaut. Sie heilen innerhalb von 14 Tagen ohne Narbenbildung ab.
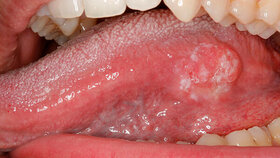
Majoraphthen: Sie können ein bis drei Zentimeter groß werden (Abbildung 4), sind in der gesamten Mundhöhle einschließlich Zungenrücken und hartem Gaumen lokalisiert und heilen innerhalb von ein bis drei Monaten unter Narbenbildung ab.
Bei herpetiformen Aphthen entstehen multiple kleine Ulzera mit zerklüfteten Rändern. Die Diagnostik ist anhand des klinischen Bildes und der Anamnese (Rezidive) mög-lich. Differenzialdiagnostisch müssen andere orale Ulzerationen (siehe auch Gingi-vostomatitis herpetica) abgegrenzt werden. Die Therapie besteht in der Spülung mit lokalen Antiseptika (Chlorhexidin 0,2 Prozent Mundspüllösung), lokaler Steroid anwendung (Triamcinolon Haftsalbe) beziehungsweise Tetracyclin-Spülungen.
Lokalisierte Autoimmunerkrankungen
Lichen: Der Lichen ist mit einer Prävalenz von ein bis zwei Prozent der adulten Bevölkerung eine der häufigsten Mukodermatosen, gefolgt von Lupus erythematodes (0,025 Prozent), bullösem Pemphigoid (0,002 Prozent) und Pemphigus vulgaris (0,0001-0,0005 Prozent).
Oraler Lichen planus: Er ist eine chronisch mukokutane Erkrankung unbekannter Ätiologie, die sich auf Haut und Schleimhaut (besonders oraler und genitaler Mukosa) manifestiert (Abbildung 5). Er wird bei Frauen und Männern im Verhältnis 60:40 angetroffen. Bei Kindern ist die Erkrankung selten.
In der Pathogenese des Lichen scheint eine Störung der zellvermittelten Immunreaktion eine wichtige Rolle zu spielen. CD8+ T-Zellen richten sich spezifisch gegen basale Keratinozyten und leiten deren Apoptose ein.
Vereinfacht können die oralen Mani-festationen in zwei objektive Formen – hyperkeratinisiert (retikulär, plaque like, papulär) und erosiv (ulzerativ, bullös, atrophisch) – und in zwei subjektive Formen – symptomatisch und asymptomatisch – eingeteilt werden. Während der erstgenannte Typ zu keinerlei Beschwerden führt, kann der symptomatische Typ für die betroffenen Patienten äußerst schmerzhaft sein (häufig subjektiv als Brennen beschrieben) und die Nahrungsaufnahme sowie die tägliche Mundhygiene deutlich beeinträchtigen.
Die Therapie des oralen Lichen planus erfolgt nach wie vor über topische Kortiko steroidgaben. Ein Reviewartikel von Lehman et al. fasst zusammen, dass die topische Anwendung von Ciclosporin dem Gold-standard Triamcinolon-Paste 0,1 Prozent nicht überlegen ist [Lehman et al., 2009]. Nur bei schweren Verläufen sollte beim oralen Lichen planus eine systemische Therapie eingesetzt werden. Sind zusätzlich die Haut oder der Genitalbereich betroffen, ist eine interdisziplinäre Therapie mit einem Dermatologen anzustreben. Da der orale Lichen planus als Risikofaktor für eine maligne Entartung angesehen wird, muss ein regelmäßiger Recall erfolgen, wobei die Nachsorgefrequenz individuell entsprechend der Symptomatik angepasst wird.