Dentin- und Hartgewebeneubildung nach Überkappung der Pulpa
Die Pulpa des Zahnes besteht aus einem lockeren Bindegewebe, umgeben von einem Hartgewebe, dem Dentin. Eine spezifische Zellart der Pulpa sind die Odontoblasten, die palisadenförmig angeordnet in der äußeren Schicht der Pulpa liegen, in direktem Kontakt mit dem von ihnen gebildeten Prädentin [30, 85].
Bildung von Primär- und Sekundärdentin
Prädentin ist die extrazelluläre Ablagerung einer Typ-I-Kollagen-reichen Matrix, die von den Odontoblasten sezerniert wird. Durch eine anschließende Mineralisation wird diese Matrix zu Dentin. Odontoblasten sind daher sekretorische Zellen mit der Hauptaufgabe der Dentinbildung [79]. Daneben dienen sie aber auch als sensorische Zellen und Abwehrzellen [69, 70, 101]. Odontoblasten sind Mesenchymzellen der Neuralleiste und mit Osteoblasten und Fibroblasten ontogenetisch und funktionell verwandte Bindegewebszellen [30, 85]. Identisch zu Myozyten des Herzens und Nervenzellen [97] sind Odontoblasten terminal hoch spezialisierte, differenzierte, postmitotische Zellen, die während der Lebenszeit eines Individuums nicht ersetzt werden [82, 86]. Charakteristisch für Odontoblasten ist ein zytoplasmatischer Fortsatz der Zellen. Dieser Odontoblastenfortsatz reicht in die Dentinmatrix und sezerniert Dentin-spezifische, nicht-kollagene Proteine, zum Beispiel Glykoproteine, Proteoglykane und Dentinphosphoproteine, die für die Mineralisation dieser Matrix verantwortlich sind. Die Odontoblastenfortsätze formen so die Dentintubuli, die für das zirkumpulpale und radikuläre Dentin kennzeichnend sind [81]. Reguläres Dentin zeichnet sich daher durch das Vorhandensein von Dentintubuli aus [91].
Grundsätzlich kann man das Dentin von Säugetieren in primäres, sekundäres und tertiäres unterteilen. Primärdentin ist reguläres, tubuläres Dentin, das vor dem Zahndurchbruch entsteht. Sekundärdentin ist ebenfalls ein reguläres Dentin, das lebenslänglich gebildet wird. Tertiärdentin ist ein mehr oder weniger irreguläres Dentin, das lokal als Reaktion auf zum Beispiel Karies oder Kavitätenpräparation entsteht [56, 91]. Daher wird Tertiärdentin auch als Reizdentin bezeichnet.
Die sekundäre Dentinbildung läuft insgesamt langsamer ab als die primäre, da vermutlich nach Zahndurchbruch die Zellaktiviät der Odontoblasten durch Autophagozytose herunterreguliert wird [19]. Ein milder externer Stimulus auf die Odontoblasten führt dann wieder zu einer Hochregulation der Odontoblastenaktivität und damit zur Tertiärdentinbildung [88, 91]. Im Gegensatz zu Knochen, der lebenslang gebildet und sich physiologischen Veränderungen anpassen kann, wird Dentin aber weder umgebaut noch ersetzt, wenn es einmal verlorengegangen ist [81].
Tertiärdentinbildung
Pulpairritationen durch Eindringen von Bakterien beziehungsweise Bakterientoxinen in das Dentin, Kavitätenpräparation und Füllungstherapie können den biologischen Effekt der Hartgewebeneubildung in der Pulpa beeinflussen. Sobald das Dentin durch zum Beispiel Karies oder Präparation freigelegt wird, werden die Dentintubuli eröffnet und somit die Odontoblasten verletzt oder sogar zerstört. Sind diese Pulpairritationen von moderater Intensität, führen sie zu einer kurzzeitigen Entzündung, die abklingt, wenn die Irritation (wie Karies) entfernt wird. Danach wird Tertiärdentin in dem betroffenen Bereich der Pulpa gebildet [81, 91]. Das heißt als Resultat eines leichten Traumas des Pulpagewebes werden die nicht zerstörten, primären Odontoblasten dazu stimuliert, neues Dentin zu bilden [91]. Dieses Tertiärdentin wird daher auch als Reaktionsdentin bezeichnet und definiert als Dentin, dessen Matrix als Antwort auf einen adäquaten Stimulus von primären postmitotischen Odontoblasten sezerniert wird [59, 90, 91]. Der primäre, postmitotische Odontoblast bildet also primäres und sekundäres Dentin sowie Reaktionsdentin [91]. Das Reaktionsdentin liegt direkt dem Sekundärdentin an; zwischen Sekundär- und Tertiärdentin verläuft histologisch sichtbar eine dunkle Linie [81]. Dass das Reaktionsdentin von denselben Odontoblasten gebildet wird, wie das Primär- und das Sekundärdentin, ist histologisch dadurch sichtbar, dass sich die Dentintubuli vom Reaktionsdentin ununterbrochen durch das Sekundär- bis in das Primärdentin fortsetzen [81, 91]. Die Odontoblasten, die an das Reaktionsdentin grenzen, sind allerdings nicht mehr typisch kubuidal, sondern abgeflacht, mit reduziertem Zytoplasma und kleinem Zellkern [81].
Durch die Verletzung des Dentins und der Odontoblastenfortsätze kommt es zu einem Herauslösen beziehungsweise Freisetzen von Wachstumsfaktoren, was wiederum zu einer Hochregulation der Odontoblastenaktivität führt [88, 91]. Die Steuerung der Odontoblastenaktivität erfolgt vermutlich durch eine Reihe von Gewebefaktoren beziehungsweise Signalmolekülen, vor allem aus der TGF-β-Familie (Transforming Growth Factor) [36, 37]. TGF-β1 wird nach Gewebeverletzung aus dem Dentin freigesetzt, da es sich in der Dentinmatrix findet, aber auch von Odontoblasten sezerniert werden kann [91]. Auch von Karies-verursachenden Bakterien sezernierte Säuren führen zur Freisetzung von Wachstumsfaktoren aus dem Dentin [89]. Gewebefaktoren werden zudem durch verschiedene Spüllösungen, wie EDTA (Ethylendiamintetraacetat), NaOCl (Natriumhypochlorit) oder Zitronensäure aus dem Dentin herausgelöst [91]. Zudem führt die Applikation von Calciumhydroxid oder Calciumsilikatzementen (wie MTA oder Biodentine) auf Dentin beziehungsweise in Kontakt zu Pulpagewebe zu einer TGF-β1-Freisetzung [39, 58, 98]. Die Phosphorsäureätzung von Dentin hat diesbezüglich einen deutlich geringeren Effekt [91].
Die Restdentinstärke hat einen signifikanten Einfluss auf die Reaktionsdentinbildung. Auch wenn die Dentindecke über der Pulpa geschlossen bleibt, überleben nicht alle Odontoblasten. Bei einer Restdentinstärke von weniger als 0,25 mm überleben etwa 50 Prozent dieser Zellen [67], in flacheren Kavitäten liegt die Überlebensrate bei 85 Prozent und mehr [36, 91]. Trotz des Absterbens der Odontoblasten kann in den Kavitäten eine Tertiärdentinbildung beobachtet werden. Die hier beschriebene Reaktionsdentinbildung durch den primären, postmitotischen Odontoblasten ist daher nur eine spezifische Form des Tertiärdentins. Kommt es zu einem Verlust des Odontoblasten, zum Beispiel nach Pulpafreilegung, spricht man von einer Reparaturdentinbildung [36, 37, 91].
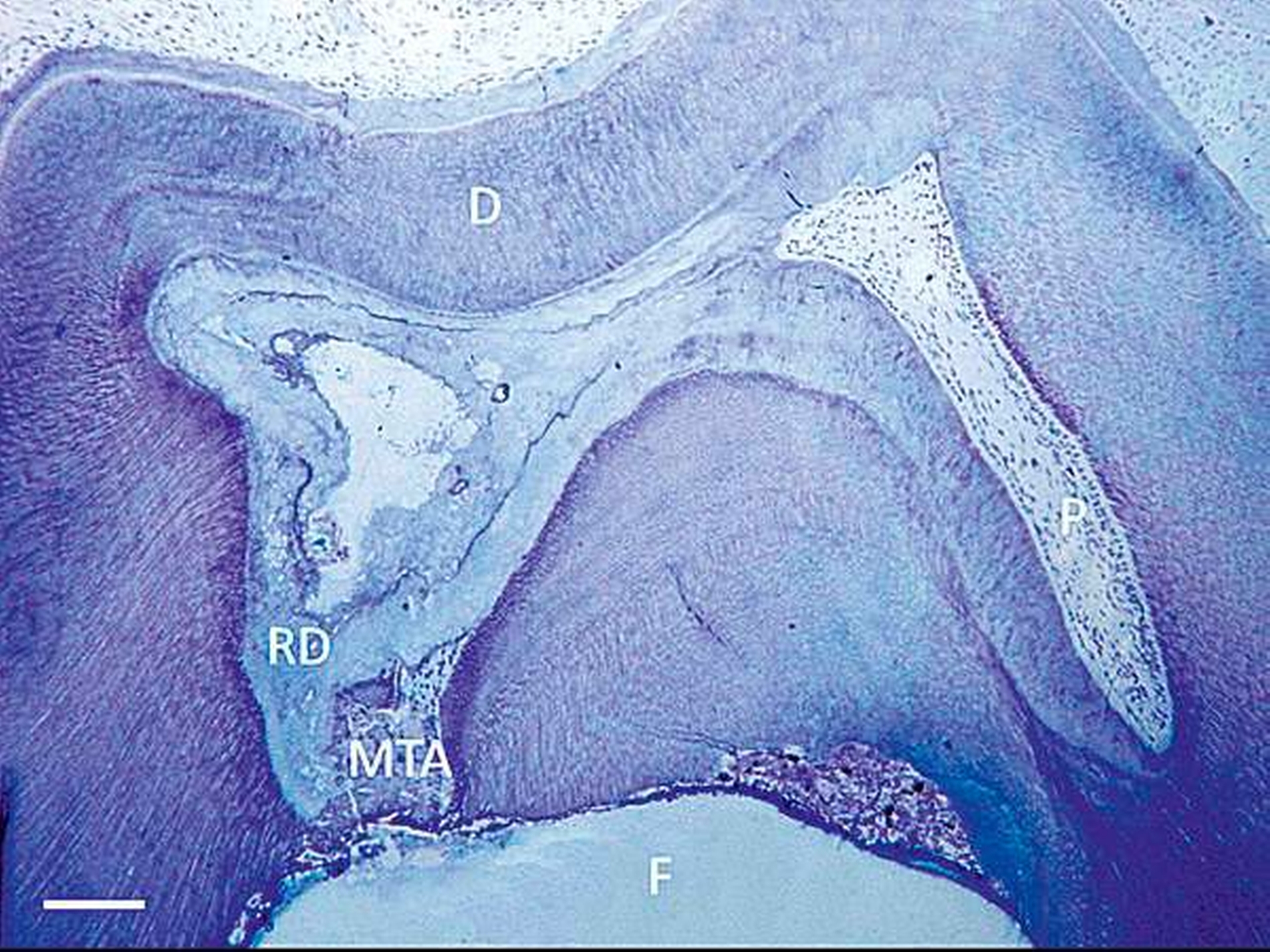
Hartgewebeneubildung nach Odontoblastenverlust
Im Gegensatz zu Reaktionsdentin wird Reparaturdentin definiert als Tertiärdentin, dessen Matrix nach dem Untergang der primären postmitotischen Odontoblasten als Reaktion auf einen Reiz hin gebildet wird [59, 90, 91]. Die Bildung von Reparaturdentin ist dabei unter biologischen Gesichtspunkten sehr viel komplexer als die von Reaktionsdentin, da in Fällen einer ausgeprägteren Verletzung der Pulpa, zum Beispiel nach mechanischer Pulpafreilegung, der primäre Odontoblast zerstört wird. Wie bereits ausgeführt, ist aber ohne Odontoblasten eine physiologische Dentinbildung nicht möglich. Trotzdem kommt es nach direkter Überkappung einer gesunden, nicht-entzündeten Pulpa zu einem hartgewebigen Verschluss der Eröffnungsstelle. Dieses Reparaturdentin ist ein sehr heterogenes, amorphes, atubuläres, mineralisiertes Gewebe und unterscheidet sich daher histologisch von Primär- und Sekundärdentin, aber auch von Reaktionsdentin. Reparaturdentin ist knochenähnlich und wird daher auch als Fibrodentin oder Osteodentin bezeichnet [36, 37] (Abbildungen 1 und 2). Es ist daher fraglich, ob man hier von einer Dentinbrücke reden kann, da es sich unter histologischem Aspekt nicht um Dentin handelt. Sollte es sich bei Reparaturdentin wirklich um eine Bildung neuen Dentins handeln, würde dies bedeuten, dass ein neuer Typ Zellen den zerstörten primären Odontoblasten ersetzen würde. Woher diese Ersatzzellen allerdings stammen sollen, ist auch bisher völlig ungeklärt [81]. Es gibt dazu verschiedene Theorien: Zum einen vermutet man, dass bei der Zahnbildung während der letzten Zellteilung des Prä-Odontoblasten vor der terminalen Differenzierung eine der Tochterzellen an der dentalen Basalmembran positioniert wird und dort dann das induktive Signal erhält, sich zu einem Odontoblasten zu differenzieren. Die andere Tochterzelle wandert in die sogenannte Höhlzellschicht der Pulpa und dient möglicherweise als Progenitorzelle („Vorläuferzelle“) zur Bildung von Odontoblasten-ähnlichen Zellen während der tertiären Dentinogenese [35–37, 59, 82, 91]. Bisher gibt es keinen Nachweis, dass sich Zellen aus der Höhlzellschicht zu einem sekundären Odontoblasten (Ersatzodontoblasten) differenzieren. Es gibt aber Autoren, die dies dennoch für wahrscheinlich halten. Zumindest scheinen Höhlzellen den geschädigten primären Odontoblasten in seiner Funktion zu unterstützen [36, 37].
Zum anderen wird spekuliert, dass sich Zellen des Pulpagewebes (Fibroblasten, Endothelzellen, Perizyten), die sich in der bipolaren Zone der Pulpa beziehungsweise perivaskulär finden, nach Pulpafreilegung in undifferenzierte Mesenchymalzellen umwandeln (ent-differenzieren). Diese undifferenzierten Mesenchymalzellen können sich dann in Odontoblasten differenzieren (re-differenzieren). Diese Zellen wandern zur Pulpa-Dentin-Grenzfläche und werden dort möglicherweise stimuliert, sich zu sekundären Odontoblasten zu differenzieren. Im Fall einer direkten Überkappung mit Calciumhydroxid wird dabei eine Metaplasie des Gewebes induziert [32, 86, 103]. Metaplasie bezeichnet die reversible Umwandlung einer Gewebeart in eine andere beziehungsweise die Umwandlung von differenzierten Zellarten in eine anders differenzierte Zellart. Die Metaplasie von Pulpazellen zu sekundären Odontoblasten wurde bereits 1932 von Euler und Rebel beschrieben [29].
Neuere Untersuchungen legen die Existenz von multipotenten adulten Stammzellen in der Pulpa des Menschen nahe, die bei diesen Vorgängen eine Rolle spielen [40, 41], d. h. durch die direkte Überkappung mit zum Beispiel Calciumhydroxid oder Calciumsilikatzement induziert, werden adulte Stammzellen aus der Pulpa rekrutiert und wandeln sich in sekundäre Odontoblasten beziehungsweise Odontoblasten-ähnliche Zellen um. Anschließend erfolgt eine Hochregulation der Matrixsekretion und ein Reparaturdentin wird gebildet [91].
Tatsächlich konnte aber bisher der Beweis einer Umwandlung irgendwelcher Progenitorzellen in Odontoblasten-ähnliche Zellen nicht erbracht werden [17]. Histologisch konnte eine Hartgewebsbrückenbildung aus regulärem, das heißt tubulärem Dentin mit angelagerten Odontoblasten-ähnlichen Zellen nur an intakten karies- und füllungsfreien Zähnen nach experimenteller direkter Überkappung (zum Beispiel im Tierversuch) beobachtet werden. Bisher gibt es daher keine Evidenz dafür, dass sich solch ein tubuläres Dentin nach direkter Überkappung an kariösen menschlichen Zähnen bildet [81]. Ricucci et al. [81] konnten in ihrer histologischen Untersuchung an menschlichen Zähnen nach direkter Überkappung keinen Nachweis für die Bildung von Ersatzodontoblasten oder neuen Odontoblasten-ähnlichen Zellen erbringen. Odontoblasten oder Odontoblasten-ähnliche Zellen sind demnach bei menschlichen, kariösen Zähnen histologisch nicht nachweisbar. Es ist daher gar nicht gesichert, ob es sich bei der Hartgewebsneubildung wirklich um Dentin handelt oder nur um eine dystrophische intrapulpale Mineralisation als Reaktion auf eine Entzündung [81]. Die dystrophische Mineralisation von Narbengewebe im Körper ist nicht ungewöhnlich. Sie findet sich in der Lunge, der arteriosklerotischen Plaque der Blutgefäße [27] oder auch in Form von Dentikeln in der Pulpa [22].
Eine freigelegte Pulpa hat die Kapazität, nach direkter Überkappung eine Hartgewebebrücke zu bilden, doch wird diese vermutlich nicht von sekundären Odontoblasten, Odontoblasten-ähnlichen Zellen oder irgendwelchen Ersatzzellen gebildet, sondern von Fibroblasten-ähnlichen Zellen [81]. Tatsächlich kommt es nach direkter Überkappung zu einer Proliferation von Fibroblasten-ähnlichen Zellen sowie Endothelzellen und der Bildung von Granulationsgewebe infolge einer Entzündungsreaktion. Die Bildung von Granulationsgewebe durch die Proliferation von Kapillaren und Fibroblasten-ähnlichen Zellen initiiert die Reparatur des Pulpagewebes. So ist die entzündliche Reaktion ein wesentlicher Bestandteil des Wundheilungsprozesses [26]. Zerstörte Odontoblasten werden also durch Fibroblasten-ähnliche Zellen ersetzt, die eine lockere Kollagenmatrix bilden. Anschließend wird dieses Narbengewebe mineralisiert, was zur Bildung eines amorphen, atubulären Hartgewebes führt. Bei einer Hartgewebsbrückenbildung nach direkter Überkappung handelt es sich folglich um mineralisiertes Narbengewebe [81]. Diese dystrophische Mineralisation nach Untergang des primären Odontoblasten ist ein Reparaturvorgang und keine Dentinregeneration [81]. Regeneration und Reparatur sind zwei verwandte, aber doch unterschiedliche Prozesse. Regeneration bedeutet eine Proliferation von Zellen und Gewebebildung, die verlorenes oder geschädigtes Gewebe oder Zellen ersetzen, sodass es zur Regeneration einer normalen Gewebestruktur kommt. Reparatur bedeutet zwar auch den Ersatz originaler Strukturen, aber immer in Kombination mit Kollagenanlagerung und Narbenbildung [42].
Bei der Regulation der Repaturdentinbildung sind vermutlich wiederum Wachstumsfaktoren der TGF-β-Familie beteiligt, da sie auch fibröse Veränderungen verschiedener chronischer Entzündungsprozesse, zum Beispiel von Lunge, Nieren und Leber, regulieren und grundsätzlich eine Rolle bei der Bildung von hypertrophem Narbengewebe spielen [81].
Wichtig ist aber zu betonen, dass beides, Reaktionsdentinbildung (durch primäre Odontoblasten) und Reparaturdentinbildung zeitgleich in ein und derselben Kavität ablaufen und somit in der gleichen Läsion beide Arten von Tertiärdentin beobachtet werden können [81, 91].
Überkappungsmaterialien
Für den Erfolg einer Überkappung sind die Entfernung der Reizfaktoren (Karies), die Kontrolle der Infektion und die Biokompatibilität des Überkappungsmaterials wichtige Voraussetzungen [10, 15]. Kakehashi et al. [54] konnten in einem klassischen Experiment zeigen, dass die Pulpa der Ratte bei Abwesenheit von Mikroorganismen die Regenerationskraft besitzt, auch ohne Medikamente oder Deckfüllung eine Eröffnungsstelle mit Hartgewebe zu verschließen. Das Vorkommen beziehungsweise das Fehlen von Mikroorganismen ist der bestimmende Faktor bei der Heilung von Pulpagewebe [54]. Das Experiment wurde später in ähnlicher Form von Paterson und Watts wiederholt und erbrachte das gleiche Ergebnis [74]. Pulpagewebe besitzt also die Fähigkeit, nach einer Verletzung ohne bakterielle Kontaminationen auszuheilen, wobei die Gewebereaktionen nach Überkappung (zum Beispiel Kollagensynthese und -sekretion) grundsätzlich die gleichen wie bei Verletzungen von Bindegewebe sind [84, 91].
Bei der Exkavation einer profunden Karies oder bei einem Trauma kann entweder das Pulpagewebe direkt oder Dentinareale freigelegt werden, die aufgrund der anatomischen Struktur des Dentins besonders permeabel sind. Dentintubuli sind pulpanah pro Quadratmillimeter sehr viel häufiger anzutreffen und vom Durchmesser her größer als pulpafern [85]. Da nicht nur Mikroorganismen und deren Toxine (Lipopolysaccharide), sondern auch viele Restaurationsmaterialien das freigelegte Pulpagewebe schädigen oder via Dentintubuli Richtung Pulpa diffundieren und so auf das Gewebe irritierend wirken können, sollten die Pulpa und die pulpanahen Dentinareale mit einem Überkappungsmaterial abgedeckt werden. Überkappungsmaterialien müssen einerseits eine künstliche Barriere zwischen der vitalen Pulpa und der Mundhöhle schaffen, um ein Eindringen von Mikroorganismen zu verhindern. Andererseits sollte das Überkappungsmaterial antimikrobielle Eigenschaften besitzen, ohne selber pulpatoxisch zu sein [21]. Neben der Desinfektion und der Versiegelung des Dentins ist ein weiteres Ziel der Applikation eines Überkappungsmaterials, die Hartgewebsneubildung durch Pulpazellen gezielt zu induzieren und so die Pulpavitalität zu erhalten [28, 65, 84]. Kann eine bakterielle Kontamination ausgeschlossen werden, besitzt Pulpagewebe grundsätzlich die Fähigkeit, auch nach einer caries-profunda-Behandlung oder gar einer Freilegung auszuheilen [54].
Eine Hartgewebsneubildung kann bei gesunder Pulpa vermutlich unter einer Vielzahl von Überkappungsmaterialien entstehen [3]. Die Heilung der Pulpawunde ist also nicht mit einem speziellen Medikament oder Wundverband assoziiert [8]. Medikamente zur Versorgung einer exponierten Pulpa sollten aber die natürlicherweise vorhandene Potenz der Pulpazellen zur Hartgewebsbildung fördern [84].
Wässrige Calcium-hydroxid-Suspensionen
Als Medikament bei der Überkappung dient auch heutzutage noch in der Regel Calciumhydroxid zum Schutz der Pulpa sowie zur Anregung einer Tertiärdentinbildung. Eine wässrige Calciumhydroxid-Suspension hat einen hohen pH-Wert und kann daher den niedrigen pH in Kariesläsionen neutralisieren. Außerdem wirkt eine wässrige Calciumhydroxid-Suspension bakterizid, neutralisiert Lipopolysaccharide und unterstützt die Ausheilung des Pulpagewebes [7, 90]. Zudem führt die Applikation von Calciumhydroxid auf Dentin beziehungsweise in Kontakt zu Pulpagewebe zu einer Freisetzung von Wachstumsfaktoren [39, 57]. Calciumhydroxid beteiligt sich folglich aktiv an der Bildung von neuem Hartgewebe in der Pulpa. Klinische Studien zeigen Erfolgsraten beim Menschen von über 80 % für die direkte Überkappung mit einer wässrigen Calciumhydroxid-Suspension [23]. Trotzdem gibt es einige Nachteile bei der Anwendung von Calciumhydroxid [21]:
Calciumhydroxid haftet nur schlecht an Dentin.
Es wurden Resorptionserscheinungen und eine mechanische Instabilität des Materials beobachtet [6, 38].
Calciumhydroxid bietet keinen Langzeitschutz vor Undichtigkeiten (Mikroleakage) [15, 21].
Darüber hinaus können in neu gebildetem Hartgewebe Porositäten vorkommen, die als „Tunneldefekte“ bezeichnet werden und als Eintrittspforten für Mikroorganismen dienen können, wenn Calciumhydroxid resorbiert wird. Dies kann zu einer sekundären Entzündung des Pulpagewebes und somit zu einem Scheitern der Vitalerhaltung führen [20].
Zudem verursacht der hohe pH-Wert von Calciumhydroxid-Suspensionen (12,5) in direktem Kontakt mit dem Pulpagewebe eine Liquidationsnekrose [93].
Daher sollte Calciumhydroxid nur kleinflächig im Bereich der Pulpafreilegung oder im pulpanahen Bereich der Kavität aufgetragen werden, da es bei großflächiger Applikation unter einer definitiven Restauration im Laufe der Zeit zu Resorptionserscheinungen und somit zu mechanischer Instabilität kommen kann [6, 93, 94, 96]. Diese Vorgehensweise ist in Bezug auf Calciumhydroxid vollkommen richtig und wichtig, allerdings ist auch zu bedenken, dass das umgebende Hartgewebe ebenfalls mit überlebensfähigen Bakterien kontaminiert sein kann. Ein antibakterielles Überkappungsmaterial sollte idealerweise nicht nur an der tiefsten Stelle der Kavität appliziert werden, sondern auch auf das umgebende Dentin, um diese Bakterien wirksam zu bekämpfen. Ein solches Vorgehen erhöht möglicherweise die Wahrscheinlichkeit, dass die verbliebenen Mikroorganismen eingedämmt werden und so eine Infektion der Pulpa verhindert wird. Dadurch lässt sich evtl. die Erfolgsrate der Überkappung bei Zähnen mit profunder Karies erhöhen [10, 15]. Durch diese Überlegungen wird allerdings das Konzept der Überkappung mit Calciumhydroxid infrage gestellt. Aus diesen Gründen ist die Pulpaüberkappung mit Calciumhydroxid nicht unumstritten und wird von einigen Autoren nicht mehr als Mittel der ersten Wahl zur Vitalerhaltung der Pulpa angesehen [2, 15].
Erhärtende Calciumhydroxid-Zemente
Im Gegensatz zu wässrigen Calciumhydroxid-Suspensionen sind andere Calciumhydroxid-Kombinationen wie Zemente (Calciumsalicylatester-Zemente), aber auch Liner oder Kitte aufgrund der wesentlich geringeren Freisetzung von Hydroxyl-Ionen für die Überkappung der Pulpa weniger geeignet. Bei diesen Präparaten ist der resultierende pH-Wert niedriger [92, 93] und der antimikrobielle Effekt deutlich schwächer [31]. Zudem weisen aushärtende Calciumsalicylatester-Zemente (wie Kerr Life; KerrHawe, Bioggio, Schweiz oder Dycal; Dentsply, Konstanz) eine kontinuierliche Desintegration auf [6]. Sie bietet daher keine notwendige dauerhafte Abstützung für die Hauptfüllung [66, 93, 94].
Neues Hartgewebe bildet sich unter Calciumhydroxidsalicylatester-Zementen sowohl langsamer als auch in der Form uneinheitlicher und weniger dicht. Die Hartgewebsneubildung kann demnach unter diesen Calciumhydroxid-Präparaten schwächer ausfallen. Außerdem kommt es im Vergleich zu Calciumhydroxid-Suspensionen häufiger zu Entzündungszeichen, d. h. der Zustand der Pulpa ist als schlechter zu bezeichnen [61, 75, 84]. Einige Zusätze, die für eine Erhärtung der Calciumhydroxidpräparate sorgen, können sich möglicherweise sogar toxisch auf das Pulpagewebe auswirken [61]. Insbesondere für die direkte Überkappung sind erhärtende Calciumhydroxidzemente auf Calciumsalicylatesterbasis abzulehnen.
Dentinadhäsive und Komposite
Aufgrund der Nachteile, die bei der Überkappung mit Calciumhydroxid beschrieben wurden, wird immer wieder nach Alternativen gesucht. Dazu gehört die Überkappung des vitalen Pulpagewebes mit Dentinadhäsiven; diese wurden seit Mitte der 1990er-Jahre für jene Indikation propagiert [48], allerdings ohne den Erfolg durch langfristige klinische oder histologische Untersuchungen zu belegen.
Dentinadhäsiv- beziehungsweise Kompositbestandteile kommen dabei in direkten Kontakt mit Zellen des vitalen Pulpa-Dentin-Komplexes. Hinter dieser Vorgehensweise steht der Grundgedanke, dass es sich bei dem Überkappungsmaterial nicht um ein Medikament handeln muss, das eine Hartgewebsbildung initiiert. Wichtig sei vielmehr, dass eine sekundäre (nach Legen der Füllung) Besiedlung der Pulpa mit Bakterien durch einen absolut dichten Randschluss verhindert wird. Daher eignen sich Dentinadhäsive nach Meinung einiger Autoren besonders zur Überkappung, denn aufgrund der guten Abdichtungseigenschaften kann eine (Re)Infektion der Pulpa verhindert werden [2, 20]. Dass Dentinadhäsive die Fähigkeit besitzen, einen dichten Verbund von Dentin mit Kompositmaterial zu erzielen, ist hinreichend untersucht.
Bis heute gibt es allerdings keine tierexperimentellen Studien, die eine eindeutige Überlegenheit der Überkappung mit Dentinadhäsiven im Vergleich zu Calciumhydroxid nachweisen konnten. Die meisten am Menschen durchgeführten Untersuchungen dagegen zeigten eindeutig, dass eine Überkappung mit Dentinadhäsiven aufgrund der signifikant schlechteren histologischen Ergebnisse abzulehnen ist [28].
Obwohl die pathologischen Reaktionen der Pulpa auf eine Überkappung hauptsächlich durch Bakterien bedingt sind, ist es sehr wohl möglich, dass auch Bestandteile aus Kompositen zu Misserfolgen beitragen [8, 18], denn grundsätzlich sind Dentinadhäsive als pulpatoxisch einzustufen [18, 24]. Schon seit Langem ist nachgewiesen, dass Monomerbestandteile aus Dentinadhäsiven und Kompositen auf menschlichen Pulpazellen bei direktem Kontakt zytotoxisch wirken [12, 44, 51, 62]. Auch die Applikation von Dentinadhäsiv auf eine dünne Schicht Dentin (0,5 mm) führt sowohl zu einer Erweiterung der Blutgefäße und Blutstau als auch zu einer chronischen Entzündung des Pulpagewebes [46]. Nicht oder nur teilweise polymerisierte Dentinadhäsive verursachen eine Apoptose (programmierter Zelltod) bei verschieden Arten von Pulpazellen, zum Beispiel Makrophagen, undifferenzierten Pulpazellen und Odontoblasten-ähnlichen Zellen [62].
Neben Monomeren aus Dentinadhäsiven können identische zytotoxische Bestandteile auch aus Kompositen freigesetzt werden, die dann durch Dentintubuli penetrieren, in das Pulpagewebe eindringen und dort zu einer Pulpaschädigung führen [13, 72]. Auch tiefe Kavitäten (ohne Pulpafreilegung) stellen hier ein Problem dar, da einerseits die Restdentinstärke über der Pulpa sehr gering ist und es zu einem Ausstrom von Gewebeflüssigkeit aus den angeschnittenen Dentintubuli kommt. Diese Feuchtigkeit verhindert die vollständige Polymerisation. Zusätzlich kann die vollständige Polymerisation durch zu dicke Kompositschichten, die nur ungenügend von Licht durchdrungen werden können, verhindert werden [64]. Beide Faktoren führen zu einem erhöhten Anteil von freien Restmonomeren, die dann aus dem Kompositmaterial freigesetzt werden und in das Pulpagewebe diffundieren. In klinischen Studien resultiert daher nach Anwendung von Dentinadhäsiven in tiefen Kavitäten vergleichsweise häufig eine Pulpanekrose [87]. Sowohl aus unpolymerisierten als auch aus polymerisierten sowie gealterten Dentinadhäsiven werden chemische Bestandteile freigesetzt, die zytotoxisch wirken [18]. Die Zytotoxizität der Inhaltsstoffe von Dentinadhäsiven kann als Erklärung für das schlechte Abschneiden der direkten Überkappung mit Dentinadhäsiven am Menschen [1] und im Tierexperiment [24] dienen. Monomere aus den Füllungsmaterialien (Dentinadhäsive/Komposite) gehen darüber hinaus möglicherweise eine Wechselwirkung mit dem Immunsystem der Pulpa ein und schwächen so deren Abwehr bei der Invasion von Mikroorganismen [8, 18]. In direktem Kontakt mit Dentinadhäsiven beziehungsweise Kompositen kommt es vermutlich zu einer Reduktion der Abwehrleistung der Pulpa, entweder bedingt durch die Zytotoxizität oder durch spezifische Änderungen der Immunantwort [52]. Adhäsivbestandteile inhibieren demnach die Proliferation von immunkompetenten Zellen und verursachen eine chemische Immunsuppression, die die Entwicklung pathologischer Veränderungen der Pulpa fördert [8]. Dentinadhäsive und Komposite sind grundsätzlich nicht biokompatibel [18] und daher für eine Überkappung abzulehnen [2].
Lichthärtende Liner und Zemente
Um die Nachteile der bewährten Calciumhydroxidpräparate auszugleichen, wurden lichthärtende Liner und Zemente mit Calciumhydroxidzusatz entwickelt (Produktbeispiel Calcimol LC; VOCO, Cuxhaven). Diese Materialien sind trotz des Kompositanteils in ihrer mechanischen Festigkeit aber nicht ausreichend, zudem fehlt ihnen die spezifische Calciumhydroxidwirkung [66]. Der pH-Wert dieser Produkte ist hochsignifikant niedriger im Vergleich zu anderen Calciumhydroxidprodukten [95]. Trotzdem konnte eine gewisse antibakterielle Wirkung in vitro festgestellt werden [77]; andere Untersuchungen konnten dies allerdings nicht bestätigen [102]. Eindeutig nachgewiesen ist aber eine Zytotoxizität dieser Produkte, die auf den Kompositanteil zurückzuführen ist [47, 77, 78]. Daher ist zum Beispiel laut Herstellerangaben der direkten Kontakt von Calcimol LC zu Pulpazellen zu vermeiden.
Ein anderes lichthärtendes Produkt in dieser Richtung ist TheraCal LC (Bisco, Schaumburg, USA). Das Indikationsspektrum entspricht laut Hersteller dem von Calciumsilikat-Zementen (siehe unten: Hydraulische Zemente auf Calciumsilikatbasis). Im Gegensatz zu allen anderen Calciumsilikat-Zementprodukten, bei denen ein Zementpulver mit einer Flüssigkeit (Wasser) angemischt werden muss, besteht TheraCal LC aus 45 ProzentPortland-Zement CEM III und 45 Prozent Komposit-Kunststoff [33] und ist daher lichtpolymerisierbar, was die klinische Anwendung von TheraCal LC im Vergleich zu anderen Zementen auf Calciumsilikatbasis deutlich vereinfacht.
Bekannt ist aber, dass alle Monomerbestandteile in TheraCal LC in vitro zellschädigend sind [44, 51, 52]. Hebling et al. [47] konnten nachweisen, dass es nach einem Tag direktem Kontakt zu TheraCal LC zu einer Abnahme der Zellumsatzrate um 31,5 Prozent kam und nach einer Woche zu einer Abnahme der Zellumsatzrate um 45,9 Prozent [47]. Nach 72 Stunden Kontakt zu TheraCal LC kam es zu einer deutlichen Abnahme der prozentualen Überlebensrate der Zellen [78]. Für eine Gewebeheilung (zum Beispiel Hartgewebeneubildung der Pulpa nach Überkappung) ist es aber entscheidend, dass es nicht zu einer Abnahme, sondern zu einer Zunahme der Zellumsatzrate kommt. Im Gegensatz zu TheraCal LC induzieren andere Calciumsilikatprodukte und Calciumhydroxid nachweislich die Zellproliferation an der Pulpa [25, 26]. TheraCal LC hat – wie auch andere lichthärtende Liner mit Calciumhydroxidzusatz – in direktem Kontakt einen erheblichen zellschädigenden Effekt [47, 77, 78]. Darüber hinaus wurde ein potenziell negativer biologischer Effekt von TheraCal LC auf menschliche dentale Stammzellen der Pulpa (hDPSCs) beschrieben [11]. Zudem ist bisher unklar, wie viel Portlandzement aus der Kunststoffmatrix überhaupt freigesetzt werden kann, wenn das Material polymerisiert ist. TheraCal LC zeigt nach Aushärtung eine heterogene Struktur mit einem hohen Anteil großer, unhydrierter Partikel, da durch den Kunststoffzusatz nicht genügend Feuchtigkeit vorhanden ist, um eine Hydratation zu ermöglichen. Die Hydratation von TheraCal LC, das heißt die Reaktion des Zementanteils mit Wasser ist wegen der begrenzten Feuchtigkeitsdiffusion innerhalb des Materials unvollständig. Somit wird kein Calciumhydroxid und nur eine geringe Menge an Calciumionen freigesetzt [14].
Lichthärtende Liner und Zemente mit Calciumhydroxid- beziehungsweise MTA-Zusatz sind insgesamt zytotoxisch [77, 78]. Und nach derzeitiger Datenlage ist daher von einer indirekten oder direkten Überkappung der Pulpa mit lichtpolymerisierbaren Calciumhydroxid- oder Calciumsilikat-haltigen Materialien abzuraten.
Hydraulische Zemente auf Calciumsilikatbasis
Calciumsilikat-Zemente sind werkstoffkundlich ähnlich den aus der Bauindustrie bekannten Portlandzementen. Sie werden auch als „hydraulische“ Zemente bezeichnet, da sie sowohl an der Luft als auch unter Wasser erhärten und auch beständig sind [9].
Calciumsilikat-Zemente werden seit Ende der 1990er-Jahre in der Zahnmedizin eingesetzt. Der erste Vertreter dieser neuen Stoffklasse war Mineral Trioxide Aggregate (ProRoot MTA; Maillefer Dentsply, Ballaigues, Schweiz). Ursprünglich wurde Mineral Trioxide Aggregate (MTA) zur Deckung von Perforationen im Wurzelkanalsystem entwickelt. Es wurde aber bald festgestellt, dass sich MTA auch sehr gut für die Vitalerhaltung der Pulpa eignet [21]. MTA ist ein Zementpulver, das hauptsächlich aus Di- und Tricalciumsilikat besteht und mit Wasser angemischt wird. Bei der Reaktion mit Wasser und der anschließenden Aushärtung wird über einen längeren Zeitraum Calciumhydroxid freigesetzt [9]. Dadurch erklären sich anhaltende antibakterielle Eigenschaften, obwohl es sich um erhärtende Zemente mit geringer Löslichkeit handelt [71, 99]. Die Freisetzung von Calciumhydroxid hat aber noch einen weiteren Effekt: Calciumsilikat-haltige Zemente haben die Fähigkeit, Hydroxylapatitkristalle auf der Oberfläche zu bilden, wenn sie in Kontakt mit Calcium- und Phosphat-haltigen (Körper)Flüssigkeiten kommen [34]. Der Apatit-haltige Niederschlag auf der Zementoberfläche ist ein Zeichen für die Biokompatibilität von Calciumsilikat-Zementen [43]. Osteoblasten, parodontale Ligamentzellen, Zellen des Zahnzements, aber auch Pulpazellen lagern sich direkt auf Calciumsilikat-Zementoberflächen an, da das Material als „nicht fremd“ erkannt wird [100]. Dies erklärt die hohe Biokompatibilität dieser Zemente.
Neben Calciumhydroxid wird bei der Aushärtung von Calciumsilikat-haltigen Zementen auch Silizium freigesetzt. Die genaue Funktion von Silizium bei den Stoffwechselprozessen des Hartgewebes ist unklar, aber es wird angenommen, dass es eine Rolle in der Frühphase der Mineralisation spielt [16]. Es ist auch bekannt, dass Silizium die Rate an neuem Hartgewebe fördert, wenn es aus bioaktiven Materialien wie MTA freigesetzt wird [73]. Darüber hinaus kann Silizium in vitro demineralisiertes Dentin remineralisieren [83], was auch für Calciumsilikat-Zemente nachgewiesen wurde [4]. Daraus kann man schlussfolgern, dass die Freisetzung von Silizium aus Calciumsilikat-haltigen Materialien zusätzlich zur Induktion von Hartgewebebildung beiträgt [43]. Calciumsilikat-haltige Materialien sind daher dafür bekannt, nicht nur biokompatibel, sondern auch bioaktiv zu sein [58, 104].
Bioaktivität bezeichnet einen positiven Effekt eines Medikaments oder Materials auf lebendes Gewebe. Ein Material wird als bioaktiv bezeichnet, wenn es mit Zellen des menschlichen Körpers interagiert oder eine vorteilhafte Wirkung auf Zellen hat [49]. In Studien zur Biomineralisation bezeichnet Bioaktivität zumeist die Förderung einer Hartgewebsbildung, die von einem Material induziert wird.
Calciumsilikat-Zemente stimulieren die osteogene beziehungsweise odontogene Kapazität von Pulpazellen (DPC) durch die Aktivierung und Expression verschiedener Gene, was zu Zellproliferation, Angiogenese und Biomineralisation führt. Wenn DPCs in direkten Kontakt mit Calciumsilikat-Zementen gebracht werden, zeigen sie eine höhere Genaktivierung, was wiederum eine effektivere Reparatur von geschädigtem Pulpagewebe und eine schnellere und besser vorhersagbare Bildung von Hartgewebe zur Folge hat [80]. Die Zellproliferation und Biomineralisationsleistung von Pulpazellen wird in Kontakt mit Calciumsilikat-Zement angehoben [104]. So konnte in vitro zum Beispiel nachgewiesen werden, dass Pulpafibroblasten Mineralisationskerne bilden, nachdem der Zement dem Zellmedium hinzugefügt wurde [58]. Ursache dafür ist die Freisetzung von TGF-β1. Dieser Wachstumsfaktor wirkt als Regulator bei vielen Reparaturvorgängen in diversen Gewebearten. Calciumsilikat-Zemente können – identisch zu Calciumhydroxid – die Zellsekretion von TGF-β1 signifikant erhöhen [57, 98]. Calciumsilikat-Zemente fördern zudem die Proliferation zum Beispiel von humanen Osteoblasten und parodontalen Ligamentzellen [53].
Calciumsilikat-Zemente gehen einen dichten Verbund zum Dentin ein. Mineralanteile aus dem Zement interagieren mit der Dentinoberfläche und dringen in die Dentintubuli ein [5]. Daher haben Calciumsilikat-Zemente eine Haftung an Dentin, die mit der von Glasionomerzementen vergleichbar ist [55]. Wenn diese hydraulischen Calciumsilikat-Zemente als Medikament zur Überkappung verwendet werden, kann daher eine erneute Kontamination von Pulpagewebe verhindert werden [76].
Der Vorteil im Vergleich zu Calciumhydroxidprodukten liegt in der höheren mechanischen Festigkeit, der geringeren Löslichkeit und dem dichteren Verschluss dieser Materialen auf Calciumsilikatbasis. Drei Hauptnachteile von Calciumhydroxid könnten bei der Anwendung eines Calciumsilikat-Zements somit vermieden werden: Resorptionserscheinungen des Überkappungsmaterials sowie die mechanische Instabilität und daraus folgend der fehlende Langzeitschutz vor Mikroleakage aufgrund von Undichtigkeiten [21].
Nachgewiesenermaßen können Calciumsilikat-Zemente die Pulpa zur Bildung von Hartgewebe (Tertiärdentin) stimulieren und sind daher für die Versorgung tiefer kariöser Defekte nach Exkavation und somit für die Vitalerhaltung der Pulpa sehr gut geeignet [15, 21]. Nach indirekter Überkappung mit Biodentine kommt es reproduzierbar zur Ausheilung einer reversiblen Pulpitis [45]. Auch wenn mehr klinische Langzeitstudien zur Vitalerhaltung der Pulpa mit Calciumsilikat-Zementen wünschenswert sind, scheinen nach bisheriger Datenlage Calciumsilikat-Zemente für die indirekte Überkappung der Pulpa besser geeignet zu sein als Calciumhydroxid [2]. Für die direkte Überkappung wurde nachgewiesen, dass Calciumsilikat-Zemente zu besseren klinischen Ergebnissen und höheren Erfolgsraten führt als Calciumhydroxid [50, 60, 63]. Hinsichtlich der Hartgewebebildung ist es dabei unerheblich, ob man ein MTA-Zement oder Biodentine verwendet. Beide Arten von Calciumsilikat-Zement führen beim Menschen zu einer identischen Hartgewebsbrückenbildung [68] (Abbildungen 3 bis 10).
Zusammenfassung
Das menschliche Dentin kann in primäres, sekundäres und tertiäres unterteilt werden. Das primäre Dentin wird vor Zahndurchbruch gebildet, das sekundäre ein Leben lang. Die Primär- und Sekundärdentinbildung ist ein physiologischer Vorgang und erfolgt durch Odontoblasten. Diese sind postmitotische Zellen, die bei Verlust nicht ersetzt werden können. Kommt es zum Beispiel durch Karies und/oder Kavitätenpräparation zu einer Verletzung der Odontoblastenfortsätze in den Dentintubuli, führt dies zur Bildung von Tertiärdentin, das auch als Reaktionsdentin bezeichnet werden kann. Das Reaktionsdentin wird, wie das Primär- und Sekundärdentin, von den primären Odontoblasten gebildet. Durch die Verletzung des Dentins und der Odontoblastenfortsätze kommt es zu einer Freisetzung von Wachstumsfaktoren, was die Reaktionsdentinbildung positiv beeinflusst. Kommt es zum Beispiel bei einer Pulpafreilegung zu einem Verlust des primären Odontoblasten, kann kein physiologisches Dentin mehr gebildet werden. Trotzdem ist nach direkter Überkappung eine Hartgewebsbrückenbildung zu beobachten. Dieses Hartgewebe ist ein spezielles Tertiärdentin und wird auch als Reparaturdentin bezeichnet, wobei fraglich ist, ob man dieses Hartgewebe überhaupt als Dentin charakterisieren kann, da es amorph und atubulär ist. Bisher ist nicht geklärt, welche Zellen dieses Reparaturdentin bilden. So wurde die Umwandlung anderer Pulpazellen in sogenannte sekundäre Odontoblasten beschrieben (Metaplasie). Eine andere Theorie geht davon aus, dass Höhlzellen, die sich in der Embryogenese zusammen mit den Odontoblasten bilden, diese bei Verlust ersetzen können. Auch wurden multipotente, adulte Stammzellen in der Pulpa nachgewiesen, die sich möglicherweise in Ersatzodontoblasten umwandeln können. Solche sekundären Odontoblasten konnten aber bisher histologisch nach direkter Überkappung nicht nachgewiesen werden. Vermutlich handelt es sich daher bei der Hartgewebsbildung um eine dystrophische Mineralisation von Narbengewebe. Reaktions- und Reparaturdentinbildung laufen parallel in einer Kavität ab.
Ein Material für die Überkappung der Pulpa sollte idealerweise die Zellen zur Hartgewebsbildung anregen, dabei antibakteriell wirken und nicht zytotoxisch sein. Im Falle einer Pulpafreilegung muss das Überkappungsmaterial in der Lage sein, die Eröffnungsstelle dicht zu verschließen, ohne resorbiert zu werden. Wässrige Calciumhydroxid-Suspensionen werden seit vielen Jahrzehnten mit hohen Erfolgsquoten für diesen Zweck eingesetzt. Trotzdem hat Calciumhydroxid einige Nachteile wie Resorptionserscheinungen und mangelnde Stabilität. Eine gute Alternative stellen daher neuerdings hydraulische Calciumsilikatzemente wie Mineral Trioxide Aggregate (MTA) oder Biodentine dar. Alle anderen Materialien wie Calciumsalicylatester-Zemente, Dentinadhäsive, lichthärtende Liner und mehr können nach derzeitiger Datenlage für die Überkappung der Pulpa nicht empfohlen werden.
Prof. Dr. Till Dammaschke
Westfälische Wilhelms-Universität Münster
Poliklinik für Parodontologie und Zahnerhaltung
Albert-Schweitzer-Campus 1, Gebäude W 30, 48149 Münster
tillda@uni-muenster.de
Nachdruck aus: Dammaschke T: Dentin- und Hartgewebeneubildung nach indirekter und direkter Überkappung der Pulpa. Oralprophylaxe Kinderzahnheilkd 2017; 39: 27–37 DOI 10.3238/OPKZH.2017.0027–0037
Interessenkonflikt: Der Autor gibt an, dass er Honorare der Firma Septodont für Vorträge erhalten hat.
Literaturliste












