Wie sind Parodontitis und Diabetes mellitus vergesellschaftet?
Die „Volkskrankheiten“ Parodontitis und Diabetes mellitus teilen nicht nur viele Gemeinsamkeiten – wie Risikofaktoren, eine multifaktorielle Ätiologie, einen überwiegend chronischen Krankheitsverlauf mit destruktiven Veränderungen, möglichen Funktionseinschränkungen und einer Beeinträchtigung der Lebensqualität Betroffener. Im vergangenen Jahrzehnt wurde auch eine bidirektionale Beziehung zwischen den beiden Erkrankungen festgestellt [Preshaw et al., 2012; Kuzmanova et al., 2016].
Wechselbeziehungen zwischen den Krankheiten
Einfluss von Diabetes auf Parodontitis
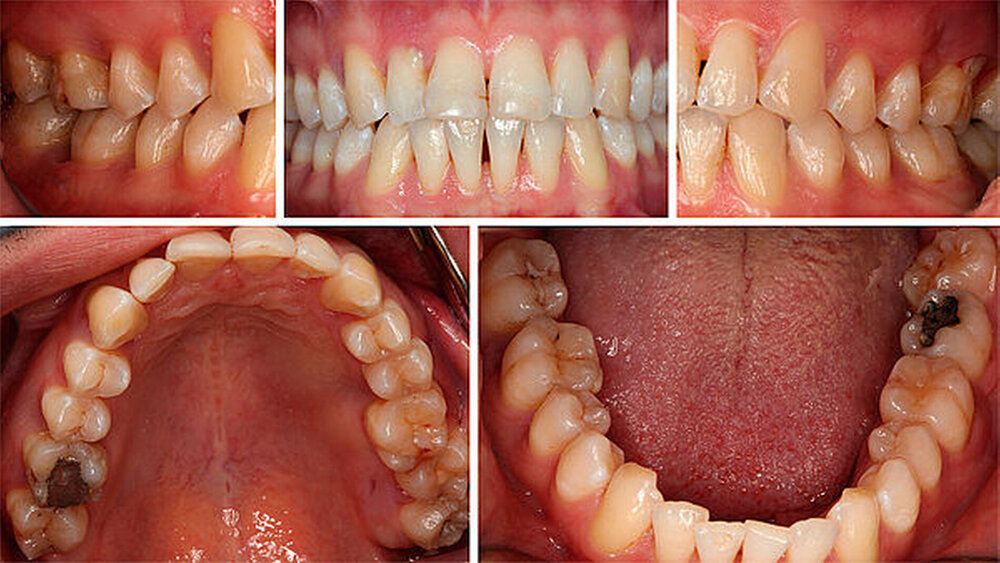
Diabetes mellitus gilt heutzutage als etablierter Risikofaktor für Parodontitis [Genco Borgnakke, 2013]. Studien aus den vergangenen Jahrzehnten haben gezeigt, dass Diabetiker häufiger an einer Parodontitis erkranken als Nichtdiabetiker. Darüber hinaus wurde bei Diabetikern in allen Altersgruppen und unabhängig vom Diabetes-Typ ein höherer und im Alter zunehmender
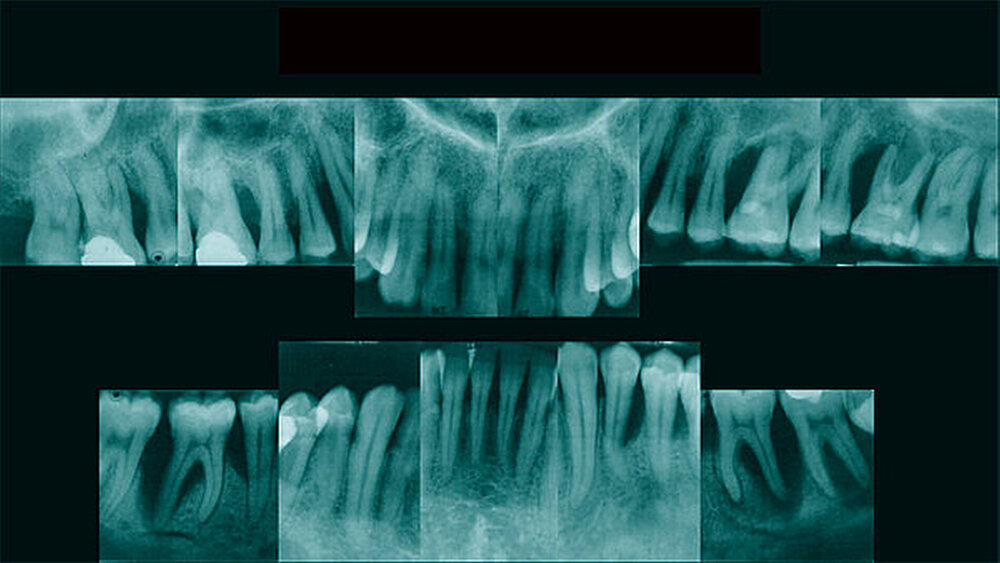
Schweregrad der Parodontitis als bei Nichtdiabetikern festgestellt. Dabei sind sowohl die mittlere Sondierungstiefe als auch der mittlere klinische Attachmentverlust bei Diabetikern erhöht [Khader et al., 2006; Lalla et al., 2006]. Prospektiv gesehen schreitet der parodontale Knochenabbau bei Diabetikern schneller als bei Nichtdiabetikern voran. Insbesondere bei schlechter glykämischer Einstellung steigt das Risiko für parodontale Destruktionen und gingivale Entzündungen. Es wurde von einem dreifach erhöhten Risiko für Zahnverlust und Parodontitisprogression berichtet [Costa et al., 2013]. Hingegen ist der klinische parodontale Zustand gut eingestellter Diabetiker mit dem von Nichtdiabetikern vergleichbar [Chávarry et al., 2009].
Die für Diabetes charakteristische Hyperglykämie scheint einen direkten Effekt auf die Immunzellfunktionen von Monozyten, neutrophilen Granulozyten und T-Zellen zu haben und eine Zytokindysregulation zu verursachen, was zu einem parodontalen Knochenabbau führen kann. Bei Patienten mit Parodontitis ist Diabetes mit höheren Konzentrationen mehrerer spezifischer Zytokine und anderer Mediatoren assoziiert [Taylor et al., 2013]. Aufgrund der Hyperglykämie bei Diabetes mellitus kommt es zu einer verstärkten Glykierung von Proteinen und zur irreversiblen Bildung der sogenannten Endprodukte der fortgeschrittenen Glykierung (advanced glycation end products, AGE). Diese werden unter anderem in parodontalen Geweben abgelagert und können sowohl direkte pro-inflammatorische als auch pro-oxidative Wirkungen auf Zellen haben. Binden AGEs an deren Signalrezeptor RAGE werden Phänotyp und Funktion der Zielzelle (Endothelzellen, Monozyten) dermaßen beeinflusst, dass es zur Anlockung von Immunzellen beziehungsweise zur Freisetzung reaktiver Sauerstoffspezies, von Zytokinen und von anderen Entzündungsmediatoren kommt, die eine überschießende Entzündungsreaktion, oxidativen Stress und eine Beeinträchtigung der Gewebereparaturmechanismen zur Folge haben können. Die parodontale Infektion potenziert weiter diesen Prozess, was in anfälligen Individuen mit Diabetes zu einer beschleunigten und schweren Zerstörung von parodontalem Gewebe führt [Taylor et al., 2013].
Einfluss von Parodontits auf Diabetes mellitus
Diabetiker mit Parodontitis weisen eine schlechtere metabolische Einstellung als parodontalgesunde Diabetiker auf [Chapple Genco, 2013]. Eine schwere Parodontitis kann die HbA1c-Werte bei Typ-2-Diabetikern verschlechtern und somit das Risiko für die Entstehung von Diabetes erhöhen.
Zusätzlich stellen parodontale Erkrankungen ein erhöhtes Risiko für Diabetes-assoziierte Komplikationen dar. Es wurde berichtet, dass eine moderate bis schwere Parodontitis mit einer Makroalbuminurie, einer Nierenerkrankung im Endstadium, einer Verkalkung von atherosklerotischen Plaques und einer kardio-renalen Mortalität assoziiert ist [Chapple Genco, 2013; Saremi et al., 2005; Sharma et al., 2016; Shultis et al., 2007]. Zusätzlich wurde gezeigt, dass Parodontitis bei Patienten ohne Diabetes nach fünf Jahren zu einer Progression der HbA1c-Werte führen und die Entstehung eines Diabetes fördern kann [Demmer et al., 2010].
Eine erfolgreiche Diabetestherapie beinhaltet die Senkung des Blutglukosespiegels, was insbesondere mikrovaskuläre Komplikationen aufschieben könnte. In Metaanalysen wurde nachgewiesen, dass drei Monate nach einer nichtchirurgischen parodontalen Therapie bei parodontal erkrankten Diabetikern eine mittlere Reduktion des HbA1c-Wertes von 0,29–0,36 Prozent erreicht werden konnte, was eine klinisch relevante Verbesserung der glykämischen Einstellung bedeutet [Engebretson Kocher, 2013; Simpson et al., 2015].
Ein möglicher Pathomechanismus für den Einfluss von Parodontitis auf Diabetes ist die systemische Inflammation. Entzündungsmediatoren wie C-reaktives Protein (CRP), Tumor Nekrosis Factor-α (TNF-α) und IL-6 können bei Parodontalerkrankungen erhöht sein und mit klinischen parodontalen Parametern korrelieren. So zeigte eine Langzeitstudie über fünf Jahre, dass die HbA1c-Werte bei den Parodontitispatienten am höchsten waren, bei denen die höchsten CRP-Werte festgestellt wurden, was auf eine Wechselbeziehung zwischen Parodontitis und systemischer Entzündung hindeutet [Demmer et al., 2010].
Leitlinie kommt
Ein deutsches Expertengremium aus Diabetologen und Parodontologen hat ein Konsenspapier über die Wechselbeziehung zwischen Parodontitis und Diabetes mellitus und die sich daraus ergebenen klinischen Implikationen erstellt [Deschner et al., 2011]. Darauf aufbauend wird gegenwärtig von der Deutschen Gesellschaft für Zahn-, Mund- und Kieferheilkunde (DGZMK), der Deutschen Gesellschaft für Parodontologie (DGPARO) sowie der Deutschen Diabetesgesellschaft (DDG) eine Leitlinie der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e. V. (AWMF) zum Thema „Diabetes und Parodontitis“ vorbereitet und ist kurz vor Fertigstellung (Registriernummer: 083–015).
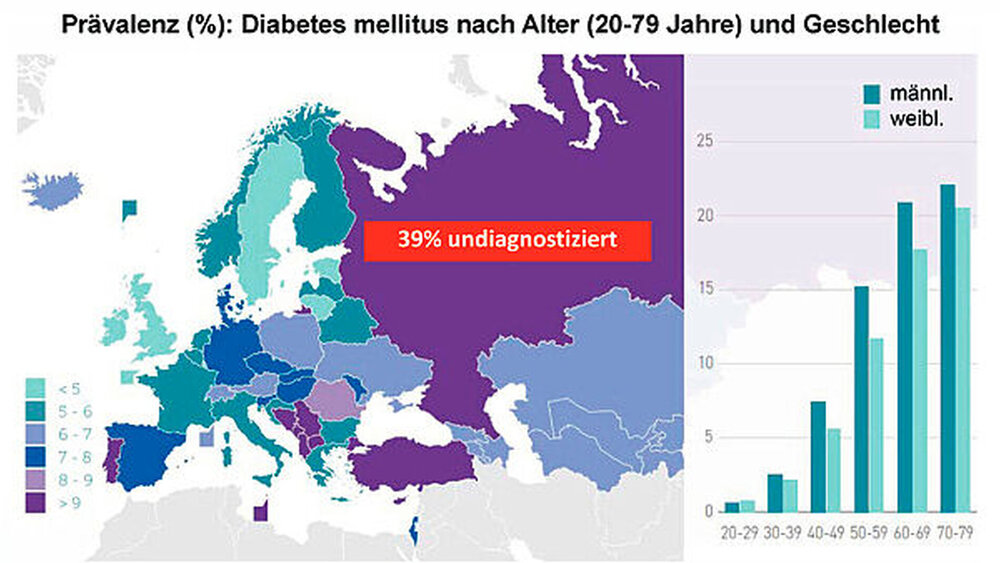
Diese Leitlinie hat unter anderem zum Ziel, die neuesten Erkenntnisse zu den Zusammenhängen zwischen beiden Erkrankungen auch in der Ärzteschaft zu kommunizieren. Die enge interdisziplinäre Zusammenarbeit zwischen Hausärzten/Internisten beziehungsweise Diabetologen und den parodontologisch tätigen Zahnärzten beziehungsweise Parodontologen bei der Betreuung von Patienten mit Diabetes und/oder Parodontitis soll wichtige Impulse erhalten. Ein besonderes Augenmerk wird dabei auf der Früherkennung von Riskopatienten durch Screeningmaßnahmen liegen. Man geht von einer Dunkelziffer in Höhe von etwa zwei Millionen unerkannter Diabetespatienten für Deutschland aus [www.2mio.de]. Eine Reihe von Studien konnte bereits zeigen, dass es in der Tat möglich ist, unerkannten Diabetes oder Prädiabetes in der zahnärztlichen Praxis zu identifizieren [Lalla et al., 2011, 2013, 2015; Genco et al., 2014].
Dr. med. dent. D. Kuzmanova, M.Sc.
Abteilung für Parodontologie und Synoptische Zahnmedizin
CharitéCentrum für Zahn-, Mund- und Kieferheilkunde
Charité – Universitätsmedizin Berlin
Aßmannshauser Str. 4–6, 14197 Berlin
denica.kuzmanova@charite.de
Prof. Dr. Dr. S. Jepsen, MS
Direktor der Poliklinik für Parodontologie
Zahnerhaltung und Präventive Zahnheilkunde
Zentrum für ZMK
Welschnonnenstr. 17, 53111 Bonn
Prof. Dr. med. dent. Henrik Dommisch
Direktor der Abteilung für Parodontologie und Synoptische Zahnmedizin
CharitéCentrum für Zahn-, Mund- und Kieferheilkunde
Charité – Universitätsmedizin Berlin
Aßmannshauser Str. 4–6, 14197 Berlin
Literaturliste
Chapple ILC, Genco R and working group 2 of the joint EFP/AAP workshop (2013) Diabetes and periodontal diseases: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Periodontol. 84(4 Suppl):106-12
Chávarry NG, Vettore MV, Sansone C, Sheiham A (2009) The relationship between diabetes mellitus and destructive periodontal disease: a meta-analysis. Oral Health Prev Dent. 7:107-127
Costa FO, Miranda Cota LO, Pereira Lages EJ, Soares Dutra Oliveira AM, Dutra Oliveira PA, Cyrino RM, Medeiros Lorentz TC, Cortelli SC, Cortelli JR (2013) Progression of periodontitis and tooth loss associated with glycemic control in individuals undergoing periodontal maintenance therapy: a 5-year follow-up study. J Periodontol 84:595-605
Demmer RT, Desvarieux M, Holtfreter B, Jacobs DR Jr, Wallaschofski H, Nauck M, Völzke H, Kocher T (2010) Periodontal status and A1C change: longitudinal results from the study of health in Pomerania (SHIP). Diabetes Care 33:1037-43
Deschner J, Haak T, Jepsen S, Kocher T, Mehnert H, Meyle J, Schumm-Draeger PM, Tschöpe D. (2011) Diabetes mellitus und Parodontitis. Wechselbeziehung und klinische Implikationen. Ein Konsensuspapier. Internist 52: 466-477.
Engebretson S, Kocher T (2013) Evidence that periodontal treatment improves diabetes outcomes: a systematic review and meta-analysis. J Periodontol 84:153-69
Genco R & Borgnakke W (2013) Risk factors for periodontal disease. Periodontol 2000. 62:59-94
Genco RJ, Schifferle RE, Dunford RG, Falkner KL, Hsu WC, Balukjaian. (2014) Screening for diabetes mellitus in dental practices: a field trial. J Am Dent Assoc 145: 57-64.
Khader YS, Dauod AS, El-Qaderi SS, Alkafajei A, Batayha WQ (2006) Periodontal status of diabetics compared with nondiabetics: a meta-analysis. J Diabetes Complications. 20:59-68 • Kuzmanova D, Jepsen S, Dommisch H. Parodontitis und Diabetes. Wissen kompakt (2016)10:103- 120
Lalla E, Cheng B, Lal S, Tucker S, Greenberg E, Goland R, Lamster IB (2006) Periodontal changes in children and adolescents with diabetes: a case-control study. Diabetes Care. 29:295-299
Lalla E, Kunzel C, Burkett S, Cheng B, Lamster IB. (2011) Identification of unrecognized diabetes and pre-diabetes in a dental setting. J Dent Res. 90: 855-860.
Lalla E, Cheng B, Kunzel C, Burkett S, Lamster IB. (2013) Dental findings and identification of undiagnosed hyperglycemia. J Dent Res. 92: 888-892.
Lalla E, Cheng B, Kunzel C, Burkett S, Ferraro A, Lamster IB. (2015) Six-month outcomes in dental patients identified with hyperglycaemia: a randomized clinical trial. J Clin Periodontol. 42: 228-235.
Preshaw PM, Alba AL, Herrera D, Jepsen S, Konstantinidis A, Makrilakis K, Taylor R (2012) Periodontitis and diabetes: a two-way relationship. Diabetologia 55:21-31.
Saremi A, Nelson RG, Tulloch-Reid M, Hanson RL, Sievers ML, Taylor GW, Shlossman M, Bennett PH, Genco R, Knowler WC (2005) Periodontal disease and mortality in type 2 diabetes. Diabetes Care 28:27-32
Sharma P, Dietrich T, Ferro CJ, Cockwell P, Chapple IL. Association between periodontitis and mortality in stages 3-5 chronic kidney disease: NHANES III and linked mortality study. (2016) J Clin Periodontol 43:104-13
Shultis WA, Weil EJ, Looker HC, Curtis JM, Shlossman M, Genco RJ, Knowler WC, Nelson RG (2007) Effect of periodontitis on overt nephropathy and end-stage renal disease in type 2 diabetes. Diabetes Care 30:306-11
Simpson TC, Weldon JC, Worthington HV, Needleman I, Wild SH, Moles DR, Stevenson B, Furness S, Iheozor-Ejiofor Z (2015) Treatment of periodontal disease for glycaemic control in people with diabetes mellitus. Cochrane Database Syst Rev 6;11:CD004714
Taylor JJ, Preshaw PM, Lalla E (2013) A review of the evidence for pathogenic mechanisms that may link periodontitis and diabetes. J Periodontol 84(4 Suppl):113-34