Ätiologie der Parodontitis – gibt es neue Erkenntnisse?
Gingivitis und Parodontitis gelten als Biofilm-induzierte entzündliche Erkrankungen. Sie sind die häufigsten Krankheiten der Menschheit [Guinness World Records, 2011]. Aufgrund der zunehmenden Weltbevölkerung und des erhöhten Zahnerhalts ist die globale Belastung durch schwere Parodontitis zwischen 1990 und 2013 um 67 Prozent angestiegen [GBD, 2015] mit enormer ökonomischer Auswirkung auf die Gesundheitssysteme [Listl et al., 2015].
Was heißt parodontal (un)gesund?
Bei parodontaler Gesundheit besteht eine Symbiose zwischen dem (mit Gesundheit assoziierten) Biofilm und einer angemessenen immuninflammatorischen Wirtsantwort. Eine Parodontitis entsteht als Folge der Entwicklung einer Dysbiose in anfälligen Individuen, die mit einer Dysregulation der immunentzündlichen Antwort einhergeht und die zu einem wirtsvermittelten Abbau von Bindegewebe und Alveolarknochen führt [Darveau, 2010; Kebschull & Papapanou, 2011; Jepsen & Dommisch, 2014; Dommisch & Jepsen, 2015; Meyle & Chapple, 2015; Kilian et al., 2016; Mira et al., 2017].
Im Kontext dieses Beitrags gelten die folgenden Begriffsbestimmungen [Sanz et al., 2017]:
Biofilm – an einer Oberfläche anheftende Mikroorganismen sind eingebettet in einer extrazellulären Matrix im Kontakt zu einem flüssigen Medium: Die Eigenschaften von Mikroorganismen im Biofilm sind anders als in einem planktonischen Stadium. Plaque auf einer Zahnoberfläche ist ein typisches Beispiel eines Biofilms, der als dentaler Biofilm bezeichnet wird. Mikroorganismen funktionieren in dentalen Biofilmen als interaktive mikrobielle Gemeinschaften, wobei die Interaktionen synergistisch, aber auch antagonistisch sein können.
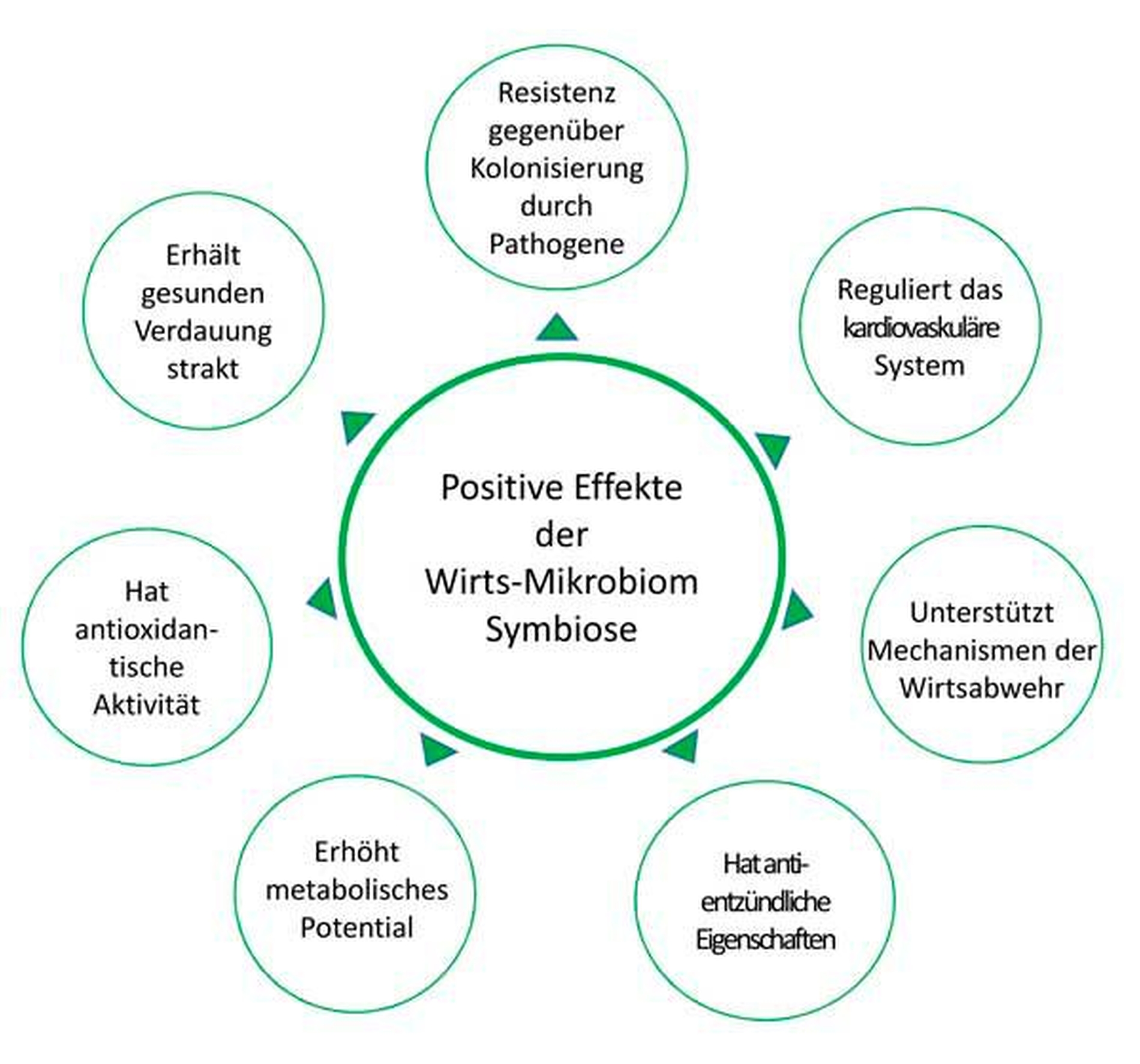
Symbiose – ein gegenseitig benefizielles Verhältnis zwischen den Mitgliedern einer mikrobiellen Gemeinschaft sowie zwischen den mikrobiellen Gemeinschaften und dem Wirt.
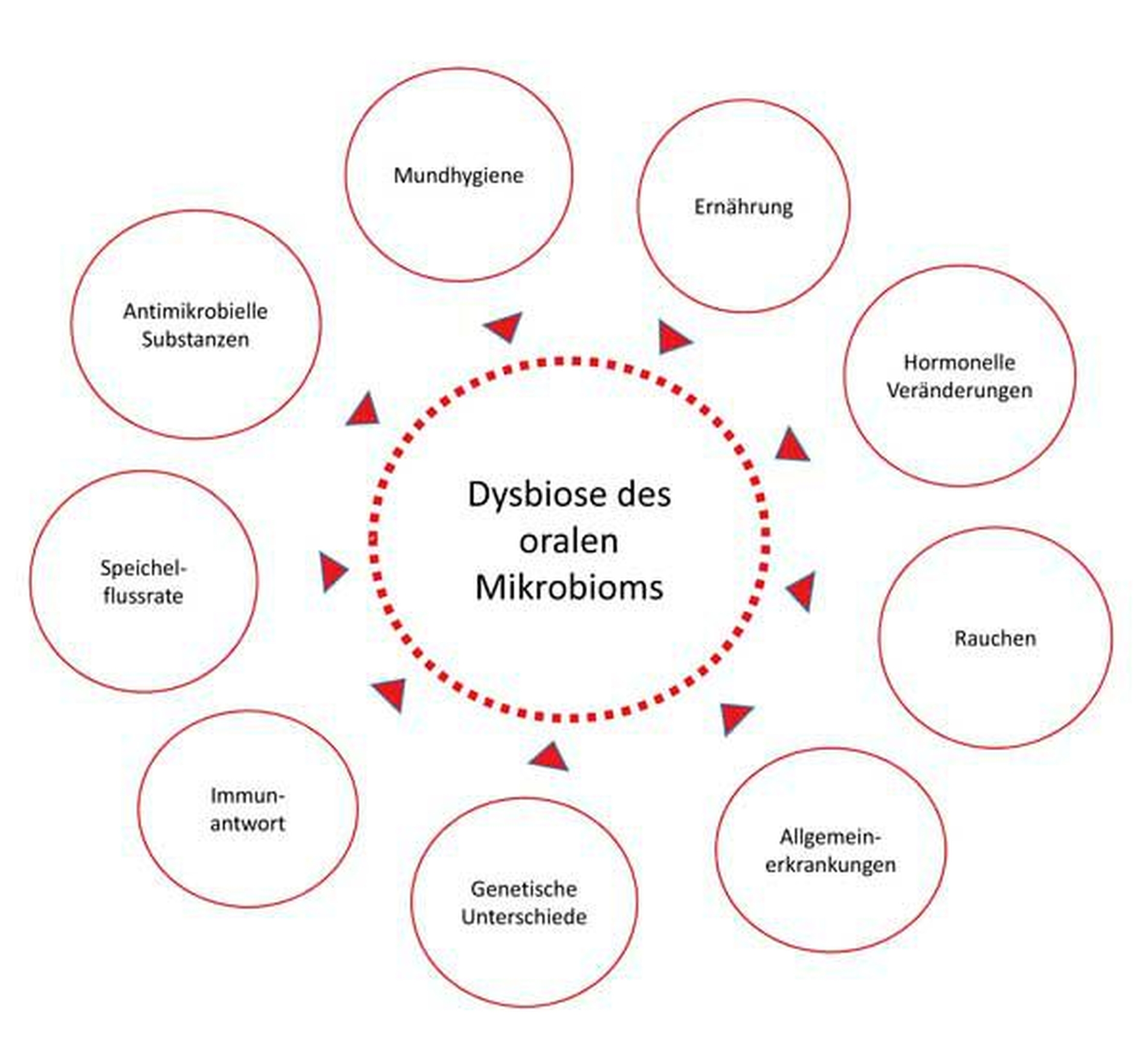
Dysbiose – eine Veränderung innerhalb der mit Gesundheit assoziierten mikrobiellen Gemeinschaft, die zu einem Zusammenbruch der benefiziellen Beziehung mit dem Wirt führt, was sich gesundheitsschädlich auswirkt.
Wirtsantwort – aktive Prozesse, die von einem mikrobiellen Angriff herrühren: Unterschieden wird eine innate (angeborene) und eine adaptive (erworbene) Wirtsantwort. Die innate Immunantwort ist ein schützender Mechanismus gegenüber einem mikrobiellen Angriff, der rasch erfolgt und unspezifisch ist. Die adaptive Immunantwort ist erworben und spezifisch.
Als komplexe, multifaktorielle Erkrankung werden die Entstehung und der Verlauf der Parodontitis zudem von einer Reihe von modifizierbaren und nicht-modifizierbaren Risikofaktoren beeinflusst (Abbildung 1).
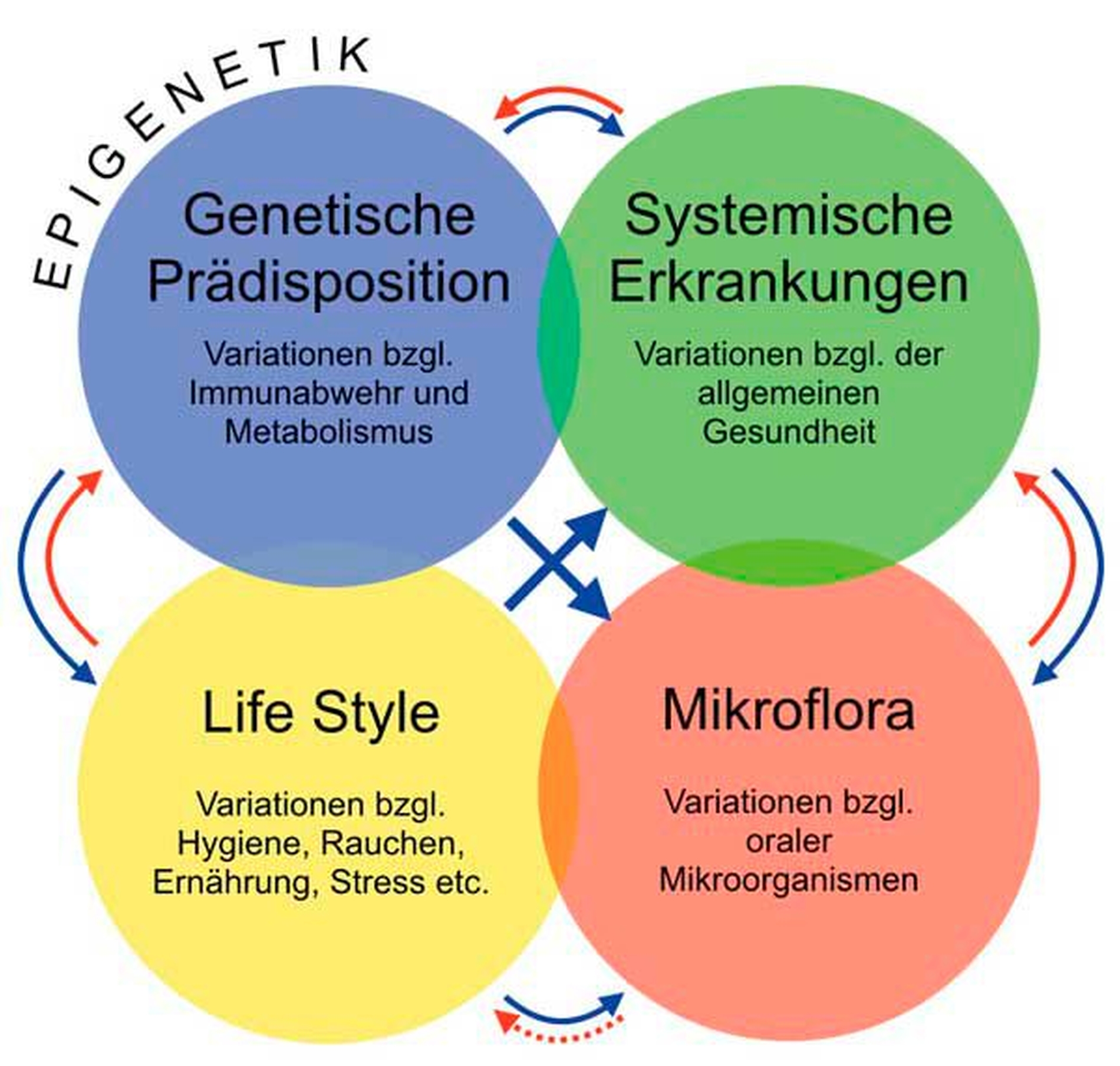
Abbildung 1: Die Parodontitis ist eine komplexe Erkrankung, in der multiple Faktoren den Beginn und das Voranschreiten der Erkrankung individuell beeinflussen. Die individuelle genetische Konstitution beeinflusst sowohl die Prädisposition für andere Erkrankungen (zum Beispiel Diabetes) als auch die Zusammensetzung der Mikroflora. Beide nehmen Einfluss auf das Immunsystem und damit auf das Erkrankungsrisiko für Parodontitis. Lifestyle-Faktoren (zum Beispiel Hygiene oder Rauchen) tragen ebenfalls erheblich zum Krankheitsrisiko bei. |
Jepsen
Der dentale Biofilm ist hochgradig organisiert
Die Bakterien auf und in unserem Körper bilden ein funktionelles Organ, das eine fundamentale Bedeutung für unsere Gesundheit besitzt (Abbildung 2) [Bordenstein & Theis, 2015]. Zusammen mit seinem Mikrobiom bildet der menschliche Organismus einen „Superorganismus“ – einen sogenannten Holobionten, wobei dieser mindestens ebenso viele Bakterien- wie Körperzellen enthält [Sender et al., 2016]. Dabei leben die Mikroorganismen (Mikrobiota) im menschlichen Körper nicht in Isolation, sondern in hochgradig regulierten, strukturell und funktionell organisierten Gemeinschaften auf Oberflächen – den Biofilmen. Hier können Bakterien untereinander mittels „Quorum Sensing“ kommunizieren, was ihnen zahlreiche Vorteile hinsichtlich der Kolonisation, des Überlebens und der Anpassung an veränderliche Umweltbedingungen verschafft [Li & Tian, 2012]. Störungen der Funktion und Zusammensetzung des Mikrobioms können deutliche negative Auswirkungen auf die menschliche Gesundheit haben [Cho & Blaser, 2012].
Das orale Mikrobiom (www.homd.org) in der Mundhöhle besiedelt eine Reihe ganz unterschiedlicher Habitate – zum Beispiel Zähne, Zunge, Wangen. Zähne sind die einzige nicht-abschilfernde Oberfläche im menschlichen Körper und bieten günstige Bedingungen für eine Biofilmbildung. Der Speichel und die gingivale Sulkusflüssigkeit bieten Nährstoffe für das Bakterienwachstum, enthalten aber auch antibakteriell wirksame Komponenten [Kilian et al., 2016]. Das komplexe Gleichgewicht zwischen den verschiedenen bakteriellen Spezies in der Mundhöhle ist verantwortlich für die Erhaltung eines gesunden Zustands – in Symbiose – oder für einen Zustand – in Dysbiose –, der mit Erkrankung assoziiert ist [Marsh & Zaura, 2017]. Eine ganze Reihe von Einflüssen können eine Störung des Ökosystems im Mund bewirken und eine Veränderung in Richtung zu einer Dysbiose verursachen (Abbildung 3) [Hajishengallis & Lamont, 2016]. Diese Vorstellung beruht auf der sogenannten „ökologischen Plaquehypothese“, die beinhaltet, dass veränderte lokale Umweltbedingungen die Vermehrung derjenigen Mikroorganismen begünstigen, die dieser Umwelt am besten angepasst sind (Abbildung 4) [Marsh, 2003].

Die Wirtsantwort ist entscheidend
In Abbildung 5 ist ein aktuelles Modell der Wirts-Bakterien-Interaktion in der Pathogenese von Gingivitis und Parodontitis dargestellt [Meyle & Chapple, 2015]. Bei klinischer Gesundheit sind leichte entzündliche Veränderungen durchaus im Einklang mit der Aufrechterhaltung einer ortsständigen gesundheitsfördernden parodontalen Mikrobiota. Die Wechselbeziehung ist symbiotisch, sodass der Wirt in Harmonie mit den Mikroorganismen lebt. Wenn sich der Biofilm allerdings ungestört vermehren kann und nicht regelmäßig entfernt wird, können sich bestimmte parodontalpathogene Bakterien hervortun, und es kann sich eine beginnende Dysbiose entwickeln. Die lokale Entzündung verursacht einen erhöhten Fluss der an Nährstoffen reichen gingivalen Sulkusfüssigkeit sowie eine Sauerstoffarmut, was das Wachstum anaerober und Protein-abhängiger Bakterien fördert. So profitiert beispielsweise Porphyromonas gingivalis von dem zunehmend entzündlichen Milieu und der damit einhergehenden gingivalen Blutung und kann seinerseits wiederum zur Dysbiose beitragen [Hajishengallis, 2014a, 2014b]. Bei einer Gingivitis ist die Wirtsantwort weiterhin angemessen, aber aufgrund der Reifung des Biofilms kann die damit verbundene Entzündung nicht ohne Weiteres aufgelöst werden und wird chronisch, was gleichfalls die Dysbiose unterstützt [Lamont & Hajishengallis, 2015].
Abhängig von einer ganzen Reihe von genetischen, Umwelt- und Lifestyle-Risikofaktoren (siehe unten) wird sich in einigen anfälligen Individuen eine Parodontitis entwickeln. Diese wird vorangetrieben durch eine unangemessene und überschießende immuninflammatorische Wirtsantwort, die den Großteil der Schädigung der parodontalen Strukturen des Wirts verursacht. Sie ist verantwortlich für die nun ausgeprägte Dysbiose mit fehlender Auflösung der chronischen destruktiven Entzündung. Ein Teufelskreis ist entstanden, der dieses Ungleichgewicht unterhält [Meyle & Chapple, 2015; Kilian et al.,2016].
Allerdings kann eine regelmäßige und gründliche Entfernung des Biofilms (antiinfektiöse Therapie) zur Auflösung der Entzündung beitragen und eine Symbiose wiederherstellen [Kebschull et al., 2017, S. 72–79 in diesem Heft]. Dabei ist ein verantwortungsvoller, zurückhaltender Umgang mit systemischen Antibiotika anzumahnen, um die benefizielle Mikrobiota zu schützen und antibiotische Resistenzen zu vermeiden [Jepsen & Jepsen, 2016].
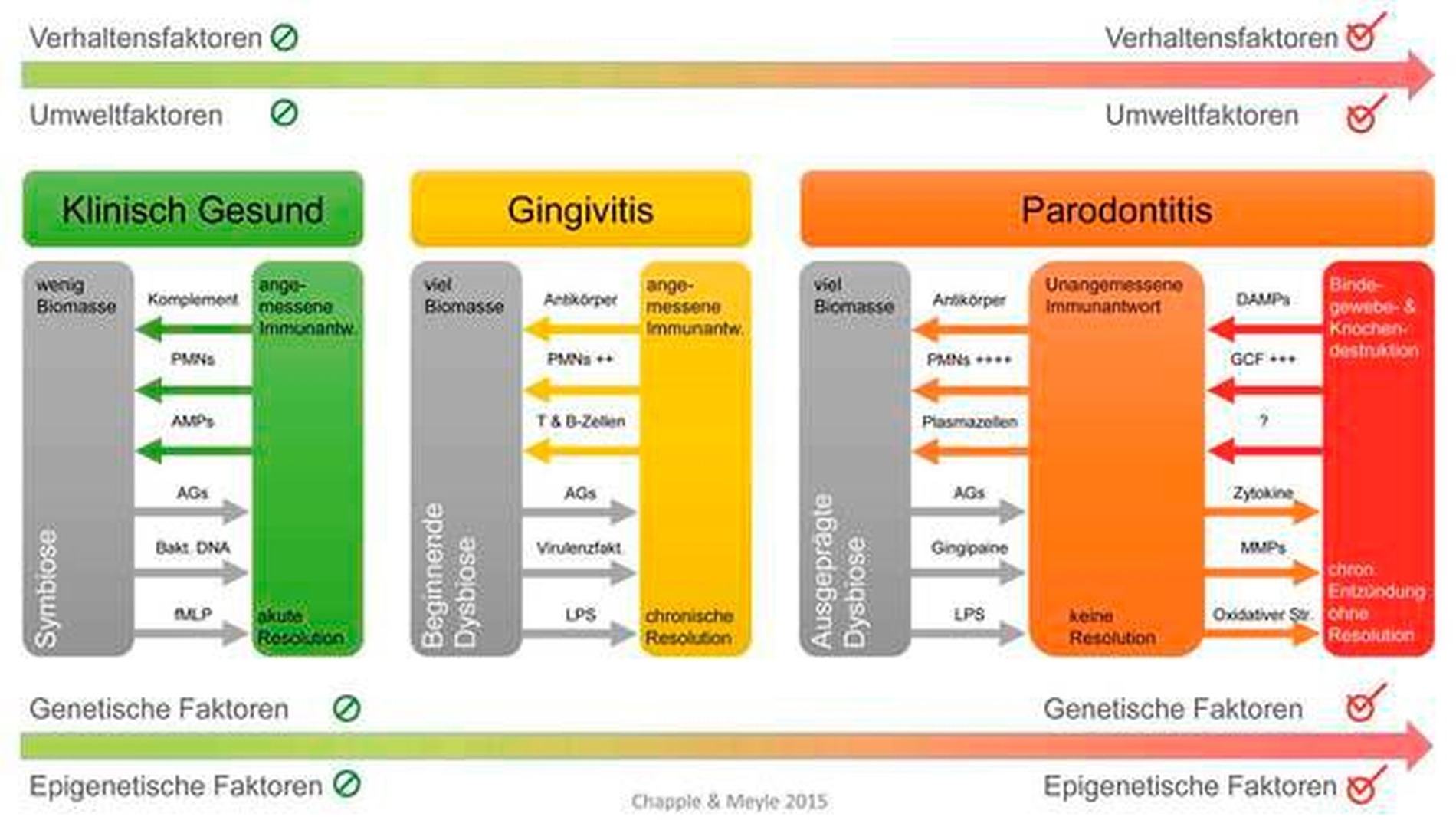
Abbildung 5: Modell der Pathogenese der Parodontitis, das sich aus dem klassischen Modell von Page & Kornman [1997] entwickelt hat. (AMP = Antimikrobielle Peptide, DAMP = Damage-Associated Molecular Pattern, fMLP = f-Met-Leu-Phe, GCF = Gingivale Sulkusflüssigkeit, LPS = Lipopolysaccharide, MMP = Matrix-Metalloproteinasen, PMN = Polymorphkernige neutrophile Granulozyten) |
nach Meyle & Chapple 2015
Welche Rolle spielen die Risikofaktoren?
Die große Bedeutung von Verhaltens-, Lifestyle-, sozialen und systemischen Faktoren im Kontext präventiver Therapien wurde kürzlich umfassend aufgearbeitet [Jepsen et al., 2017; Chapple et al., 2017]. Assoziationen zwischen einem niedrigen sozio-ökonomischen Status und einer höheren Parodontitisprävalenz sind belegt [Boillot et al., 2011]. Auch ist die Prävalenz der Parodontitis bei Männern höher als bei Frauen [Shiau & Reynolds, 2010]. Abgesehen von diesen Determinanten variiert das Ausmaß, in dem die Akkumulation eines Biofilms die Entstehung und das Voranschreiten einer Parodontitis befördert, interindividuell entsprechend des jeweiligen Risikoprofils der Patienten [Genco & Borgnakke, 2013].
Im Folgenden werden einige der systemischen beziehungsweise Patientenfaktoren, die das Risiko für Parodontitis mitbestimmen, beleuchtet. Bei Patienten ohne eine Anfälligkeit für Parodontitis ist die Entzündungsantwort im Rahmen einer Gingivitis angemessen und selbstauflösend, während bei anfälligen Patienten multiple Risikofaktoren eine überschießende, aber ineffektive und sich nicht wieder auflösende Entzündung im bindegewebigen Zahnhalteapparat triggern. Unterschieden werden nicht-modifizierbare Risikofaktoren (genetische Faktoren), modifizierbare Risikofaktoren (Lifestyle-Faktoren wie Rauchen, Ernährung) und erworbene Faktoren (zum Beispiel ein Diabetes mellitus).
Unkontrollierter Diabetes: Insbesondere bei einem unkontrollierten Diabetes beeinflusst die metabolische Dysregulation die Entzündungsantwort, mit der Folge eines hochinflammatorischen Zustands, der den parodontalen Gewebeabbau beschleunigt. Diese Aspekte wurden von Dommisch et al. [zm 23/24, 2017] ausführlich adressiert.
Rauchen: Neben einem unkontrollierten Diabetes gilt Rauchen als der wichtigste modifizierbare Risikofaktor für Parodontitis mit einer klar dokumentierten Dosis-Wirkungs-Beziehung [Palmer et al., 2005; Genco & Borgnakke, 2013; Nociti et al., 2015]. Pathogene Mechanismen beinhalten Einflüsse auf die Komposition der subgingivalen Mikrobiota, eine reduzierte Mikrozirkulation, gestörte Funktionen der neutrophilen Granulozyten, die Produktion proinflammatorischer Zytokine und erhöhte Spiegel pathogener T-Zellen [Heasman et al., 2006; Loos et al., 2004]. Positive Effekte einer Verhaltensänderung (Raucherstopp) auf die parodontale Gesundheit und Zahnerhalt sind belegt [Chambrone et al., 2013; Costa et al., 2013; Fiorini et al., 2014; Rosa et al., 2014; Dietrich et al., 2015].
Ernährung: Parodontitis kann auch durch die Ernährung beeinflusst werden [Hujoel & Lingström, 2017; Chapple et al., 2017]. So ist beispielsweise eine umgekehrte Assoziation zwischen der Einnahme und den Plasmakonzentrationen von Vitamin C und der Parodontitisprävalenz gezeigt worden [van der Velden et al., 2011]. Niedrige Spiegel an Omega-3-Fettsäuren korrelieren mit stärkerer Parodontitis [Iwasaki et al., 2010]. Eine kohlenhydratreiche Diät kann die Blutungsneigung der Gingiva erhöhen [Hujoel, 2009; Wölber et al., 2016]. Die Zusammenhänge zwischen Parodontitis und Ernährung sind in einem Beitrag von Wölber und Tennert [2017] und hinsichtlich Probiotika und parodontaler Therapie in einem Beitrag von Schlagenhauf [2017] in den zm 23/24, 2017, näher ausgeführt worden.
Genetisches Risiko: Der aktuelle Stand der Erkenntnisse zum genetischen Risiko wurde in aktuellen Übersichten von Schäfer et al. [zm, 2015] sowie Nibali et al. [2017] zusammengefasst. Der genetische Beitrag zum Parodontitisrisiko wird auf bis zu 50 Prozent geschätzt. Insbesondere bei jungen Patienten mit fortgeschrittener Parodontitis wird eine starke genetische Komponente vermutet [Laine et al., 2014; Loos et al., 2015]. Genetische Risikoprofile könnten zukünftig das Potenzial haben, die Effektivität und Effizienz präventiver Interventionen individuell zu verbessern. Derzeit sind aber die wissenschaftlichen Belege für die meisten der veröffentlichten Risikovarianten noch unzureichend. Die wenigen, als validiert geltenden Risikogene (unter anderen ANRIL, PLG, NPY, GLT6D1, IL10) und ihre entsprechenden assoziierten Varianten verleihen eine zu geringe Vorhersagegenauigkeit für eine dem Patienten gewinnbringende Anwendung in einem persönlichen genetischen Risikoprofil. Dennoch liefern die als validiert geltenden Risikogene bereits wichtige Erkenntnisse für das Verständnis der Ätiopathogenese der Parodontitis, indem sie auf eine große Bedeutung der Interaktion des Fett- und Glukosemetabolismus mit dem Immunsystem für die Parodontitis hinweisen. Allerdings müssen die genauen Mechanismen mit ihrer funktionellen Relevanz erst noch aufgeklärt werden. Interessant ist die Erkenntnis, dass genetische Varianten offenbar auch Einfluss auf die subgingivale bakterielle Kolonisierung nehmen [Divaris et al., 2012; Nibali et al., 2016].
Parodontitis gilt nach WHO als eine chronische, nicht-übertragbare Erkrankung [Non-Communicable Disease = NCD] und teilt soziale Determinanten und viele der oben angeführten Risikofaktoren mit anderen großen NCDs (wie Herz-Kreislauf-Erkrankungen, Diabetes, Krebs und chronischen Atemwegserkrankungen), die für zwei Drittel der weltweiten Mortalität verantwortlich sind [Ezzati & Riboli, 2012]. Dabei kann die systemische entzündliche Belastung und beeinträchtigte Ernährung bei fortgeschrittener Parodontitis zur Pathogenese chronischer NCDs beitragen [Dommisch et al., 2017]. Dies bedeutet, dass die Krankheitslast durch Parodontitis in Übereinstimmung mit den WHO/UN-Prioritäten und -Strategien zur Bekämpfung der NCDs mittels „Common Risk Factor Approach“ adressiert werden sollte [Sheiham & Watt, 2000; Tonetti et al., 2017a].
Altern und Parodontitis
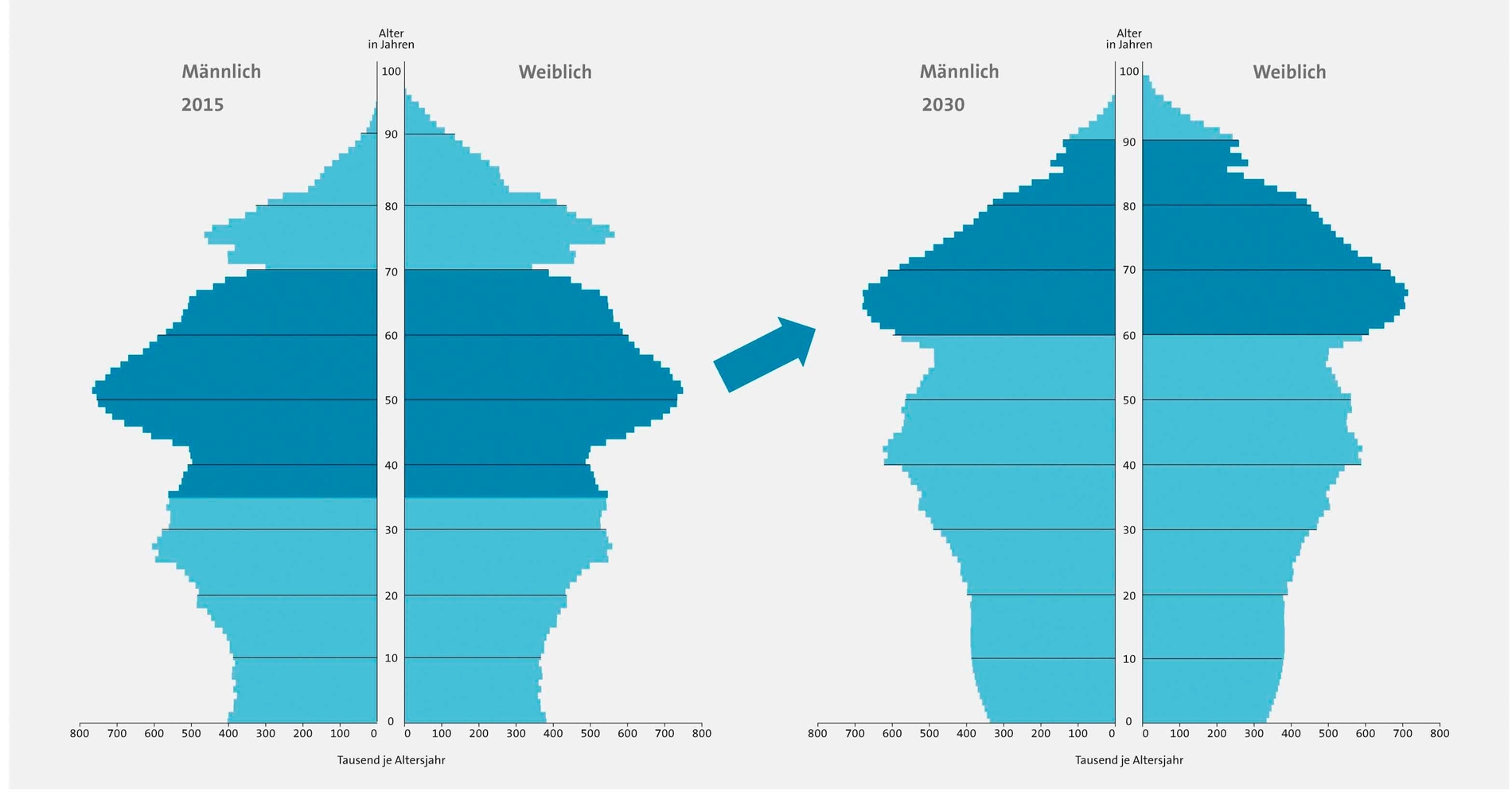
Ältere Patienten sind häufig an einer oder mehreren NCDs erkrankt. Zugleich steigt die Parodontitisprävalenz mit zunehmendem Lebensalter an [DMS V]. Aufgrund des zunehmenden Zahnerhalts bis ins höhere Lebensalter und des demografischen Wandels wird der parodontale Behandlungsbedarf in Deutschland noch steigen (Abbildung 6). Vor diesem Hintergrund sind die Zusammenhänge von Altern, Parodontitis und Immunstatus von Bedeutung.
In der Immungerontologie bezeichnet Immunseneszenz die Abnahme der Leistung des Immunsystems mit zunehmendem Alter. „Inflamm-aging“ beschreibt einen chronischen Entzündungsprozess als Altersphänomen, der durch die Zunahme proinflammatorischer Zytokine und Akute-Phase-Proteine mit zunehmenden Alter gekennzeichnet ist [Franceschi et al., 2000].
Der komplexe Zusammenhang zwischen Altern und Parodontitis ist aufgrund zahlreicher Komorbiditäten und Medikationen nicht ohne Weiteres zu entschlüsseln. Heute wird der Einfluss des Alterns nicht nur als Folge der langjährigen entzündlichen Belastung mit kumulativen Gewebeschäden angesehen (Hypothese des kumulativen Effekts), vielmehr trägt das Altern zur Pathogenese der Parodontitis durch altersabhängige Veränderungen im immuninflammatorischen Status des Wirts bei (Hypothese der altersveränderten Anfälligkeit) (Abbildung 7) [Hajishengallis, 2014c]. Diese altersbedingten Veränderungen im Immunstatus betreffen Funktionseinschränkungen sowohl der innaten als auch der adaptiven Immunantwort mit chronischer Entzündung [Ebersole et al., 2016; Preshaw et al., 2017], was in Prävention und Therapie der Parodontitis bei älteren Patienten berücksichtigt werden muss [Tonetti et al., 2017b].
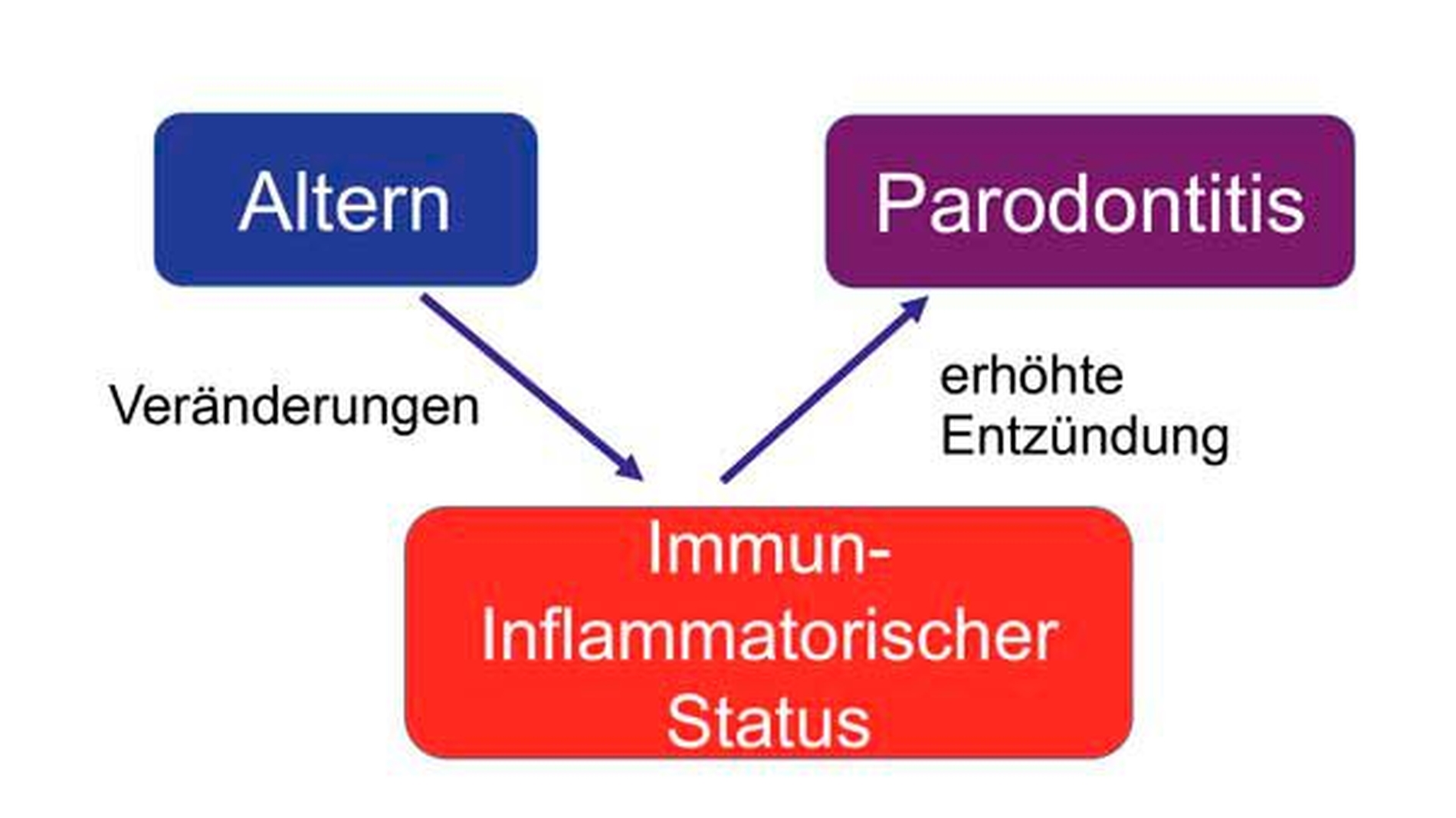
Abbildung 7: Das Altern trägt zur Pathogenese der Parodontitis durch altersabhängige Veränderungen im immuninflammatorischen Zustand des Wirts bei, der die alternden parodontalen Gewebe anfälliger für die Parodontitis macht. |
nach Hajishengallis, 2014c
Zusammenfassung
Weitere Fortschritte im Verständnis der Ätiopathogenese der Parodontitis werden in Zukunft weiter verbesserte individuelle Risikoeinschätzungen für eine zielgerichtete Prävention und personalisierte Therapieansätze im Sinne einer „Precision Medicine“ ermöglichen, um nach einer Dsybiose ein mit Gesundheit assoziiertes orales Mikrobiom wiederherzustellen.
Univ.-Prof. Dr. med. dent. Dr. med. Søren Jepsen, MS
Direktor der Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde, Zentrum für ZMK
Welschnonnenstr. 17, 53111 Bonn
sjepsen@uni-bonn.de
Univ.-Prof. Dr. med. dent. Henrik Dommisch
CharitéCentrum ZMK CC 3
Direktor der Abteilung für Parodontologie und Synoptische Zahnmedizin
Aßmannshauser Str. 4–6, 14197 Berlin
PD Dr. med. dent. Moritz Kebschull
Oberarzt der Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde, Zentrum für ZMK
Welschnonnenstr. 17, 53111 Bonn
Literaturverzeichnis
Boillot A, El Halabi B, Batty GD, Range H, Czernichow S, Bouchard P. Education as a predictor of chronic periodontitis: a systematic review with meta-analysis population-based studies. PLoS ONE 2011; 6: e21508.
Bordenstein SR, Theis KR. Host Biology in Light of the Microbiome: Ten Principles of Holobionts and Hologenomes. PLoS Biol 2015; 13: e1002226.
Chambrone L, Preshaw PM, Rosa EF, Heasman PA, Romito GA, Pannuti CM, Tu YK. Effects of smoking cessation on the outcomes of non-surgical periodontal therapy: a systematic review and individual patient data meta-analysis. J Clin Periodontol 2013; 40(6):607-615.
Chapple ILC, Bouchard P, Cagetti MG, Campus G, Carra M-C, Cocco F, Nibali L, Hujoel P, Laine ML, Lingström P, Manton DJ, Montero E, Pitts N, Range H, Schlueter N, Teughels W, Twetman S, Van Loveren C, Van der Weijden F, Vieira AR, Schulte AG. Interaction of lifestyle, behaviour or systemic diseases with dental caries and periodontal diseases: consensus report of group 2 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol 2017; 44 (Suppl. 18): S39–S51.
Cho I, Blaser MJ. The human microbiome: at the interface of health and disease. Nat Rev Genet 2012; 13(4):260-270.
Costa FO, Cota LO, Lages EJ, Cyrino RM, Oliveira AM, Oliveira PA, Cortelli JR.Associations of duration of smoking cessation and cumulative smoking exposure with periodontitis. J Oral Sci 2013; 55(3):245-253.
Darveau RP. Periodontitis: a polymicrobial disruption of host homeostasis. Nat Rev Microbiol 2010; 8(7):481-490.
Dietrich T, Walter C, Oluwagbemigun K, Bergmann M, Pischon T, Pischon N, Boeing H. Smoking, Smoking Cessation, and Risk of Tooth Loss: The EPIC-Potsdam Study. J Dent Res 2015; 94(10):1369-75.
Divaris K, Monda K, North KE, Olshan AF, Lange EM, Moss K, Barros SP, Beck JD & Offenbacher S. Genomewide association study of periodontal pathogen colonization. J Dent Res 2012; 91: 21S–28S.
Dommisch H, Jepsen S. Diverse functions of defensins and other antimicrobial peptides in periodontal tissues. Periodontol 2000 2015; 69: 96-110.
Dommisch H, Kebschull M, Jepsen S. Allgemeine Gesundheit und Parodontitis. ZM 2017; 107: 46-54.
Ebersole JL, Graves CL, Gonzalez OA, Dawson D 3rd, Morford LA, Huja PE, Hartsfield JK Jr, Huja SS, Pandruvada S, Wallet SM. Aging, inflammation, immunity and periodontal disease. Periodontol 2000 2016; 72(1):54-75
Ezzati M & Riboli E. Can non-communicable diseases be prevented? Lessons from studies of population and individuals. Science 2012; 337:1482–1487.
Fiorini T, Musskopf ML, Oppermann RV, Susin C. Is there a positive effect of smoking cessation on periodontal health? A systematic review. J Periodontol 2014; 85(1):83-91.
Franceschi C, Bonafè M, Valensin S, Olivieri F, De Luca M, Ottaviani E, De Benedictis G. Inflamm-aging. An evolutionary perspective on immunosenescence. Ann N Y Acad Sci 2000; 908:244-254.
Genco RJ, Borgnakke WS. Risk factors for periodontal disease. Periodontol 2000 2013; 62(1):59-94.
GBD 2015. Disease and Injury Incidence and Prevalence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 310 diseases and injuries, 1990–2015: a systematic analysis for the Global Burden of Disease Study 2015. Lancet 2016; 388:1545–1602
Guinness World Records (Eds.) (2001). Gum disease. In: Guinness World Records (p. 175). New York: Mint Publishers, Incorporated.
Hajishengallis G. Immunomicrobial pathogenesis of periodontitis: keystones, pathobionts, and host response. Trends Immunol 2014a; 35(1):3-11.
Hajishengallis G. The inflammophilic character of the periodontitis-associated microbiota. Mol Oral Microbiol 2014b;29(6):248-257
Hajishengallis G. Aging and its Impact on Innate Immunity and Inflammation: Implications for Periodontitis. J Oral Biosci 2014c; 56(1):30-37.
Hajishengallis G, Lamont RJ. Dancing with the Stars: How Choreographed Bacterial Interactions Dictate Nososymbiocity and Give Rise to Keystone Pathogens, Accessory Pathogens, and Pathobionts. Trends Microbiol 2016; 24(6):477-489.
Heasman L, Stacey F, Preshaw PM, McCracken GI, Hepburn S, Heasman PA. The effect of smoking on periodontal treatment response: a review of clinical evidence. J Clin Periodontol. 2006; 33: 241-253.
Hujoel PP, Lingström P. Nutrition, dental caries, and periodontal disease: a practical overview. J Clin Periodontol 2017; 44(Suppl.18):79–84.
Hujoel P. Dietary carbohydrates and dental-systemic diseases. J Dent Res 2009; 88:490-502.
Iwasaki M, Yoshihara A, Moynihan P, Watanabe R, Taylor GW, Miyazaki H. Longitudinal relationship betweendietary omega-3 fatty acids and periodontal disease. Nutrition 2010; 26:1105-1109.
Jepsen S, Blanco J, Buchalla W, Carvalho JC, Dietrich T, Dörfer C, Eaton KA, Figuero E, Frencken JE, Graziani F, Higham SM, Kocher T, Maltz M, Ortiz-Vigon A, Schmoeckel J, Sculean A, Tenuta LMA, van der Veen MH, Machiulskiene V. Prevention and control of dental caries and periodontal diseases at individual and population level: consensus report of group 3 of joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol 2017; 44(Suppl 18):85–93.
Jepsen K, Jepsen S. Antibiotics/antimicrobials: systemic and local administration in the therapy of mild to moderately advanced periodontitis. Periodontology 2000 2016; 71(1):82-112.
Jepsen S, Dommisch H. Die parodontale Entzündung. ZM 2014; 104:32-40.
Kebschull M, Papapanou PN. Periodontal microbial complexes associated with specific cell and tissue responses. J Clin Periodontol 2011; 38 (Suppl 11):17-27.
Kebschull M, Jepsen S, Dommisch H. Parodontitistherapie – invasiv/nicht-invasiv oder beides? ZM im Druck
Kilian M, Chapple IL, Hannig M, Marsh PD, Meuric V, Pedersen AM, Tonetti MS, Wade WG, Zaura E. The oral microbiome - an update for oral healthcare professionals. Br Dent J 2016; 221(10):657-666.
Laine M, Jepsen S, Loos BG. Progress in the Identification of Genetic Factors in Periodontitis Curr Oral Health Rep 2014; 1: 272–278.
Lamont RJ, Hajishengallis G. Polymicrobial synergy and dysbiosis in inflammatory disease. Trends Mol Med 2015; 21(3):172-183.
Li YH, Tian X. Quorum sensing and bacterial social interactions in biofilms. Sensors (Basel). 2012; 12(3):2519-2538.
Listl S, Galloway J, Mossey PA, Marcenes W. Global economic impact of dental diseases. J Dent Res 2015; 94:1355–1361.
Loos BG, Roos MT, Schellekens PT, van der Velden U, Miedema F. Lymphocyte numbers and function in relation to periodontitis and smoking. J Periodontol 2004; 75:557-564.
Loos BG, Papantonopoulos G, Jepsen S, Laine ML. What is the Contribution of Genetics to Periodontal Risk? Dent Clin North Am 2015; 59(4):761-780.
Marsh PD. Are dental diseases examples of ecological catastrophes? Microbiology 2003; 149(Pt 2):279-94.
Marsh PD, Zaura E. Dental plaque biofilm: ecological interactions in health and disease. J Clin Periodontol 2017; 44(Suppl. 18):12-22.
Meyle J, Chapple I. Molecular aspects of the pathogenesis of periodontitis. Periodontol 2000. 2015; 69(1):7-17.
Mira A, Simon-Soro A, Curtis MA. Role of microbial communities in the pathogenesis of periodontitis and caries. J Clin Periodontol 2017; 44(Suppl.18):23–38.
Nibali L, Di Iorio A, Tu YK, Vieira AR. Host genetics role in the pathogenesis of periodontal disease and caries. J Clin Periodontol 2017; 44 Suppl 18:S52-S78.
Nibali L, Di Iorio A, Onabolu O, Lin GH. Periodontal infectogenomics: systematic review of associations between host genetic variants and subgingival microbial detection.J Clin Periodontol 2016; 43(11):889-900.
Nociti FH Jr, Casati MZ, Duarte PM. Current perspective of the impact of smoking on the progression and treatment of periodontitis. Periodontology 2000, 2015; 67:187–210.
Palmer RM, Wilson RF, Hasan AS, Scott DA. Mechanisms of action of environmental actors–tobacco smoking. J Clin Periodontol 2005; 32 (Suppl. 6):180–195.
Preshaw PM, Henne K, Taylor JJ, Valentine RA, Conrads G. Age-related changes in immune function (immune senescence) in caries and periodontal diseases: a systematic review. J Clin Periodontol 2017; 44 Suppl 18:S153-S177
Rosa EF, Corraini P, Inoue G, Gomes EF, Guglielmetti MR, Sanda SR, Lotufo JP, Romito GA, Pannuti CM. Effect of smoking cessation on non-surgical periodontal therapy: results after 24 months. J Clin Periodontol 2014; 41(12):1145-1153.
Sanz M, Beighton D, Curtis MA, Cury J, Dige I, Dommisch H, Ellwood R, Giacaman R, Herrera D, Herzberg MC, Könönen E, Marsh PD, Meyle J, Mira A, Molina A, Mombelli A, Quirynen M, Reynolds E, Shapira L, Zaura E. Role of microbial biofilms in the maintenance of oral health and in the development of dental caries and periodontal diseases. Consensus report of group 1 of the Joint EFP/ORCA workshop on the boundaries between caries and periodontal disease. J Clin Periodontol 2017; 44(Suppl 18):5-11.
Schäfer A, Dommisch H, Jepsen S. Genetische Risikofaktoren ZM 2015; 105, Nr. 10 A, 16.5.2015
Schlagenhauf U. Probiotika für die PAR-Therapie. ZM 2017; 107: 40-45.
Sender R, Fuchs S, Milo R. Are We Really Vastly Outnumbered? Revisiting the Ratio of Bacterial to Host Cells in Humans. Cell 2016; 164(3):337-340.
Sheiham A, & Watt RG. The common risk factor approach: A rational basis for promoting oral health. Commun Dent Oral Epidem 2000; 28: 399–406.
Shiau HJ, Reynolds MA. Sex differences in destructive periodontal disease: a systematic review. J Periodontol 2010; 81:1379-1389.
Tonetti MS, Jepsen S, Jin L, Otomo-Corgel J. Impact of the global burden of periodontal diseases on health, nutrition and wellbeing of mankind: A call for global action. J Clin Periodontol. 2017a;44(5):456-462.
Tonetti MS, Bottenberg P, Conrads G, Eickholz P, Heasman P, Huysmans M-C, Lopez R, Madianos P, Müller F, Needleman I, Nyvad B, Preshaw PM, Pretty I, Renvert S, Schwendicke F, Trombelli L, van der Putten G-J, Vanobbergen J, West N, Young A, Paris S. Dental caries and periodontal diseases in the ageing population: call to action to protect and enhance oral health and well-being as an essential component of healthy ageing– Consensus report of group 4 of the joint EFP/ORCA workshop on the boundaries between caries and periodontal diseases. J Clin Periodontol 2017b; 44(Suppl 18):135-144.
van der Velden U, Kuzmanova D, Chapple ILC. Micronutritional approaches to periodontal therapy. J Clin Periodontol. 2011;38 (Suppl. 11):142–158.
Wölber JP, Bremer K, Vach K, Konig D, Hellwig E, Ratka-Kruger P, Al Ahmad A, Tennert C. An oral health optimized diet can reduce gingival and periodontal inflammation in humans - a randomized controlled pilot study. BMC Oral Health 2016; 17(1):28.
Wölber J & Tennert C. Parodontitis und Ernährung. ZM 2017: 107: 32-39.