Medikamenten-assoziierte Kiefernekrosen
Noch immer stellt die Medikamenten-assoziierte Kiefernekrose sowohl Patienten als auch Behandler vor große Herausforderungen. In den fünfzehn Jahren nach der Erstbeschreibung eines Kausalzusammenhangs zwischen der Einnahme von antiresorptiven Medikamenten und der Entstehung von Kiefernekrosen wurden hinsichtlich der Wahrnehmung, in der Vorbeugung sowie in der Therapie dieser Erkrankung deutliche Fortschritte gemacht. Das zunächst als seltene Nebenwirkung beschriebene Phänomen zeigte sich immer mehr als eine zunehmende, die Lebensqualität der Betroffenen maßgeblich beeinflussende Erkrankung.
Obwohl eine multifaktorielle Pathogenese sehr wahrscheinlich ist, mehren sich in der Literatur Hinweise darauf, dass Infektionen im Kieferbereich als Trigger und auslösender Faktor eine Schlüsselrolle bei der Entstehung der Medikamenten-assoziierten Kiefernekrose spielen könnten. Dadurch bekommen die Prophylaxe (zahnärztliche Maßnahmen vor Beginn einer antiresorptiven Therapie) und die Prävention (Maßnahmen während und nach einer antiresorptiven Therapie) einen immer höheren Stellenwert. Von besonderer Bedeutung ist daher ein guter interdisziplinärer Austausch zwischen den die antiresorptiven Medikamente verordnenden Ärzten, den Hauszahnärzten, den spezialisierten Zahnärzten und den Mund-, Kiefer- und Gesichtschirurgen.
In diesem Artikel werden die Erfahrungen und Behandlungskonzepte eines klinischen Zentrums dargestellt, in dem sich in den vergangenen fünf Jahren die Behandlungszahlen von Patienten unter antiresorptiver Medikation vervielfacht haben. Ziel ist es, allen beteiligten Fachdisziplinen, die Patienten unter antiresorptiver Therapie betreuen, insbesondere den Zahnärzten, einen Überblick über die aktuelle Evidenz sowie die auf eigenen Erfahrungswerten beruhenden Vorbeugungs- und Behandlungskonzepte zu geben.
Antiresorptive Medikamente und Nomenklatur
Bisphosphonate und Denosumab spielen eine bedeutende Rolle in der pharmakologischen Therapie von Erkrankungen des Skelettsystems. Diese antiresorptiven Medikamente finden vor allem in der Behandlung der Osteoporose und der ossären Metastasierung solider Tumore ihren Einsatz [Raje, 2018]. Gemeinsames Wirkprinzip ist eine Hemmung der Osteoklasten-vermittelten Knochenresorption mit dem Ziel einer positiven Gewebebilanz im Knochen – das heißt, es wird mehr Knochen auf- als abgebaut.
Die Bisphosphonate werden hierbei kovalent an das Hydroxylapatit des Knochens gebunden. Hierdurch kann die Halbwertszeit, je nach Medikament, Jahre betragen und ist somit unkalkulierbar lang. Im Gegensatz dazu greift der monoklonale Antikörper Denosumab gezielt in das Gleichgewichtssystem zwischen Osteoblasten und Osteoklasten ein und mindert auf diese Weise die Bildung und Ausreifung der Knochenzellen. Die Halbwertszeit von Denosumab ist mit einigen Wochen deutlich kürzer als die der Bisphosphonate [Grötz, 2016].
Bei Patienten mit Osteoporose bewirkt die antiresorptive Therapie eine signifikante Verminderung pathologischer Frakturen, wodurch die Lebensqualität von Osteoporosepatienten deutlich verbessert wird [Papapoulos, 2015]. Auch im Bereich der Krebstherapie haben die antiresorptiven Medikamente einen hohen Stellenwert. Diese werden sowohl zur Vorbeugung als auch in der Therapie bei Patienten mit Multiplem Myelom und soliden Tumoren mit Knochenmetastasierung (wie Mamma- und Prostatakarzinomen) eingesetzt [Stopeck, 2016]. In diesen Indikationsgebieten konnte für die antiresorptiven Medikamente eine Verminderung der Häufigkeit unerwünschter skelettaler Ereignisse (insbesondere pathologischer Frakturen), eine Schmerzreduktion und, unter bestimmten Umständen, sogar ein lebensverlängernder Effekt belegt werden [Dearnaley, 2009].
Grundsätzlich werden diese antiresorptiv wirksamen Medikamente sehr gut vertragen und ihre Anwendung gilt als nebenwirkungsarm. Jedoch haben sich zunächst die Bisphosphonat-assoziierten Kiefernekrosen seit den ersten gemeldeten Fällen im Jahr 2001 und den ersten Publikationen im Jahr 2003 zu einem ernsthaften klinischen Problem entwickelt [Marx, 2003]. In der vergangenen Dekade wurde auch zunehmend über Fälle von Kiefernekrosen unter Denosumab-Therapie berichtet [Ruggiero, 2014]. Dieser Umstand hat zu einer Veränderung der Definition und Nomenklatur sowie zur Bezeichnung als Antiresorptiva-assoziierte Kiefernekrose („antiresorptiva-related osteonecrosis of the jaw“: ARONJ) geführt.
Noch weiter gefasst ist die Begrifflichkeit nach der „American Association of Oral and Maxillofacial Surgeons“ (AAOMS), wonach die Medikamenten-assoziierte Kiefernekrose („medication-related osteonecrosis of the jaw“: MRONJ) weitere Medikamente, insbesondere die Gruppe der Angiogenesehemmer (als häufiger Vertreter: Bevazicumab, Avastin®) und Tyrosinkinaseinhibitoren (als häufiger Vertreter: Sunitinib, Sutent®), berücksichtigt. Auch für diese supportive onkologische Medikamentengruppe wurden ungewöhnliche entzündliche Zustände sowie Nekrosen im Kieferbereich beschrieben. Diese sind jedoch sehr viel seltener als die Antiresorptiva-assoziierten Kiefernekrosen [Sivolella, 2013].
Trotz der Nebenwirkung der Medikamenten-assoziierten Kiefernekrose handelt es sich bei den antiresorptiven Medikamenten um medizinisch sinnvolle Medikamente, welche die Lebensqualität und Lebenserwartung der Patienten deutlich steigern können. Die onkologischen sowie osteologischen Therapien müssen zunächst immer im Vordergrund stehen und es darf nicht das Ziel sein, die Anwendung der antiresorptiven Medikamente dem Patienten gegenüber infrage zu stellen. Es geht vielmehr darum, die nötigen prophylaktischen, präventiven und therapeutischen Maßnahmen abzuleiten und zu optimieren, um die Sicherheit der Verwendung der antiresorptiven Medikamente bezüglich ihres Nebenwirkungsspektrums zu verbessern.
Warum fast ausschließlich der Kieferknochen?
Ein wesentlicher Schlüssel zur Optimierung der klinischen Vorbeugung und Therapie der Medikamenten-assoziierten Kiefernekrose liegt im besseren Verständnis ihrer Pathogenese. Diese ist bis heute nicht vollständig geklärt und bleibt ein wichtiger Bestandteil der aktuellen wissenschaftlichen Diskussion. Zahlreiche potenzielle Entstehungsmechanismen werden weiterhin diskutiert, insbesondere
- eine übermäßige Unterdrückung des Kieferknochenumsatzes [Ristow, 2013; Ristow, 2014],
- eine veränderte Immunabwehr bei Infektion [Sedghizadeh, 2008],
- eine Ischämie bedingt durch antiangiogene Effekte [Hansen, 2006],
- eine direkte Gewebstoxizität [Sonis, 2004] sowie
- eine spezifische Infektion mit Aktinomyzeten [Panya, 2017].
Obwohl all diese Mechanismen eine Rolle im Rahmen der Pathogenese spielen könnten und es sich sehr wahrscheinlich um ein multifaktorielles Ereignis handelt, ist keine der genannten Theorien in der Lage, die wesentlichen mit der Erkrankung in Verbindung stehenden Fragestellungen endgültig zu klären. Insbesondere bleibt unklar, warum fast ausschließlich der Kieferknochen (es gibt Beschreibungen von seltenen Nekrosen im Ohr und im Hüftgelenk) betroffen ist, welche Rolle die potenziellen Risikofaktoren sowie sogenannten auslösenden Ereignisse spielen und warum das Problem vor allem nach der Einnahme stickstoffhaltiger Bisphosphonate sowie Denosumab in onkologischer Dosierung auftritt.
Eine Besonderheit des Kieferknochens im Vergleich zu allen anderen Knochen des Körpers ist der direkte Kontakt nach „außen“ über die Zähne. Während andere Knochen des Körpers meist von einem dicken Weichgewebsmantel geschützt werden, liegen dem Kieferknochen lediglich das Periost und eine dünne Schleimhautschicht auf. Dies hat zur Folge, dass der Kieferknochen möglicherweise schon nach kleinsten schleimhäutigen Verletzungen einer mikrobiellen Flora ausgesetzt ist.
In diesem Zusammenhang könnte die Pathogenesetheorie der durch dentogene Entzündungen getriggerten Nekroseentstehung erklären, warum die Medikamenten-assoziierte Kiefernekrose fast ausschließlich am Kieferknochen entsteht [Otto, 2010]. Es konnte nicht nur gezeigt werden, dass präventive dentale Maßnahmen, die darauf abzielen, chronische Entzündungen zu behandeln, signifikant die Inzidenz von Medikamenten-assoziierten Kiefernekrosen reduzieren [Poxleitner, 2017], sondern auch, dass eine begleitende antibiotische Behandlung und die lokale Desinfektion den Krankheitsfortschritt stoppen können [Hoefert, 2011]. Die Tatsache, dass dem Auftreten von Medikamenten-assoziierten Kiefernekrosen oft eine lokale Infektion vorangeht, gibt einen weiteren klinischen Hinweis auf die Rolle von vorausgegangenen Entzündungen [Saia, 2010].
Im Umkehrschluss kann mit der entzündungsabhängigen Pathogenesetheorie auch erklärt werden, warum in der Literatur als Entstehungsursachen einer Medikamenten-assoziierten Kiefernekrose meist lokal begrenzte Entzündungen am Kieferknochen genannt werden. Auslöser dafür könnten insbesondere die Gingivitis, Parodontitis und Dentitio difficillis [Nicolatou-Galitis, 2015; Wazzan, 2018] sein, aber auch unsachgemäß durchgeführte zahnärztlich chirurgische Eingriffe (Verzicht auf modellierende Osteotomie, Offenlassen der Alveole) sowie artifizielle Verletzungen der Mundschleimhaut (Prothesendruckstellen, scharfe Knochenkanten, Putzdefekte und Einbisse in die Mundschleimhaut) [Grötz, 2016].
Häufigkeitsraten und Risikoprofil
Sowohl in der Therapie der Osteoporose und in der Therapie der Krebserkrankungen mit Knochenmetastasierung als auch in der Behandlung des Multiplen Myeloms sind die antiresorptiven Medikamente fester Bestandteil der leitliniengerechten Therapie. Obendrein werden antiresorptive Medikamente zunehmend ab dem Moment der Erstdiagnose einer Krebserkrankung zur Vorbeugung skelettbezogener Komplikationen eingesetzt [Wagner-Johnston, 2015; Raje, 2018]. Demnach ist zu erwarten, dass mit immer neuen Indikationsstellungen und Zulassungen die Verordnungshäufigkeit der antiresorptiven Medikamente weiter zunehmen wird.
Grundsätzlich gilt: je länger eine antiresorptive Therapie andauert und je höher die Dosierung der antiresorptiven Medikamente ist, desto höher ist auch die Gefahr der Entwicklung einer Kiefernekrose. Durch eine verbesserte onkologische Therapie mit längeren Überlebenszeiten und einer generell längeren Lebenserwartung wird voraussichtlich zukünftig sowohl die Anzahl an Patienten, die antiresorptiv behandelt werden, als auch die antiresorptive Behandlungsdauer an sich weiter steigen.
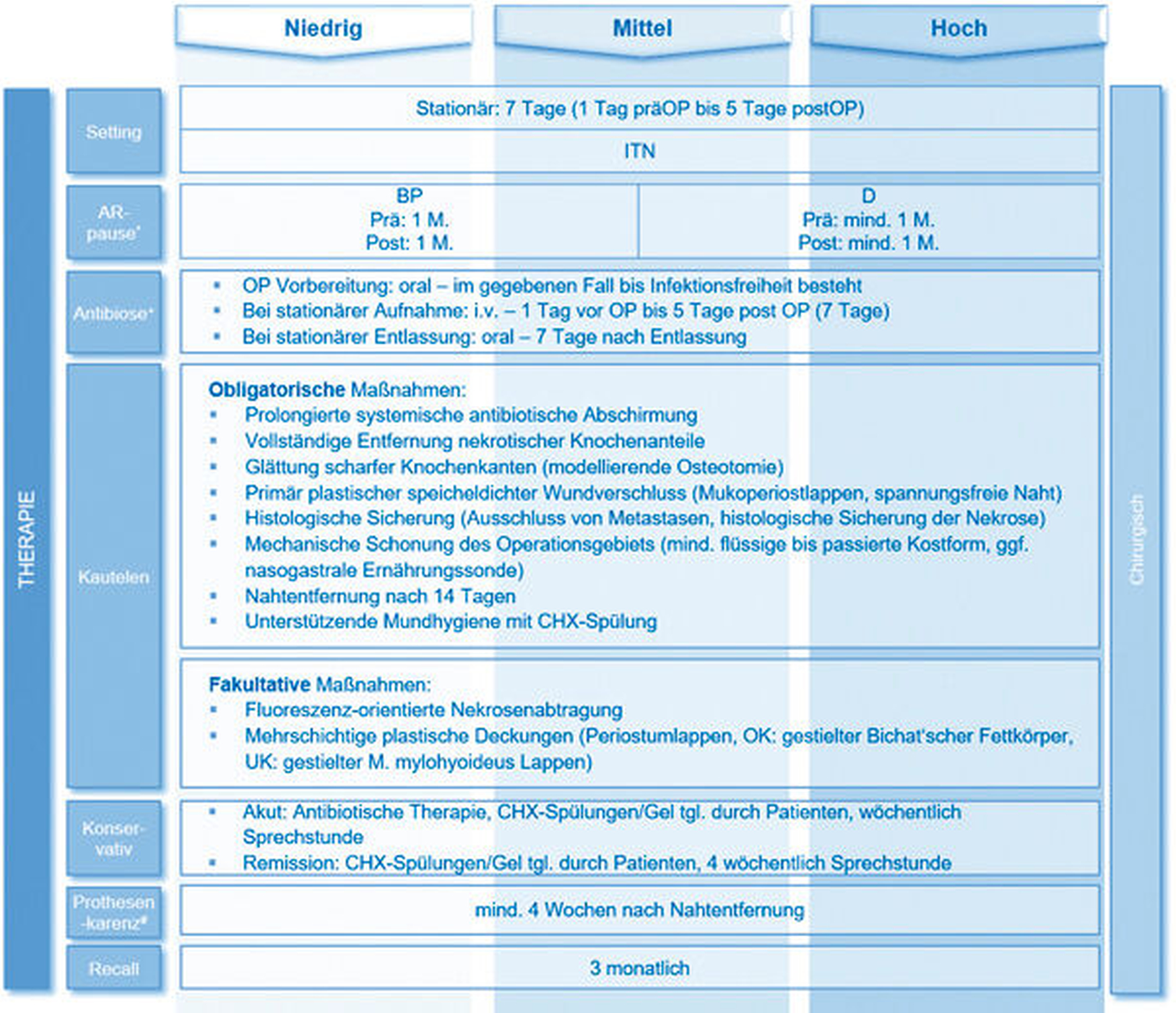
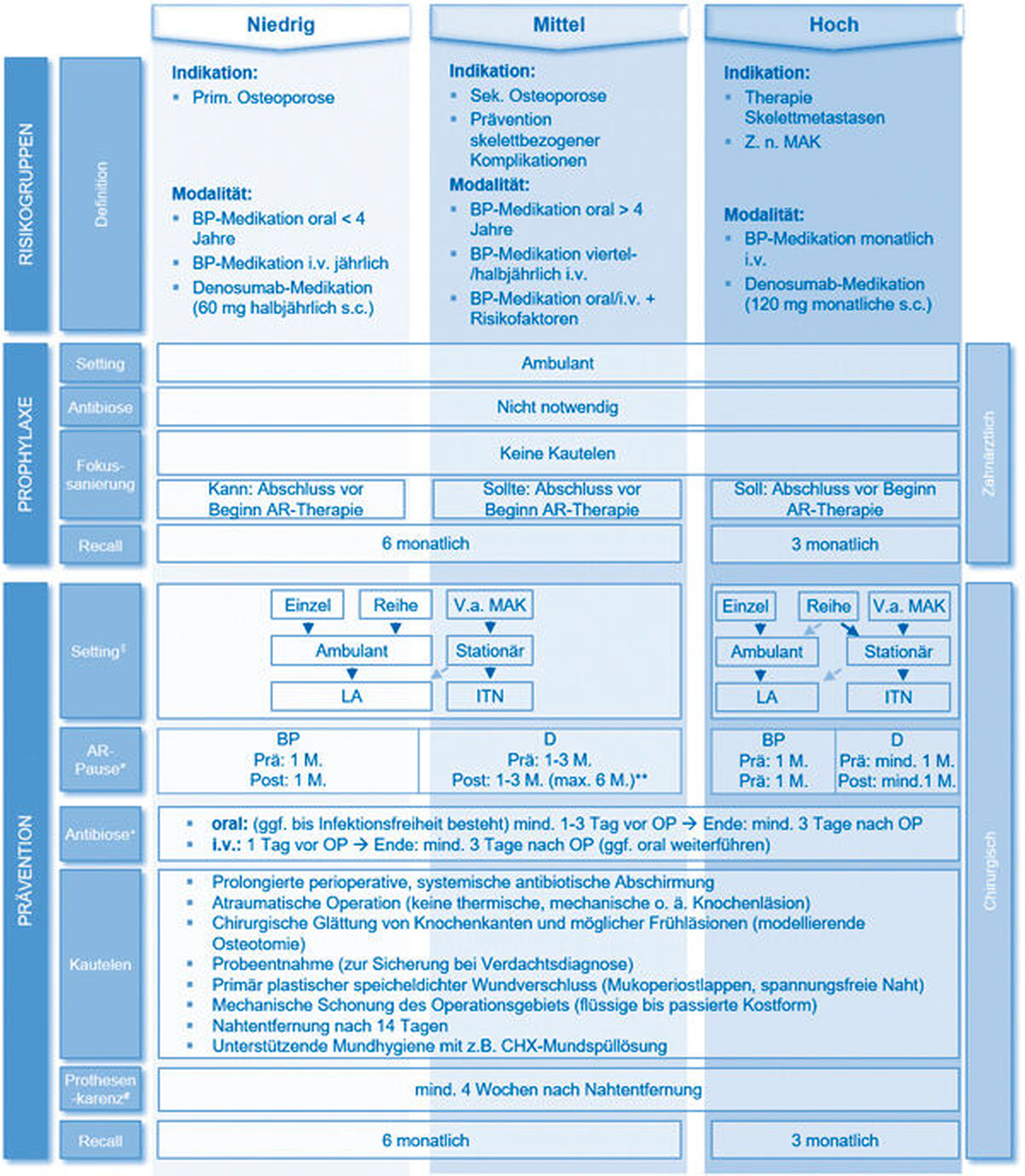
Um die richtigen Entscheidungen in der zahnärztlichen Behandlung zu treffen, ist es wichtig, eine Risikobewertung des Patienten vor, unter und nach antiresorptiver Therapie durchzuführen. Hier hat sich die Einteilung des Risikoprofils in die Kategorien „niedrig“, „mittel“ und „hoch“ etabliert. Zur niedrigen Risikogruppe gehören Patienten, die aufgrund einer primären Osteoporose antiresorptiv behandelt werden. Die Therapie mit Bisphosphonaten erfolgt entweder wöchentlich oral oder mit jährlichen Infusionen (Tabelle 1). Der Antikörper Denosumab wird in Form des Präparats Prolia® halbjährlich subkutan injiziert. Die Prävalenz von Medikamenten-assoziierten Kiefernekrosen im niedrigen Risikoprofil wird derzeit in der Literatur mit 0,01 bis 0,5 Prozent diskutiert [Lo, 2010; Hallmer, 2014]. Insbesondere bei Patienten, die über mehrere Jahre eine antiresorptive Behandlung verabreicht bekommen, steigt die Gefahr, eine Kiefernekrose zu entwickeln. So setzt sich das mittlere Risikoprofil zum einen aus Patienten zusammen, die orale Bisphosphonate länger als vier Jahre bekommen haben (Risikorate von circa 1,0 Prozent [Lo, 2010; Hallmer, 2014]), oder zusätzlich zu ihrer Einnahme weitere Risikofaktoren (Co-Medikation zum Beispiel mit Rheumamedikamenten, Kortison) aufweisen. Des Weiteren zählen zur mittleren Risikogruppe alle Patienten, die zur Vorbeugung skelettbezogener Komplikationen bei Tumorleiden antiresorptiv behandelt werden (zum Beispiel Brust- und Prostatakrebs ohne Metastasierung). Die Therapie mit Bisphosphonaten erfolgt entweder halb- oder vierteljährlich mit Infusionen (Risikoraten bis zu 10 Prozent werden kritisch diskutiert) [Smith, 2013; Rugani, 2014; Wagner-Johnston, 2015]. Zum hohen Risikoprofil gehören Patienten, die aufgrund von Knochenmetastasen oder einem Multiplen Myelom vierwöchentlich mit Bisphosphonaten (intravenös) oder mit Denosumab (subkutan, Präparat: XGEVA®) antiresorptiv behandelt werden. Die Auftretenswahrscheinlichkeit ist durch die häufigere und höhere Dosierung deutlich höher als bei der niedrigen und mittleren Risikogruppe und wird in der Literatur mit Werten von 3 bis 20 Prozent angegeben [Walter, 2010; Saad, 2012; Raje, 2018].
Zur patientenindividuellen Risikobewertung dient ein Algorithmus, der auf der Grundlage einer guten Anamnese basiert. Grunderkrankung, Applikationsform, Häufigkeit und Dauer der antiresorptiven Therapie sowie mögliche kompromittierende Begleiterkrankungen und/oder Medikamente geben direkten Aufschluss über das Risiko, an der Medikamenten-assoziierten Kiefernekrose zu erkranken. Die Zusammensetzung der Risikogruppen nach einem Abhandlungsalgorithmus ist in Tabelle 3 dargestellt.
Um das individuelle Risikoprofil von Patienten unter antiresorptiver Therapie einfach zu evaluieren und den interdisziplinären Austausch und die Achtsamkeit der Patienten zu steigern, kann der ASORS-Laufzettel verwendet werden (http://www.onkosupport.de/asors). Eine regelmäßige Aktualisierung der Medikamentenanamnese ist insbesondere bei älteren Patienten obligat. Obwohl sich die Kenntnis um die unerwünschte Nebenwirkung in den vergangenen 15 Jahren deutlich gewandelt hat, werden noch nicht alle Patienten routinemäßig über die Notwendigkeit einer zahnärztlichen Untersuchung vor Therapiebeginn aufgeklärt. Aus eigener Erfahrung ist hier vor allem hervorzuheben, dass Patienten mit niedrigem Risikoprofil oftmals einen größeren Nachholbedarf haben.
Definition und Klassifikation
Nach der 2014 überarbeiteten und noch immer gültigen Definition der AAOMS [Ruggiero, 2014] wird eine Medikamenten-assoziierte Kiefernekrose definiert als:
- über mehr als acht Wochen exponierter oder sondierbarer nekrotischer Knochen,
- bei aktueller oder früherer Einnahme von antiresorptiven Medikamenten
- und bei Abwesenheit einer Bestrahlung oder einer offensichtlichen Metastasierung im Kopf-Hals-Bereich.
Diese „Amerikanische Definition“ tritt zunehmend in den Fokus wissenschaftlicher Diskussionen. Das liegt unter anderem an zwei Dingen: erstens die fehlende Berücksichtigung einer histologischen Sicherung der Medikamenten-assoziierten Kiefernekrose in der Definition und zweitens die immer mehr in den Vordergrund tretenden frühen nekrotischen Läsionen der Erkrankung, bei denen es noch keinen freiliegenden Knochen gibt, aber Symptome und gegebenenfalls radiologische Zeichen auf eine Medikamenten-assoziierte Kiefernekrose hinweisen. Die Abgrenzung früher nekrotischer Läsionen, vor allem zu Differenzialdiagnosen wie periapikalen Infektionen und Paradontitiden, bleibt eine Herausforderung und muss in zukünftigen wissenschaftlichen Ansätzen bearbeitet werden [Thumbigere-Math, 2014; Rao, 2017].
Die gleichzeitig mit der Definition ins Leben gerufene AAOMS-Klassifikation der Medikamenten-assoziierten Kiefernekrose wurde anfangs von den meisten Fachgesellschaften übernommen, in den vergangenen Jahren aber zunehmend kontrovers diskutiert [Grötz, 2012; Khan, 2015; Yoneda, 2017]. Stadieneinteilungen sollten die Schwere beziehungsweise das Ausmaß einer Erkrankung abbilden, daraus abgeleitet evidenzbasierte Therapieempfehlungen geben und Informationen über die Prognose einer Erkrankung ermöglichen. Hinsichtlich der Therapieempfehlungen der AAOMS stellt sich das Problem, dass frühe Stadien keine therapeutische Konsequenz für die Nekrose haben und meist eine symptomatische Behandlung nach sich ziehen. Der Übergang zwischen dem frühen und dem mittleren Stadium ist hingegen fließend und kann mittels forcierter antibiotischer Therapie und topischer antibakterieller Behandlung beeinflusst werden. Es besteht das Risiko der asymptomatischen Progredienz des nekrotischen Knochens. Erst in den fortgeschrittenen Stadien wird von der AAOMS ein operatives Vorgehen vorgesehen, welches dann meist ausgedehnte Eingriffe erfordert und mit einer schlechteren Prognose einhergeht [Ruggiero, 2015; Ristow, 2018]. Ein weiterer wichtiger Diskussionspunkt ist, dass weder die Lokalisation noch die Größe einer Kiefernekrose Berücksichtigung im Staging (und der daraus gefolgerten therapeutischen Konsequenz) finden und dass diese Einteilung größtenteils auf klinischen sowie inspektorischen Untersuchungen basiert. So werden auch radiologische Untersuchungen nicht zur Stadieneinteilung herangezogen. Dies führt zwangsläufig dazu, dass mittels der klinischen Untersuchung die wahre Ausdehnung der Medikamenten-assoziierten Kiefernekrose nicht erfasst werden kann und in einem Großteil der Fälle unterschätzt wird [Bedogni, 2014]. Denn das, was man von der Nekrose sieht, nämlich der schleimhäutige Defekt, ist häufig nur die Spitze des Eisbergs. CT-gestützte Untersuchungen postulieren, dass durch die AAOMS-Klassifikation in etwa jeder dritte Patient falsch klassifiziert beziehungsweise in diesen Fällen das Ausmaß der Erkrankung durch die Klassifikation falsch eingeschätzt wird [Fedele, 2015]. So überrascht es nicht, dass mittlerweile viele Arbeitsgruppen Versuche unternommen haben, die Einteilung der Medikamenten-assoziierten Kiefernekrose und die daraus abgeleiteten Therapieempfehlungen neu zu definieren.
Leitsymptom und Diagnostik
Stand heute ist aber die gründliche intraorale Inspektion noch immer der Goldstandard zur frühzeitigen Identifikation der Nekrose. Das Leitsymptom einer Medikamenten-assoziierten Kiefernekrose ist demnach der inspektorisch oder sondenpalpatorisch freiliegende Knochen [Grötz, 2012; Ruggiero, 2014]. Hierbei ist anzumerken, dass im frühen Stadium intraorale Fisteln vorliegen können, was – in Anbetracht der oben genannten Diskussion – dem inspektorisch freiliegenden Knochen gleichzusetzen ist [Grötz, 2016]. Weitere häufige Symptome sind Mundgeruch, Weichgewebsschwellungen, intra- oder extraorale Fisteln sowie Abszedierungen. Möglich sind auch eine Schädigung der Nervenfunktion (vor allem des Nervus alveolaris inferior), eine Sinusitis [Voss, 2016] sowie pathologische Frakturen des Unterkiefers [Otto, 2009]. Zusätzlich treten in vielen Fällen ausgeprägte Schmerzen auf. Diese sind jedoch kein direktes Symptom, sondern vielmehr die Konsequenz einer stattfindenden (Super-) Infektion der Nekrose [Grötz, 2016].

Das inspektable Erscheinungsbild variiert stark von kleinen sondierbaren Fistelungen bis zu großflächigen Mundschleimhautdefekten. Bei bereits freiliegendem Knochen, stellt sich dieser meist als gelblich, gräulich bis hin zu grünlich verfärbt (mit vergrößerter Porosität) und häufig aufgeweichter Struktur dar. Möglich sind ebenfalls eitriger Ausfluss (auf der Basis einer Superinfektion) und in manchen Fällen gelockerte Knochenanteile im Sinne eines Knochen-Sequesters.
Auch die bildgebende Diagnostik ist derzeit Bestandteil der nationalen wie internationalen wissenschaftlichen Diskussion. Dies liegt vor allem daran, dass in Röntgenbildern pathologische Veränderungen vollständig fehlen können und es bis dato, bis auf die „persistierenden Alveolen“, keine pathognomonische radiologische Befundkonstellation für die Erkrankung gibt. Das Orthopantomogramm jedoch hat sich als Standard für den ersten Überblick und zur Abschätzung des Krankheitsausmaßes durchgesetzt [Otto, 2018]. Zur Planung eines operativen Prozedere empfiehlt sich die Ergänzung einer dreidimensionalen Modalität, um das Ausmaß der Nekrose besser einordnen zu können. Hier zeigt, bei derzeitiger Datenlage, die digitale Volumentomografie gegenüber anderen Modalitäten (wie Magnetresonanztomografie, Positronenemissionstomografie) bessere Ergebnisse [Guggenberger, 2013].
Mit den immer weiter in den Vordergrund rückenden frühen nekrotischen Läsionen (ohne freiliegenden Knochen) bekommt die Diskussion um bildgebende Verfahren für die Primärdiagnostik neuen Fahrtwind. Hier scheint vor allem die dreidimensionale knöcherne Darstellung (zum Beispiel mittels DVT) einen Vorteil zu bringen [Soundia, 2018].
Bei manifester Medikamenten-assoziierter Kiefernekrose sind häufig sklerotische Veränderungen des betroffenen Kieferareals, Verdickungen der Unterkieferkortikalis beziehungsweise der Kieferhöhlenschleimhaut und Periostanlagerungen, aber auch Erosionen, Radioluzenzen und Sequestrierungen darstellbar. Hier sei zu erwähnen, dass vor allem die sklerotischen Veränderungen einer Latenzzeit unterliegen und meist das betroffene Areal „als reaktiver Schutzmechanismus“ ummanteln. Vorsicht ist geboten, um die sklerotischen Areale nicht mit dem Ausmaß der Nekrose gleichzusetzen und daraus abgeleitet falsche Schlüsse für eine Therapieplanung zu ziehen.
Die intraoperative Entnahme von Gewebe bei einer manifesten nekrotischen Läsion zur histologischen Untersuchung ist als obligat anzusehen. Hierdurch kann einerseits der wichtige Ausschluss eines malignen Geschehens (im Sinne einer Metastasierung der Grunderkrankung) erfolgen, zum anderen die Diagnose der Medikamenten-assoziierten Kiefernekrose histologisch untermauert werden [Grötz, 2012]. Auch im Zuge der präventiven Zahnextraktion wird eine histologische Untersuchung diskutiert. Aktuelle wissenschaftliche Untersuchungen haben gezeigt, dass bei einem Großteil der präventiv durchgeführten Zahnextraktionen/ zahnärztlich chirurgischen Eingriffe bereits nekrotische Frühläsionen nachgewiesen werden können [Saia, 2010; Otto, 2015].
Vermeidung einer Kiefernekrose
Wie durch die noch aktuelle, sich derzeit aber in Überarbeitung befindliche S3-Leitlinie „Bisphosphonat-assoziierte Kiefernekrosen“ definiert [Grötz, 2012] (neuer Titel nach Überarbeitung: S3-Leitlinie Antiresorptiva-assoziierte Kiefernekrosen), hat man sich zum besseren Verständnis, zur Vereinheitlichung der Nomenklatur und um Missverständnisse in der Behandlung vorzubeugen auf zwei Zeitfenster geeinigt:
1. Prophylaxe – vor Beginn einer antiresorptiven Therapie
2. Prävention – unter laufender und/oder nach antiresorptiver Therapie.
Bezug nehmend auf die Infektionsabhängigkeit in der Pathogenese der Medikamenten-assoziierten Kiefernekrose leiten sich sämtliche vorbeugenden Maßnahmen zur Vermeidung und Entfernung von Infektionen und möglichen Keimeintrittspforten im Kiefer ab [Saia, 2010; Otto, 2015].
Dem niedergelassenen Zahnarzt kommt daher bei der Behandlung von Patienten unter antiresorptiver Therapie eine zentrale Rolle zu. Dessen Aufgabe sollte es sein, Infektionsherde frühzeitig zu identifizieren und diese möglichst zu verhindern. Außerdem entscheidet der Zahnarzt, ob eine Erhaltungswürdigkeit etwaiger Zähne gegeben ist. Es empfiehlt sich rechtzeitig eine interdisziplinäre Abstimmung, um das Risiko der Entstehung einer Medikamenten-assoziierten Kiefernekrose gemeinsam zu minimieren. Herausforderung hierbei ist es, vor allem patientenspezifisch und risikoadaptiert abzuwägen, da es zu konservierenden, prothetischen, endodontischen oder parodontalen Behandlungsmaßnahmen in der Literatur kaum belastbare Daten mit hoher Evidenz gibt.
Prophylaxe
Der positive Effekt von prophylaktischen therapeutischen Maßnahmen vor Beginn einer antiresorptiven Therapie konnte schon früh gezeigt werden [Ripamonti, 2009] und hat sich über die vergangenen Jahre in einer Vielzahl von Arbeiten weiter bestätigt [Papapoulos, 2015]. Alle Patienten müssen über das Risiko zur Entstehung einer Medikamenten-assoziierten Kiefernekrose unterrichtet werden und eine zahnärztliche Vorstellung soll durch den Verordnenden der antiresorptiven Medikamente initialisiert werden (interdisziplinäre Kommunikation zum Beispiel durch ASORS-Laufzettel). Durch den Zahnarzt soll dann eine Fokussuche, prothetische Anpassung und Sanierung von möglichen Bakterieneintrittspforten und Infektionen begonnen werden. Außerdem sollten eine Empfehlung zur Inanspruchnahme von professionellen Mundhygienemaßnahmen und eine Unterweisung zur Verbesserung der häuslichen Mundhygiene erfolgen. Da der Patient im eigentlichen Sinne noch kein erhöhtes Risiko für die Entstehung einer Medikamenten-assoziierten Kiefernekrose hat, sind für sämtliche notwendigen Sanierungen keine spezifischen Schutzmaßnahmen empfohlen (zur Hilfestellung ist ein algorithmischer Ablaufplan zur Prophylaxe in Tabelle 3 dargestellt). Je nach individuellem Risikoprofil sollen die prophylaktischen Maßnahmen möglichst vor Beginn der Therapie mit den antiresorptiven Medikamenten abgeschlossen sein. Dies sollte jedoch patientenspezifisch nach Grunderkrankung, Allgemeinzustand und nach Rücksprache mit dem Verordnenden der antiresorptiven Medikamente erfolgen.
Dringlich notwendige onkologische Therapien dürfen nicht für eine langwierige erhaltende zahnärztliche Therapie aufgeschoben werden.
Zuletzt sollen alle Patienten darüber informiert werden, dass unter laufender oder nach durchgeführter antiresorptiver Therapie, je nach Risikoprofil, regelmäßige vorbeugende Verlaufskontrollen notwendig werden.
Im Gegensatz zu den Osteoporosepatienten, die mit oralen Bisphosphonaten behandelt werden, scheinen Patienten, die mit Denosumab therapiert werden, ab der ersten Injektion ein erhöhtes Risiko zu Entstehung einer Medikamenten-assoziierten Kiefernekrose zu haben [Matsumoto, 2017]. Ein Abschluss der prophylaktischen Maßnahmen ist daher, wenn möglich, vor Erstgabe anzustreben.
Prävention
Im Zeitfenster der Prävention bedarf es laut momentaner Datenlage in der konservativen und prothetischen Zahnheilkunde, sofern die bedeckenden Schleimhäute nicht verletzt werden und der Knochen unangetastet bleibt, keiner besonderen Maßnahmen. Hinsichtlich der endodontischen oder parodontologischen Therapie von Patienten unter antiresorptiver Therapie ist derzeit nicht genügend Evidenz vorhanden, die eine klare Behandlungsempfehlung zulässt. Klar scheint jedoch zu sein, dass parodontale oder periapikale Entzündungen einen Risikofaktor darstellen, sodass Medikamenten-assoziierte Kiefernekrosen bei davon betroffenen Patienten vermehrt auftreten können [Thumbigere-Math, 2014; Nicolatou-Galitis, 2015; Rao, 2017; Wazzan, 2018]. Bis es mehr belastbare Daten gibt, sollte in solchen Fällen gemeinsam in interdisziplinärer Abstimmung und patientenorientiert ein Behandlungskonzept festgelegt werden.
Hingegen sollten sämtliche chirurgisch durchzuführenden oder sanierenden Maßnahmen, bei denen es zu einer Verletzung der Knochen und der bedeckenden Schleimhäute kommt, unter Einhaltung bestimmter Kautelen erfolgen. Lange wurde vermutet, dass Zahnextraktionen das Auslösen der Medikamenten-assoziierten Kiefernekrose provozieren. Jedoch wurde über die Jahre immer klarer, dass nicht die Zahnextraktion selbst der auslösende Faktor ist (wenn man sich an die vorgegebenen Kautelen hält), sondern vielmehr die zur Zahnextraktion führende lokale Infektion. Darüber hinaus postulieren aktuelle Studien, dass ein signifikanter Anteil der Patienten zum Zeitpunkt des operativen Eingriffs bereits osteonekrotische Veränderungen der Knochenarchitektur aufweisen könnte, daher sollte zum Zeitpunkt der präventiven Zahnextraktion [Saia, 2010; Otto, 2015] eine Probeentnahme zur möglichen Diagnosesicherung erfolgen. Aktuelle Studien zeigen, dass Zahnextraktionen, selbst bei Hochrisikopatienten unter antiresorptiver Therapie, sicher durchgeführt werden können, wenn bestimmte Kautelen eingehalten werden (Details siehe Tabelle 3) [Saia, 2010; Mozzati, 2013; Otto, 2015; Matsumoto, 2017]. Daher muss es das Ziel sein, unter laufender oder nach antiresorptiver Therapie Infektionsherde und mögliche Keimeintrittspforten im Kieferbereich zeitnah zu beseitigen und notwendige chirurgische Maßnahmen nicht zu unterlassen.
Es ist bekannt, dass der Knochen vor allem in den endständigen Gebieten („der letzten Wiese“) in seinem natürlichen Remodelling geschwächt ist. Dieser Effekt ist um ein Vielfaches potenziert, wenn der Patient zusätzlich unter oder nach antiresorptiver Therapie steht. Um dem Knochen keine Prädilektionsstelle für eine Kiefernekrose zu bieten, hat sich ein modellierendes Abtragen sämtlicher endständiger Knochenteile und Kanten nach der Zahnextraktion als vorteilhaft erwiesen. Außerdem ist bekannt, dass die sichere und speicheldichte schleimhäutige Abdeckung des Extraktionsgebiets von entscheidender Wichtigkeit ist, um das Risiko einer möglichen bakteriellen Besiedlung zu minimieren. Um diese meist sensible, schleimhäutige Deckung adäquat zu gewährleisten, sollte, nachdem mechanische Störfaktoren wie spitze Knochenkanten entfernt wurden, eine stabile mukoperiostale plastische Deckung erfolgen. Noch in der aktuellen Diskussion steht die Fragestellung, ob dieses Vorgehen für alle Risikogruppen gleich anzusehen ist. Hierbei besteht weiterer studieninterventioneller Klärungsbedarf. Um die Keimbelastung im betroffenen, bereits reduzierten Areal so niedrig wie möglich zu halten, ist eine prolongierte antibiotische Abschirmung obligat [Montefusco, 2008]. Je mehr Infektionstherapie notwendig ist, umso länger ist die Vor- und Nachlaufzeit. Belastbare Daten hinsichtlich der Dauer der antibiotischen Therapie vor und nach der Operation gibt es bis dato wenig. Um aber eine suffiziente Anreicherung des Antibiotikums im betroffenen Gewebe und dem Knochen zu erreichen, soll mindestens ein Tag vor dem Eingriff begonnen werden – „Single-shot Applikationen“ sind zu vermeiden.
Die Frage, ob eine Unterbrechung der antiresorptiven Therapie („drug holiday“) die Ereignisraten zur Entstehung einer manifesten Nekrose verringert, konnte bis heute nicht zufriedenstellend beantwortet werden. Jedoch lässt die Pharmakokinetik und die kurze Halbwertszeit von Denosumab eine etwaige Diskussion offen. Auch bei den Bisphosphonatpräparaten wird, trotz der langen Halbwertszeit, eine Medikamentenunterbrechung positiv diskutiert [Hasegawa, 2017]. Die Entscheidung zur Therapieunterbrechung sollte aber immer interdisziplinär in Rücksprache mit den onkologisch und osteologisch behandelnden Ärzten getroffen werden. Über die oben genannten prophylaktischen sowie präventiven Empfehlungen hinaus, sind vor allem regelmäßige Verlaufskontrollen hinsichtlich der Vermeidung von Infektionsherden und möglichen Keimeintrittspforten sowie, falls notwendig, deren zeitnahe Entfernung als empfohlen anzusehen [Goodday, 2015; Poxleitner, 2017].
Implantologie
An die Prävention, im Sinne einer chirurgischen Sanierung des Gebisses, schließt sich notwendigerweise die kaufunktionelle, prothetische Rehabilitation des Patienten an. Hierbei bewegt man sich in einem Spannungsfeld zwischen tegumental-, parodontal- oder implantatgetragenem Zahnersatz. Erneut muss es das Ziel einer prothetischen Rehabilitation des Patienten sein, das zukünftige Risiko zur Entstehung einer Medikamenten-assoziierten Kiefernekrose so gering wie möglich zu halten und den Patienten ohne Einschränkung der Lebensqualität zu versorgen.
Die Fachliteratur ist sich hinsichtlich der Implantatinsertion als auslösenden Faktor für eine Medikamenten-assoziierte Kiefernekrose uneinig [de-Freitas, 2016; Walter, 2016]. Klar ist allerdings, dass entzündliche Prozesse, wie eine Periimplantitis, eine Kiefernekrose induzieren können [Giovannacci, 2016; Troeltzsch, 2016]. Alternativ zur implantatgetragenen Versorgung besteht die Möglichkeit von rein tegumental oder kombiniert parodontal-tegumental abgestütztem Zahnersatz. Die hierbei jedoch vielfach auftretenden Prothesendruckstellen können bewiesenermaßen selbst eine Nekrose induzieren [Hasegawa, 2012; Niibe, 2015]. Hingegen können durch Implantatinsertion zum Zweck einer Pfeilervermehrung Druckstellen oder eine tegumentale Abstützung vollständig vermieden werden. Auf diese Weise kann das Risiko einer durch eine Druckstelle induzierten Nekrose reduziert werden – bei andauerndem Implantationsrisiko.
Die aktuelle S3-Leitlinie „Zahnimplantate bei medikamentöser Behandlung mit Knochenantiresorptiva“ aus dem Jahr 2016 zeigt dieses Spannungsfeld auf. Die Leitlinie empfiehlt bei Patienten mit Indikation zur Implantation eine genaue Evaluation des patientenspezifischen Risikos. Hierfür wurde im Auftrag der Deutschen Gesellschaft für Implantologie im Zahn-, Mund- und Kieferbereich e. V. (DGI) der „Laufzettel Risiko-Evaluation bei antiresorptiver Therapie vor Implantation“ entwickelt (https://www.dginet.de/web/dgi/laufzettel-bisphosphonate). Dieser erlaubt, basierend auf fünf Kriterien, eine orientierende Einteilung des Osteonekroserisikos in drei Grade (niedrig bis hoch). Daneben sollte auch die Mundhygiene des Patienten und damit die künftig zu erwartende periimplantäre Hygiene mitbedacht werden. Auf der Basis des zugehörigen systematischen Reviews [Walter, 2016] zeigt sich für Patienten mit niedrigem Risikoprofil, dass die Gefahr der Auslösung einer Nekrose durch implantologische Maßnahmen eher gering ist. Hingegen kann bei hohem und mittlerem Risikoprofil eine Empfehlung nicht gegeben werden (hierzu gibt es auch so gut wie keine Daten). Im Vorfeld einer Implantation sollte stets eine vollständige Sanierung von potenziellen Infektionsherden erfolgen. Im Falle einer chirurgischen Sanierung liefern die postoperative Wundheilung ebenso wie röntgenologische Verlaufskontrollen (beispielsweise röntgenologische Ossifikation oder Persistieren einer Alveole) wertvolle Informationen zum individuellen Grad der Kompromittierung der Weichgewebsheilung sowie der Knochenneubildungsrate, welche ebenfalls in eine Risikoevaluation mit einbezogen werden sollten. Hinsichtlich des chirurgischen Vorgehens sollten Implantatinsertionen dem Zeitfenster der Prävention zugeordnet werden und somit nach denselben Kautelen erfolgen (siehe Tabelle 3). Augmentative Verfahren sind für alle Risikogruppen kritisch zu betrachten und sollten angesichts der schwachen Datenlage (wenn überhaupt) einer strengen Indikationsabwägung unterliegen. Vor allem aber für die hohen Risikogruppen sind diese nicht zu empfehlen. Auch die Implantation in bereits ausgeheilte Regionen Medikamenten-assoziierter Kiefernekrosen sollte erfahrungsgemäß vermieden werden.
Therapie
Bei einer verspäteten Diagnose oder Behandlung kann die Medikamenten-assoziierte Kiefernekrose einen komplikationsträchtigen und behandlungsintensiven Verlauf zeigen [Ruggiero, 2015; Ristow, 2018]. So besteht insbesondere die Gefahr, dass es bei betroffenen Patienten zu einem großvolumigen Verlust von Kieferabschnitten kommen kann [Fliefel, 2015; Ristow, 2015]. Deshalb sollte die Therapie der diagnostizierten Erkrankung aus unserer Sicht keinesfalls aufgeschoben werden.
Jedoch besteht hinsichtlich der Behandlung der Medikamenten-assoziierten Kiefernekrosen seit Jahren eine kontrovers geführte Diskussion [Grötz, 2012; Ruggiero, 2014; Khan, 2015; Yoneda, 2017]. Vor allem im Hinblick auf die Behandlung früher nekrotischer Veränderungen herrscht Uneinigkeit. Grundsätzlich wird in der Literatur zwischen konservativer (nicht-chirurgischer) und operativer (chirurgischer) Therapie unterschieden. Die konservative Therapie manifester Medikamenten-assoziierter Kiefernekrosen umfasst engmaschige ambulante Verlaufskontrollen, zum Teil langwierige systemische antibiotische Anwendungen und lokal desinfizierende Maßnahmen. Zwar können diese konservativen Behandlungsmaßnahmen zu einer Besserung der Krankheitssymptome führen, jedoch kommt es bei einem großen Teil der Fälle zu keiner kompletten schleimhäutigen Abheilung [Hoff, 2008; Nicolatou-Galitis, 2011; Fliefel, 2015]. Darüber hinaus besteht das Risiko der asymptomatischen Progredienz der Nekrose unter der geschlossenen Schleimhautdecke [Ristow, 2017]. Die erhebliche Dauer der Behandlung sowie das meist damit verbundene Pausieren der notwendigen antiresorptiven und onkologischen Therapien müssen in die Gesamtrisikobetrachtung miteinbezogen werden. Des Weiteren ist eine prothetische Versorgung bei nicht ausgeheilter Medikamenten-assoziierter Kiefernekrose nur erschwert möglich, was nicht zuletzt einen nachgewiesenen Einfluss auf die patientenbezogene Lebensqualität hat [Kyrgidis, 2012].
Letztendlich kann die konservative Therapie ausschließlich als Alternative für den (dem onkologischen oder Allgemeinzustand geschuldeten) stark reduzierten Patienten angezeigt oder dem ausdrücklichen Wunsch des Patienten vorbehalten sein. Dann muss die konsequente konservative Therapie als Mittel zur Besserung von Symptomen, nicht aber als Alternative zur chirurgischen Therapie gesehen werden [Grötz, 2012; Grötz, 2016]. Eine strenge interdisziplinäre Absprache zwischen den Verordner der antiresorptiven Medikamente und dem Mund-, Kiefer- und Gesichtschirurgen ist obligat.
Um die dringend notwendige onkologische beziehungsweise osteologische Therapie weiterführen zu können, sowie eine zeitnahe prothetische Rehabilitation zu ermöglichen, sollte das primäre Ziel der Behandlung die vollständige, rasche, schleimhäutige Abheilung und Beschwerdefreiheit des Patienten sein. Klinische Studien zum Therapieerfolg der chirurgischen Therapie zeigen konstant hohe schleimhäutige Abheilungsraten von über 90 Prozent, wenn man sich an die vorgegebenen Kautelen hält (Tabelle 3) [Bedogni, 2011; Otto, 2016; Ristow, 2017; Schiodt, 2018]. Außerdem ist die chirurgische Therapie die einzige Möglichkeit, den nekrotischen Knochen vollständig zu entfernen. Je früher diese Therapie erfolgt, umso geringer ist der Verlust an Knochen, was sich wiederum positiv auf eine spätere prothetische Versorgung auswirkt [Otto, 2016; Ristow, 2018]. Auch vergleichende Fallserien und systematische Übersichtsarbeiten bestätigen die Überlegenheit der chirurgischen Therapie im Vergleich zu konservativen Therapiekonzepten [Rupel, 2014; Fliefel, 2015; El-Rabbany, 2017]. Daher besteht derzeit in Deutschland der Konsens (unter Einbezug des Allgemeinzustands des Patienten und nach osteologisch/ onkologischer Rücksprache) zur frühzeitigen und konsequenten operativen Therapie, die letztlich zur Vermeidung größerer knöcherner Defekte beiträgt [Ristow, 2015; Grötz, 2016; Otto, 2016].
Fazit
Antiresorptive Medikamente steigern die Lebensqualität und Lebenserwartung von Patienten mit Osteoporose oder mit skelettal-metastasierenden malignen Grunderkrankungen.
Die Medikamenten-assoziierte Kiefernekrose stellt eine Herausforderung in der Prophylaxe, Prävention, Früherkennung und Therapie dar.
Eine gute Anamnese sowie der interdisziplinäre Austausch zwischen dem Verordner der antiresorptiven Medikamente, dem Zahnarzt und dem MKG-Chirurgen vermeiden unnötige Risiken.
Eine patientenspezifische Risikobewertung ist vor jeder Behandlung obligat und minimiert das Risiko zur Entstehung einer manifesten Medikamenten-assoziierten Kiefernekrose.
Ziel der Prophylaxe ist, das künftige Risiko für eine Medikamenten-assoziierte Kiefernekrose so gering wie möglich zu halten.
Sämtliche dentoalveolär-chirurgischen Eingriffe unter laufender und/oder nach antiresorptiver Therapie müssen unter Einhalt bestimmter Kautelen durchgeführt werden.
Eine frühzeitige und konsequente operative Therapie trägt zur Vermeidung größerer knöcherner Defekte, der schnellen Wiederaufnahme notwendiger onkologischer/osteologischer Therapien sowie einer raschen prothetischen Rehabilitation bei.
Dr. Dr. Oliver Ristow
Dr. Thomas Rückschloß
Prof. Dr. Dr. Jürgen Hoffmann
Prof. Dr. Dr. Christian Freudlsperger
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Universitätsklinikum Heidelberg
Im Neuenheimer Feld 400
69120 Heidelberg
oliver.ristow@med.uni-heidelberg.de
Literaturliste
Bedogni, A., S. Fedele, et al. (2014). „Staging of osteonecrosis of the jaw requires computed tomography for accurate definition of the extent of bony disease.“ Br J Oral Maxillofac Surg.
Bedogni, A., G. Saia, et al. (2011). „Long-term outcomes of surgical resection of the jaws in cancer patients with bisphosphonate-related osteonecrosis.“ Oral Oncol 47(5): 420-424.
de-Freitas, N. R., L. B. Lima, et al. (2016). „Bisphosphonate treatment and dental implants: A systematic review.“ Medicina Oral Patología Oral y Cirugia Bucal: 0.
Dearnaley, D. P., M. D. Mason, et al. (2009). „Adjuvant therapy with oral sodium clodronate in locally advanced and metastatic prostate cancer: long-term overall survival results from the MRC PR04 and PR05 randomised controlled trials.“ Lancet Oncol 10(9): 872-876.
El-Rabbany, M., A. Sgro, et al. (2017). „Effectiveness of treatments for medication-related osteonecrosis of the jaw: A systematic review and meta-analysis.“ J Am Dent Assoc 148(8): 584-594 e582.
Fedele, S., G. Bedogni, et al. (2015). „Up to a quarter of patients with osteonecrosis of the jaw associated with antiresorptive agents remain undiagnosed.“ Br J Oral Maxillofac Surg 53(1): 13-17.
Fliefel, R., M. Troltzsch, et al. (2015). „Treatment strategies and outcomes of bisphosphonate-related osteonecrosis of the jaw (BRONJ) with characterization of patients: a systematic review.“ Int J Oral Maxillofac Surg 44(5): 568-585.
Giovannacci, I., M. Meleti, et al. (2016). „Medication-Related Osteonecrosis of the Jaw Around Dental Implants: Implant Surgery-Triggered or Implant Presence-Triggered Osteonecrosis?“ The Journal of craniofacial surgery 27(3): 697–701.
Goodday, R. H. (2015). „Preventive Strategies for Patients at Risk of Medication-related Osteonecrosis of the Jaw.“ Oral Maxillofac Surg Clin North Am 27(4): 527-536.
Grötz, K., J.-U. Piesold, et al. (2012). Bisphosphonat-assoziierte Kiefernekrose (BP-ONJ) und andere Medikamenten-assoziierte Kiefernekrosen. AWMF online (www.awmf.org).
Grötz, K. and B. Al-Nawas (2016). „Antiresorptiva-assoziierte Kiefernekrose.“ MKG-Chirurg(9): 207–217.
Guggenberger, R., D. R. Fischer, et al. (2013). „Bisphosphonate-induced osteonecrosis of the jaw: comparison of disease extent on contrast-enhanced MR imaging, [18F] fluoride PET/CT, and conebeam CT imaging.“ AJNR Am J Neuroradiol 34(6): 1242-1247.
Hallmer, F., T. Bjornland, et al. (2014). „Osteonecrosis of the jaw in patients treated with oral and intravenous bisphosphonates: experience in Sweden.“ Oral Surg Oral Med Oral Pathol Oral Radiol 118(2): 202-208.
Hansen, T., M. Kunkel, et al. (2006). „Osteonecrosis of the jaws in patients treated with bisphosphonates - histomorphologic analysis in comparison with infected osteoradionecrosis.“ J Oral Pathol Med 35(3): 155-160.
Hasegawa, T., A. Kawakita, et al. (2017). „A multicenter retrospective study of the risk factors associated with medication-related osteonecrosis of the jaw after tooth extraction in patients receiving oral bisphosphonate therapy: can primary wound closure and a drug holiday really prevent MRONJ?“ Osteoporos Int.
Hasegawa, Y., M. Kawabe, et al. (2012). „Influence of dentures in the initial occurrence site on the prognosis of bisphosphonate-related osteonecrosis of the jaws: A retrospective study.“ Oral surgery, oral medicine, oral pathology and oral radiology 114(3): 318–324.
Hoefert, S. and H. Eufinger (2011). „Relevance of a prolonged preoperative antibiotic regime in the treatment of bisphosphonate-related osteonecrosis of the jaw.“ J Oral Maxillofac Surg 69(2): 362-380.
Hoff, A. O., B. B. Toth, et al. (2008). „Frequency and risk factors associated with osteonecrosis of the jaw in cancer patients treated with intravenous bisphosphonates.“ J Bone Miner Res 23(6): 826-836.
Khan, A. A., A. Morrison, et al. (2015). „Diagnosis and management of osteonecrosis of the jaw: a systematic review and international consensus.“ J Bone Miner Res 30(1): 3-23.
Kyrgidis, A., S. Triaridis, et al. (2012). „Quality of life in breast cancer patients with bisphosphonate-related osteonecrosis of the jaws and patients with head and neck cancer: a comparative study using the EORTC QLQ-C30 and QLQ-HN35 questionnaires.“ Anticancer Res 32(8): 3527-3534.
Lo, J. C., F. S. O'Ryan, et al. (2010). „Prevalence of osteonecrosis of the jaw in patients with oral bisphosphonate exposure.“ J Oral Maxillofac Surg 68(2): 243-253.
Marx, R. E. (2003). „Pamidronate (Aredia) and zoledronate (Zometa) induced avascular necrosis of the jaws: a growing epidemic.“ J Oral Maxillofac Surg 61(9): 1115-1117.
Matsumoto, A., M. Sasaki, et al. (2017). „Primary wound closure after tooth extraction for prevention of medication-related osteonecrosis of the jaw in patients under denosumab.“ Clin Oral Investig 21(1): 127-134.
Montefusco, V., et al., Antibiotic prophylaxis before dental procedures may reduce the incidence of osteonecrosis of the jaw in patients with multiple myeloma treated with bisphosphonates. Leuk Lymphoma, 2008. 49(11): p. 2156-62.
Mozzati, M., V. Arata, et al. (2013). „Tooth extraction in osteoporotic patients taking oral bisphosphonates.“ Osteoporos Int 24(5): 1707-1712.
Nicolatou-Galitis, O., E. Papadopoulou, et al. (2011). „Osteonecrosis of the jaw in oncology patients treated with bisphosphonates: prospective experience of a dental oncology referral center.“ Oral Surg Oral Med Oral Pathol Oral Radiol Endod 112(2): 195-202.
Nicolatou-Galitis, O., E. Razis, et al. (2015). „Periodontal disease preceding osteonecrosis of the jaw (ONJ) in cancer patients receiving antiresorptives alone or combined with targeted therapies: report of 5 cases and literature review.“ Oral surgery, oral medicine, oral pathology and oral radiology 120(6): 699–706.
Niibe, K., T. Ouchi, et al. (2015). „Osteonecrosis of the jaw in patients with dental prostheses being treated with bisphosphonates or denosumab.“ Journal of prosthodontic research 59(1): 3–5.
Otto, S., S. Hafner, et al. (2009). „The role of inferior alveolar nerve involvement in bisphosphonate-related osteonecrosis of the jaw.“ J Oral Maxillofac Surg 67(3): 589-592.
Otto, S., C. Pautke, et al. (2010). „Osteonecrosis of the jaw: effect of bisphosphonate type, local concentration, and acidic milieu on the pathomechanism.“ J Oral Maxillofac Surg 68(11): 2837-2845.
Otto, S., C. Pautke, et al. (2018). „Medication-related osteonecrosis of the jaw: Prevention, diagnosis and management in patients with cancer and bone metastases.“ Cancer Treat Rev 69: 177-187.
Otto, S., O. Ristow, et al. (2016). „Fluorescence-guided surgery for the treatment of medication-related osteonecrosis of the jaw: A prospective cohort study.“ J Craniomaxillofac Surg 44(8): 1073-1080.
Otto, S., M. Troltzsch, et al. (2015). „Tooth extraction in patients receiving oral or intravenous bisphosphonate administration: A trigger for BRONJ development?“ J Craniomaxillofac Surg 43(6): 847-854.
Panya, S., R. Fliefel, et al. (2017). „Role of microbiological culture and polymerase chain reaction (PCR) of actinomyces in medication-related osteonecrosis of the jaw (MRONJ).“ J Craniomaxillofac Surg 45(3): 357-363.
Papapoulos, S., K. Lippuner, et al. (2015). „The effect of 8 or 5 years of denosumab treatment in postmenopausal women with osteoporosis: results from the FREEDOM Extension study.“ Osteoporos Int 26(12): 2773-2783.
Poxleitner, P., M. Engelhardt, et al. (2017). „The Prevention of Medication-related Osteonecrosis of the Jaw.“ Dtsch Arztebl Int 114(5): 63-69.
Raje, N., E. Terpos, et al. (2018). „Denosumab versus zoledronic acid in bone disease treatment of newly diagnosed multiple myeloma: an international, double-blind, double-dummy, randomised, controlled, phase 3 study.“ Lancet Oncol 19(3): 370-381.
Rao, N. J., J. Y. Wang, et al. (2017). „Role of Periapical Diseases in Medication-Related Osteonecrosis of the Jaws.“ BioMed research international 2017: 1560175.
Ripamonti, C. I., M. Maniezzo, et al. (2009). „Decreased occurrence of osteonecrosis of the jaw after implementation of dental preventive measures in solid tumour patients with bone metastases treated with bisphosphonates. The experience of the National Cancer Institute of Milan.“ Ann Oncol 20(1): 137-145.
Ristow, O., C. Gerngroß, et al. (2013). „Is the bone turnover of the jawbone and its possible oversuppression by bisphosphonates of etiological importance for the pathogenesis of the bisphosphonate-related osteonecrosis?“ Journal of Oral and Maxillofacial Surgery.
Ristow, O., C. Gerngross, et al. (2014). „Does regular zoledronic acid change the bone turnover of the jaw in men with metastatic prostate cancer: a possible clue to the pathogenesis of bisphosphonate related osteonecrosis of the jaw?“ J Cancer Res Clin Oncol 140(3): 487-493.
Ristow, O., S. Otto, et al. (2017). „Comparison of auto-fluorescence and tetracycline fluorescence for guided bone surgery of medication-related osteonecrosis of the jaw: a randomized controlled feasibility study.“ Int J Oral Maxillofac Surg 46(2): 157-166.
Ristow, O., S. Otto, et al. (2015). „Treatment perspectives for medication-related osteonecrosis of the jaw (MRONJ).“ J Craniomaxillofac Surg 43(2): 290-293.
Ristow, O., T. Ruckschloss, et al. (2018). „Double-layer closure techniques after bone surgery of medication-related osteonecrosis of the jaw - A single center cohort study.“ J Craniomaxillofac Surg 46(5): 815-824.
Rugani, P., G. Luschin, et al. (2014). „Prevalence of bisphosphonate-associated osteonecrosis of the jaw after intravenous zoledronate infusions in patients with early breast cancer.“ Clin Oral Investig 18(2): 401-407.
Ruggiero, S. L., T. B. Dodson, et al. (2014). „American Association of Oral and Maxillofacial Surgeons Position Paper on Medication-Related Osteonecrosis of the Jaw—2014 Update.“ J Oral Maxillofac Surg.
Ruggiero, S. L. and N. Kohn (2015). „Disease Stage and Mode of Therapy Are Important Determinants of Treatment Outcomes for Medication-Related Osteonecrosis of the Jaw.“ J Oral Maxillofac Surg 73(12 Suppl): S94-S100.
Rupel, K., G. Ottaviani, et al. (2014). „A systematic review of therapeutical approaches in bisphosphonates-related osteonecrosis of the jaw (BRONJ).“ Oral Oncol 50(11): 1049-1057.
Saad, F., J. E. Brown, et al. (2012). „Incidence, risk factors, and outcomes of osteonecrosis of the jaw: integrated analysis from three blinded active-controlled phase III trials in cancer patients with bone metastases.“ Ann Oncol 23(5): 1341-1347.
Saia, G., S. Blandamura, et al. (2010). „Occurrence of bisphosphonate-related osteonecrosis of the jaw after surgical tooth extraction.“ J Oral Maxillofac Surg 68(4): 797-804.
Schiodt, M., S. Vadhan-Raj, et al. (2018). „A multicenter case registry study on medication-related osteonecrosis of the jaw in patients with advanced cancer.“ Support Care Cancer 26(6): 1905-1915.
Sedghizadeh, P. P., S. K. Kumar, et al. (2008). „Identification of microbial biofilms in osteonecrosis of the jaws secondary to bisphosphonate therapy.“ J Oral Maxillofac Surg 66(4): 767-775.
Sivolella, S., F. Lumachi, et al. (2013). „Denosumab and anti-angiogenetic drug-related osteonecrosis of the jaw: an uncommon but potentially severe disease.“ Anticancer Res 33(5): 1793-1797.
Smith, M. R., F. Saad, et al. (2013). „Denosumab and bone metastasis-free survival in men with nonmetastatic castration-resistant prostate cancer: exploratory analyses by baseline prostate-specific antigen doubling time.“ J Clin Oncol 31(30): 3800-3806.
Sonis, S. T., L. S. Elting, et al. (2004). „Perspectives on cancer therapy-induced mucosal injury: pathogenesis, measurement, epidemiology, and consequences for patients.“ Cancer 100(9 Suppl): 1995-2025.
Soundia, A., D. Hadaya, et al. (2018). „Radiographic predictors of bone exposure in patients with stage 0 medication-related osteonecrosis of the jaws.“ Oral Surg Oral Med Oral Pathol Oral Radiol.
Stopeck, A. T., K. Fizazi, et al. (2016). „Safety of long-term denosumab therapy: results from the open label extension phase of two phase 3 studies in patients with metastatic breast and prostate cancer.“ Support Care Cancer 24(1): 447-455.
Thumbigere-Math, V., B. S. Michalowicz, et al. (2014). „Periodontal disease as a risk factor for bisphosphonate-related osteonecrosis of the jaw.“ Journal of periodontology 85(2): 226–233.
Troeltzsch, M., D. Cagna, et al. (2016). „Clinical features of peri-implant medication-related osteonecrosis of the jaw: Is there an association to peri-implantitis?“ Journal of cranio-maxillo-facial surgery : official publication of the European Association for Cranio-Maxillo-Facial Surgery 44(12): 1945–1951.
Voss, P. J., G. Vargas Soto, et al. (2016). „Sinusitis and oroantral fistula in patients with bisphosphonate-associated necrosis of the maxilla.“ Head Face Med 12: 3.
Wagner-Johnston, N. D., J. A. Sloan, et al. (2015). „5-year follow-up of a randomized controlled trial of immediate versus delayed zoledronic acid for the prevention of bone loss in postmenopausal women with breast cancer starting letrozole after tamoxifen: N03CC (Alliance) trial.“ Cancer 121(15): 2537-2543.
Walter, C., B. Al-Nawas, et al. (2010). „Prevalence of bisphosphonate associated osteonecrosis of the jaws in multiple myeloma patients.“ Head Face Med 6(1): 11.
Walter, C., B. Al-Nawas, et al. (2016). „Dental implants in patients treated with antiresorptive medication - a systematic literature review.“ Int J Implant Dent 2(1): 9.
Wazzan, T., D. Kashtwari, et al. (2018). „Radiographic bone loss and the risk of medication-related osteonecrosis of the jaw (MRONJ) in multiple myeloma patients-A retrospective case control study.“ Special care in dentistry : official publication of the American Association of Hospital Dentists, the Academy of Dentistry for the Handicapped, and the American Society for Geriatric Dentistry.
Yoneda, T., H. Hagino, et al. (2017). „Antiresorptive agent-related osteonecrosis of the jaw: Position Paper 2017 of the Japanese Allied Committee on Osteonecrosis of the Jaw.“ J Bone Miner Metab 35(1): 6-19.

















