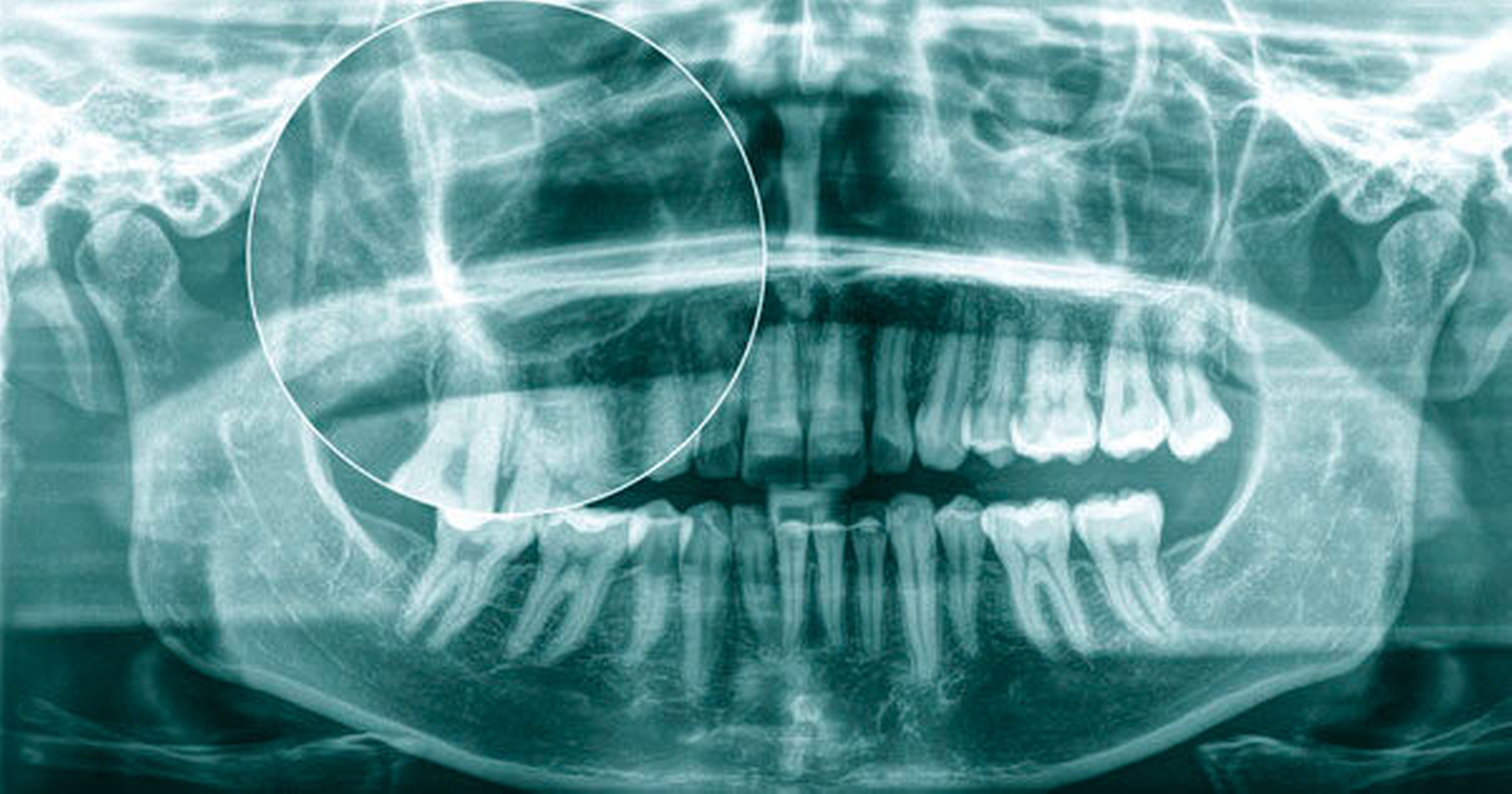
Keratozyste im Oberkiefer
Eine Patientin stellt sich mit einer unklaren Raumforderung im Bereich des rechten Sinus maxillaris vor. Der histopathologische Befund bestätigt die Verdachtsdiagnose einer regelmäßig auftretenden Zystenform in eher seltener Lokalisation.
Im Oktober 2018 wurde eine 27-jährige Patientin von ihrem Hauszahnarzt in die Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie der Universitätsmedizin Mainz zur konsiliarischen Mitbeurteilung einer unklaren Raumforderung der rechten Kieferhöhle überwiesen. Grundlage hierfür bildete eine durch den Hauszahnarzt durchgeführte Orthopantomografie (OPG) mit dem radiologischen Korrelat einer kreisrunden, zystisch konfigurierten Raumforderung (Abbildung 1).
Auf Nachfrage berichtete die Patientin von seit Monaten wiederkehrenden Episoden sinusitischer Beschwerden mit dem Gefühl einer Drucksteigerung im Bereich der rechten Nasennebenhöhle beim Vornüberbeugen des Kopfes sowie einer eingeschränkten Nasenatmung rechts. Bei der klinischen Untersuchung zeigten sich sämtliche Zähne im ersten Quadranten vital, was die initiale Verdachtsdiagnose einer radikulären Zyste formal unwahrscheinlich machte.
Die Durchführung einer digitalen Volumentomografie (DVT) zeigte die dreidimensionale Ausdehnung der eiförmigen Raumforderung mit einem Volumen von 2,34 cm3 (Abbildung 2).
Anfang November erfolgte in Absprache und auf Wunsch der Patientin die operative Befundentfernung im Sinne einer diagnostischen transoralen Antrozystektomie in Intubationsnarkose. Nach paramarginaler Schnittführung und maxillärer Fensterung stellte sich der oben beschriebene Befund in situ als septierte, prall-elastische Raumforderung mit rötlichem Kolorit dar (Abbildung 3a). Nach der vollständigen endoskopisch-gestützten Exstirpation (Abbildung 3b) präsentierte sich das makroskopische Präparat als bräunlich-graue, solide Masse, umgeben von einer für Zysten typischen Bindegewebskapsel (Abbildung 3c), was in Zusammenschau mit der positiven Vitalitätstestung am ehesten die Verdachtsdiagnose einer odontogenen Keratozyste unterstützte. Nach sorgfältiger Spülung der Kieferhöhle wurde der entnommene Knochendeckel unter Verwendung von zwei Miniosteosyntheseplatten belastungsstabil re-inseriert und das Weichgewebe mittels Naht verschlossen (Abbildung 3d).
Das Ergebnis der histopathologischen Nachuntersuchung bestätigte den intraoperativen Verdacht einer odontogenen Keratozyste (Abbildung 4). Während der Nachsorge zeigte sich die Wundheilung reizlos und zeitgerecht. Zur Rezidivprophylaxe wurde ein regelmäßiges Nachsorgeintervall von zwölf Monaten festgelegt.
Diskussion
Obwohl alle odontogenen Zysten eine epitheliale Auskleidung besitzen, trifft dies nicht grundsätzlich auf alle den Zysten zugeordneten Raumforderungen zu. So zeigen beispielsweise solitäre und aneurysmatische Knochenzysten keine Epithelauskleidung. Bei Zysten handelt es sich im Allgemeinen um einen von Hart- oder Weichgewebe ummantelten, zur Umgebung abgeschlossenen, nicht-präformierten Hohlraum [Kramer, 1974]. Der Zysteninhalt ist meist flüssig, semi-flüssig oder gasförmig und besteht im Gegensatz zu Abszessen nicht in der Akkumulation von Pus.
Bei genauer Betrachtung unterscheiden sich die vierte, aktuelle WHO-Klassifikation der Kieferzysten aus dem Jahr 2017 [EI-N et al., 2017] und die zweite Auflage aus dem Jahr 1992 [Kramer et al., 1992] nur wenig, wobei in beiden Versionen eine Subgruppierung der Kieferzysten entsprechend ihrem epithelialen Ursprung und der vermeintlichen Pathogenese erfolgt. Handelt es sich demnach bei dem auskleidenden Epithel um einen Abkömmling der embryonalen Zahnleiste, besteht eine Zugehörigkeit zu den odontogenen Kieferzysten, die weiter entsprechend ihrem Entstehungsmechanismus in solche mit einem inflammatorischen und solche mit einem entwicklungsbedingten Ursprung unterteilt werden. Fehlt dagegen die Zugehörigkeit zum Epithel der Zahnleiste, handelt es sich wie etwa beim ossifizierenden Fibrom um nicht-odontogene Zystenformen [Speight und Takata, 2018].
Die am häufigsten beobachtete Form der odontogenen Zysten ist die „radikuläre Zyste“, die als Vertreterin der inflammatorisch-bedingten Zysten mit einem Anteil von 60 Prozent, die Liste der mandibulo-maxillär lokalisierten Zysten vor der „Residualzyste“ anführt [Jones et al., 2006]. Als Mitglied der entwicklungsbedingten odontogenen Zysten, ist die „odontogene Keratozyste“ mit zwölf Prozent die dritthäufigste Form der humanen Kieferzysten [Jones et al., 2006; Shear und Speight, 2008].
Der oben geschilderte Patientenfall thematisiert mit der odontogenen Keratozyste eine regelmäßig auftretende zystische Veränderung im Bereich der Kieferknochen. Hierbei zeigt sich der Unterkiefer deutlich häufiger betroffen, sodass die beschriebene Kasuistik einen eher seltenen Befund darstellt.
Nachdem die odontogene Keratozyste (OKZ) erstmalig im Jahr 1956 durch Philipsen als eine der aggressivsten odontogenen Zystenformen der Mundhöhle beschrieben und benannt wurde [Philipsen, 1956], klassifizierte man sie aufgrund ihrer Malignom-ähnlichen Eigenschaften im Jahr 2005 im Rahmen der aktualisierten Auflage der Kopf-Hals-Tumoren erstmalig als „keratozystisch odontogener Tumor“ (KCOT) [Barnes et al., 2005]. Andere Synonyme sind das „odontogene Keratozystom“ und die „Primordialzyste“. Bei der aktuellen Neuauflage der WHO-Klassifikation aus dem Jahr 2017 entschied man sich zu einer Wiederzuordnung des keratozystisch odontogenen Tumors von der Gruppe der Neoplasien in die Gruppe der Zysten („odontogene Keratozyste“) [Soluk-Tekkesin und Wright, 2018].
Grund für die einstige Zuordnung der OKZ zu den mandibulo-maxillären Neoplasien war ihr „aggressives Verhalten“, definiert durch ihr destruktives Wachstum, deren Fähigkeit zur Ausbildung von „Satellitenzysten“ und die hohen Lokalrezidivraten (bis zu 25 Prozent). Zusätzlich unterstützt wurde der Neoplasiegedanke maßgeblich durch die Tatsache, dass Mutationen oder Inaktivierungen des PTCH1-Gens bei einem Großteil (80 Prozent) der keratozystischen Läsionen beobachtet wurden [Li, 2011; Qu et al., 2015]. Nachdem sich jedoch herausgestellt hatte, dass auch andere Formen entwicklungsbedingter Zysten Veränderungen des PTCH1-Gens auf Chromosom 9 aufweisen [Levanat et al., 2000; Pavelic et al., 2001], entfiel die Spezifität für keratozystische Läsionen, was in Zusammenschau mit der beschriebenen Möglichkeit einer erfolgreichen, Rezidiv-reduzierten Behandlung durch Marsupialisation [Wushou et al., 2014] zur Reevaluation und Neugruppierung im Rahmen der vierten WHO-Klassifikation führte.
Odontogene Keratozysten sind demnach definiert als benigne, uni- oder multizystische, potenziell destruktiv wachsende Läsionen odontogenen Ursprungs mit einer parakeratotischen Plattenepithelauskleidung. Der Unterkiefer ist zweimal häufiger betroffen als der Oberkiefer, wobei mehr als 50 Prozent der Läsionen ihren Ursprung im Bereich des Unterkieferwinkels haben. Frauen und Männer sind etwa gleich häufig betroffen [Kaczmarzyk et al., 2018], überdies zeigt sich ein Altersgipfel in der zweiten und in der dritten Lebensdekade.
Ein multiples Auftreten wird in Verbindung mit dem Gorlin-Goltz-Syndrom beobachtet, bei dem es sich um ein autosomal-dominant vererbtes Leiden aufgrund einer Mutation im PTCH-1 Gen handelt. Klinisch handelt es sich hierbei definitionsgemäß um einen Symptomkomplex mit multiplen Basalzellkarzinomen und odontogenen Keratozysten in Verbindung mit Rippenanomalien [Todd und August, 2003].
Histopathologisch zeichnet sich die odontogene Keratozyste durch eine regelmäßige Schichtung (sechs bis acht Zelllagen) plattenepithelialer Zellen ohne Reteleisten aus. Neben einer oberflächlichen Keratinschicht erscheinen die Basalzellen häufig kubisch-hyperchromatisch mit palisadenförmiger Anordnung [Soluk-Tekkesin und Wright, 2013]. Die luminale Oberfläche weist meist ein gewellt parakeratotisches Epithel auf (Abbildung 4). Aufgrund der symptomarmen Klinik handelt es sich bei den meisten odontogenen Keratozysten um Zufallsbefunde, die meist im Rahmen zahnärztlich-radiologischer Routineuntersuchungen manifest werden [Shear, 2003]. Bei erheblicher Volumenzunahme können Schmerzen in Verbindung mit sekundären Infektionen des Zysteninhalts sowie Schwellungen und Fistelungen auftreten. Die angrenzenden Zähne sind meist vital, hier zeigen sich eher Zahnverlagerungen als Zahnresorptionen [Yang et al., 2011].
Radiologisch imponiert die Keratozyste durch scharf begrenzte Osteolysen und eine uni- oder multilokuläre Radiotransluzenz. Dabei verläuft das Wachstum häufig in antero-posteriorer Richtung innerhalb des spongiösen Raums [Yang et al., 2011; Belmehdi et al., 2016], was die Abgrenzung gegenüber follikulären und radikulären Zysten vereinfacht.
Differenzialdiagnostisch abgegrenzt werden muss die odontogene Keratozyste insbesondere vom Ameloblastom. Hierbei handelt es sich um einen langsam wachsenden, lokal invasiven, benignen, epithelialen odontogenen Tumor mit einem radiologisch ebenfalls uni- oder multilokulären Erscheinungsbild [Ruslin et al., 2018]. Als weitere Differenzialdiagnosen gelten die follikuläre Zyste, die traumatische Knochenzyste, das zentrale Riesenzellgranulom sowie das ameloblastische Fibrom [Giuliani et al., 2006]. In 25 bis 40 Prozent der Fälle kommt es zu einer Einbeziehung nicht-durchgebrochener Zähne, bei der es sich jedoch am ehesten um ein lagebedingtes Phänomen mit enger Nachbarschaftsbeziehung des Zahns zu den Zysten-initiierenden Epithelzellresten mit anschließender Ummantelung des Zahns handelt [Neville et al., 2015].
Hinsichtlich des zu favorisierenden Therapiekonzepts herrscht Uneinigkeit. Regelmäßig beinhaltet das Vorgehen die Enukleation/Zystektomie mit Kürettage, wohingegen alternative Therapieformen – wie die Zystostomie – unter Berücksichtigung spezifischer Limitationen als ebenso Erfolg versprechend gelten [Marx und Stern, 2012]. Häufig in Verbindung mit der Enukleation/Zystektomie beschrieben und angewendet wird die periphere Osteotomie mit maschinellem Anfrischen der angrenzenden Knochenstrukturen unter zusätzlichem Einsatz der modifizierten Carnoy’schen Lösung (ein Gramm Eisenchlorid, sechs Milliliter Ethanol, ein Milliliter Eisessig) zur restlosen Entfernung sämtlicher Tumorausläufer im Sinne eines mechano-chemischen Vorgehens [Voorsmit et al., 1981; Alchalabi et al., 2017]. Hierbei sollte die kritische Einwirkzeit der Lösung von drei bis fünf Minuten aus Gründen der Nerv- und Gefäßtoxizität beachtet sowie der direkte neuronale Kontakt der Lösung vermieden werden [Frerich et al. 1994; Alchalabi et al., 2017].
Entsprechend der aktuellen Literatur liegt das Gesamt-Lokalrezidivrisiko in Abhängigkeit von der Behandlungsmethode bei 5 bis 65 Prozent mit einem gehäuften Auftreten innerhalb der ersten drei postoperativen Jahre [Apajalahti et al., 2011]. Hierzu zeigten Studien die höchsten Lokalrezidivraten nach einfacher Enukleation (28,7 Prozent), gefolgt von der Enukleation plus Carnoy’sche Lösung (1,6 Prozent) und der Enukleation mit peripherer Osteotomie plus Carnoy’sche Lösung (null Prozent) [Blanas et al., 2000; Alchalabi et al., 2017]. Da eine postoperative Lokalrezidiventstehung nach zehn Jahren äußerst selten, jedoch gehäuft während der ersten fünf Jahre beobachtet wird, sollte eine jährliche klinische und radiologische (OPG) Verlaufskontrolle durchgeführt werden.
Fazit für die Praxis
Odontogene Keratozysten entstehen vornehmlich in den Bereichen Angulus und Ramus mandibulae. Maxilläre Manifestationen sind deutlich seltener. Keratozysten sind meist klinisch unauffällig und werden häufig im Rahmen zahnärztlicher Routineuntersuchungen diagnostiziert. Symptome entstehen meist erst bei deutlicher Größenzunahme im Zusammenhang mit sekundär-bakteriellen Infektionen des Zysteninhalts. Bei multiplem Auftreten oder einer Manifestation innerhalb der ersten beiden Lebensdekaden wird der genetische Ausschluss des autosomal-dominant vererbten Gorlin-Goltz-Syndroms (Multiples Auftreten von Basalzellkarzinomen, Keratozysten und Rippenanomalien) empfohlen.Differenzialdiagnostische Abgrenzung vom Ameloblastom sowie zu radikulären und follikulären Zysten. Es besteht immer die Empfehlung zum chirurgischen Vorgehen mit Enukleation, Osteotomie der Zysten-begrenzenden Knochenareale sowie nach Möglichkeit Anwendung der modifizierten Carnoy’schen Lösung. Jährlich klinische und radiologische Nachsorge über mindestens fünf Jahre.
Dr. Dr. Daniel G. E. Thiem
Weiterbildungsassistent Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
Prof. Dr. Beate K. Straub
Erste Oberärztin
Institut für Pathologie
Langenbeckstr. 1, 55131 Mainz
Dr. Dr. Maximilian Krüger
Oberarzt Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
PD Dr. Dr. Peer W.Kämmerer, MA, FEBOMFS
Leitender Oberarzt und stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie, Plastische Operationen
Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
Literaturliste
Alchalabi, N. J., et al. (2017). „Using Carnoy's Solution in Treatment of Keratocystic Odontogenic Tumor.“ Ann Maxillofac Surg 7(1): 51-56.
Apajalahti, S., et al. (2011). „Computerized tomography findings and recurrence of keratocystic odontogenic tumor of the mandible and maxillofacial region in a series of 46 patients.“ Oral Surg Oral Med Oral Pathol Oral Radiol Endod 111(3): e29-37.
Barnes, L., et al. (2005). „World health organization classification of tumors. Pathology & genetics of head and neck tumors.“.
Belmehdi, A., et al. (2016). „Odontogenic Keratocyst Tumor: A Case Report and Literature Review.“ Open Journal of Stomatology 06(07): 171-178.
Blanas, N., et al. (2000). „Systematic review of the treatment and prognosis of the odontogenic keratocyst.“ Oral Surg Oral Med Oral Pathol Oral Radiol Endod 90(5): 553-558.
EI-N, A., et al. (2017). „World Health Organization Classification of Head and Neck Tumours.“
Frerich, B., et al. (1994). „Critical time of exposure of the rabbit inferior alveolar nerve to Carnoy's solution.“ J Oral Maxillofac Surg 52(6): 599-606.
Giuliani, M., et al. (2006). „Conservative management of a large odontogenic keratocyst: report of a case and review of the literature.“ J Oral Maxillofac Surg 64(2): 308-316.
Jones, A. V., et al. (2006). „Range and demographics of odontogenic cysts diagnosed in a UK population over a 30-year period.“ Journal of Oral Pathology & Medicine 35(8): 500-507.
Kaczmarzyk, T., et al. (2018). „Investigation of clinicopathological parameters and expression of COX-2, bcl-2, PCNA, and p53 in primary and recurrent sporadic odontogenic keratocysts.“ Clin Oral Investig 22(9): 3097-3106.
Kramer, I. R., et al. (1992). WHO international histological classification of tumours. Histology typing of odontogenic tumor, Berlin: springer vering.
Kramer, I. R. H. (1974). „Changing Views on Oral Disease.“ Proceedings of the Royal Society of Medicine-London 67(4): 271-276.
Levanat, S., et al. (2000). „Involvement of PTCH gene in various noninflammatory cysts.“ Journal of Molecular Medicine 78(3): 140-146.
Li, T. J. (2011). „The odontogenic keratocyst: a cyst, or a cystic neoplasm?“ J Dent Res 90(2): 133-142.
Marx and Stern (2012). Oral and Maxillofacial Pathology: A Radional for Diagnosis and Treatment: 616-631.
Neville, B. W., et al. (2015). Oral and Maxillofacial Pathology - First South Asia Edition, RELX India Private Limited.
Pavelic, B., et al. (2001). „PTCH gene altered in dentigerous cysts.“ Journal of Oral Pathology & Medicine 30(9): 569-576.
Philipsen, H. (1956). „Om keratocyster (kolesteatom) i kaeberne.“ Tandlaegeblated 60: 963-981.
Qu, J., et al. (2015). „Underestimated PTCH1 mutation rate in sporadic keratocystic odontogenic tumors.“ Oral Oncol 51(1): 40-45.
Ruslin, M., et al. (2018). „The Epidemiology, treatment, and complication of ameloblastoma in East-Indonesia: 6 years retrospective study.“ Med Oral Patol Oral Cir Bucal 23(1): e54-e58.
Shear, M. (2003). „Odontogenic keratocysts: clinical features.“ Oral Maxillofac Surg Clin North Am 15(3): 335-345.
Shear, M. and P. Speight (2008). Cysts of the oral and maxillofacial regions, John Wiley & Sons.
Soluk-tekkesin, M. and J. M. Wright (2013). „The world health organization classification of odontogenic lesions: a summary of the changes of the 2017 (4th) edition.“ Turkish Journal of Pathology.
Soluk-Tekkesin, M. and J. M. Wright (2018). „The World Health Organization Classification of Odontogenic Lesions: A Summary of the Changes of the 2017 (4th) Edition.“ Turk Patoloji Derg 34(1).
Speight, P. M. and T. Takata (2018). „New tumour entities in the 4th edition of the World Health Organization Classification of Head and Neck tumours: odontogenic and maxillofacial bone tumours.“ Virchows Arch 472(3): 331-339.
Todd, R. and M. August (2003). „Molecular approaches to the diagnosis of sporadic and nevoid basal cell carcinoma syndrome-associated odontogenic keratocysts.“ Oral Maxillofac Surg Clin North Am 15(3): 447-461.
Voorsmit, R. A., et al. (1981). „The management of keratocysts.“ J Maxillofac Surg 9(4): 228-236.
Wushou, A., et al. (2014). „Marsupialization is the optimal treatment approach for keratocystic odontogenic tumour.“ J Craniomaxillofac Surg 42(7): 1540-1544.
Yang, S.-I., et al. (2011). „A retrospective study of 220 cases of keratocystic odontogenic tumor (KCOT) in 181 patients.“ Asian Journal of Oral and Maxillofacial Surgery 23(3): 117-121.