Die MRT als Bilddatenbasis für die computergestützte 3-D-Implantatplanung
Röntgenbasierte dreidimensionale Schnittbildverfahren wie die Computertomografie und insbesondere die digitale Volumentomografie (DVT) dienen derzeit standardmäßig als Datenbasis für die prächirurgische Planung in der zahnärztlichen Implantologie. Neben der Erkennung beziehungsweise der Diagnose unterschiedlicher Pathologien dienen CT und DVT zur Bewertung implantologisch relevanter anatomischer Strukturen wie insbesondere des Mandibularkanals, der Kieferhöhlen und der Zähne. Darüber hinaus hat sich in der Praxis die DVT zunehmend als die Bildgebungsmethode der Wahl für die virtuelle chirurgische Planung und anschließende Herstellung von CAD/CAM-gefertigten chirurgischen Schablonen (schablonengeführte Implantatchirurgie) etabliert [Jacobs et al., 2018; Tahmaseb et al., 2018].
Spezialisierte Planungssoftware ermöglicht eine virtuelle Implantatpositionierung, die von Anfang an sowohl die prothetischen Anforderungen als auch anatomische Aspekte sowie das verfügbare Knochenangebot berücksichtigt. Statische Führungssysteme in Form von Positionierungsschablonen übertragen während der Operation die virtuell geplante Implantatposition in den operativen Situs. Dies ist mit einem klinisch hinreichenden Genauigkeitslevel möglich [Tahmaseb et al., 2018; Wismeijer et al., 2018; Zhou et al., 2018]. Allerdings gehen röntgenbasierte Verfahren wie die DVT mit einer auf den Patienten einwirkenden ionisierenden Strahlung einher. Aktuelle Studien deuten darauf hin, dass die diagnostische Strahlenbelastung durch zahnmedizinisches Röntgen mit einem erhöhten Risiko für Schilddrüsenkrebs und Meningiomen verbunden sein könnte [Han et al., 2018; Memon et al., 2019]. Die Anwendung ionisierender Strahlen ist besonders kritisch im Rahmen elektiver Eingriffe bei ansonsten gesunden Patienten. Auch wenn man davon ausgeht, dass das Risiko für den Einzelnen gering ist, ist die Strahlenexposition durch DVT-Untersuchungen aus Sicht der öffentlichen Gesundheit als nicht unerheblich einzustufen [Ludlow et al., 2015]. Ein weiterer Nachteil der DVT im Hinblick auf die Planung in der Implantologie ist, dass die Weichgewebekontrastierung nicht ausreicht, um den Nervus alveolaris inferior direkt darzustellen. Ebenso können Strukturen der Mukosa nur bedingt visualisiert werden. Des Weiteren schränken mitunter Metallartefakte in der DVT die Bildqualität stark ein.
Die Magnetresonanztomografie (MRT) ist eine mögliche nicht-invasive Alternative für die 3-D-Bildgebung in der Implantologie. Einige frühere klinische Studien haben gezeigt, dass MRT-Daten prinzipiell als Grundlage für die Implantatplanung dienen können, wobei der Aspekt der schablonengeführten Implantatpositionierung zunächst nicht berücksichtigt wurde [Hassfeld et al., 2001; Gray et al., 2003; Pompa et al., 2010]. Die ehemals sehr langen Scanzeiten von bis zu 30 Minuten und die geringe Bildqualität mit unzureichender Auflösung (Schichtdicke 2–4 mm) haben sich für die klinische Routine bis vor Kurzem noch als ungeeignet erwiesen.
Aktuelle Entwicklungen gehen hin zu neuartigen, für die dentale Bildgebung angepassten MRT-Protokollen. Spezialisierte MRT-Sequenzen mit hoher isotroper 3-D-Auflösung (zum Beispiel 3-D T1-gewichtete Black-Bone-Sequenzen) sowie dedizierte Spulen ermöglichen eine signifikante Steigerung der Auflösung, eine Verbesserung des Signal-Rausch-Verhältnisses, eine Reduzierung der Aufnahmezeiten sowie eine Artefaktunterdrückung [Assaf et al., 2014; Prager et al., 2015; Flügge et al., 2016; Ludwig et al., 2016; Hilgenfeld et al., 2017; Probst et al., 2017]. Damit zeichnen sich nun breite Einsatzmöglichkeiten im Bereich verschiedener zahnmedizinischer Indikationen ab und die MRT scheint als praktikable Alternative zur DVT infrage zu kommen.
Hinsichtlich der Messung der knöchernen Dimensionen wurde bereits eine gute Übereinstimmung zwischen CT beziehungsweise DVT und der MRT beschrieben [Goto et al., 2007; Duttenhoefer et al., 2015; Flügge et al., 2016]. Neben der Knochendarstellung gelingt auch eine gute Darstellung von Zahnstrukturen, was die Planung der Implantatposition ermöglicht [Detterbeck et al., 2016; Gradl et al., 2017]. Sowohl für die DVT als auch die MRT gilt jedoch gleichermaßen, dass Okklusalflächen nicht genau genug dargestellt werden, um eine zahngetragene schablonengeführte Implantatpositionierung zu gewährleisten. In einer aktuellen In-vivo-Studie zeigen Hilgenfeld und Kollegen, dass Zahnoberflächen in der MRT hinreichend präzise dargestellt werden, um eine Überlagerung mit scanbasierten virtuellen Modellen zu ermöglichen, was als Grundvoraussetzung für die schablonengestützte Implantatchirurgie gilt [Flügge et al., 2017; Hilgenfeld et al., 2019].
Neben der mittlerweile qualitativ und quantitativ guten und strahlenfreien Darstellungsmöglichkeit von Knochen ermöglichen MRT-Scans aufgrund ihres überragenden Weichgewebekontrasts auch einen diagnostischen Mehrwert gegenüber DVT und CT. Dadurch ist es etwa möglich, Mukosa oder Gingiva, neurovaskuläre Strukturen wie insbesondere den Nervus alveolaris inferior oder die Zahnpulpa direkt sichtbar zu machen [Assaf et al., 2015; Agbaje et al., 2017; Probst et al., 2017; Hilgenfeld et al., 2018; Burian et al., 2019].
Workflow
MRT-Geräte mit hoher Feldstärke wie 3 Tesla bieten sich an, um hohe Auflösungen und ein geeignetes Signal-Rausch-Verhältnis bei kurzen Untersuchungszeiten zu gewährleisten. Alternativ können 1,5-Tesla-Geräte unter Verwendung geeigneter Spulen eingesetzt werden. Standard-Kopf-Hals-Spulen, die das Magnetfeld optimieren, kommen bereits heute zur Darstellung des Gesichtsschädelbereichs in der klinischen Routine zum Einsatz.
Mittlerweile sind auch Dental-Spulen verfügbar, die auf die Bildgebung in der Zahnmedizin und im MKG-Bereich spezialisiert sind [Sedlacik et al., 2016]. Einen Schritt weiter gehen intraorale Spulensysteme [Ludwig et al., 2016; Flügge et al., 2021].
Zur Knochendarstellung eignen sich unterschiedliche MRT-Protokolle mit ihren jeweiligen Vor- und Nachteilen. Diesen Protokollen ist prinzipiell zu eigen, dass Sie kurze beziehungsweise ultrakurze Echozeiten nutzen und somit Gewebetypen wie Knochen oder Zahnhartsubstanz darstellen. Dabei sind derzeit in der klinischen Anwendung isotrope Auflösungen von 0,3 bis 0,6 mm möglich [Flügge et al., 2020; Flügge et al., 2020; Hilgenfeld et al., 2020; Probst et al., 2020] (Abbildung 1). Die MRT-Scanzeiten können aktuell bis in den Bereich von etwa drei Minuten reduziert werden [Probst et al., 2020]. Zudem existieren unterschiedliche Sequenzprotokolle, um metallische Artefakte, sogenannte Suszeptibilitätsartefakte, zu verringern [Hilgenfeld et al., 2017; Probst et al., 2017]. Als Vorbereitung für die MRT-Aufnahme werden Kunststoffschablonen beispielsweise in Tiefziehtechnik angefertigt und kurz vor der MRT-Aufnahme mit einem Material befüllt, das lokal die Kontrastierung der Zahnoberflächen verbessert. Im Anschluss werden die Schablonen mit dem kontrastierenden Material während der MRT-Aufnahme getragen [Hilgenfeld et al., 2019; Probst et al., 2020].
Feste Materialien wie beispielsweise thermoplastisches Abformmaterial (Hydrokolloid) eignen sich nach Auffassung der Autoren besser als flüssige oder zähflüssige Materialien (Wasser, Säfte oder Zahnpasta).
Bei der MRT-Untersuchung werden – wie bei CT oder DVT – Daten im DICOM-Format bereitgestellt und können in gängige Implantatprogramme wie coDiagnostiX® (Dental Wings) oder Implant Studio® (3Shape) importiert werden. Analog zur DVT-Planung werden zusätzlich hochauflösende Datensätze der Zahnoberflächen im STL-Format importiert, die direkt über Intraoralscans oder indirekt mittels Modellscan akquiriert wurden. Die MRT-Daten werden anschließend mit dem Oberflächenscan der Zähne koregistriert. Dabei wird die Ausrichtung des Oberflächenscans in der koronalen, der axialen und der sagittalen Ebene mithilfe von Translations- und Rotationswerkzeugen optimiert. Das Ergebnis ist ein „Hybrid-Modell“, bestehend aus einem hochpräzisen Scan der Zahnoberflächen und der MRT (Abbildung 2).
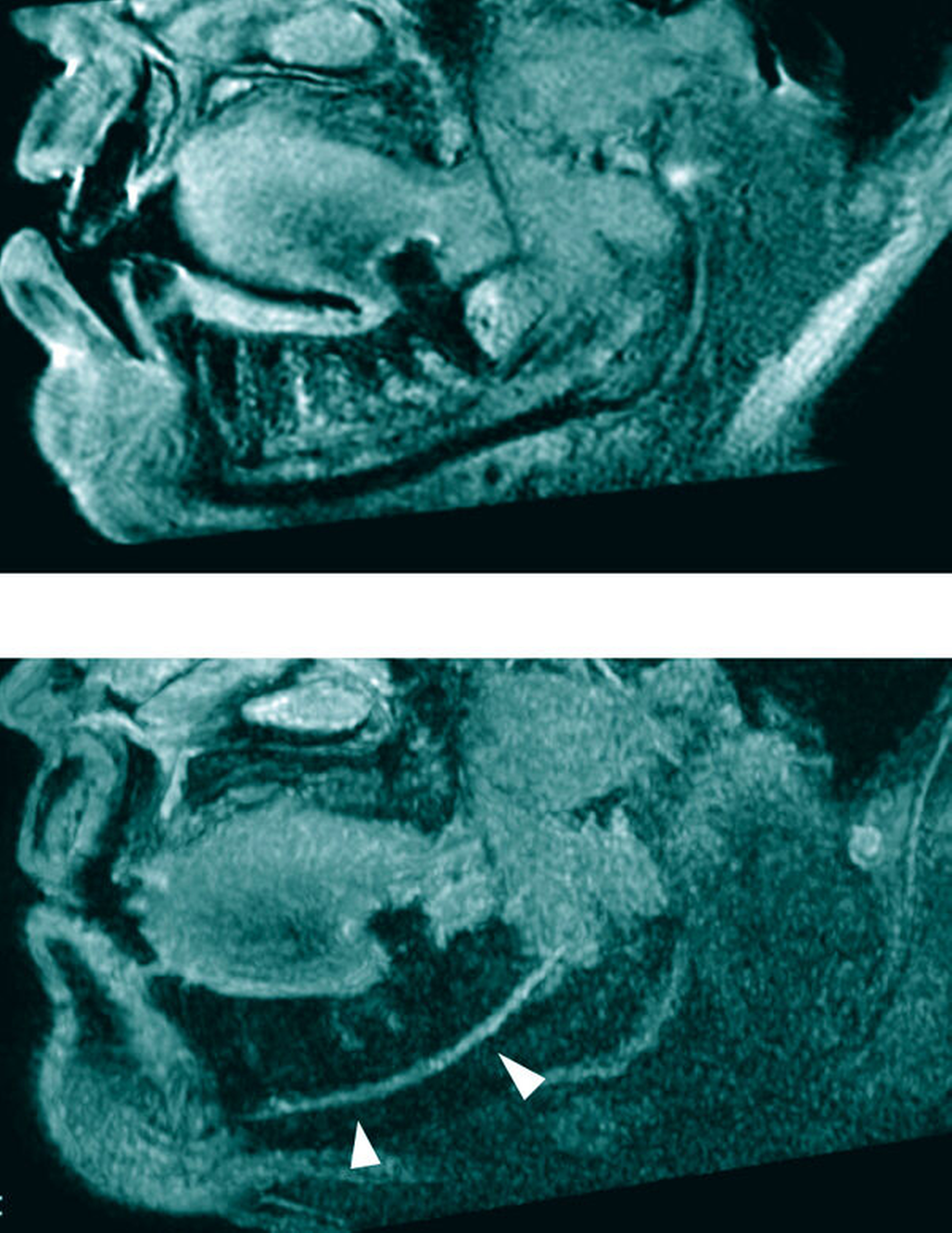
Anschließend kann die Implantatpositionierung entsprechend den prothetischen Anforderungen, dem sogenannten „Backward Planning“, und unter Berücksichtigung der anatomischen Situation festgelegt werden (Abbildung 3). In der Seitenzahnregion des Unterkiefers kann im Gegensatz zur DVT der Verlauf des Nerven-Gefäßbündels (Nervus alveolaris inferior) eindeutig und direkt visualisiert werden [Probst et al., 2017; Burian et al., 2019; Probst et al., 2020], was einen gewissen Sicherheitsaspekt beinhaltet [Agbaje et al., 2017] (Abbildung 4).
Monika Probst
Nach der CAD-Konstruktion einer Bohrschablone werden die generierten STL-Daten für den 3-D-Druck bereitgestellt (Abbildung 5). Mithilfe der Bohrschablone kann dann eine vollständig geführte Bohrsequenz entsprechend den Spezifikationen des Implantatherstellers durchgeführt werden (Abbildung 5). Zur Qualitätskontrolle ist es möglich, die tatsächlich resultierende Implantatposition mit der computergestützt geplanten Position zu vergleichen (Abbildung 6). Die tatsächliche Implantatposition kann dabei beispielsweise über Scanbodys erfasst werden.
Evidenz aus Studien
Sowohl In-vitro- als auch In-vivo-Studien belegen aktuell die Machbarkeit und Genauigkeit des MRT-basierten Ansatzes. Bei einer humanen Kadaverstudie von Flügge und Kollegen [Flügge et al., 2020] zeigte sich die Machbarkeit einer MRT-basierten und vollständig schablonengeführten Implantation für die Versorgung von Einzelzahnlücken sowie bei nur teilweise bezahnten und zahnlosen Unterkiefern. Die Genauigkeit der MRT-basierten, vollständig geführten Implantatinsertion in vitro war vergleichbar mit dem konventionellen Arbeitsablauf mittels DVT. Dabei konnten alle implantologisch relevanten anatomischen Strukturen mittels MRT dargestellt werden. Mercado und Kollegen [Mercado et al., 2019] kommen anhand einer porcinen In-vitro-Studie zu vergleichbaren Ergebnissen und Schlussfolgerungen. In beiden Arbeiten wird darauf hingewiesen, dass aufgrund der sehr guten Weichgewebekontrastierung der MRT die Oberflächenkontur der Mukosa bestens visualisiert werden kann. Insbesondere bei zahnlosen oder nur teilweise bezahnten Patienten erleichtert dies den Ausrichtungsprozess von MRT-Daten mit den optischen Scans über die Mukosa als gemeinsame Referenzstruktur zur Implantatplanung. Dies erweist sich erfahrungsgemäß mittels DVT aufgrund mangelnder Weichgewebedarstellung, als schwierig.
Die Arbeitsgruppe um Flügge und Kollegen zeigt ebenso anhand von einigen Fällen die klinische Machbarkeit (Proof of principle) der vollständig geführten Implantation anhand von MRT-Daten am Patienten [Flügge et al., 2020]. Erste Daten zur Genauigkeit der MRT-basierten schablonengeführten Implantatplanung und -insertion veröffentlichte jüngst die Arbeitsgruppe der Autoren dieses Beitrags [Probst et al., 2020]. In einem Patientenkollektiv mit Schaltlücken beziehungsweise Freiendsituationen wurde neben der Machbarkeit verdeutlicht, dass bei der MRT-basierten schablonengeführten Implantation eine hohe metrische Übereinstimmung zwischen Planung und Umsetzung resultieren kann (mittlere Abweichungen am Implantateintrittspunkt 0,8 mm, apikal 1,2 mm sowie Achsabweichung 4,9°). Diese Werte bewegen sich im Rahmen dessen, was in jüngsten Übersichtsarbeiten beziehungsweise Metaanalysen angegeben wird. Darüber hinaus ergab sich in Analogie zu einer Arbeit von Hilgenfeld und Kollegen [Hilgenfeld et al., 2019] eine klinischerseits akzeptabel geringe Abweichung bei der Überlagerung von Zahnoberflächen der MRT mit den aus dem optischen Scan erfassten Oberflächen [Probst et al., 2020]. Für die Implantation wichtige anatomische Strukturen wie kortikaler und spongiöser Knochen, Zähne, Kieferhöhlen sowie der N. alveolaris inferior konnten gut bis sehr gut dargestellt werden. Metallische Zahnrestaurationen schränkten die Bildqualität nicht wesentlich ein.
In einer aktuell erschienenen prospektiven Arbeit demonstrieren Hilgenfeld und Kollegen [Hilgenfeld et al., 2020] ebenfalls die Machbarkeit der MRT-basierten computergestützten Implantatplanung. Auf der Basis einer MRT erfolgte eine virtuelle Planung und die Festlegung eines Behandlungsplans (Implantattyp und -dimensionen, Implantatposition sowie Notwendigkeit und Art einer Knochenaugmentation), gefolgt von der CAD/CAM-Fertigung einer Bohrschablone. Um die Planung mittels MRT zu verifizieren, wurde bei den Patienten eine DVT mit der MRT-basierten Bohrschablone in situ durchgeführt und folglich MRT- und DVT-Planung qualitativ und quantitativ verglichen. Es zeigte sich eine sehr hohe Übereinstimmung zwischen MRT-basierten und DVT-basierten implantologischen Behandlungsplänen im Rahmen eines Backward Planning. Die mittleren dreidimensionalen Abweichungen zwischen MRT- und DVT-basierter Implantatposition betrugen 1,1 mm (Eintrittspunkt) und 1,3 mm (Apex), die mittlere Winkelabweichung betrug 2,4°). Die dentale MRT erwies sich als zuverlässig und ausreichend genau für die Herstellung von Bohrschablonen. Zusammenfassend zeigen die genannten Arbeiten übereinstimmend und deutlich, dass mit einer MRT-basierten Implantatplanung Ergebnisse erzielt werden können, die mit denen einer DVT-basierten Planung vergleichbar sind [Nakamura, 2020].
Darüber hinaus sind weitere Einsatzbereiche innerhalb der implantologischen Bildgebung denkbar. Beispielsweise ermöglicht die non-invasive strahlenfreie MRT-Diagnostik die wiederholte Darstellung und Längsschnittbeobachtung von autologen Knochentransplantaten [Flügge et al., 2021]. Die ausgezeichnete Weichgewebekontrastierung der MRT trägt beispielsweise zur zuverlässigen Bestimmung der palatinalen Mukosadicke sowie der Lokalisation der Arteria palatina major bei und erleichtert die Planung von palatinalen Gewebetransplantaten, um Komplikationen während der Operation zu vermeiden.
Mittels DVT (und OPT) ist es nur indirekt möglich, über die kortikalen Wandstrukturen des Mandibularkanals auf die Lage des N. alveolaris inferior zu schließen, was problematisch sein kann, da der Mandibularkanal in der DVT in circa 20 bis 40 Prozent der Fälle aufgrund geringer beziehungsweise fehlender Kortikalisierung nur schwierig bis nicht abgrenzbar ist [de Oliveira-Santos et al., 2012; Politis et al., 2013]. In einer In-vitro-Studie an humanen Unterkiefern zeigen Agbaje und Kollegen [Agbaje et al., 2017], dass das DVT-basierte sogenannte „Nerv-Tracing“ in der implantologischen Planungssoftware signifikant Form und Volumen des neurovaskulären Bündels unterschätzen kann, die Abweichungen können Ausmaße von 1,5 bis zu 5 mm Dicke erreichen [Agbaje et al., 2017; Burian et al., 2019]. Eine MRT-Planung kann somit wesentlich zur Sicherheit bei Implantationen im Unterkieferseitenzahnbereich beitragen [Agbaje et al., 2017].
Die MRT ist ein in der Neuroradiologie etabliertes Instrument, um periphere Nervenschädigungen oder Neuritiden zu visualisieren. Diese Option ist auch auf die Mund-Kiefer-Gesichtsregion übertragbar. Bildmorphologische Korrelate sind hierbei Kontinuitätsunterbrechungen oder ödematöse Veränderungen nervaler Strukturen. So können Nervenverletzungen im Rahmen chirurgischer Eingriffe wie Weisheitszahnentfernungen oder Umstellungsosteotomien, aber auch bei der Implantatchirurgie dargestellt werden und zur weiteren klinischen Entscheidungsfindung beitragen [Probst et al., 2017; Wanner et al., 2018].
Grundsätzlich ist die MRT auch in der Lage, die unmittelbare Umgebung eines bereits gesetzten Implantats darzustellen – beispielsweise zur Diagnostik bei Periimplantitis. Allerdings können Suszeptibilitätsartefakte die Beurteilung der unmittelbaren periimplantären Umgebung limitieren. Bei Keramikimplantaten, die metallfrei sind, stellt dies kein Problem dar. So zeigt sich aktuell, dass mittels MRT Zirkonoxidimplantate und ihre unmittelbare Umgebung sehr gut und besser als mittels DVT dargestellt werden können [Duttenhoefer et al., 2015; Hilgenfeld et al., 2018; Demirturk Kocasarac et al., 2019]. Zur Darstellung der Umgebung von Titanimplantaten scheint die DVT im Vorteil zu sein, wobei artefaktreduzierende MRT-Sequenzen diesen Nachteil verringern beziehungsweise perspektivisch möglicherweise aufheben [Probst et al., 2017; Hilgenfeld et al., 2018].
Wie würden Sie ein Dental-MRT-Angebot nutzen?
Die TU München hat eine kleine Umfrage online gestellt – zu finden über diesen Link: https//dental-imaging.de/umfrage/
Interessant erscheint, dass mittels MRT auch die Binnenstruktur und Mikroarchitektur des Knochens qualitativ und quantitativ beurteilbar ist [Techawiboonwong et al., 2008; Chang et al., 2017; Karampinos et al., 2018]. Dies könnte eine neue Option zur präoperativen Abschätzung der Knochenqualität der Kiefer darstellen und eine daran orientierte Auswahl des Implantationsprotokolls zulassen.
Durch die Möglichkeit, ödematöse Veränderungen direkt darzustellen, ist die MRT dazu prädestiniert, akute entzündliche Reaktionen und deren Ausmaß im Weichgewebe und auch im Knochen abzubilden [Jimenez-Boj et al., 2007]. Während die MRT bei der Kieferosteomyelitis schon länger Anwendung findet, könnte sie auch zur Diagnostik von parodontalen Erkrankungen, aber auch zum Ausschluss oder zum Nachweis der Ausheilung einer akuten Ostitis im Rahmen der implantologischen Diagnostik mit beitragen.
Diskussion und Ausblick
Den Vorteilen und neuen Möglichkeiten der implantologischen MRT-Bildgebung stehen einige Limitationen gegenüber. Bewegungsartefakte können die Gesamtbildqualität beeinträchtigen und bei der MRT-Bildgebung eine Rolle spielen, da die Untersuchungszeiten im Vergleich zu CT oder DVT länger sind. Lösungsmöglichkeiten zur Reduzierung von Bewegungsartefakten sind die Verwendung kürzerer Messzeiten, die stabile Positionierung des Kopfes des Patienten sowie der Einsatz und die Weiterentwicklung von softwarebasierten Bewegungskorrekturen. Darüber hinaus können Suszeptibilitätsartefakte, die durch magnetisierbare metallische zahnärztliche Materialien verursacht werden, die lokale Beurteilung von Strukturen beeinträchtigen. Im Wesentlichen beschränken sich diese auf den Bereich der Okklusalflächen und Zahnkronen. Strukturen wie Knochen, Kieferhöhle und Weichgewebe sind eher nicht betroffen, weshalb die Implantatplanung meist nicht beeinträchtigt wird. Es gilt zu berücksichtigen, dass auch bei strahlenbasierten Techniken (CT oder DVT) teils ausgeprägte Artefakte auftreten.Spezielle Anwendungen zur Artefaktunterdrückung sind bereits etabliert und sollten weiter optimiert werden [Hilgenfeld et al., 2017; Probst et al., 2017]. Prinzipiell gilt, dass Materialien wie Edelstahl und Kobalt-Chrom-Legierungen sehr ausgeprägte Artefakte verursachen, während die große Mehrheit der Dentalmaterialien wie Zirkoniumdioxid, Amalgam, Goldlegierung, Gold-Keramik-Kronen, Titanlegierungen, Komposite und Nickel-Titan-Legierungen keine oder nur geringe Artefakte hervorrufen [Chockattu et al., 2018]. Als Kontraindikationen für die MRT-Bildgebung sind das Vorhandensein von Herzschrittmachern, Cochlea-Implantaten oder Neurostimulatoren zu nennen. Daneben scheinen aktuell die hohen Kosten und die beschränkte Verfügbarkeit den Einsatz der MRT in der Zahnmedizin zu limitieren.
Die DVT stellt aktuell die wichtigste dreidimensionale Bildgebungsmodalität in der zahnärztlichen Implantologie dar. Die in diesem Übersichtsartikel zitierten Arbeiten zeigen allerdings, dass die MRT-basierte Planung Ergebnisse erzielt, die mit denen einer DVT-basierten Planung vergleichbar sind und dies ohne die Anwendung ionisierender Strahlung. Zu den international anerkannten und auch im deutschen Strahlenschutzgesetz festgeschriebenen Prinzipien des Strahlenschutzes gehört neben dem Gebot der Rechtfertigung (rechtfertigende Indikation in der Medizin) auch das ALARA-Prinzip („As Low As Reasonably Achievable“), das die Anwendung ionisierender Strahlung mit der für die Fragestellung geringstmöglichen Strahlendosis bei gleichzeitig suffizienter Abbildungsqualität vorschreibt. Dieser Grundsatz der „Optimierung“ durch geringstmögliche Strahlenexposition gilt auch unterhalb der gesetzlich vorgegebenen Grenz- beziehungsweise Richtwerte. Daraus folgt, dass die MRT als strahlenfreie Alternative in der implantologischen Diagnostik perspektivisch nicht ohne Weiteres zu ignorieren sein wird. Gerade bei planbaren und elektiven Eingriffen wie in der Implantologie spricht vieles dafür, dem MRT zukünftig eine erkennbare Rolle bei der Planung implantologischer Eingriffe zukommen zu lassen. Dies gilt umso mehr, wenn man den potenziellen diagnostischen Mehrwert im Hinblick auf die Darstellung von Mukosa, Nerven oder Entzündungsaktivität einbezieht.
PD Dr. med. Dr. med. dent. Florian A. Probst
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie,
Klinikum der Ludwig-Maximilians-Universität (LMU) München
Lindwurmstr. 2a, 80337 München
florian.probst@med.uni-muenchen.de
Josef Schweiger, M.Sc.
Poliklinik für Zahnärztliche Prothetik,
Klinikum der Ludwig-Maximilians-Universität (LMU) München
Goethestr. 70, 80336 München
Dr. med. dent. Maria Juliane Stumbaum
Poliklinik für Zahnärztliche Prothetik,
Klinikum der Ludwig-Maximilians-Universität (LMU) München
Goethestr. 70, 80336 München
Dr. med. Dr. med. dent. Egon Burian
Abteilung für Diagnostische und Interventionelle Neuroradiologie,
Neuro-Kopf-Zentrum, Klinikum rechts der Isar, Technische Universität München
Ismaninger Straße 22, 81675 München
Dr. med. Monika Probst
Abteilung für Diagnostische und Interventionelle Neuroradiologie,
Neuro-Kopf-Zentrum, Klinikum rechts der Isar, Technische Universität München
Ismaninger Straße 22, 81675 München
Literaturliste
Agbaje, J. O., E. V. de Casteele, A. S. Salem, D. Anumendem, I. Lambrichts and C. Politis (2017). „Tracking of the inferior alveolar nerve: its implication in surgical planning.“ Clin Oral Investig 21(7): 2213-2220.
Assaf, A. T., T. A. Zrnc, C. C. Remus, A. Khokale, C. R. Habermann, D. Schulze, J. Fiehler, M. Heiland, J. Sedlacik and R. E. Friedrich (2015). „Early detection of pulp necrosis and dental vitality after traumatic dental injuries in children and adolescents by 3-Tesla magnetic resonance imaging.“ J Craniomaxillofac Surg 43(7): 1088-1093.
Assaf, A. T., T. A. Zrnc, C. C. Remus, M. Schonfeld, C. R. Habermann, B. Riecke, R. E. Friedrich, J. Fiehler, M. Heiland and J. Sedlacik (2014). „Evaluation of four different optimized magnetic-resonance-imaging sequences for visualization of dental and maxillo-mandibular structures at 3 T.“ J Craniomaxillofac Surg 42(7): 1356-1363.
Burian, E., F. A. Probst, D. Weidlich, C. P. Cornelius, L. Maier, T. Robl, C. Zimmer, D. C. Karampinos, L. M. Ritschl and M. Probst (2019). „MRI of the inferior alveolar nerve and lingual nerve-anatomical variation and morphometric benchmark values of nerve diameters in healthy subjects.“ Clin Oral Investig.
Chang, G., S. Boone, D. Martel, C. S. Rajapakse, R. S. Hallyburton, M. Valko, S. Honig and R. R. Regatte (2017). „MRI assessment of bone structure and microarchitecture.“ J Magn Reson Imaging 46(2): 323-337.
Chockattu, S. J., D. B. Suryakant and S. Thakur (2018). „Unwanted effects due to interactions between dental materials and magnetic resonance imaging: a review of the literature.“ Restor Dent Endod 43(4): e39.
de Oliveira-Santos, C., P. H. Souza, S. de Azambuja Berti-Couto, L. Stinkens, K. Moyaert, I. R. Rubira-Bullen and R. Jacobs (2012). „Assessment of variations of the mandibular canal through cone beam computed tomography.“ Clin Oral Investig 16(2): 387-393.
Demirturk Kocasarac, H., G. Ustaoglu, S. Bayrak, R. Katkar, H. Geha, S. T. Deahl, 2nd, B. L. Mealey, M. Danaci and M. Noujeim (2019). „Evaluation of artifacts generated by titanium, zirconium, and titanium-zirconium alloy dental implants on MRI, CT, and CBCT images: A phantom study.“ Oral Surg Oral Med Oral Pathol Oral Radiol 127(6): 535-544.
Detterbeck, A., M. Hofmeister, E. Hofmann, D. Haddad, D. Weber, A. Holzing, S. Zabler, M. Schmid, K. H. Hiller, P. Jakob, J. Engel, J. Hiller and U. Hirschfelder (2016). „MRI vs. CT for orthodontic applications: comparison of two MRI protocols and three CT (multislice, cone-beam, industrial) technologies.“ J Orofac Orthop 77(4): 251-261.
Duttenhoefer, F., M. E. Mertens, J. Vizkelety, F. Gremse, V. A. Stadelmann and S. Sauerbier (2015). „Magnetic resonance imaging in zirconia-based dental implantology.“ Clin Oral Implants Res 26(10): 1195-1202.
Flügge, T., W. Derksen, J. Te Poel, B. Hassan, K. Nelson and D. Wismeijer (2017). „Registration of cone beam computed tomography data and intraoral surface scans - A prerequisite for guided implant surgery with CAD/CAM drilling guides.“ Clin Oral Implants Res 28(9): 1113-1118.
Flügge, T., J. B. Hovener, U. Ludwig, A. K. Eisenbeiss, B. Spittau, J. Hennig, R. Schmelzeisen and K. Nelson (2016). „Magnetic resonance imaging of intraoral hard and soft tissues using an intraoral coil and FLASH sequences.“ Eur Radiol 26(12): 4616-4623.
Flügge, T., U. Ludwig, P. Amrein, F. Kernen, K. Vach, J. Maier and K. Nelson (2021). „MRI for the display of autologous onlay bone grafts during early healing-an experimental study.“ Dentomaxillofac Radiol 50(2): 20200068.
Flügge, T., U. Ludwig, J. B. Hovener, R. Kohal, D. Wismeijer and K. Nelson (2020). „Virtual implant planning and fully guided implant surgery using magnetic resonance imaging-Proof of principle.“ Clin Oral Implants Res.
Flügge, T., U. Ludwig, G. Winter, P. Amrein, F. Kernen and K. Nelson (2020). „Fully guided implant surgery using Magnetic Resonance Imaging - An in vitro study on accuracy in human mandibles.“ Clin Oral Implants Res 31(8): 737-746.
Goto, T. K., S. Nishida, Y. Nakamura, K. Tokumori, Y. Nakamura, K. Kobayashi, Y. Yoshida and K. Yoshiura (2007). „The accuracy of 3-dimensional magnetic resonance 3D vibe images of the mandible: an in vitro comparison of magnetic resonance imaging and computed tomography.“ Oral Surg Oral Med Oral Pathol Oral Radiol Endod 103(4): 550-559.
Gradl, J., M. Horeth, T. Pfefferle, M. Prager, T. Hilgenfeld, D. Gareis, P. Baumer, S. Heiland, M. Bendszus and S. Hahnel (2017). „Application of a Dedicated Surface Coil in Dental MRI Provides Superior Image Quality in Comparison with a Standard Coil.“ Clin Neuroradiol 27(3): 371-378.
Gray, C. F., T. W. Redpath, F. W. Smith and R. T. Staff (2003). „Advanced imaging: Magnetic resonance imaging in implant dentistry.“ Clin Oral Implants Res 14(1): 18-27.
Han, M. A. and J. H. Kim (2018). „Diagnostic X-Ray Exposure and Thyroid Cancer Risk: Systematic Review and Meta-Analysis.“ Thyroid 28(2): 220-228.
Hassfeld, S., J. Fiebach, S. Widmann, S. Heiland and J. Muhling (2001). „[Magnetic resonance tomography for planning dental implantation].“ Mund Kiefer Gesichtschir 5(3): 186-192.
Hilgenfeld, T., A. Juerchott, U. K. Deisenhofer, J. Krisam, P. Rammelsberg, S. Heiland, M. Bendszus and F. S. Schwindling (2018). „Accuracy of cone-beam computed tomography, dental magnetic resonance imaging, and intraoral radiography for detecting peri-implant bone defects at single zirconia implants-An in vitro study.“ Clin Oral Implants Res 29(9): 922-930.
Hilgenfeld, T., A. Juerchott, U. K. Deisenhofer, D. Weber, S. Rues, P. Rammelsberg, S. Heiland, M. Bendszus and F. S. Schwindling (2019). „In vivo accuracy of tooth surface reconstruction based on CBCT and dental MRI-A clinical pilot study.“ Clin Oral Implants Res 30(9): 920-927.
Hilgenfeld, T., A. Juerchott, J. M. E. Jende, P. Rammelsberg, S. Heiland, M. Bendszus and F. S. Schwindling (2020). „Use of dental MRI for radiation-free guided dental implant planning: a prospective, in vivo study of accuracy and reliability.“ Eur Radiol 30(12): 6392-6401.
Hilgenfeld, T., T. Kastel, A. Heil, P. Rammelsberg, S. Heiland, M. Bendszus and F. S. Schwindling (2018). „High-resolution dental magnetic resonance imaging for planning palatal graft surgery-a clinical pilot study.“ J Clin Periodontol 45(4): 462-470.
Hilgenfeld, T., M. Prager, A. Heil, F. S. Schwindling, M. Nittka, D. Grodzki, P. Rammelsberg, M. Bendszus and S. Heiland (2017). „PETRA, MSVAT-SPACE and SEMAC sequences for metal artefact reduction in dental MR imaging.“ Eur Radiol 27(12): 5104-5112.
Jacobs, R., B. Salmon, M. Codari, B. Hassan and M. M. Bornstein (2018). „Cone beam computed tomography in implant dentistry: recommendations for clinical use.“ BMC Oral Health 18(1): 88.
Jimenez-Boj, E., I. Nobauer-Huhmann, B. Hanslik-Schnabel, R. Dorotka, A. H. Wanivenhaus, F. Kainberger, S. Trattnig, R. Axmann, W. Tsuji, S. Hermann, J. Smolen and G. Schett (2007). „Bone erosions and bone marrow edema as defined by magnetic resonance imaging reflect true bone marrow inflammation in rheumatoid arthritis.“ Arthritis Rheum 56(4): 1118-1124.
Karampinos, D. C., S. Ruschke, M. Dieckmeyer, M. Diefenbach, D. Franz, A. S. Gersing, R. Krug and T. Baum (2018). „Quantitative MRI and spectroscopy of bone marrow.“ J Magn Reson Imaging 47(2): 332-353.
Ludlow, J. B., R. Timothy, C. Walker, R. Hunter, E. Benavides, D. B. Samuelson and M. J. Scheske (2015). „Effective dose of dental CBCT-a meta analysis of published data and additional data for nine CBCT units.“ Dentomaxillofac Radiol 44(1): 20140197.
Ludwig, U., A. K. Eisenbeiss, C. Scheifele, K. Nelson, M. Bock, J. Hennig, D. von Elverfeldt, O. Herdt, T. Flügge and J. B. Hovener (2016). „Dental MRI using wireless intraoral coils.“ Sci Rep 6: 23301.
Memon, A., I. Rogers, P. Paudyal and J. Sundin (2019). „Dental X-Rays and the Risk of Thyroid Cancer and Meningioma: A Systematic Review and Meta-Analysis of Current Epidemiological Evidence.“ Thyroid 29(11): 1572-1593.
Mercado, F., K. Mukaddam, A. Filippi, O. P. Bieri, T. J. Lambrecht and S. Kuhl (2019). „Fully Digitally Guided Implant Surgery Based on Magnetic Resonance Imaging.“ Int J Oral Maxillofac Implants 34(2): 529-534.
Nakamura, T. (2020). „Dental MRI: a road beyond CBCT.“ Eur Radiol 30(12): 6389-6391.
Politis, C., X. B. Ramirez, Y. Sun, I. Lambrichts, N. Heath and J. O. Agbaje (2013). „Visibility of mandibular canal on panoramic radiograph after bilateral sagittal split osteotomy (BSSO).“ Surg Radiol Anat 35(3): 233-240.
Pompa, V., S. Galasso, M. Cassetta, G. Pompa, F. De Angelis and S. Di Carlo (2010). „A comparative study of Magnetic Resonance (MR) and Computed Tomography (CT) in the pre-implant evaluation.“ Ann Stomatol (Roma) 1(3-4): 33-38.
Prager, M., S. Heiland, D. Gareis, T. Hilgenfeld, M. Bendszus and C. Gaudino (2015). „Dental MRI using a dedicated RF-coil at 3 Tesla.“ J Craniomaxillofac Surg 43(10): 2175-2182.
Probst, F. A., J. Schweiger, M. J. Stumbaum, D. Karampinos, E. Burian and M. Probst (2020). „Magnetic resonance imaging based computer-guided dental implant surgery-A clinical pilot study.“ Clin Implant Dent Relat Res 22(5): 612-621.
Probst, M., V. Richter, J. Weitz, J. S. Kirschke, C. Ganter, M. Troeltzsch, M. Nittka, C. P. Cornelius, C. Zimmer and F. A. Probst (2017). „Magnetic resonance imaging of the inferior alveolar nerve with special regard to metal artifact reduction.“ J Craniomaxillofac Surg 45(4): 558-569.
Sedlacik, J., D. Kutzner, A. Khokale, D. Schulze, J. Fiehler, T. Celik, D. Gareis, R. Smeets, R. E. Friedrich, M. Heiland and A. T. Assaf (2016). „Optimized 14 + 1 receive coil array and position system for 3D high-resolution MRI of dental and maxillomandibular structures.“ Dentomaxillofac Radiol 45(1): 20150177.
Tahmaseb, A., V. Wu, D. Wismeijer, W. Coucke and C. Evans (2018). „The accuracy of static computer-aided implant surgery: A systematic review and meta-analysis.“ Clin Oral Implants Res 29 Suppl 16: 416-435.
Techawiboonwong, A., H. K. Song, M. B. Leonard and F. W. Wehrli (2008). „Cortical bone water: in vivo quantification with ultrashort echo-time MR imaging.“ Radiology 248(3): 824-833.
Wanner, L., U. Ludwig, J. B. Hovener, K. Nelson and T. Flügge (2018). „Magnetic resonance imaging-a diagnostic tool for postoperative evaluation of dental implants: a case report.“ Oral Surg Oral Med Oral Pathol Oral Radiol 125(4): e103-e107.
Wismeijer, D., T. Joda, T. Flügge, G. Fokas, A. Tahmaseb, D. Bechelli, L. Bohner, M. Bornstein, A. Burgoyne, S. Caram, R. Carmichael, C. Y. Chen, W. Coucke, W. Derksen, N. Donos, K. El Kholy, C. Evans, V. Fehmer, S. Fickl, G. Fragola, B. Gimenez Gonzales, H. Gholami, D. Hashim, Y. Hui, A. Kokat, K. Vazouras, S. Kuhl, A. Lanis, R. Leesungbok, J. van der Meer, Z. Liu, T. Sato, A. De Souza, W. C. Scarfe, M. Tosta, P. van Zyl, K. Vach, V. Vaughn, M. Vucetic, P. Wang, B. Wen and V. Wu (2018). „Group 5 ITI Consensus Report: Digital technologies.“ Clin Oral Implants Res 29 Suppl 16: 436-442.
Zhou, W., Z. Liu, L. Song, C. L. Kuo and D. M. Shafer (2018). „Clinical Factors Affecting the Accuracy of Guided Implant Surgery-A Systematic Review and Meta-analysis.“ J Evid Based Dent Pract 18(1): 28-40.








