Behandlung eines Mundbodenkarzinoms bei einer Long-COVID-Patientin
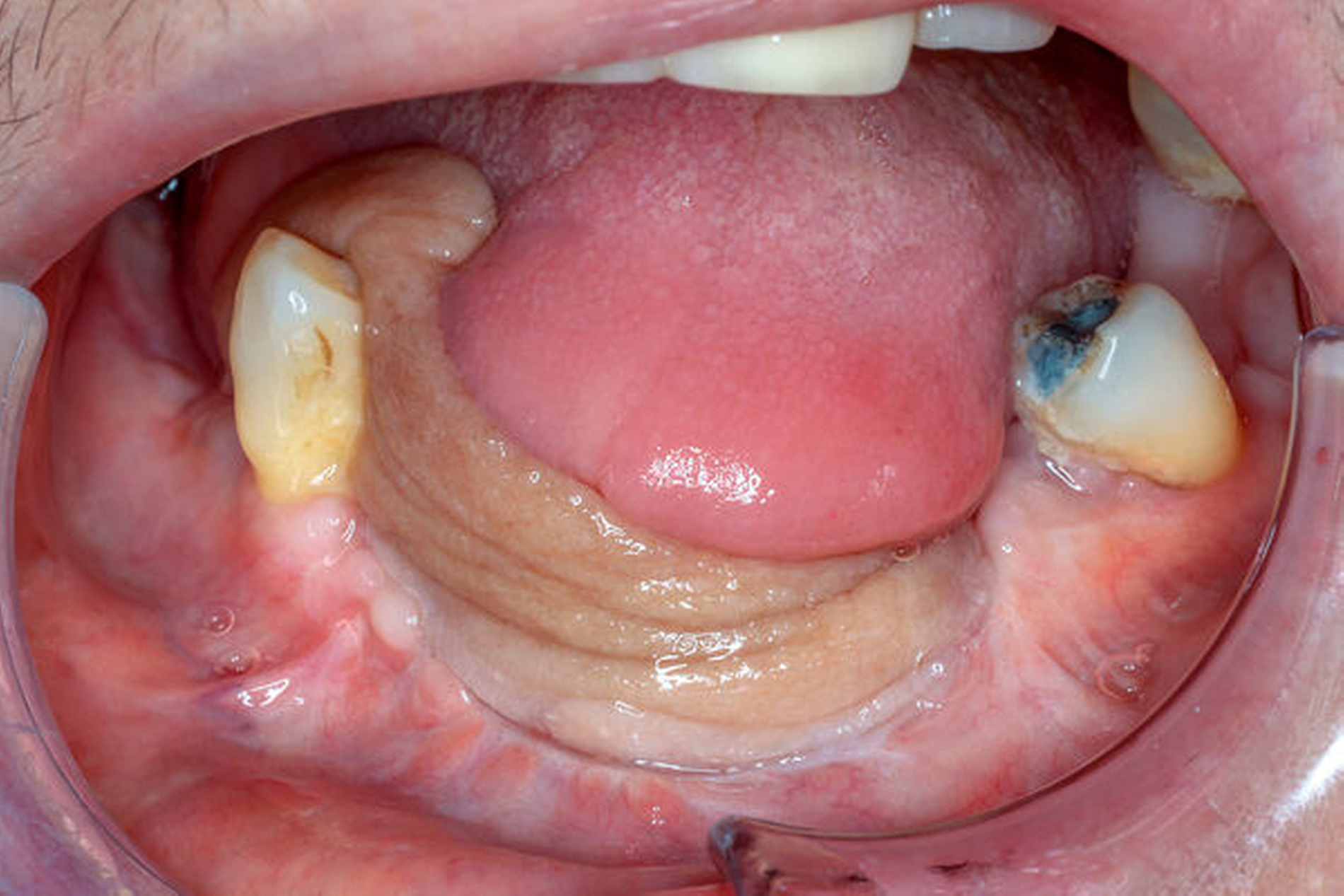
Im September 2020 stellte sich eine 58-jährige Patientin in unserer Mund-, Kiefer- und Gesichtschirurgischen Hochschulambulanz vor. Sie war von einer niedergelassenen oralchirurgischen Kollegin zur weiteren Abklärung bei klinisch hochgradigem Verdacht auf ein Plattenepithelkarzinom im anterioren Mundboden überwiesen worden.
In der allgemeinen Anamnese gab die Patientin einen Nikotinabusus in Form von zehn Zigaretten täglich seit 44 Jahren an. Einen Aufenthalt in Corona-Risikogebieten, Kontakte mit SARS-CoV-2-positiven Patienten oder Erkältungssymptome in den vergangenen 14 Tagen verneinte die Patientin. Bei der intraoralen Untersuchung zeigte sich ein exophytisch wachsender Tumor im anterioren Mundboden, rechtsbetont von etwa 2,5 cm x 1 cm Durchmesser. Im Orthopantomogramm zeigte sich ein konservierend, prothetisch und implantatprothetisch versorgtes adultes, teilbezahntes Gebiss mit einem retinierten und verlagerten Zahn 38 sowie parodontologisch stark geschädigten Zähnen 36, 46 und 47.
Zur Komplettierung des Stagings wurde am gleichen Tag eine Computertomografie der Kopf-Hals-Region und des Thorax mit Kontrastmittel angefertigt, die eine kontrastmittelaufnehmende Läsion im anterioren Mundboden rechts von circa 2 cm x 1 cm Größe zeigte. Radiologisch ergab sich kein Anhalt für eine knöcherne Arrosion des Corpus mandibulae oder eine lymphogene Metastasierung. Zusammenfassend ergab sich ein cT2 cN0 cMx-Befund.
Im Anschluss an die radiologische Diagnostik erfolgte eine Probeexzision der Tumorregion in Lokalanästhesie, die das Vorliegen eines G3-Plattenepithelkarzinoms bestätigte. Im interdisziplinären Kopf-Hals-Tumorboard wurde entschieden, der Patientin primär eine chirurgische Behandlung des Tumors zu empfehlen. Die Patientin hat sich für eine chirurgische Therapie entsprechend der Empfehlung entschieden.
Der bei stationärer Aufnahme der Patientin obligatorische Test auf das SARS-CoV-2-Virus zeigte bei fehlender klinischer Symptomatik einen positiven Befund. Nach Rücksprache mit dem Hygienebeauftragten der Mund-, Kiefer- und Gesichtschirurgischen Klinik sowie dem zuständigen Krankenhaushygieniker des Universitätsklinikums Erlangen wurde im interdisziplinären Konsens entschieden, das zu erwartende zeitnahe Abklingen der Infektionserkrankung unter regelmäßiger PCR-Testung abzuwarten und die chirurgische Tumortherapie zu verschieben.
In Absprache mit dem lokalen Gesundheitsamt am Wohnort der Patientin wurde sie nach stationärer Demission unter eine 14-tägige häusliche Quarantäne gestellt. Bei weiterhin fehlenden Symptomen der molekularbiologisch bestätigten SARS-CoV-2-Infektion wurde die Patientin am 7.10.2020 vom lokalen Gesundheitsamt erneut positiv getestet. Die Wiederholungs-Testung eine Woche später ergab schließlich einen negativen Befund. Hierauf wurde bei subjektiver Wachstumsprogredienz eine erneute klinische Vorstellung und eine Re-Staging-Computertomografie terminiert. Der hierfür entnommene SARS-CoV-2-Test ergab in der ersten Analyse nach 40 PCR-Zyklen keinen Nachweis von Virus-RNA, in der zweiten Testung ließ sich hingegen ab dem 36. PCR-Zyklus SARS-CoV-2-RNA nachweisen. Dieser Befund wurde mit dem Virologischen Institut diskutiert. Eine Infektiösität der Patientin sei sehr unwahrscheinlich – jedoch nicht unmöglich. Die Re-Staging-Untersuchung zeigte in Kenntnis der Voruntersuchung eine suspekte Kontrastmittelaufnahme am anterioren Mundboden rechts mit einer Ausdehnung von circa 2,4 cm x 1,0 cm. Es zeigten sich keine typischen CT-morphologischen Hinweise auf eine aktive SARS-CoV-2-Infektion.
Die Problematik der progredienten onkologischen Erkrankung bei mittlerweile Langzeit-SARS-CoV-2-Positivität in der PCR-Testung wurde daraufhin im interdisziplinären Kopf-Hals-Tumorboard wie auch mit den Kollegen der Anästhesiologischen Klinik erneut erörtert. Im gemeinsamen Konsens wurde das weitere Aufschieben der onkologischen Therapie im Sinne des Infektionsschutzes als nicht mehr medizinisch vertretbar angesehen. Die Patientin wurde daraufhin stationär in einem Einzelzimmer unter Einhaltung aller entsprechenden COVID-19-Hygienekautelen aufgenommen. Der bei stationärer Aufnahme obligatorische SARS-CoV-2 PCR-Test zeigte abermals einen positiven Befund nach 37 Zyklen. Daraufhin wurde gemeinsam mit dem Krisenstab des Universitätsklinikums Erlangen entschieden, ein uneingeschränktes chirurgisches Konzept unter den notwendigen infektionshygienischen Schutzmaßnahmen zu verfolgen, da die weitere Verzögerung der chirurgischen Therapie zu einer Prognoseverschlechterung der Patientin führen könnte.
Am 30.10.2020 wurde nach anästhesiologischer Einleitung in entsprechender Schutzausrüstung die Panendoskopie sowie im Anschluss die Tumoroperation als Two-Team-Approach in einem speziell für COVID-19-Patienten bereitgestellten Isolations-Operationssaal des Universitätsklinikums Erlangen vorgenommen. Zu den notwendigen Schutzmaßnahmen zählten neben obligatorischen FFP-3-Masken für alle im Operationssaal befindlichen Personen zusätzliche Vollsichtschutz-Visiere für das gesamte Operationsteam. Nach der temporären Tracheotomie wurde eine beidseitige Neck dissection der Lymphknoten-Level I-III nach Robbins sowie eine radikale Mundbodenresektion unter Mitnahme einer knöchernen Unterkiefer-Innenspange durchgeführt. An den Resektionsgrenzen wurden insgesamt vier Schnellschnitte entnommen, die nach Markierung als potenziell infektiöses Material vom Pathologischen Institut des Universitätsklinikums begutachtet wurden. Nach Bestätigung der tumorfreien Randproben konnte die Rekonstruktion mit einem mikrovaskulär anastomosierten Radialistransplantat vom rechten Unterarm durchgeführt werden. Die Unterarm-Entnahmestelle wurde mit einem Vollhauttransplantat aus der rechten Leistenregion gedeckt.
Postoperativ wurde die Patientin auf eine bereitgestellte Isolierungseinheit der operativen Intensivstation für COVID-19-Patienten verbracht. Am ersten postoperativen Tag ergab der PCR-Test noch ein grenzwertig nachweisbares Ergebnis von SARS-CoV-2-RNA nach 38 PCR-Zyklen, das in Rücksprache mit dem Institut für Virologie des Universitätsklinikums Erlangen als geringe Restausscheidung viraler RNA ohne wesentliche Infektionsgefahr gewertet wurde. Am zweiten postoperativen Tag ergab die erneute PCR-Analyse erstmalig ein negatives Ergebnis, das am Folgetag bestätigt werden konnte. Der postoperative Wundheilungsverlauf war unauffällig, weshalb die Patientin am dritten postoperativen Tag auf die Mund-, Kiefer- und Gesichtschirurgische Normalstation zurückverlegt werden konnte. In Rücksprache mit dem Virologischen Institut war ab diesem Zeitpunkt bei zwei konsekutiv vorliegenden negativen SARS-CoV-2-PCR-Nachweisen keine räumliche Isolierung mehr indiziert. Ein zusätzlich am 4.11.2020 durchgeführter Test auf SARS-CoV-2-IgG-Antikörper ergab eine quantitativ ausreichende Anzahl vorliegender Antikörper. Der weitere stationäre Verlauf war zeitgerecht und komplikationslos. In interdisziplinärer Zusammenarbeit mit den Teams der Pflege, der Physiotherapie, der Ergotherapie und der Logopädie gelang innerhalb kurzer Zeit die Mobilisation und Rehabilitation der Sprach- sowie der Schluckfunktion der Patientin. Am dreizehnten postoperativen Tag konnte die Patientin bei guter Atem- und Schluckfunktion in die ambulante Nachbehandlung entlassen werden.
Diskussion
Das Plattenepithelkarzinom der Mundhöhle stellt die mit Abstand größte Untergruppe der Malignome der Mundhöhle dar. Nach histologischer Sicherung der malignen Läsion besteht die aktuelle Erstlinientherapie aus der Resektion des Tumors in Verbindung mit einer Halslymphknotenausräumung sowie notwendigen chirurgisch-rekonstruktiven Maßnahmen und einer stadiengerechten adjuvanten Behandlung [Wolff et al., 2019]. Aufgrund des aggressiven Wachstums dieser Tumorentität in Kombination mit der bekannten hohen okkulten lymphogenen Metastasierungstendenz von 20 bis 40 Prozent zählt es zu den wichtigsten Maßnahmen, die Zeitspanne von der Diagnosestellung bis zum Behandlungsbeginn möglichst kurz zu gestalten [Sparano et al., 2004]. Mehrere Studien konnten zeigen, dass eine Verzögerung des Therapiebeginns von wenigen Wochen bereits einen signifikanten Progress des Tumorstadiums mit entsprechend negativen Auswirkungen auf die Operabilität sowie das Überleben der Patienten haben kann [Xiao et al., 2018; Hanna et al., 2020]. So konnten Murphy et al. hoch signifikante Unterschiede im medianen Gesamtüberleben von Patienten mit Kopf-Hals-Tumoren und Einleitung der chirurgischen Therapie 46 bis 52 Tage nach Erstdiagnose (71,9 Monate) gegenüber Patienten mit einer Tumoroperation 53 bis 67 Tage (61 Monate) und länger als 67 Tage (46,6 Monate) nach Initialdiagnose feststellen [Murphy et al., 2016]. Somit ist die möglichst schnelle Einleitung der Tumortherapie hoch prognoserelevant und erfordert auch im normalen klinischen Alltag aufgrund der Multimodalität der Therapiearme bereits eine sehr effiziente interdisziplinäre Zusammenarbeit in der Koordination von operativer und adjuvanter Tumortherapie sowie den gegebenenfalls notwendigen rehabilitativen Maßnahmen [Jensen et al., 2007].
Mit der derzeit herrschenden COVID-19-Pandemie kamen weitere erhebliche Schwierigkeiten hinzu. Selbstverständlich hat die schnellstmögliche therapeutische Versorgung von Patienten mit malignen Erkrankungen hierbei weiterhin höchste Priorität, die aktuell knappen Intensivbettenkapazitäten, notwendige Personalverschiebungen sowie die ausgiebigen Maßnahmen zur Infektionsprophylaxe bei COVID-19-Patienten mit entsprechenden Maßnahmen zum Schutz von Patienten und Mitarbeitern sind eine enorme zusätzliche Herausforderung. Hinzu kommt, dass die Exposition von klinischem Personal gegenüber dem SARS-CoV-2-Virus möglichst gering gehalten werden muss, um weitere Infektionen und potenzielle Ausbrüche in Krankenhäusern bestmöglich zu verhindern und nicht durch Personalausfälle die weitere medizinische Versorgung zusätzlich einzuschränken. Dies hat zur Folge, dass die Indikation und Dringlichkeit einer Therapie von Patienten mit nebenbefundlich vorliegendem Nachweis einer SARS-CoV-2-Infektion kritisch eingeschätzt werden muss.
In einem internationalen Gremium renommierter Experten in der Therapie von Kopf-Hals-Tumoren wurde daher im Konsens die Empfehlung ausgesprochen, Tumoroperationen ohne Notfallcharakter bei COVID-19-positiven Patienten und Personen mit hoher Wahrscheinlichkeit für das Vorliegen einer COVID-19-Infektion zu verschieben, bis die respiratorische Symptomatik abgeklungen ist und ein negativer Labortest vorgewiesen werden kann [Mehanna et al., 2020]. Hierbei wurden vier Wochen als höchstmögliche akzeptable Zeitspanne festgelegt, bei kleinen Tumoren (T1–2) kann unter besonderen Umständen und engmaschiger klinischer Kontrolle der Zeitraum auf maximal acht Wochen ausgeweitet werden [Mehanna et al., 2020].
In bisher vorliegenden klinischen Beobachtungsstudien zu Verläufen von COVID-19-Infektionen konnte eine durchschnittliche Dauer von weniger als 20 Tagen vom Erzielen des ersten positiven SARS-CoV-2-PCR-Testergebnisses bis zum negativen Virusnachweis festgestellt werden [Gombar et al., 2020; Xiao et al., 2020]. In diesen Studien war jedoch bei einem Teil der Patienten (10 bis 26,3 Prozent) auch nach 28 Tagen noch SARS-CoV-2-Virus mittels PCR nachweisbar. Auch Einzelfälle von deutlich prolongierten SARS-CoV-2-Infektionen über mehrere Wochen werden in der Literatur beschrieben [McKie et al., 2020; Wang et al., 2020; Wang et al., 2020; Chen et al., 2020; D’Ardes et al., 2020].
PCR-Test / Zyklusschwellwert
Aktuell stellt der Nachweis von SARS-CoV-2-RNA aus nasopharyngealen, gegebenenfalls in Kombination mit oropharyngealen Abstrichen mittels real-time quantitativer PCR den klinischen Standard in der Diagnostik dar. Hierbei werden bestimmte Zielabschnitte viraler Erbsubstanz durch exponentielle Amplifikation sichtbar gemacht.
In der klinischen Praxis verwendet man aktuell RT-PCR-Systeme, die 40 bis 45 Replikationszyklen zur exponentiellen Vermehrung der genetischen Information benötigen. Der sogenannte Cycle threshold (Ct)-Wert (Zyklusschwellenwert) gibt die Anzahl an PCR-Zyklen an, nach denen eine ausreichende Nachweisbarkeit von SARS-CoV-2-RNA in der Amplifikation erreicht wurde. Der Ct-Wert korreliert somit mit der Menge vorliegender Virus-RNA im Probenmaterial: je höher der Ct-Wert, desto niedriger die Virenlast und desto geringer die Infektiösität.
Der mittels RT-PCR ermittelte SARS-CoV-2-Nachweis unterliegt Schwankungen, die unter anderem durch präanalytische Faktoren wie beispielsweise korrekte Abnahmetechnik sowie Probenlagerung beeinflusst werden und mit Blick auf das vermutete Krankheitsstadium interpretiert werden müssen. Die Einschätzung der Nachweisergebnisse ist im Einzelfall komplex und sollte daher durch einen in der PCR-Diagnostik erfahrenen Arzt erfolgen.
Quellen: RKI, Virologisches Institut des Universitätsklinikums Erlangen
Dies deutet darauf hin, dass bei zeitlichen Verläufen einer COVID-19-Erkrankung große interindividuelle Unterschiede bestehen und dass insbesondere das klinische Erscheinungsbild und die laborchemische Nachweisbarkeit einer SARS-CoV-2-Infektion oftmals nicht miteinander korrelieren. Hierbei stellt sich die Einschätzung des tatsächlichen Infektionsrisikos von Patienten mit grenzwertig positiven PCR-Befunden als große Schwierigkeit in der klinischen Praxis dar, da Virus-RNA nachweisbar ist, jedoch nur in sehr geringer Konzentration und mit fraglicher Virulenz. Gniazdowski et al. konnten feststellen, dass ab einem medianen Wert von 27,5 PCR-Zyklen kein SARS-CoV-2-Wachstum mehr in einer Zellkultur nachweisbar ist und dass bei Werten zwischen 30 bis 40 Zyklen nur noch in 2,9 Prozent der Fälle SARS-CoV-2 in einer Kultur nachgewiesen werden kann [Gniazdowski et al., 2020].
Dennoch zählen selbstverständlich auch die grenzwertig nachweisbaren Tests als positive Ergebnisse und erfordern letztendlich eine kritische interdisziplinäre Evaluation bezüglich des tatsächlichen Infektionsrisikos, da bisher bedauerlicherweise kein einheitlicher Zyklen-Grenzwert im SARS-CoV-2-PCR-Nachweis vorliegt, ab dem ein Patient als nicht-infektiös gelten kann. In unserem klinischen Fall wurde der Zeitraum von vier Wochen positiver SARS-CoV-2-PCR-Nachweise abgewartet und ein Aufschieben der Tumortherapie – nach dezidierter Abwägung der Risiken für Patientin, Mitpatienten und Mitarbeiter – als gerade noch akzeptabel eingeschätzt. Bei langzeitpositiven Patienten mit persistierenden SARS-CoV-2-Nachweisen muss jedoch an einem universitären Standort der Maximalversorgung eine adäquate und leitliniengerechte onkologische Therapie auch unter Pandemiebedingungen gewährleistet sein. Der hier gezeigte Fallbericht soll die Notwendigkeit und in interdisziplinärer Zusammenarbeit auch die gute sowie sichere Durchführbarkeit der geforderten chirurgisch-onkologischen Behandlung unter Pandemiebedingungen darstellen. Es gab innerhalb des Zeitraums der Behandlung der Patientin keine Infektion von Mitarbeitern und Mitpatienten sowie von Kontaktpersonen.
Jacek Glajzer
Mund-, Kiefer- und Gesichtschirurgische Klinik,
Klinikdirektor: Univ.-Prof. Dr. med. Dr. med. dent. Marco Kesting, FEBOMFS,
Universitätsklinikum Erlangen
Glückstr. 11, 91054 Erlangen
jacek.glajzer@uk-erlangen.de
Dr. med. Christopher-Philipp Nobis
Mund-, Kiefer- und Gesichtschirurgische Klinik,
Klinikdirektor: Univ.-Prof. Dr. med. Dr. med. dent. Marco Kesting, FEBOMFS,
Universitätsklinikum Erlangen
Glückstr. 11, 91054 Erlangen
Dr. med. dent. Anne Bauersachs
Praxis für Oralchirurgie Dr. Anne Bauersachs
Bahnhofstr. 43, 96515 Sonneberg
PD Dr. med. Dr. med. dent. Manuel Weber
Mund-, Kiefer- und Gesichtschirurgische Klinik,
Klinikdirektor: Univ.-Prof. Dr. med. Dr. med. dent. Marco Kesting, FEBOMFS,
Universitätsklinikum Erlangen
Glückstr. 11, 91054 Erlangen
Literaturliste
1. Leitlinienprogramm Onkologie (Deutsche Krebsgesellschaft, Deutsche Krebshilfe, AWMF): S3-Leitlinie Diagnostik und Therapie des Mundhöhlenkarzinoms, Langversion 3.01(Konsultationsfassung), 2019,AWMF Registernummer: 007/100OLhttps://www.leitlinienprogramm-onkologie.de/leitlinien/mundhoehlenkarzinom/ (abgerufen am: 03.01.2021)
2. Sparano A, Weinstein G, Chalian A, Yodul M, Weber R. Multivariate predictors of occult neck metastasis in early oral tongue cancer. Otolaryngol Head Neck Surg. 2004;131(4):472-6.
3. Xiao R, Ward MC, Yang K, Adelstein DJ, Koyfman SA, Prendes BL, et al. Increased pathologic upstaging with rising time to treatment initiation for head and neck cancer: A mechanism for increased mortality. Cancer. 2018;124(7):1400-14.
4. Hanna TP, King WD, Thibodeau S, Jalink M, Paulin GA, Harvey-Jones E, et al. Mortality due to cancer treatment delay: systematic review and meta-analysis. Bmj. 2020;371:m4087.
5. Murphy CT, Galloway TJ, Handorf EA, Egleston BL, Wang LS, Mehra R, et al. Survival Impact of Increasing Time to Treatment Initiation for Patients With Head and Neck Cancer in the United States. J Clin Oncol. 2016;34(2):169-78.
6. Jensen AR, Nellemann HM, Overgaard J. Tumor progression in waiting time for radiotherapy in head and neck cancer. Radiother Oncol. 2007;84(1):5-10.
7. Mehanna H, Hardman JC, Shenson JA, Abou-Foul AK, Topf MC, AlFalasi M, et al. Recommendations for head and neck surgical oncology practice in a setting of acute severe resource constraint during the COVID-19 pandemic: an international consensus. Lancet Oncol. 2020;21(7):e350-e9.
8. Gombar S, Chang M, Hogan CA, Zehnder J, Boyd S, Pinsky BA, et al. Persistent detection of SARS-CoV-2 RNA in patients and healthcare workers with COVID-19. J Clin Virol. 2020;129:104477.
9. Xiao AT, Tong YX, Gao C, Zhu L, Zhang YJ, Zhang S. Dynamic profile of RT-PCR findings from 301 COVID-19 patients in Wuhan, China: A descriptive study. J Clin Virol. 2020;127:104346.
10. McKie AM, Jones TPW, Sykes C. Prolonged viral shedding in an immunocompetent patient with COVID-19. BMJ Case Rep. 2020;13(10).
11. Wang X, Huang K, Jiang H, Hua L, Yu W, Ding D, et al. Long-Term Existence of SARS-CoV-2 in COVID-19 Patients: Host Immunity, Viral Virulence, and Transmissibility. Virol Sin. 2020:1-10.
12. Wang J, Hang X, Wei B, Li D, Chen F, Liu W, et al. Persistent SARS-COV-2 RNA positivity in a patient for 92 days after disease onset: A case report. Medicine (Baltimore). 2020;99(34):e21865.
13. Chen W, Hu Z, Yi C, Chi Y, Xiong Q, Tan CW, et al. An unusual COVID-19 case with over four months of viral shedding in the presence of low neutralizing antibodies: a case report. J Biomed Res. 2020;34(6):470-4.
14. D'Ardes D, Boccatonda A, Rossi I, Pontolillo M, Cocco G, Schiavone C, et al. Long-term Positivity to SARS-CoV-2: A Clinical Case of COVID-19 with Persistent Evidence of Infection. Eur J Case Rep Intern Med. 2020;7(6):001707.
15. Gniazdowski V, Morris CP, Wohl S, Mehoke T, Ramakrishnan S, Thielen P, et al. Repeat COVID-19 Molecular Testing: Correlation of SARS-CoV-2 Culture with Molecular Assays and Cycle Thresholds. Clin Infect Dis. 2020.