Wir sind alle Kinder des Lungenfischs
Fast alle Varianten der Zahnentwicklung waren im Genom der frühen Lungenfische angelegt und führten zu den vielfältigsten Formen der Zähne, der Resorption von Zahnplatten und der lebenslangen Neubildung von Ersatzzähnen sowie deren hypoplastischen Entwicklungsdefekten oder kariösen Läsionen – 400 bis 200 Millionen Jahre bevor Wirbeltiere das Land eroberten.
Die Amphibien begnügten sich mit einfacheren Dentitionen, auch die Reptilien und erst recht die zahnlosen Vögel mit schlafenden Zahn-bildungsgenen. Und mit den Säugetieren kam im Lauf der Evolution eine größere Vielfalt von Dentitionen. Aber niemals wieder wurde der Formenreichtum der Zähne des Lungenfischs erreicht.
Von der Endodontologie zur Endodontie
Der deutsch-amerikanische Biologe Ernst Mayr hatte anlässlich seines 100. Geburtstags 2004 zutreffend das Einzigartige der Biologie („What makes biology unique“) herausgehoben: Sie sei mehr als die Summe ihrer stofflichen Physik und Chemie.
Die Dynamiken biologischer Entitäten sind nicht allein mit den bekannten Naturgesetzen dieser Disziplinen zu erklären, sondern enthalten darüber hinaus eigene Antriebskräfte. Und das trifft ganz besonders auf die Entwicklungsbiologie zu. Deshalb ist auch die Endodontologie eine komplexe Wissenschaftsauffassung der entwicklungsbiologischen, biophysikalischen und biochemischen Grundlagen von Struktur und Funktion ektomesenchymaler und mesenchymaler Gewebe der Zähne, die neben dem Schmelz den absoluten Hauptteil der Zahnsubstanz ausmachen. Konsequenterweise ist dann die klinische Endodontie mit Diagnostik und Therapie nur so gut und sicher, wie die Endodontologie eindeutige und belastbare wissenschaftliche Fakten zur Verfügung stellt.
Warum hat der Australische Lungenfisch ein 14-mal größeres Genom als wir?
Der Neoceratodus forsteri wurde 1870 vom deutsch-australischen Zoologen Johann Ludwig Gerard Krefft im Bay District von Queensland, Australien, entdeckt und irrtümlicherweise, jedoch naheliegend, als Amphibium bezeichnet [Kemp, 1977]. Anderthalb Jahrhunderte später klärte eine internationale Biologengruppe unter der Leitung von Axel Meyer aus Konstanz die Bedeutung des Riesen-Genoms für den Landgang der Wirbeltiere [Meyer et al., 2021]. Diese rasante Genom-Ausdehnung bei frühen Australischen Lungenfischen fand vor 400 bis 200 Millionen Jahren (Ma) statt und verlangsamte sich nach dem Godwana-Abbruch zur Formierung der späteren Erdkontinente vor etwa 180 Ma bis heute. Es ist das größte Genom aller Tiere und hat damit eine Schlüsselposition in der Evolution als der nächste Verwandte der Tetrapoden – dazu gehören alle lebenden Vierfüßler und natürlich auch unsere Vorfahren, die Australopithecinen, und heute wir selbst. Erst auf der Grundlage des Australischen Lungenfisch-Genoms sind die Innovationen bei der Terrestrialisierung möglich geworden, die zu den Amphibien, Reptilien, Vögeln und schließlich Mammalia (Säugetiere) geführt haben.
Einschränkend gilt natürlich, dass das Wissen über die frühen Stadien der Evolution so lückenhaft ist, dass es auch eine andere Kreatur gewesen sein könnte, die das Land eroberte und deshalb unser aller Vorfahre wurde. Die Evolution lebt ohne Zweifel vom Zufall, und die einen sterben aus, die anderen überleben, worauf seit Stephen J. Gould [1989], Neil Shubin [2013] und Anne Kemp [2021] alle großen Paläobiologen immer wieder hingewiesen haben.
Warum ändern sich Endodont und Parodont vom Flossentier zum Vierfüßler so wie kein anderes Organ?
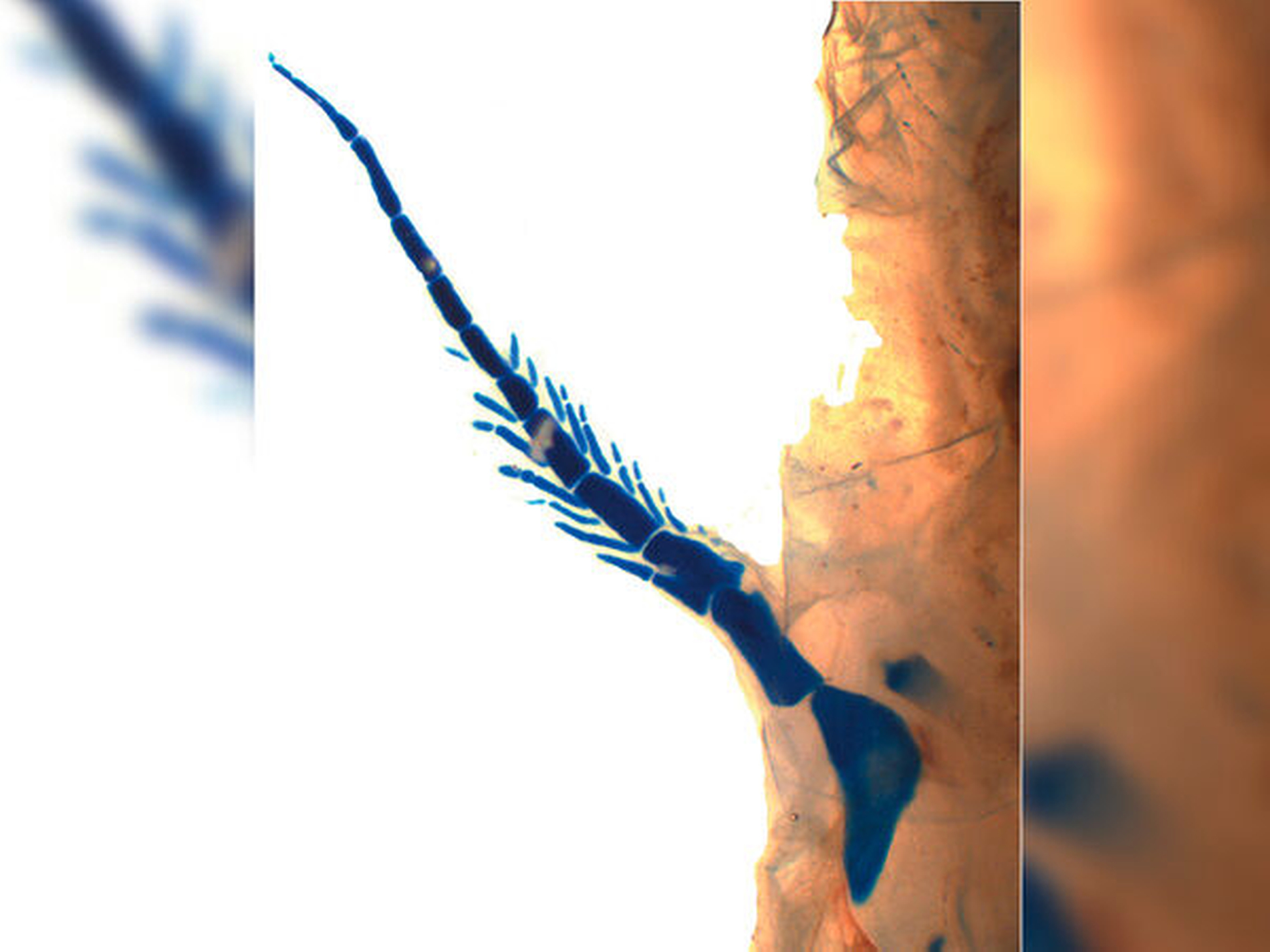
Die Antwort beginnt beim Australischen Lungenfisch. Die bis heute bedeutendste Bearbeitung an Larven, Jungfischen und Erwachsenen liegt von Anne Kemp [1977] vor. Aus verschmelzenden Conodont-Zähnen (der Urform aller Zähne als Kegel ohne jegliche Invaginationen) entstehen in Ober- und Unterkiefer je zwei paarige Zahnplatten, die akrodontal (knöchern) mit dem Kieferknochen verwachsen sind. Sie bestehen aus Dentin und Osteodentin mit einer härteren oralen Schicht von Enemaloid (einem mesenchymalen schmelzähnlichen Durodentin), das trotzdem rasch abradiert wird, vor allem bei der Ernährung mit Muscheln. Zusätzlich, wenn auch nur bei Larven, bilden sich labiale kleinere Zahnplatten. Diese befestigen sich an einem Knorpelbogen und werden als ein Mesiodens im jugendlichen Stadium resorbiert. Zwei kleinere Zahnplatten labial vom Pflugscharbein (Vomer) verbleiben auch beim erwachsenen Fisch. Von entscheidender Bedeutung für die Entwicklungsbiologie der Zähne sind demnach folgende Merkmale beim Landgang der Fische:
Aus dem Endoderm hervorgegangenes orales Epithel induziert das Mesenchym zur Zahnentwicklung mit Enemaloid, Dentin und Osteodentin mit akrodontaler knöcherner Kieferbefestigung und (nur bei Larven) mit Zahn-Knorpel-Verbindung wie bei Haifischen.
Zahnkeime verschmelzen während der Dentinbildung einzelner conodontaler Zähne (Urkonus) zu Zahnplatten.
Abrasion der Zahnplattenspitzen und -höcker
Resorption von Zähnen und Zahnplatten nach dem Larvenstadium
Resorption aller Zahnplatten anterior und posterior, aber auch knochenseitig (apikal)
Apposition neuer conodontaler Zähne posterior an den Platten anstelle von fehlenden Ersatzzähnen
Hypoplasien von Enemaloid und Dentin als bekannte Entwicklungsdefekte (wie beim Menschen!) direkt nach dem Larvenstadium
Dentinkaries/Erosionen durch Biofilme in Schleimhaut-bedeckten Zahnplatten
Diese hohe Komplexität ist paläoanatomisch bei Lungenfischen seit dem Devon nachgewiesen. Die Vielzahl der Zähne hört nach den Knorpelfischen wie Haien und Rochen auf. Die morphologische Vielfalt bringt der Lungenfisch mit zu uns Tetrapoden, und sie kulminiert in extrem funktioneller Anpassung (wie Giftzähnen von Schlagen) oder völliger Zahnlosigkeit bei Erhalt der genetischen Information (wie bei Vögeln).
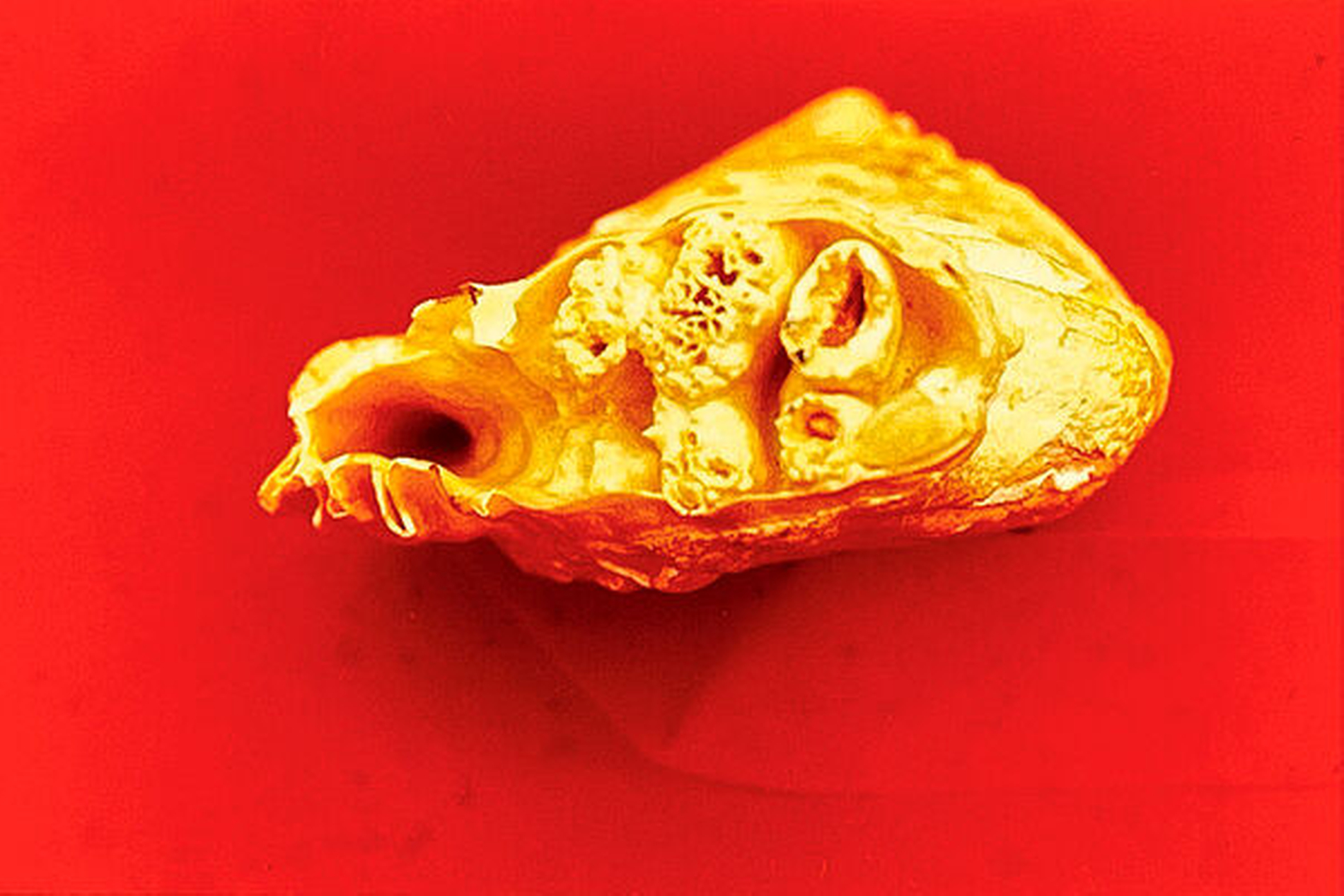
Also verdanken die meisten Vierfüßler (aber eben nicht alle) dem Riesen-Genom wie einem „selbstsüchtigen Gen“ (Selfish Gene) [Dawkins, 1976] nach seiner Landeroberung die Innovationen des Pulpa-Dentin-Komplexes und des thekodontalen Parodonts mit in Alveolen verankerten Zähnen und mit dem krönenden Abschluss der ektodermalen Schmelzentwicklung aus der Neuralleiste. So beginnt die Endodontologie und Periodontologie* tatsächlich erst mit der Landnahme.
Klinische Konsequenzen
Entwicklungsbiologisch zeigt das Endodont eine wahre Vielfalt von Dentinbildungen [Gängler, 1986, 2000; Gängler und Metzler, 1989; Arnold et al., 2008]:
Mesodentin (unregelmäßige Tubuli mit noch zentrifugalem Wachstum wie Knochen)
Osteodentin (mit Trabekulardentin und Vasodentin mit Gefäßeinschlüssen an Basis oder Krone)
Semidentin (mit uni- oder bipolaren Odontoblasten, anfangs ohne Pulpakammer, später mit Pulpa bei einigen Haien und mehreren Fischen)
Orthodentin (parallele Tubuli bei allen Mammalia, als Plicadentin mit Faltungen pulpawärts bei Fischen, Amphibien, Reptilien-Giftzähnen und Elefanten-Molaren)
Diese Endodontogenese mit vielfältigen Übergängen ist im Silur vor 460 Ma bei den Haien und Rochen entstanden, weiterentwickelt bei frühen Fischen wie dem Lungenfisch im Devon vor 420 Ma. Aber die Ektodontogenese mit eher einfältigen Schmelzentwicklungen in zwei Formen, dem prismatischen und dem aprismatischen Schmelz, setzte erst mit den Reptilien vor 310 Millionen Jahren im Carbon ein. Die Endodontologie ist damit die Mutter aller dentalen Wissenschaften. Und das ist auch die wichtigste klinische Konsequenz! Kein anderes Gebiet außer dem Pulpa-Dentin-Komplex hat eine so vielfältige orale Physiologie und Pathologie, die die alltägliche zahnmedizinische Praxis unmittelbar beeinflusst:
Das humane Endodont von Milch- und bleibenden Zähnen ist am einfachsten aufgebaut, gemessen an allen Schritten der Endodontogenese. Es hat eine einmalige Innervation, die nirgendwo anders im Organismus vorkommt. Die ektomesenchymalen (!) Odontoblastenfortsätze übertragen an freie Nervenendigungen einen biologisch sinnlosen physiologischen Schmerz, die Entzündung löst einen pathologischen Schmerz aus, der auch niemandem hilft.
Alle pathologischen Reaktionen auf bakterielle Infektionen wie bei Karies und auch Traumata lösen nach dem Konzept von Progression und Stagnation ausschließlich älteste phylogenetische Reaktionsmuster im Pulpa-Dentin-Komplex aus. Das betrifft in einem wirtsabhängigen Wechsel Resorptionen und Appositionen, den Zelluntergang der ewigen Odontoblasten und den Ersatz durch Fremdzellen aus dem Bindegewebe, die begrenzt-permanente Eruption lebenslang zum Abrasions-Ausgleich und schließlich die Reizdentinbildung zum Schutz der Pulpa.
Die Pulpakammer ist aber bei omnivoren Menschen allein als Platzhalter für die lebenslange Dentinbildung funktionsfähig.
Konsequenterweise ist das Regenerationspotenzial nach Abschluss der Wurzelbildung nahe Null. Ausnahmen sind Dentin-Brückenbildungen bei Überkappungen durch sekundäre Odontoblasten mit Orthodentin, Osteodentin oder Vasodentin.
Die Entzündung der Pulpa geht in raschen Progressionsschüben und sehr langen Stagnationsphasen auf das apikale Parodont über. Die Degeneration der Zellen führt zu partiellen oder totalen Nekrosen, der Zahn in seinem Zahnbett ist aber nicht „tot“, sondern bildet ein weiterhin vitales System – die Wurzeloberflächen in den Alveolen ermöglichen unverändert biologische Interaktionen. Daraus ergibt sich eine unikale Pathogenese apikaler Parodontitiden, die am lebenden Zahn eine lebenslange endodontische Zahnerhaltung ermöglicht. Und das ist kein Wortspiel. Der Schutz vitalen Zements und regenerationsfähigen Knochens hat deshalb Priorität.
Die Histopathologie in der Therapie
Was man in der Klinik weder mit bloßem Auge, Mikroskopen oder bildgebenden Verfahren sehen kann, verrät die Histopathologie, die uns einen detaillierten Zugang zum Inneren der Gewebe verschafft.
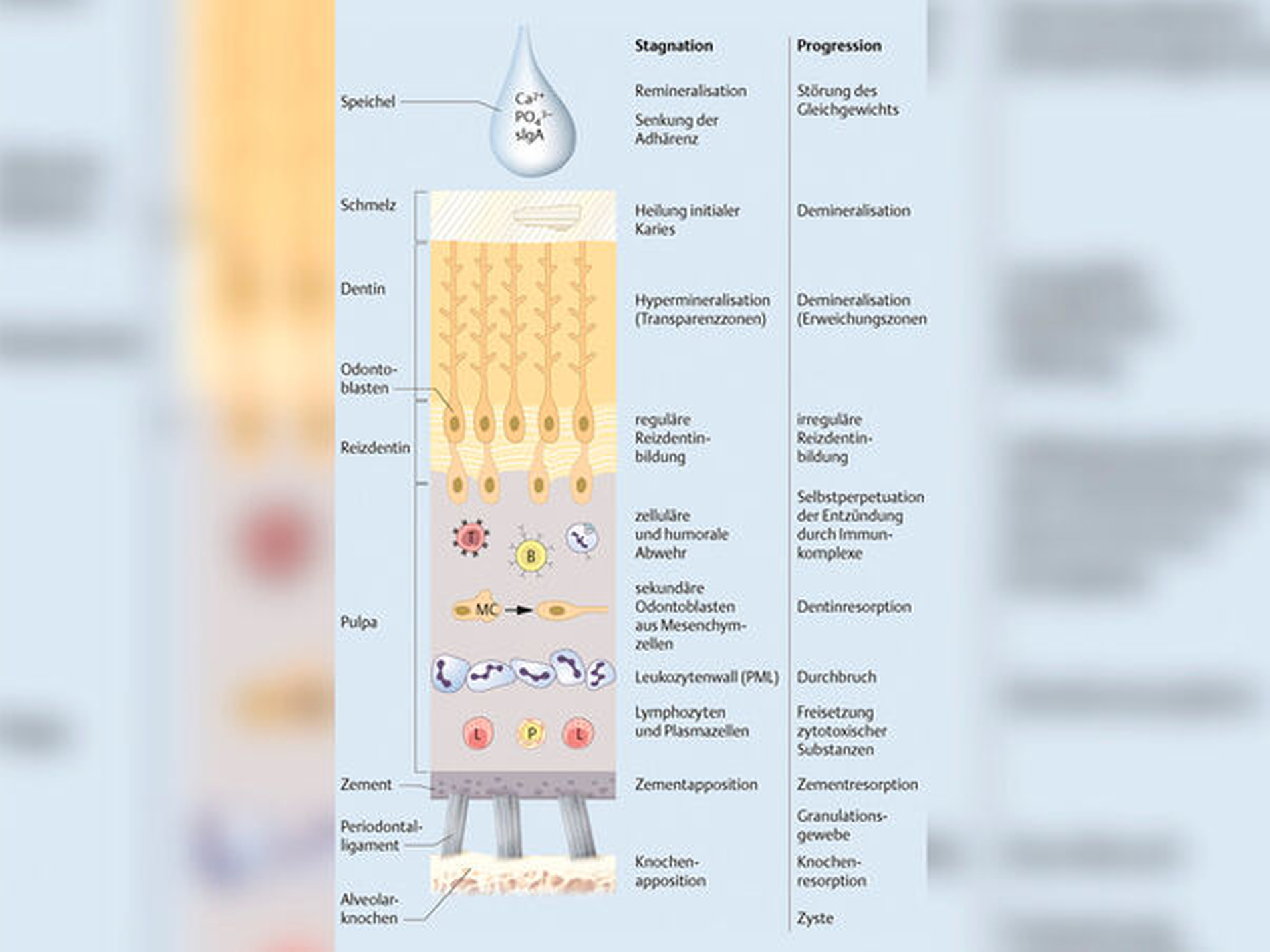
Die Entzündung verläuft an komplexen Gewebeverbänden mit Zement, Knochen und Periodontalligament mesenchymaler Herkunft und Pulpa und Dentin ektomesenchymaler Herkunft aus der Neuralleiste. Diese völlig unterschiedlichen Zellen im Entzündungsfokus finden sich an keinem anderen Organ. Deshalb ist die zelluläre Wirtsreaktion auch so vielgestaltig, wobei Resorption und Apposition von Zement und Knochen im Vordergrund stehen, gefolgt von Degeneration und Regeneration vieler beteiligter Zellen. Aber eine vollständige Heilung bleibt für immer ausgeschlossen, weil einer Zelllinie, den ektomesenchymalen primären Odontoblasten, die Regeneration verwehrt bleibt. Die Entzündungsformen werden von der Immunreaktion und den Mediatoren wie Peptiden, Prostaglandinen und Zytokinen beeinflusst.
Die primäre akute apikale Parodontitis
Sie ist ausgesprochen selten und entsteht – wie die primär akute Pulpitis – durch ein akutes Trauma und ist durch Gefäßreaktionen mit massenhafter Ausschwemmung von polymorphnukleären Leukozyten und Makrophagen charakterisiert. Bei geschwächter Abwehrsituation kann die Entzündung abszedieren und sich weiter ausbreiten. Häufig heilt sie aber auch narbig aus oder geht in eine chronische Parodontitis über.
Die Therapie ist meist abwartend oder bei Progression, insbesondere bei akut-traumatischer Dislokation, mit sofortiger Trepanation und bei Weichteil-Abszedierung durch Inzision verbunden.
Die sekundäre akute apikale Parodontitis
Sie entsteht als Exazerbation chronischer Läsionen, meist in Form eitriger Einschmelzungen (periapikale Abszesse). Dieser Phönixabszess entsteht, wenn eine akute Entzündung chronifiziert und später – wie Phönix aus der Asche – als wiederholter Abszess aufsteigt. Dabei entsteht die Ansammlung eines Exsudats mit massenhaften polymorphnukleären Leukozyten und einigen Makrophagen, wodurch die Osteoklasten zu rascher Resorption des umgebenden Alveolarknochens aktiviert werden.
Die Entzündung dehnt sich als Osteomyelitis auf den Knochen aus. In der enossalen Phase breitet sich Eiter durch den Knochen aus und sammelt sich subperiostal (subperiostale Phase). Nach Durchbruch des Periosts entsteht ein Weichgewebeabszess (submuköse oder subkutane Phase).
Der Abszess kann vor dem Durchbruch in den Knochen auch abgekapselt werden (chronischer Abszess). Neben typischen Schaumzellen, das sind mit Lipidgranula gefüllte Makrophagen, umgeben weitere Entzündungszellen den Nekroseherd, der peripher von faserreichem Bindegewebe als Abszessmembran umschlossen wird. Die osteoklastische Aktivität in der Umgebung wird sofort reduziert.
Die Therapie umfasst die frühe Trepanation und selten die Inzision. Eine Antibiotika-Gabe ist nur bei Bakteriämie mit Fieber indiziert. Die Wurzelkanalbehandlung erfolgt zeitnah.
Seltener als granulomatöse Läsionen können periapikale odontogene Zysten infiziert werden. Mit vollständiger Eiterfüllung zeigen sie dann das Bild eines periapikalen Abszesses, der zur Fistelbildung führen kann. Die Therapie schließt die Trepanation, mitunter mit chirurgischer Intervention und Wurzelkanalbehandlung, ein.
Die chronische apikale Parodontitis
Die Läsion ist der typische Ausdruck langfristig unterhaltener resorptiver und proliferativer Entzündungsformen, die durch Apposition von Zement und Knochen ergänzt werden.
Bei stagnierenden Läsionen wird dabei eine knöcherne Lamina cribriformis wieder aufgebaut, sie entsprechen dann dem Befund der Parodontitis apicalis chronica granulomatosa. Bei diffus in den Knochen ausgebreiteten Resorptionen entsteht das Bild der Parodontitis apicalis chronica diffusa.
Der entzündliche Hartgewebsverlust wird grundsätzlich durch Granulationsgewebe ersetzt. Dieses ist immer durch akute und chronische Entzündungszellpopulationen charakterisiert, in der Hälfte aller Fälle werden abgekapselte Abszesse gefunden [Lin et al., 1996]. Bis zu 40 Prozent des meist herdförmigen Infiltrats besteht aus Lymphozyten und Plasmazellen, die hauptsächlich IgG und IgA produzieren. Makrophagen kommen als Schaumzellen mit Lipidgranula vereinzelt oder auch in Haufen vor. Polymorphnukleäre Leukozyten variieren je nach dem Grad des akuten Schubes sehr stark.
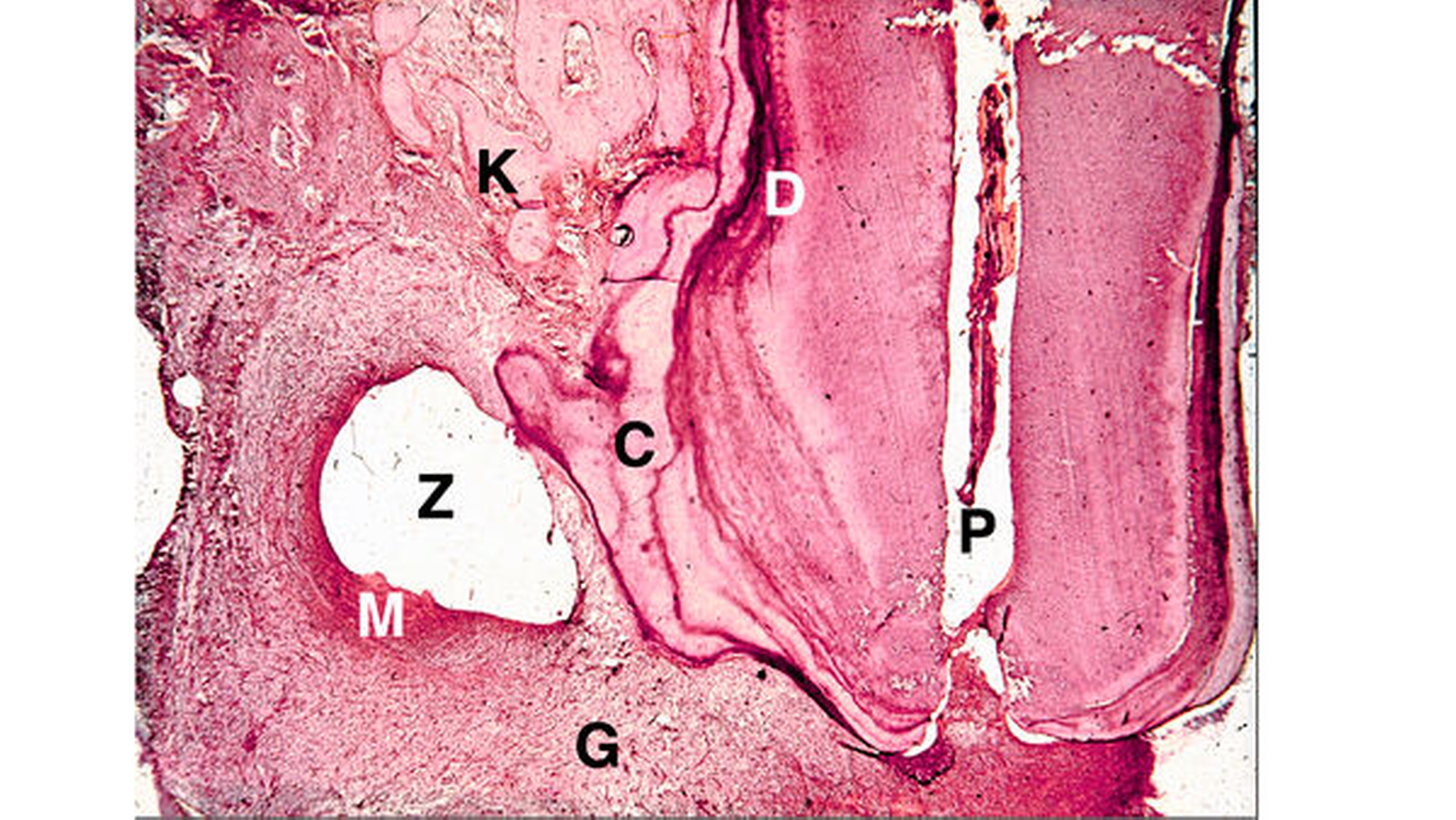
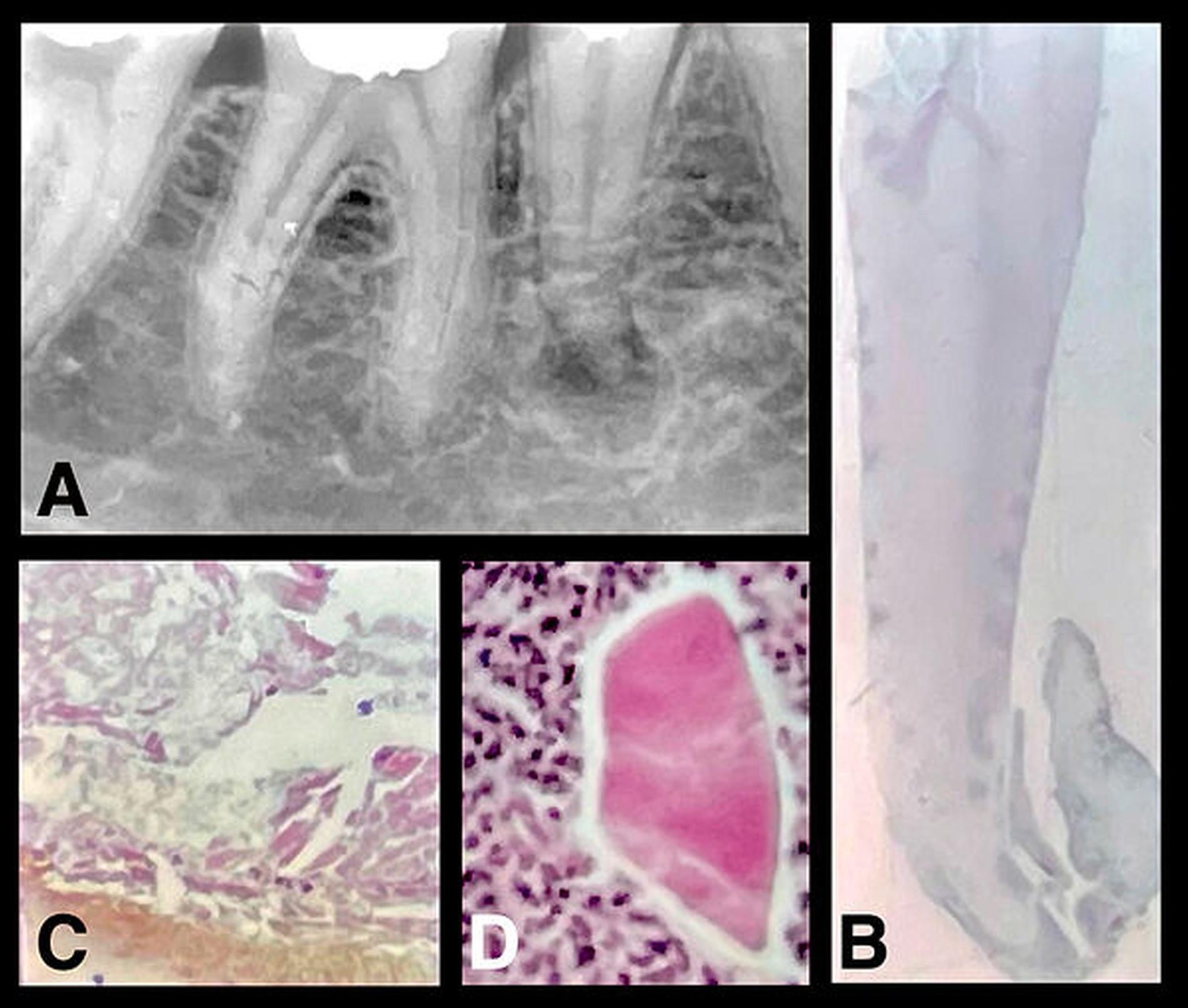
Bei der Ausdehnung des fibroblastenreichen Granulationsgewebes sprossen Arteriolen, Kapillaren und Venolen ein, die zahlreiche Anastomosen bilden. Die granulomatöse Form bildet im Gegensatz zur diffusen Parodontitis eine kollagenfaserreiche Bindegewebskapsel, die durch Zementanbau mit dem Zahn fest verwachsen sein kann.
Unter dem Einfluss der Entzündung proliferieren die Malassez-Epithelreste zu mehrschichtigen Epithelsträngen, die in 10 bis 50 Prozent der granulomatösen Läsion zur Zystenbildung führen. Während des Zystenwachstums entsteht durch intraepitheliale Apoptose und Autolyse der zentralen Zellen im proliferierenden Zellhaufen ein Hohlraum. Offenbar werden die Zellen des Zystenepithels sekretorisch tätig. Im Zystenhohlraum befindet sich deshalb eine gelblich-bräunliche Flüssigkeit, die meist Cholesterinkristalle aus Membranlipiden der untergegangenen Leukozyten enthält. Durch zerfallene Zellen (Epithelzellen, polymorphnukleäre Leukozyten, Makrophagen) hat sie eine höhere Osmolalität als das Serum, so dass wahrscheinlich Flüssigkeit aus der Umgebung in den Zystenhohlraum einströmt. Subepithelial befindet sich ein entzündliches Infiltrat mit Lymphozyten und Plasmazellen, die vorwiegend IgG und IgA produzieren. Durch Entzündungsmediatoren werden Osteoklasten zum Knochenabbau stimuliert. Die Zyste wird schließlich von einer kollagenfaserreichen bindegewebigen Kapsel umgeben, die wie die Kapsel des Granulationsgewebes auch durch Zementapposition mit dem Zahn verwachsen sein kann.
Die Therapie schließt alle Stufen einer antibakteriellen Wurzelkanalbehandlung ein, gefolgt von einer lebenslangen radiografischen Kontrolle der Remission, Stagnation oder Progression der Läsion und Zyste. Die Röntgen-Kontrolle erfolgt je nach Progressionsverlauf nach 6, 12 und 24 Monaten und nach 3, 5 und 10 bis 20 Jahren.
Warum kann ein toter Zahn länger überleben als ein Implantat?
Die humane omnivore Dentition des „Allesfressers“ ist durch Reduktion der Zahnzahl, des Zahnwechsels und der vielen Dentinformen in der Phylogenese sehr einfach geworden, obwohl bei pathologischen Reaktionen ein Rückgriff auf fast alle phylogenetischen Entwicklungsformen des Endodonts und Parodonts erfolgt. Wenn trotz dieser Simplizität unserer Zähne eine Regeneration verlorengegangener primärer Odontoblasten ausgeschlossen ist und ein ektomesenchymaler Pulpa-Dentin-Komplex sich aus der embryonalen Neuralleiste nicht neu bilden kann, dann ist nach Pulpaverlust und periapikaler Entzündung immer noch eine Reparaturheilung möglich. Über alle mineralisierenden und nicht-mineralisierenden Zelllinien in Endodont, Parodont und Knochen ist eine Zahnerhaltung biologisch und phylogenetisch Erfolg versprechender als ein Implantat, das letztlich nur zwei zelluläre Interaktionen mit seiner Umgebung erlaubt: die Osseointegration und die Epithelanheftung. Das komplexe Organ Zahn unterscheidet sich eben von allen anderen endoprothetischen Materialien.
So greifen alle bisherigen Zahnimplantate im besten Fall nur auf den allerältesten Befestigungsmodus der Ankylose im Sinn der knöchernen Zahn-Kiefer-Befestigung als Akrodont der Fische zurück. Aber während der Australische Lungenfisch das Akrodont seiner Zahnplatten mit anterioren und posterioren sowie sogar apikalen Dentinresorptionen abbauen und mit neuen Zahnabschnitten wieder aufbauen kann, verbleibt dem Mensch mit Zahnimplantat bei erfolgreicher Osseointegration nur die Osseodesintegration bei entzündlicher Knochenresorption. Außerdem ist selbst ein osseointegriertes Implantat ohne Periodontalligament am lebenslangen Umbau des Knochens nicht beteiligt.
* Anmerkung der Redaktion: Der Begriff „Periodontologie“ soll analog zum Begriffspaar „Endodontologie/Endodontie“ an die im Englischen etablierten Bezeichnungen „Periodontology/Periodontics“ anknüpfen, die den Unterschied zwischen Forschung und Klinik deutlich machen. Im deutschen Sprachgebrauch wird der Begriff „Parodontologie“ weitgehend übergreifend verwendet. Einige Zahnärzte verwenden jedoch auch hierzulande für ihre klinische Tätigkeit den Begriff „Parodontie“ und betonen damit implizit die Differenz zur wissenschaftlichen Disziplin der Parodontologie.
Prof. Dr. Dr. H. C. Peter Gängler
ORMED, Institute for Oral Medicine at the University of Witten/Herdecke, Alfred-Herrhausen-Str. 45, 58455 Witten
Dr. Tomas Lang
ORMED, Institute for Oral Medicine at the University of Witten/Herdecke, Alfred-Herrhausen-Str. 45, 58455 Witten
Literaturliste
Mayr A. What Makes Biology Unique? Considerations on the Autonomy of a Scientific Discipline. Cambrigde University Press, Cambridge, UK, 2004
Kemp A. The pattern of tooth plate formation in the Australian lungfish, Neoceratodus forsteri Krefft. Zool J Linnean Soc 60 (1977), 223-258
Kemp A. Persönliche Mitteilung 14. 6. 2021
Meyer A, Schloissnig S, Franchini P et al. Giant lungfish genome elucidates the conquest of land by vertebrates. Nature 590 (2021), 284-289
Gould SJ. Wonderful Life. The Burgess Shale and the Nature of History. W.W. Norton & Co. New York, USA, 1989
Shubin N. The Universe Within. Discovering the Common History of Rocks, Planets, and People. Pantheon Books New York, USA, 2013
Gängler P, Metzler E. Die periodontale und endodontale Differenzierung der Odontogenese – Der Weg zum Thekodont. Teile I bis III. Freiberger Forsch. Heft C 419 (1988), 122-129; C 427 (1988), 85-94; C 436 (1989), 70-92, Dtsch. Verlag Grundstoffind., Leipzig
Gaengler P. Evolution of Tooth Attachment in Lower Vertebrates to Tetrapods. In: Teaford MF, Smith MM, Ferguson WJ: Development, Function and Evolution of Teeth. Cambridge University Press, Cambridge, UK, 2000, 173-185
Gängler P. Klinische und experimentelle Aspekte der vergleichenden Odontologie und Periodontologie. Nova Acta Leopoldina NF 262, 58 (1986), 525-537
Gängler P, Kosa W, Metzler E, Schuder S. Degeneration und Regeneration des Endodonts und Periodonts als Kopie phylogenetischer Zahnentwicklungsmuster. Zahn-Mund-Kieferheilkd. 76 (1988), 4-13
Gängler P. Die Pathogenese der Zahnkaries und Periodontalerkrankungen – das Konzept von Progression und Stagnation. Zahn-Mund-Kieferheilkd. 73 (1985), 477-483
Dawkins R. The Selfish Gene. Oxford University Press, Oxford, UK, 1976
Arnold WH, Naumova KI, Naumova EA, Gaengler P. Comparative qualitative and quantitative assessment of biomineralization of tooth development in man and zebrafish (Danio rerio). Anat Rec (Hoboken), 291 (2008), 571-576
Gängler P et al. (Hrsg): Konservierende Zahnheilkunde und Parodontologie. 3. Aufl. (2010), Thieme, Stuttgart
Lin L, Gaengler P, Langeland K. Periradicular curettage, Int. Endod. J. 29 (1996), 220-227









