Periimplantäre Infektionen – ein Update mit Ausblick
Periimplantäre Infektionen sind pathologische Prozesse, die durch entzündliche Veränderungen im suprakrestalen Bindegewebe um zahnärztliche Implantate charakterisiert sind. Sie treten sowohl an Titan- als auch an Keramikimplantaten (Zirkondioxid) auf [Schwarz et al., 2018; Fretwurst et al., 2020; Becker et al., 2017] (Abbildung 1). Das Fortschreiten der Erkrankung führt zu einem progressiven, nicht-linear verlaufenden Knochenverlust [Schwarz et al., 2018; Berglundh et al., 2018]. Die Progression ist sowohl im nativen als auch im augmentierten Knochen weitestgehend vergleichbar [Carcuac et al., 2020].
Klinische Charakteristika und Diagnostik
Periimplantäre Infektionen lassen sich durch einfache klinische Maßnahmen wie visuelle Inspektion, Palpation und periimplantäre Sondierung diagnostizieren [Berglundh et al., 2018]. Durch die Abnahme der Suprakonstruktion können die klinischen Befunde genauer bestimmt werden [Serino et al., 2013].
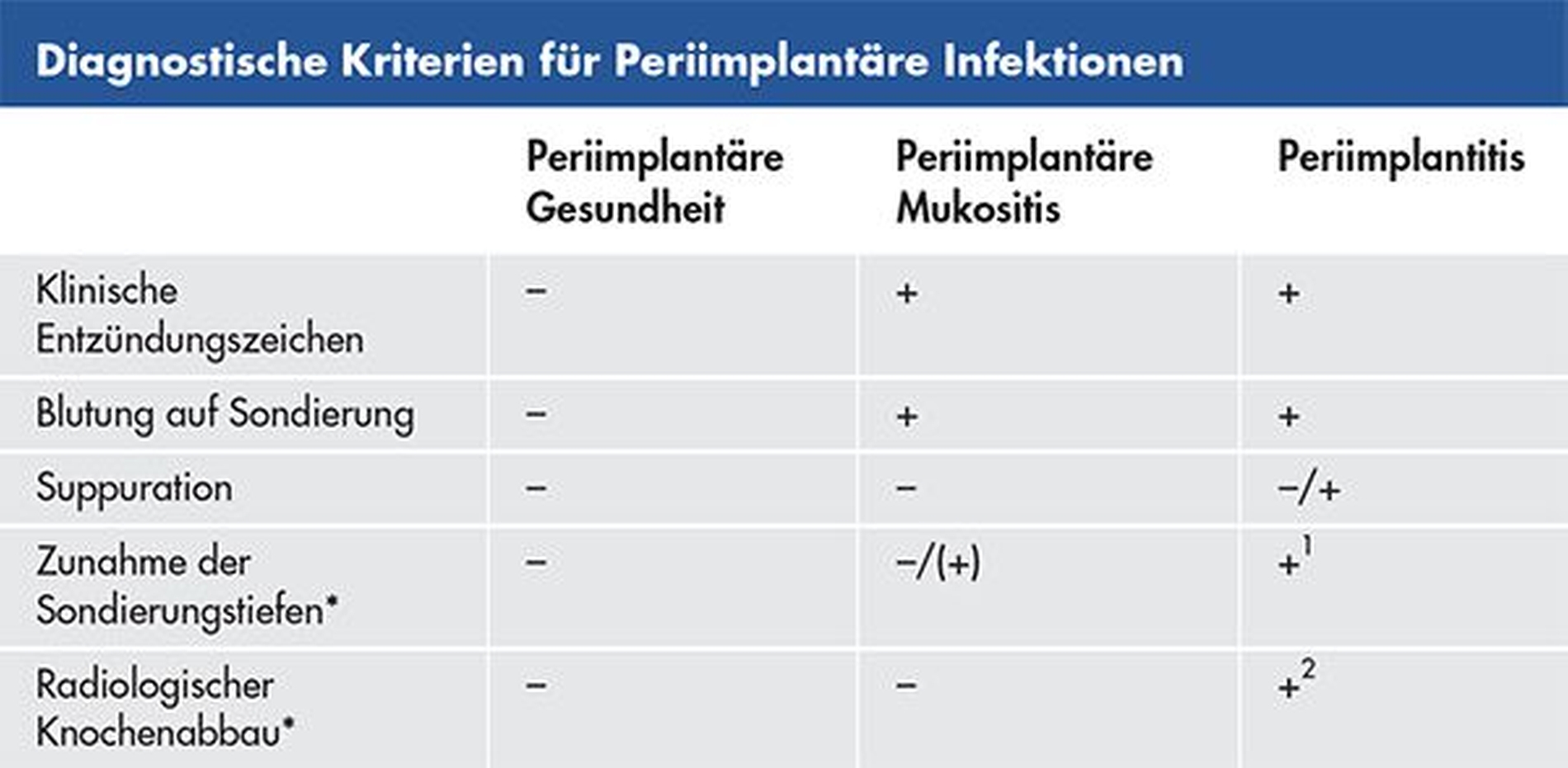
Zu den häufigsten klinischen Entzündungszeichen zählen erythematöse und hyperplastische Veränderungen im Bereich der periimplantären Mukosa, die mit einer positiven Blutung auf Sondierung (BOP) in Verbindung stehen [Berglundh et al., 2018]. Im Vergleich zu gesunden periimplantären Gewebestrukturen sind die BOP-Werte direkt mit den Diagnosen periimplantäre Mukositis (median, Patientenlevel: 24,4 Prozent; Implantatlevel: 33 Prozent) und Periimplantitis (median, Patientenlevel: 83 Prozent; Implantatlevel: 100 Prozent) korreliert [Ramanauskaite et al., 2018]. Der BOP-Erhebung kommt demnach eine Schlüsselfunktion bei der Diagnostik periimplantärer Infektionen zu.
Klinische Daten zeigen zudem, dass die Periimplantitis bei 16,7 bis 28,7 Prozent der untersuchten Implantate sowie bei 30,1 bis 54,4 Prozent der Patienten mit einer Suppuration in Verbindung steht [Ramanauskaite et al., 2018; Fransson et al., 2008; Monje et al., 2020]. Da eine Suppuration weder im Bereich gesunder Gewebestrukturen noch bei klinisch manifester periimplantärer Mukositis beobachtet werden konnte, kann sie als charakteristisches Merkmal einer Periimplantitis betrachtet werden.
Das Fehlen einer Suppuration schließt die Diagnose Periimplantitis jedoch nicht aus [Ramanauskaite et al., 2018; Monje et al., 2020].
Statt nur die Absolutwerte zu betrachten, sollten für die Bewertung von Sondierungstiefen die Veränderungen zu früheren Messungen – zum Beispiel nach Eingliederung der Suprakonstruktion – herangezogen werden [Schwarz et al., 2018; Berglundh et al., 2018]. Grundlegend geht die Periimplantitis mit einem Anstieg der Sondierungstiefen einher. In einer klinischen Querschnittsuntersuchung waren diese Werte bei einer klinisch manifesten Periimplantitis (Patientenlevel: min: 2,20 mm, max: 7,67 mm; Implantatlevel: min: 3,17 mm, max: 9,00 mm) signifikant höher als bei einer diagnostizierten periimplantären Mukositis (Patientenlevel: min: 1,09 mm, max: 3,85 mm; Implantatlevel: min: 3,17 mm, max: 4,67 mm). Die Vergleichswerte der gesunden Kontrollgruppe (Implantatlevel: min: 1,00 mm, max: 4,33 mm) waren mit denen bei vorliegender periimplantärer Mukositis vergleichbar [Ramanauskaite et al., 2018].
Die Zunahme der Sondierungstiefen in Verbindung mit positiver BOP gibt demnach einen direkten Hinweis auf die Diagnose Periimplantitis (Tabelle 1). Bei fehlenden Referenzwerten (das heißt Ausgangsbefunden) war die Erhebung der Sondierungstiefen zur Bestimmung des marginalen Knochenverlusts jedoch mit einer geringen Sensitivität verbunden. Im Gegensatz hierzu war die Sensitivität (80,9 Prozent) für BOP deutlich höher [Berglundh et al., 2020].
Mit den Sondierungstiefen sollte grundsätzlich auch eine Erfassung der mukosalen Rezessionen erfolgen. Klinische Daten legen nahe, dass die entzündlichen Prozesse primär zu einer Verdickung der periimplantären Mukosa führen. Im Vergleich zu gesunden Kontrollimplantaten (1,10 mm) war die mediane horizontale Mukosadicke sowohl bei der periimplantären Mukositis (1,68 mm) als auch bei der Periimplantitis (1,61 mm) vergleichbar und signifikant erhöht [Schwarz et al., 2017].
Wahrscheinlich wird das Auftreten mukosaler Rezessionen dadurch in frühen Phasen der Erkrankung vorerst kompensiert. Erst bei einem weiter fortgeschrittenen Knochenabbau konnte in einer experimentellen Untersuchung ein Rückgang der Mukosahöhe beobachtet werden [Monje et al., 2018]. Mukosale Rezessionen scheinen daher kein klinischer Indikator für den Übergang von einer periimplantären Mukositis in eine Periimplantitis zu sein.
Wenn die klinische Untersuchung den Verdacht auf eine Periimplantitis begründet, sollte eine radiologische Diagnostik zur Sicherung der Diagnose angeschlossen werden [Lindhe et al., 2008].
Bei initialen Knochenresorptionen und insbesondere bei der Diagnostik mehrerer Implantate können Bissflügelaufnahmen eine sehr gute Alternative zu Zahnfilmen in Paralleltechnik darstellen. Die Bewertung des Knochenabbaus sollte ebenfalls im Vergleich zu früheren Aufnahmen erfolgen [Berglundh et al., 2018].
Dreidimensionale bildgebende Verfahren insbesondere digitale Volumentomografien können zudem die Defektkonfiguration bei fortgeschrittenen und komplexen Fällen überaus akkurat bestimmen [Golubovic et al., 2012] und somit eine klinisch relevante Grundlage für die weitere Behandlungsplanung und Therapieentscheidung darstellen. Deren Anfertigung sollte allerdings einer strengen Indikationsstellung unterliegen.
Ätiologie und Risikofaktoren
Zahlreiche präklinische und klinische Untersuchungen belegen, dass bakterielle Plaque beziehungsweise Biofilme den ätiologischen Faktor bei der Entstehung periimplantärer Infektionen darstellen. Ein progressiver Knochenabbau ohne klinische Entzündungszeichen ist dagegen ein sehr seltenes Ereignis [Schwarz et al., 2018, Berglundh et al., 2020].
Als sehr gut dokumentierte patientenbezogene (systemische) Risikofaktoren, die eine Entstehung periimplantärer Infektionen begünstigen können, wurden Parodontalerkrankungen, schlechte Mundhygieneverhältnisse sowie unregelmäßige Kontrolluntersuchungen herausgestellt [Schwarz et al., 2018]. Nachfolgend werden aktuelle Untersuchungen zu einigen implantatbezogenen (lokalen) Risikofaktoren zusammenfassend dargestellt.
Das periimplantäre Weichgewebe
Das Fehlen oder eine reduzierte Breite an keratinisierter Mukosa (< 2 mm) kann zu einer Beeinträchtigung der häuslichen Reinigungsfähigkeit durch den Patienten und somit zu einer Erhöhung des Risikos für die Entstehung periimplantärer Infektionen führen [Thoma et al., 2018].
Durch Weichgewebe-Augmentationen mit dem Ziel einer Verbreiterung der keratinisierten Mukosa konnten eine klinisch relevante Reduktion entzündlicher Parameter sowie eine Stabilisierung des marginalen Knochenniveaus im Vergleich zur Kontrollgruppe erreicht werden [Thoma et al., 2018; Giannobile et al., 2018]. Positive Einflüsse einer breiteren keratinisierten Mukosa konnten auch nach einer chirurgischen Periimplantitistherapie beschrieben werden, da an diesen Implantaten eine geringere postoperative Zunahme mukosaler Rezessionen festzustellen war [Galarraga-Vinueza et al., 2020] (Abbildung 2).
Demgegenüber zeigten chirurgische Verfahren mit dem Ziel einer Verdickung der keratinisierten Mukosa keinen signifikanten Einfluss auf die erhobenen Blutungswerte und somit die Prävalenz periimplantärer Infektionen [Thoma et al., 2018].
Implantatchirurgische und prothetische Faktoren
Aktuelle Publikationen befassten sich mit der Bewertung augmentativer Verfahren und der Sofortimplantation als mögliche Risikofaktoren für die Entstehung periimplantärer Infektionen:
In einer systematischen Literaturübersicht und Metaanalyse standen laterale Augmentationsverfahren nur mit einer geringen zeitlichen Zunahme der BOP-Werte in Verbindung [n = 10 Studien; WMD = −10 Prozent; 95 Prozent CI (−22,23; 2,21)] [Schwarz et al., 2018]. In einer kürzlich veröffentlichen Querschnittsuntersuchung waren die Prävalenzen der periimplantären Mukositis (68 versus 61 Prozent) und der Periimplantitis (5 versus 10 Prozent) für Patienten 9,97 ± 6,55 Jahre nach einer simultanen lateralen Augmentation mit denen aus einer Kontrollgruppe (Patienten mit Implantaten im nichtaugmentierten, nativen Knochen) vergleichbar [Ramanauskaite et al., 2020].
Erste klinische Ergebnisse deuten auch auf eine nicht erhöhte Prävalenz periimplantärer Infektionen (periimplantäre Mukositis: 57,5 Prozent, Periimplantitis: 4,2 Prozent) nach einer Sofortimplantation und Sofortversorgung über einen Beobachtungszeitraum von zwei bis zehn Jahren hin [Parvini et al., 2020]. Unter Berücksichtigung einer strengen Indikationsstellung scheint dieses an klinischer Relevanz zunehmende Therapieverfahren kein erhöhtes Risiko für biologische Komplikationen darzustellen [Tonetti et al., 2019].
Ein erhöhtes Risko für eine Periimplantitis zeigten jedoch mesial und distal verblockte Implantate sowie Implantate mit einer überkonturierten Versorgung (konvexes Emergenzprofil, Emergenzwinkel ≥ 30 Grad) [Yi et al., 2020].
Therapie
Die Effektivität nichtchirurgischer und chirurgischer Therapieverfahren wurde in der S3-Leitlinie „Die Behandlung periimplantärer Infektionen an Zahnimplantaten“ bewertet [Schwarz et al., 2016]. Grundlegend sollten systemische und lokale Risikofaktoren vor Therapiebeginn identifiziert und gegebenenfalls kompensiert werden.
Nichtchirurgische Therapieverfahren
Durch alternative oder adjuvante Maßnahmen konnte die Effektivität einer konventionellen nichtchirurgischen Therapie der periimplantären Mukositis nicht signifikant verbessert werden. Demnach können für Abutment-/Implantatoberflächen geeignete Handinstrumente derzeit als Standardtherapie angesehen werden.
Im Vergleich zur Therapie einer Gingivitis an Zähnen erfordert die Therapie der periimplantären Mukositis ein deutlich längeres Heilungsintervall. In einer klinischen Studie konnten gesunde periimplantäre Verhältnisse erst vier Monate nach einer einmaligen mechanischen Reinigung erzielt werden [Schwarz et al., 2018]. Zu den klinisch dokumentierten Einflussfaktoren, die den Therapieerfolg beeinflussen können, zählen die Oberflächenrauigkeit von Abutments, die Insertionstiefe von Implantaten sowie die Zugänglichkeit der prothetischen Restauration [Schwarz et al., 2018; de Tapia et al., 2019; Chan et al., 2019].
Für die nichtchirurgische Therapie der Periimplantitis sollten jedoch alternative oder adjuvante Therapieverfahren zum manuellen Debridement eingesetzt werden. Zu den untersuchten Therapieverfahren zählten ein modifiziertes Ultraschallsystem mit einer Hydroxylapatit-haltigen Suspension, eine Er:YAG(erbium-doped yttrium aluminum garnet)-Laser-Monotherapie sowie ein Air-Polishing mittels Glycinpulver [Schwarz et al., 2015].
Der Behandlungserfolg und die Stabilität der erzielten klinischen Ergebnisse (> 6 Monate) sollten aber insbesondere bei initial tiefen Taschen von > 7 mm als prognostisch ungünstig eingestuft werden [Schwarz et al., 2016].
Erste klinische Daten geben Anhaltspunkte zur Effektivität nichtchirurgischer Verfahren bei der Therapie periimplantärer Infektionen an Zirkondioxidimplantaten [John et al., 2017; Schwarz et al., 2015].
Die erzielten Kurzzeitergebnisse (sechs Monate) waren grundlegend mit denen an Titanimplantaten vergleichbar. Im Unterschied hierzu konnten die BOP-Reduktionen jedoch über einen Beobachtungszeitraum von bisher 34 Monaten weitestgehend stabil erhalten werden [John et al., 2017; Schwarz et al., 2015]. Diese Ergebnisse deuten darauf hin, dass die nichtchirurgische Therapie eine bessere Prognose für die Behandlung der Periimplantitis an Zirkondioxidimplantaten zu haben scheint.
Chirurgische Therapieverfahren
Wenn das Behandlungsziel durch eine nichtchirurgische Therapie nicht erreicht werden kann, sollten daher insbesondere fortgeschrittene Läsionen frühzeitig einer chirurgischen Therapie zugeführt werden. Welches chirurgische Protokoll zu bevorzugen ist, konnte zum Zeitpunkt der Erstellung der S3-Leitlinie aus der Literatur nicht abgeleitet werden [Schwarz et al., 2016].
Aktuelle Daten lassen weiterhin keine Rückschlüsse auf die Überlegenheit einer spezifischen Methode zur Implantatoberflächen-Dekontamination [Koo et al., 2018] oder eines chirurgischen Behandlungsprotokolls zu [Khoury et al., 2019] (Abbildung 3). Ein relevanter Einflussfaktor für die Auswahl eines chirurgischen Verfahrens scheint die spezifische Defektsituation sowie die Rauigkeit der Implantatoberfläche zu sein [Monje et al., 2019; Carcuac et al., 2020; Carcuac et al., 2017]. Eine Lappenoperation zeigte bei modifizierten, das heißt rauen, Implantaten eine deutlich geringere Effektivität als bei glatten Oberflächen [Carcuac et al., 2017].
Für augmentative – sogenannte rekonstruktive– Verfahren konnten bisher sehr gute klinische Langzeitergebnisse, insbesondere im Bereich moderat rauer Implantatoberflächen und bei vorliegenden intraossären Defekten, dokumentiert werden [Ramanauskaite et al., 2019; Jepsen et al., 2019] (Abbildung 4a). Bei suprakrestalen Defekten hat sich die sogenannte Implantatplastik in klinischen Langzeituntersuchungen als effektive und sichere Therapieoption bewährt [Stavropoulos et al., 2019] (Abbildung 4b). Bei kombinierten Defekten können rekonstruktive Verfahren mit der Implantatplastik kombiniert werden (Abbildung 4c). Diese kombinierte chirurgische Therapie zeigte in klinischen Studien eine hohe Effektivität über einen bisher dokumentierten Nachuntersuchungszeitraum von sieben Jahren [Schwarz et al., 2017; de Tapia et al., 2019] (Abbildung 5).
Grundlegend sollte bei der Entscheidung gegen eine Periimplantitistherapie und für eine Explantation bedacht werden, dass eine erneute Implantatversorgung mit zahlreichen sehr komplexen Augmentationsverfahren (Hart- und Weichgewebe) in Verbindung stehen kann. Zudem geben Metaanalysen Hinweise darauf, dass die Implantatüberlebensraten in der sogenannten zweiten Therapierunde deutlich abnehmen [Oh et al., 2020].
Eine Explantation sollte jedoch in jedem Fall bei vorliegender Implantatlockerung, nicht behebbaren technischen Komplikationen, komplexen Implantatdesigns (zum Beispiel Hohlzylinder), Therapieresistenz oder Übergreifen der Infektion auf anatomische Nachbarstrukturen erfolgen (Abbildung 6).
Ausblick
Aktuelle immunhistochemische Analysen fokussieren auf die Polarisation von Makrophagen und deren potenzielle Relevanz in der Pathogenese periimplantärer Infektionen [Fretwurst et al., 2019; Galarraga-Vinueza et al., 2020]. Deren Aktivierung durch bakterielle Lipopolysaccharide oder Interferone führt zum prozentualen Anstieg des sogenannten M1-Phänotypen, der pro-inflammatorische Reaktionen und somit Interleukin(IL)-6 und IL-1β assoziierte, destruktive Reaktionen im Gewebe verursacht. Demgegenüber steht der sogenannte konstruktive M2-Phänotyp, der über die Produktion von IL-10 und TGF(transforming growth factor)-β vornehmlich anti-inflammatorische Reaktionen verursacht und somit den Gewebeaufbau und die Angiogenese fördert [Garlet and Giannobile, 2018]. Der Schweregrad der Periimplantitis korrelierte in humanen Gewebeproben direkt mit dem prozentualen Anteil von M1-Makrophagen [Galarraga-Vinueza et al., 2020] (Abbildung 7).
Neue immunmodulierende Therapieansätze verfolgen einen direkten Einfluss auf die Polarisation von Makrophagen. Sehr vielversprechende Daten existieren bereits zum Einsatz von natürlichen Cranberry(Vaccinium macrocarpon)-Extrakten (Proantocyanidins), die neben inhibitorischen Effekten auf die Biofilmädhäsion insbesondere eine hohe Potenz als anti-inflammatorische Makrophagen-Modulatoren aufweisen [Galarraga-Vinueza et al., 2020]. Durch deren topische Applikation soll künftig eine „natürlich basierte“, minimal-invasive immunmodulierende Therapie periimplantärer Infektionen ermöglicht werden.
Univ.-Prof. Dr. med. dent. Frank Schwarz
Poliklinik für Zahnärztliche Chirurgie und Implantologie, Fachbereich Medizin
Goethe-Universität Frankfurt, Zentrum der Zahn-, Mund- und Kieferheilkunde,
Carolinum Zahnärztliches Universitäts-Institut gGmbH
Theodor-Stern-Kai 7, Haus 29, 60596 Frankfurt am Main
f.schwarz@med.uni-frankfurt.de
Dr. med. dent. Amira Begic
Poliklinik für Zahnärztliche Chirurgie und Implantologie, Fachbereich Medizin
Goethe-Universität Frankfurt, Zentrum der Zahn-, Mund- und Kieferheilkunde,
Carolinum Zahnärztliches Universitäts-Institut gGmbH
Theodor-Stern-Kai 7, Haus 29, 60596 Frankfurt am Main
Foto: privat
Dr. med. dent. Ausra Ramanauskaite, PhD
Poliklinik für Zahnärztliche Chirurgie und Implantologie, Fachbereich Medizin
Goethe-Universität Frankfurt, Zentrum der Zahn-, Mund- und Kieferheilkunde,
Carolinum Zahnärztliches Universitäts-Institut gGmbH
Theodor-Stern-Kai 7, Haus 29, 60596 Frankfurt am Main
Dr. med. dent. Karina Obreja
Poliklinik für Zahnärztliche Chirurgie und Implantologie, Fachbereich Medizin
Goethe-Universität Frankfurt, Zentrum der Zahn-, Mund- und Kieferheilkunde,
Carolinum Zahnärztliches Universitäts-Institut gGmbH
Theodor-Stern-Kai 7, Haus 29, 60596 Frankfurt am Main
Literaturliste
1. Schwarz F, Derks J, Monje A, Wang HL. Peri-implantitis. Journal of clinical periodontology. 2018;45 Suppl 20:S246-S66.
2. Fretwurst T, Muller J, Larsson L, Bronsert P, Hazard D, Castilho RM, et al. Immunohistological composition of peri-implantitis affected tissue around ceramic implants-A pilot study. Journal of periodontology. 2020.
3. Becker J, John G, Becker K, Mainusch S, Diedrichs G, Schwarz F. Clinical performance of two-piece zirconia implants in the posterior mandible and maxilla: a prospective cohort study over 2 years. Clinical oral implants research. 2017;28(1):29-35.
4. Berglundh T, Armitage G, Araujo MG, Avila-Ortiz G, Blanco J, Camargo PM, et al. Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. Journal of clinical periodontology. 2018;45 Suppl 20:S286-S91.
5. Carcuac O, Abrahamsson I, Derks J, Petzold M, Berglundh T. Spontaneous progression of experimental peri-implantitis in augmented and pristine bone: A pre-clinical in vivo study. Clinical oral implants research. 2020;31(2):192-200.
6. Serino G, Turri A, Lang NP. Probing at implants with peri-implantitis and its relation to clinical peri-implant bone loss. Clinical oral implants research. 2013;24(1):91-5.
7. Ramanauskaite A, Becker K, Schwarz F. Clinical characteristics of peri-implant mucositis and peri-implantitis. Clinical oral implants research. 2018;29(6):551-6.
8. Fransson C, Wennstrom J, Berglundh T. Clinical characteristics at implants with a history of progressive bone loss. Clinical oral implants research. 2008;19(2):142-7.
9. Monje A, Vera M, Munoz-Sanz A, Wang HL, Nart J. Suppuration as diagnostic criterium of peri-implantitis. Journal of periodontology. 2020.
10. Schwarz F, Claus C, Becker K. Correlation between horizontal mucosal thickness and probing depths at healthy and diseased implant sites. Clinical oral implants research. 2017;28(9):1158-63.
11. Monje A, Insua A, Rakic M, Nart J, Moyano-Cuevas JL, Wang HL. Estimation of the diagnostic accuracy of clinical parameters for monitoring peri-implantitis progression: An experimental canine study. Journal of periodontology. 2018;89(12):1442-51.
12. Lindhe J, Meyle J, Group DoEWoP. Peri-implant diseases: Consensus Report of the Sixth European Workshop on Periodontology. Journal of clinical periodontology. 2008;35(8 Suppl):282-5.
13. Golubovic V, Mihatovic I, Becker J, Schwarz F. Accuracy of cone-beam computed tomography to assess the configuration and extent of ligature-induced peri-implantitis defects. A pilot study. 2012.
14. Thoma DS, Naenni N, Figuero E, Hammerle CHF, Schwarz F, Jung RE, et al. Effects of soft tissue augmentation procedures on peri-implant health or disease: A systematic review and meta-analysis. Clinical oral implants research. 2018;29 Suppl 15:32-49.
15. Giannobile WV, Jung RE, Schwarz F, Groups of the 2nd Osteology Foundation Consensus M. Evidence-based knowledge on the aesthetics and maintenance of peri-implant soft tissues: Osteology Foundation Consensus Report Part 1-Effects of soft tissue augmentation procedures on the maintenance of peri-implant soft tissue health. Clinical oral implants research. 2018;29 Suppl 15:7-10.
16. Galarraga-Vinueza ME, Obreja K, Magini R, Sculean A, Sader R, Schwarz F. Volumetric assessment of tissue changes following combined surgical therapy of peri-implantitis: A pilot study. Journal of clinical periodontology. 2020.
17. Schwarz F, Giannobile WV, Jung RE, Groups of the 2nd Osteology Foundation Consensus M. Evidence-based knowledge on the aesthetics and maintenance of peri-implant soft tissues: Osteology Foundation Consensus Report Part 2-Effects of hard tissue augmentation procedures on the maintenance of peri-implant tissues. Clinical oral implants research. 2018;29 Suppl 15:11-3.
18. Ramanauskaite A, Schwarz F, Begic A, Parvini P, Galarraga-Vinueza ME, Obreja K. The influence of simultaneous lateral grafting on clinical outcomes following one-stage implant placement: a cross-sectional analysis. Int J Implant Dent. 2020;6(1):37.
19. Parvini P, Schliephake C, Al-Maawi S, Schwarz K, Sader R, Ghanaati S, et al. Histomorphometrical assessment of vertical alveolar ridge augmentation using extracted tooth roots in the canine. Clinical oral investigations. 2020;24(1):317-23.
20. Tonetti MS, Jung RE, Avila-Ortiz G, Blanco J, Cosyn J, Fickl S, et al. Management of the extraction socket and timing of implant placement: Consensus report and clinical recommendations of group 3 of the XV European Workshop in Periodontology. Journal of clinical periodontology. 2019;46 Suppl 21:183-94.
21. Yi Y, Koo KT, Schwarz F, Ben Amara H, Heo SJ. Association of prosthetic features and peri-implantitis: A cross-sectional study. Journal of clinical periodontology. 2020;47(3):392-403.
22. Schwarz F, Becker J, Bach G, Bartsch K, Blume M, Iglhaut G, et al. S3 Leitlinie: Die Behandlung periimplantärer Infektionen an Zahnimplantaten. Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). 2016;Registernummer: 083-023(URL: http://www.awmf.org/leitlinien/detail/ll/083-023.html ).
23. Schwarz F, Becker J, Civale S, Hazar D, Iglhaut T, Iglhaut G. Onset, progression and resolution of experimental peri-implant mucositis at different abutment surfaces: A randomized controlled two-centre study. Journal of clinical periodontology. 2018;45(4):471-83.
24. de Tapia B, Mozas C, Valles C, Nart J, Sanz M, Herrera D. Adjunctive effect of modifying the implant-supported prosthesis in the treatment of peri-implant mucositis. Journal of clinical periodontology. 2019;46(10):1050-60.
25. Chan D, Pelekos G, Ho D, Cortellini P, Tonetti MS. The depth of the implant mucosal tunnel modifies the development and resolution of experimental peri-implant mucositis: A case-control study. Journal of clinical periodontology. 2019;46(2):248-55.
26. Schwarz F, Schmucker A, Becker J. Efficacy of alternative or adjunctive measures to conventional treatment of peri-implant mucositis and peri-implantitis: a systematic review and meta-analysis. Int J Implant Dent. 2015;1(1):22.
27. John G, Becker J, Schmucker A, Schwarz F. Non-surgical treatment of peri-implant mucositis and peri-implantitis at two-piece zirconium implants: A clinical follow-up observation after up to 3 years. Journal of clinical periodontology. 2017;44(7):756-61.
28. Schwarz F, John G, Hegewald A, Becker J. Non-surgical treatment of peri-implant mucositis and peri-implantitis at zirconia implants: a prospective case series. Journal of clinical periodontology. 2015.
29. Koo KT, Khoury F, Leander Keeve P, Schwarz F, Ramanauskaite A, Sculean A, et al. Implant Surface Decontamination by Surgical Treatment of Periimplantitis: A Literature Review. Implant dentistry. 2018.
30. Khoury F, Keeve PL, Ramanauskaite A, Schwarz F, Koo KT, Sculean A, et al. Surgical treatment of peri-implantitis - Consensus report of working group 4. Int Dent J. 2019;69 Suppl 2:18-22.
31. Monje A, Pons R, Insua A, Nart J, Wang HL, Schwarz F. Morphology and severity of peri-implantitis bone defects. Clinical implant dentistry and related research. 2019;21(4):635-43.
32. Carcuac O, Derks J, Abrahamsson I, Wennstrom JL, Berglundh T. Risk for recurrence of disease following surgical therapy of peri-implantitis - a prospective longitudinal study. Clinical oral implants research. 2020.
33. Carcuac O, Derks J, Abrahamsson I, Wennstrom JL, Petzold M, Berglundh T. Surgical treatment of peri-implantitis: 3-year results from a randomized controlled clinical trial. Journal of clinical periodontology. 2017;44(12):1294-303.
34. Ramanauskaite A, Obreja K, Sader R, Khoury F, Romanos G, Koo KT, et al. Surgical Treatment of Periimplantitis With Augmentative Techniques. Implant dentistry. 2019;28(2):187-209.
35. Jepsen S, Schwarz F, Cordaro L, Derks J, Hammerle CHF, Heitz-Mayfield LJ, et al. Regeneration of alveolar ridge defects. Consensus report of group 4 of the 15th European Workshop on Periodontology on Bone Regeneration. Journal of clinical periodontology. 2019;46 Suppl 21:277-86.
36. Stavropoulos A, Bertl K, Eren S, Gotfredsen K. Mechanical and biological complications after implantoplasty-A systematic review. Clinical oral implants research. 2019;30(9):833-48.
37. Schwarz F, John G, Schmucker A, Sahm N, Becker J. Combined surgical therapy of advanced peri-implantitis evaluating two methods of surface decontamination: a 7-year follow-up observation. Journal of clinical periodontology. 2017;44(3):337-42.
38. de Tapia B, Valles C, Ribeiro-Amaral T, Mor C, Herrera D, Sanz M, et al. The adjunctive effect of a titanium brush in implant surface decontamination at peri-implantitis surgical regenerative interventions: A randomized controlled clinical trial. Journal of clinical periodontology. 2019;46(5):586-96.
39. Oh SL, Shiau HJ, Reynolds MA. Survival of dental implants at sites after implant failure: A systematic review. J Prosthet Dent. 2020;123(1):54-60.
40. Fretwurst T, Garaicoa-Pazmino C, Nelson K, Giannobile WV, Squarize CH, Larsson L, et al. Characterization of macrophages infiltrating peri-implantitis lesions. Clinical oral implants research. 2019.
41. Galarraga-Vinueza ME, Obreja K, Ramanauskaite A, Magini R, Begic A, Sader R, et al. Macrophage polarization in peri-implantitis lesions. Clinical oral investigations. 2020.
42. Garlet GP, Giannobile WV. Macrophages: The Bridge between Inflammation Resolution and Tissue Repair? J Dent Res. 2018;97(10):1079-81.
43. Galarraga-Vinueza ME, Dohle E, Ramanauskaite A, Al-Maawi S, Obreja K, Magini R, et al. Anti-inflammatory and macrophage polarization effects of Cranberry Proanthocyanidins (PACs) for periodontal and peri-implant disease therapy. Journal of periodontal research. 2020.
44. Renvert S, Persson GR, Pirih FQ, Camargo PM. Peri-implant health, peri-implant mucositis, and peri-implantitis: Case definitions and diagnostic considerations. Journal of clinical periodontology. 2018;45:S278-S85.
45. Jessica Berglundh, Mario Romandini, Jan Derks, Mariano Sanz, Tord Berglundh. Clinical findings and history of bone loss at implant sites. Clin Oral Implants Res 2020 Dec 19. doi: 10.1111/clr.13701 . Online ahead of print.




















