Antibiotika in der Endodontie
Im Jahr 2014 rezeptierte jeder Zahnarzt im Schnitt 58-mal Antibiotika. Besonders hoch ist die Verordnung von Antibiotika im Notdienst und erfolgt dort oft ohne eine begleitende kausale zahnärztliche Intervention. Als Begründung der vermehrten Antibiotikagabe werden oft Wissens-, Trainings- und Zeitmangel sowie Arbeitsdruck angeführt [Hussein et al., 2018].
Im Jahr 2013 wurden circa 708.000 Antibiotika in Zusammenhang mit der Leistung Wurzelkanalbehandlung verschrieben. Bei circa 15 Prozent der Patienten wurde eine systemische Antibiose nach einer Wurzelkanalbehandlung rezeptiert. Zu 51 Prozent wurde nach oder während einer Wurzelkanalbehandlung Clindamycin und zu circa 24 Prozent Amoxicillin verabreicht [Hussein et al., 2018]. Weltweit ist ein Trend erkennbar, dass Antibiotika bei endodontischen Behandlungen sehr häufig verschrieben werden [Segura-Egea et al., 2017].
Vor diesem Hintergrund stellt sich die Frage, wann die Anwendung von Antibiotika in der Endodontie generell indiziert ist? Wann sollten Antibiotika ergänzend zur Kausalbehandlung eingesetzt werden und wann ist eine Verabreichung nicht notwendig oder sogar obsolet?
Schmerztherapie bei akuten odontogenen Infektionen
Ein Schreckensszenario in der Endodontie ist fraglos der infizierte Wurzelkanal. Viren, Fungi und Bakterien können sich im Wurzelkanallumen bei einer infizierten Pulpanekrose zu einem Biofilm entwickeln und formieren. Von den circa 700 Bakterienarten in der Mundhöhle kommen nur ungefähr 15 bis 20 verschiedene Spezies in den Wurzelkanälen vor [Siqueira et al., 2021]. Bereits Kakehashi et al. zeigten im Jahr 1965, dass eine Pulpitis und eine Parodontitis apicalis mikrobiell induzierte Erkrankungen darstellen [Kakehashi et al., 1965]. Die Minimierung von eben diesen Bakterien und des Biofilms im Wurzelkanal ist oberstes Ziel der endodontischen Therapie – so können apikale Parodontitiden, odontogene Infektionen oder resorptive Prozesse gestoppt werden, ausheilen und die knöchernen Strukturen regenerieren. Der Großteil der endodontischen Infektionen ist auf das Zahninnere begrenzt und kann durch eine lokale Behandlung über die Entfernung der nekrotischen Pulpa, die Drainage des Abszesses über die chemo-mechanische Aufbereitung des Wurzelkanalsystems oder – als ultima ratio – die Zahnextraktion beherrscht werden [European Society of Endodontology, 2006].
„Ubi pus, ibi evacua!“ – der lateinische Aphorismus wird häufig in vielen Bereichen der Medizin zitiert. Dieser Grundsatz trifft auch auf die Behandlung von akuten apikalen Abszessen zu. Der erste Weg der Behandlung sollte hier, wann immer möglich, über den Wurzelkanal gehen, um eine Drainage für den Pusabfluss zu schaffen (Abbildungen 1 und 2). Das nekrotische Pulpagewebe oder die bereits vorhandene Wurzelkanalfüllung gilt es von orthograd zu entfernen. Die Wurzelkanalpräparation kann die Drainage des Abszesses weiter unterstützen. Mittels der chemischen Desinfektion im Zuge eines suffizienten Spülprotokolls erfolgt eine weitere Elimination von Mikroorganismen und nekrotischem Pulpagewebe aus dem Wurzelkanallumen. Zur weiteren Desinfektion und zur Anhebung des pH-Wertes wird eine wässrige Kalziumhydroxideinlage in den Wurzelkanal eingebracht. Ein „Offenlassen“ des Zahnes nach der Schmerzbehandlung gilt es zu vermeiden, da sich Mikroorganismen aus der Mundhöhle im Wurzelkanal ansiedeln und nachfolgend zu einem Biofilm kolonialisieren können [Siren et al., 1997]. Lässt sich der Pusabfluss aus dem Wurzelkanal nicht stoppen, kann ein Zahn in Ausnahmefällen für maximal 24 Stunden offengelassen, am folgenden Tag in der Praxis endodontisch versorgt und mit einem provisorischen Verschluss versehen werden [Schäfer et al., 2021].
Bei einem bereits stark ausgebreiteten submukösen Abszess oder wenn ein suffizienter Abfluss über den Wurzelkanal nicht etabliert werden kann, kann eine Inzision zusätzlich zur Wurzelkanalaufbereitung indiziert sein. Wurde eine ausreichende Drainage geschaffen und erscheint weder der Allgemeinzustand des Patienten reduziert noch liegen beim Patienten spezifische Risiken vor, kann bei einer odontogenen Infektion und akutem apikalem Abszess ohne Ausbreitungstendenz auf eine Antibiotikatherapie verzichtet werden.
Das Vorhandensein von Schmerzen ist ebenfalls keine Indikation für eine Antibiotikagabe. Bei einer symptomatischen apikalen Parodontitis, ausgehend von einer infizierten Pulpanekrose, führt ein Antibiotikum zu keiner Schmerzreduktion [Henry et al., 2001]. In einer Studie von Fouad et al. wurde kein signifikanter Unterschied zwischen Schmerzen und Schwellung nach einer endodontischen Therapie von apikalen Parodontitiden mit oder ohne eine begleitende Antibiotikatherapie nachgewiesen. Somit kann die Gabe eines Antibiotikums niemals eine Alternative zur endodontischen Therapie darstellen.
Zusätzlich zur endodontischen Therapie ist eine unterstützende antibiotische Therapie bei den folgenden Fällen nicht indiziert [Segura-Egea et al., 2017; Segura-Egea et al., 2021¸ Longman et al., 2000]:
Symptomatische irreversible Pulpitis (Abbildung 3)
Pulpanekrose
Symptomatische Parodontitis apicalis
Chronischer apikaler Abszess und Zähne mit einer Fistel
Akuter apikaler Abszess ohne systemische Beteiligung (lokalisierte fluktuierende Schwellungen)
Postoperative Beschwerden/Schmerzen
Nach einer einzeitigen Wurzelkanalpräparation und Wurzelkanalfüllung bei einem Zahn mit infizierten Wurzelkanälen
Zur Behandlung einer Paro-Endo-Läsion
Wann ist eine systemische Antibiose indiziert?
Eine unterstützende, systemische Antibiose in Kombination mit der endodontischen Kausalbehandlung ist in den folgenden Fällen indiziert [European Society of Endodontology, 2006]:
bei einem apikalen Abszess bei gesundheitlich kompromittierten Patienten
bei einem akuten apikalen Abszess mit systemischer Beteiligung
bei progredienten Infektionen
Entleert sich kein Eiter aus der Inzision oder über den aufbereiteten und gespülten Wurzelkanal und/oder liegen bei dem Patienten Risikofaktoren für eine mögliche Ausbreitungstendenz vor, so kann ein orales, systemisches Antibiotikum verabreicht werden [Heider et al., 2021; S3-Leitlinie „Odontogene Infektionen“, 2016]. Fieber aufgrund der odontogenen Infektion, ein reduzierter Allgemeinzustand, eine schnelle Ausbreitung des apikalen Abszesses in weniger als 24 Stunden, eine eingeschränkte Mundöffnung mit Schluckbeschwerden, die Entwicklung eines Logenabszesses oder erhöhte Leukozyten im Blutbild sprechen für eine schnelle Ausbreitungstendenz des Entzündungsherdes [Al-Nawas et al., 2021, S3-Leitlinie „Odontogene Infektionen“, 2016]. Falls die Gefahr besteht, dass sich ein Logenabszess bilden könnte, sollte ebenfalls eine Antibiotikagabe in Erwägung gezogen werden. Beispiele für Logenabszesse mit dentalem Fokus sind der Fossa-canina-Abszess oder der perimandibuläre, der submandibuläre sowie der paramandibuläre Abszess [Schäfer, 2019].
Die alleinige Gabe eines Antibiotikums ohne endodontische oder chirurgische Intervention ist nur im speziellen Einzelfall eine Therapieoption und kann zu einer Chronifizierung der Infektion führen. Generell sollte das Antibiotikum eine Ergänzung und kein Ersatz für die kausale Therapie des dentalen Prozesses sein. Durch die systemische Gabe des Antibiotikums wird die ursächliche odontogene Infektion nicht therapiert, da in einer nekrotischen Pulpa oder generell im Wurzelkanal nur vernachlässigbare Konzentrationen des Antibiotikums ankommen [Fouad et al., 1996]. Diese Konzentrationen können innerhalb der infizierten Wurzelkanäle nicht zu einer Hemmung des Bakterienwachstums beitragen [Siqueira, 2011]. Unterbleibt eine kausale Therapie, kann es zu einem Rezidiv des entzündlichen Prozesses kommen. Die Dauer der Antibiotikatherapie beträgt drei bis fünf Tage bei einer etablierten Drainage des Abszesses. Hier richtet sich die Dauer der Gabe nach der klinischen Beurteilung des odontogenen Abszesses und den Entzündungsparametern. Die Patienten sollten drei Tage nach Rezeptieren des Antibiotikums erneut zur Kontrolle vorstellig werden, um gegebenenfalls eine Verlängerung der Antibiotikagabe zu prüfen [S3-Leitlinie „Odontogene Infektionen“, 2016].
Die Aufklärung der Patienten über eine weitere Behandlung sollte direkt nach der Schmerzbehandlung erfolgen. Im Fall eines erhaltungswürdigen Zahnes schließt sich nach der Trepanation und Aufbereitung des Wurzelkanals in einem weiteren Termin die Wurzelkanalfüllung an. Ein nicht erhaltungswürdiger Zahn muss entfernt werden.
Welches Antibiotikum bei odontogenen Abszessen?
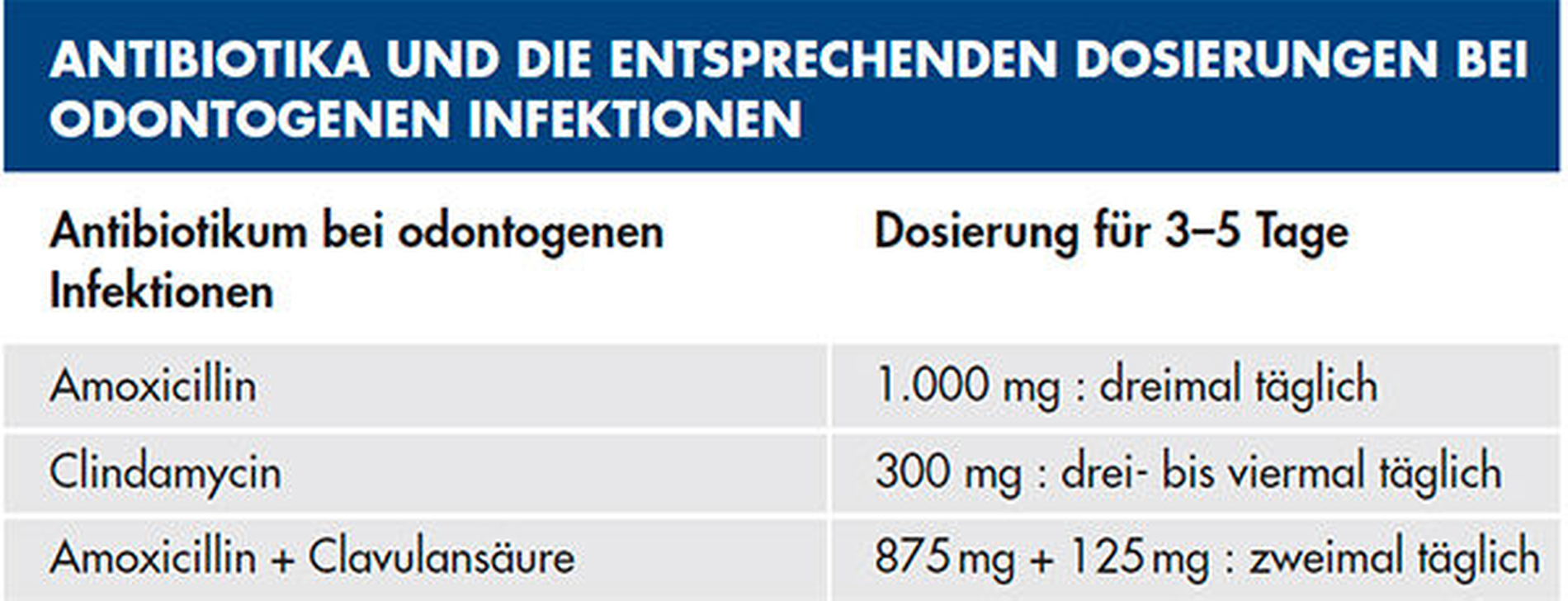
Amoxicillin stellt das Antibiotikum der ersten Wahl bei odontogenen Infektionen dar – es wirkt bakterizid. Über den oralen Zugangsweg wird das Antibiotikum mit 70 bis 90 Prozent nahezu vollständig in den Körper aufgenommen [Al-Nawas et al., 2021]. Die Resistenzrate des Amoxicillins bei odontogenen Abszessen ist mit 21 bis 50 Prozent deutlich geringer als jene des Clindamycins [Al-Nawas et al., 2021; S3-Leitlinie „Odontogene Infektionen“, 2016]. Für die Dauer von drei bis fünf Tagen sollte Amoxicillin in der Dosierung von einem Gramm dreimal täglich eingenommen werden. Das Amoxicillin führt im Gegensatz zu Clindamycin zu weniger Nebenwirkungen und verursacht geringere Kosten [Hussein et al., 2018].
Bei schweren odontogenen Infektionen mit Ausbreitungstendenz und immungeschwächten oder multimorbiden Patienten steht bei oraler Therapie die Kombination aus Amoxicillin und Beta-Lactamaseinhibitor (Clavulansäure) zur Verfügung [Eckert et al., 2012]. Diese Kombination ist sehr sinnvoll, da Resistenzen gegenüber Penicillin zu einem großen Teil auf die Induktion der bakteriellen Beta-Lactamasen zurückzuführen sind. Eine Kombination aus Amoxicillin und dem Hemmstoff dieses Enzyms ist sehr potent. Das im Handel unter dem Namen Augmentan (Glaxo SmithKline, Brentford, Großbritannien) bekannte Kombipräparat aus Antibiotikum und Enzym wird in einer Dosis 875 mg Amoxicillin und 125 mg Clavulansäure zweimal täglich für drei bis fünf Tage verschrieben [S3-Leitlinie „Odontogene Infektionen“, 2016] (Tabelle 1).
Bei einer bekannten Penicillinallergie kann das Ausweich- und Reserveantibiotikum Clindamycin zur systemischen Therapie von odontogenen Infektionen eingesetzt werden [Tent et al., 2019]. Im Gegensatz zu Penicillinen weist das Clindamycin eine geringere Sensibilität gegenüber aeroben und anaeroben Bakterien auf. Im Knochen baut Clindamycin (wie Amoxicillin) einen ausreichenden Wirkspiegel auf. Um die weitere Reduktion der Sensibilität von Bakterien gegenüber Clindamycin zu vermeiden, ist es nicht empfehlenswert, Clindamycin bei odontogenen Infektionen ohne eine vorliegende Penicillinallergie zu verabreichen. Bei Patienten mit odontogenen Infektionen liegt die Resistenzrate für Amoxicillin deutlich niedriger als für Clindamycin. Die Resistenzrate gegenüber Clindamycin wird mit 25 bis 45 Prozent angegeben. Für den zahnärztlichen Bereich wird ein bakterizides Wirkspektrum für Antibiotika gefordert, dieses kann das bakteriostatische Antibiotikum Clindamycin nicht erfüllen [Hussein et al., 2018]. Als Reserveantibiotikum wird Clindamycin bei Anaerobiern und Staphylokokkeninfektionen angesehen. Neben seiner schlechten gastrointestinalen Verträglichkeit, ist die Parallelresistenz zu Makroliden ein weiterer Nachteil [Al-Nawas et al., 2021]. Trotz dieser Fakten wird zu 51 Prozent Clindamycin im Rahmen endodontischer Therapiemaßnahmen verschrieben [Hussein et al., 2018]. Hier sollte dringend umgesteuert werden.
Der Einsatz von Antibiotika in der endodontischen Therapie sollte immer mit Bedacht gewählt werden. Lediglich bei 20 Prozent aller odontogenen Infektionen sind systemische Antibiotika indiziert, jedoch werden in circa 80 Prozent der erhobenen Patientenfälle Antibiosen rezeptiert [Siqueira et al., 2011]. Eine genaue Diagnostik und Therapie des endodontischen Problems sowie der richtige Umgang mit odontogenen Abszessen können den Einsatz von bakteriziden und bakteriostatischen Medikamenten reduzieren und überflüssige Gaben vermeiden. Um die Entwicklung von Antibiotika-resistenten Bakterienstämmen zu vermeiden, ist es wichtig, mit der Verschreibung von Antibiotika sehr bewusst umzugehen. Die Anzahl Penicillin-resistenter Streptokokken in der Mundhöhle nimmt weiter zu und ist bei Patienten, die häufig Antibiotika nehmen am höchsten [Pasquantonio et. al., 2012].
Antibiotikatherapie bei traumatisierten Zähnen
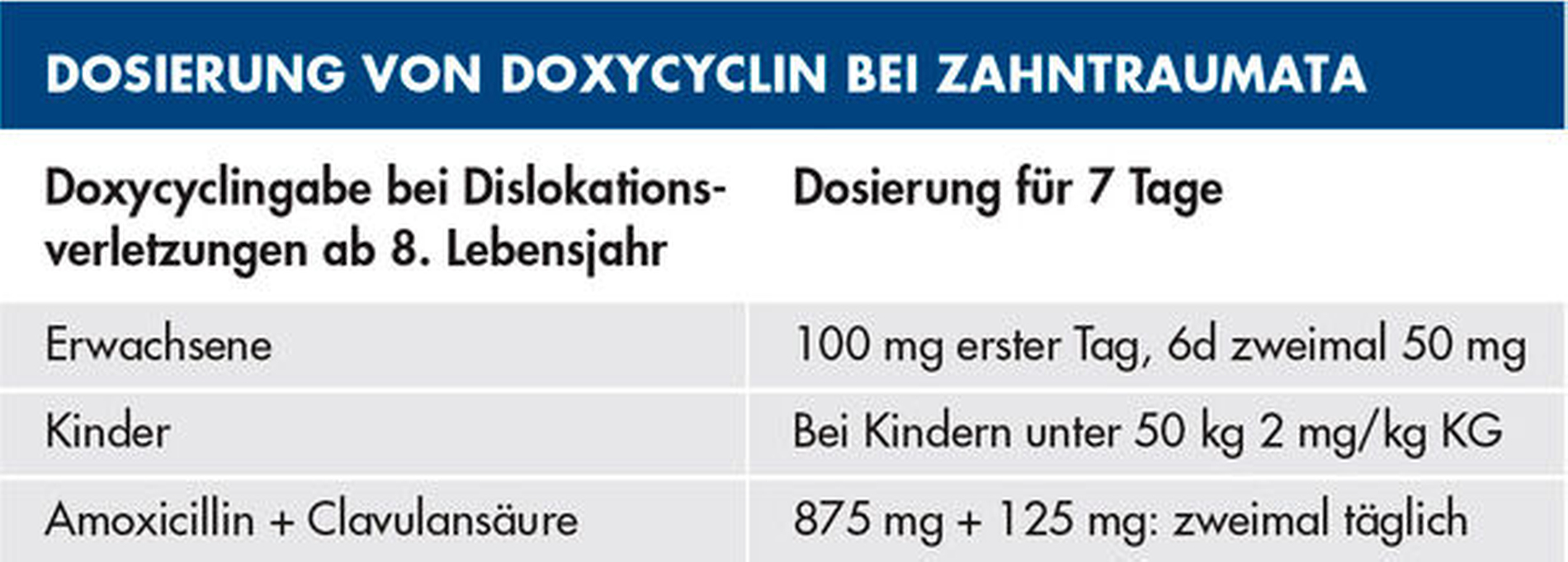
Bei einem dentalen Trauma kann es zu schweren Dislokationen der Zähne kommen. Zu den Dislokationsverletzungen gehören die Intrusion, die laterale Dislokation und die Avulsion des kompletten Zahnes als die schwerste Form der Dislokation. Bei diesen dislozierenden Zahntraumata kann von einer Verletzung oder Schädigung des Desmodonts ausgegangen werden – hier sind vor allem die Intrusion und die Avulsion der Zähne zu nennen (Abbildungen 4 und 5). In diesen Fällen wird ab dem achten Lebensjahr eine systemische Gabe von Doxycyclin zur antiresorptiven Therapie empfohlen. Die Datenlage zum klinischen Vorgehen der Antibiotikagabe ist bisher nicht eindeutig. Die Gabe des Doxycyclins beginnt am Tag des Unfalls mit einer Initialdosis von 100 mg für Patienten mit einem Körpergewicht von über 50 kg. Die Erhaltungsdosis beträgt für die kommenden sechs Tage zweimal täglich 50 mg. Kinder ab acht Jahre, die weniger als 50 kg wiegen, bekommen das Doxycyclin in einer Dosierung von 2 mg/kg Körpergewicht. Durch die kurze Gabe des Doxycylins sind Zahnverfärbungen sehr unwahrscheinlich. Des Weiteren hat bei über acht Jahre alten Patienten die Mineralisierung der Zahnkronen der ersten und zweiten Molaren bereits stattgefunden [Krastl et al., 2020] (Tabelle 2).
Ist der traumatisierte Zahn mit abgeschlossenem Wurzelwachstum um mehr als 1 mm aus der Alveole ausgelenkt worden, muss von einem apikalen Abriss des Gefäß-Nerven-Strangs ausgegangen werden. Die Regeneration der Pulpa bei einem ausdifferenzierten Foramen apicale (kleiner als zwei Millimeter im Durchmesser) ist extrem unwahrscheinlich, so dass es in diesen Fällen zu einer Pulpanekrose kommt. Über die Dentintubuli erfolgt nachfolgend bei traumatisierten Zähnen mit nekrotischer Pulpa eine bakterielle Kontamination – auch wenn die Zahnkrone intakt ist. Der Therapieentschluss über die Durchführung einer Wurzelkanalbehandlung sollte daher direkt am Unfalltag gefällt werden [Krastl et al., 2020] (Abbildungen 6 bis 9).
Lokale Anwendung bei traumatisierten Zähnen
Bei Avulsionen ist die Wahrscheinlichkeit einer Revaskularisierung der Pulpa ab einem Durchmesser des apikalen Foramens kleiner als 2 mm unwahrscheinlich. In diesen Fällen muss eine Wurzelkanalbehandlung durchgeführt werden. Wenn es der Patient und die Zeit zulassen, ist es empfehlenswert, den traumatisierten Zahn direkt in der ersten Sitzung endodontisch zu behandeln. Diese umfassende Therapie lässt sich jedoch selten in der Schmerzbehandlung realisieren, so dass eine Vitalexstirpation und die Einlage eines Kortikoid-haltigen Medikaments eine gangbareAlternative darstellen (Abbildung 10). Durch die unfallbedingte Schädigung des Wurzelzements kann es zu einem direkten Kontakt zwischen Knochen und der Zahnwurzel kommen. Schäden am Parodont können durch die Diffusion des Kortikoids an die Wurzeloberfläche in ihrer Heilung unterstützt werden [Krastl et al., 2020]. Durch das Kortikoid können Dentinoklasten in ihrer Aktivität gehemmt werden, indem die Adhärenz dieser Zellen an die Wurzeloberfläche verhindert wird [Hülsmann et al., 2021]. Kortikoid-haltige Einlagepasten sind beispielsweise Odontopaste (Australian Dental Manufacturing, Brisbane, Australia) und Ledermix (Riemser, Greifswald). Die Bedeutung des antibiotischen Zusatzes ist bisher unklar und spielt eine nur untergeordnete Rolle im Gegensatz zu dem Kortikoid. In Tiermodellstudien erzielten hochkonzentrierte reine Kortikosteroide, wie das Clobetasol, gute Ergebnisse hinsichtlich einer Resorptionsprophylaxe [Kirakozova et al., 2009]. Zur weiteren Resorptionsprophylaxe bei avulsierten Zähnen kann lokal ein Tetracyclin (Minocyclin) auf die Wurzeloberfläche aufgetragen werden.
Lokale Anwendung in der Endodontie
Antibiotika-haltige Wurzelkanalspüllösungen
Zur Desinfektion des Wurzelkanalsystems werden Spüllösungen mit verschiedenen Anforderungen benötigt. Zu den Spüllösungen mit einem antibiotischen Zusatz gehören das Bio Pure (Dentsply, Tulsa Dental, Tulsa, USA) und das Tetraclean (Ogna Laboratori Farmaceutici Muggio, Italien). Beide Spüllösungen enthalten Tetracyclin. Es liegt bisher keine Evidenz vor, dass diese Spüllösungen eine überlegene Wirksamkeit im Vergleich zum Natriumhypochlorit (NaOCl) haben. Dies liegt vermutlich daran, dass viele isolierte Bakterienstämme, die sich im Wurzelkanal befinden, gegen Tetracycline resistent sind. Hier sollte der Fokus auf der Elimination des gesamten Biofilms und dessen Bakterienformation liegen [Al-Ahmad et al., 2014]. Eine Überlegenheit Antibiotika-haltiger Spüllösungen zur Wurzelkanaldesinfektion gegenüber Natriumhypochlorit in Kombination mit einem Agens zur Entfernung der Schmierschicht, wie EDTA oder Zitronensäure, ist nicht zu erkennen [Hülsmann et al., 2021].
Antibiotika-haltige medikamentöse Einlagen
Die wohl bekannteste medikamentöse Einlage mit einem Zusatz des Tetracyclins Demeclocyclin (3,2 Prozent) ist das Ledermix (Riemser, Greifswald). Ein weiterer wichtiger Bestandteil des Ledermix ist das Kortikosteroid Triamcinolonacetoid (1 Prozent), das eine Hemmung der Entzündungsreaktion herbeiführt. Die Zugabe des Antibiotikums im Ledermix soll die durch das Kortikoid induzierte Immunsuppression kompensieren. Das Tetracyclin im Ledermix hat indes keine desinfizierende Wirkung auf das Wurzelkanalsystem [Hauman et al., 2003]. Folglich trägt Ledermix nicht zu einer Unterstützung der Heilung bei. Zur Desinfektion des Wurzelkanalsystems sind Natriumhypochlorit und Kalziumhydroxid dem Ledermix überlegen [Hülsmann et al., 2021]. Eine medikamentöse Einlage mit Ledermix verringert die Inzidenz von Flare-ups nach einer endodontischen Therapie nicht.
Zudem kann Ledermix zu dunklen, grau-braunen Verfärbungen der klinischen Krone führen [Kim et al., 2000]. Bei der Applikation sollte darauf geachtet werden, dass die Pulpakammer versäubert ist und das Präparat nur unterhalb der Schmelz-Zement-Grenze in den Zahn eingebracht wird. Vor der abschließenden Wurzelkanalfüllung sollte Ledermix gründlich aus dem Wurzelkanalsystem mit adäquaten, gegebenenfalls Schall- respektive Ultraschall-aktivierten Spüllösungen entfernt werden.
Die einzelnen Bestandteile des Ledermix diffundieren nach Applikation durch den gesamten Zahn. Das Tetracyclin diffundiert durch die Dentintubuli und ein Drittel des Kortikoids kann durch das apikale Foramen in das periapikale Gewebe diffundieren [Abbott et al., 1992]. Im periapikalen Gewebe kann das Kortikoid zu einer Immunsuppression führen und damit die körpereigene Immunantwort unterdrücken [Tepel et al 1994]. Der kurzzeitige Einsatz von Ledermix ist zu favorisieren, da es über die Schmerzlinderung hinaus keinen therapeutischen Nutzen hat [Hülsmann et al., 2021]. Der Hersteller gibt in seiner Gebrauchsanweisung eine Kontraindikation für Ledermix bei purulenten Pulpitiden und Abszessen an. Eine weitere Gegenanzeige spricht der Hersteller für die Zeiträume der Schwangerschaft und Stillzeit aus.
Eine Kombination von Kalziumhydroxid und Ledermix bringt keine Vorteile, da das Kalziumhydroxid die Inhaltsstoffe Tetracyclin und Triamcinolon zerstört und die initiale Entzündungshemmung mindert. Das Kortikoid wird im alkalischen Milieu des Kalziumhydroxids unwirksam [Athanassiadis et al., 2009].
Weitere Antibiotika-haltige Pastenpräparate sind das Pulpomixine (Septodont, Saint-Maur, Frankreich), Septomixine forte (Septodont, Saint-Maur, Frankreich) und Odontopaste (Australian Dental Manufacturing, Kenmore Hills, Australien). Das Präparat Odontopaste enthält die Wirkstoffe Clindamycin sowie Kalziumhydroxid und führt seltener zu Zahnverfärbungen als Ledermix [Hülsmann et al., 2021].
Regenerative Endodontie
Bei juvenilen Zähnen mit nicht abgeschlossenem Wurzelwachstum und einer Infektion des Endodonts kann der Versuch der Revitalisierung angezeigt sein, um das Fortschreiten des Wurzelwachstums zu induzieren. Als medikamentöse Einlage wurden hierzu ursprünglich lokale Antibiotika wie Metronidazol und Ciprofloxacin als Double Antibiotic Paste (DAP) sowie mit dem Zusatz von Minocyclin als Triple Antibiotic Paste (TAP) empfohlen [Widbiller et al., 2021]. Das Konzept der Regenerativen Endodontie beruht auf der Freisetzung von pluripotenten Stammzellen aus der apikalen Papille, die in der Lage sind, sich weiter auszudifferenzieren, zum Beispiel zu Pulpazellen oder Dentinoblasten [Sonoyama et al., 2008]. Bei einer Konzentration von über einem Milligramm pro Milliliter DAP oder TAP wurden jedoch zytotoxische Effekte auf die Stammzellen der apikalen Papille nachgewiesen [Galler et al., 2015]. Durch das applizierte Minocyclin kann es zudem zu Verfärbungen der klinischen Krone kommen. Aus diesen Gründen empfiehlt die European Society of Endodontology in ihrer Stellungnahme zur Revitalisierung primär die Verwendung von Kalziumhydroxid. Für Kalziumhydroxid wurde ein erhöhtes Überleben von Stammzellen der apikalen Papille nachgewiesen. DAP sowie TAP sind medikamentöse Einlagen der zweiten Wahl und sollten lediglich mit Bedacht, beispielweise bei persistierenden Entzündungen, angewendet werden [American Association of Endodontists (AAE), 2018].
Prophylaktische Antibiotikagabe
Die Anwesenheit von Bakterien im Blutkreislauf wird als Bakteriämie bezeichnet. Für einige Patientengruppen kann eine, durch eine zahnärztliche Behandlung verursachte Bakteriämie ein Risiko darstellen. Die Inzidenz einer durch zahnärztliche Maßnahmen verursachten Bakteriämie liegt bei circa 34 bis 100 Prozent. Beispiele für Behandlungen mit einem erhöhten Bakteriämie-Risiko sind das Anlegen einer Matrize, die Befestigung einer Kofferdamklammer, die Bestimmung der Taschensondierungstiefen, subgingivale Präparationen, intraligamentäre Anästhesien, Scaling oder die Gingivektomie. Während der Wurzelkanalbehandlung eines pulpa-avitalen Zahnes kann es ebenfalls zu einer Bakteriämie kommen. Hier liegt die Inzidenz zwischen 31 und 54 Prozent. Die Bakteriämie tritt bereits 30 Sekunden nach Behandlungsbeginn auf, überdauert die Behandlung aber lediglich etwa 15 Minuten [Murray et al., 2000]. Beispiele hier sind die Bestimmung der Arbeitslänge, die Präparation eines Gleitpfades, die Wurzelkanalpräparation, die Behandlung von Perforationen oder endodontisch-chirurgische Maßnahmen. Weitere Maßnahmen wie die Extraktion, die Replantation, die Reposition von Zähnen sowie die Inzision können ebenfalls zu einer transienten Bakteriämie führen [Schäfer, 2019]. Aufgrund der zeitlich begrenzten Bakteriämie während und kurz nach der dentalen Behandlung ist eine einmalige, hochdosierte orale Antibiotikagabe ausreichend [Schäfer, 2019].
Das Antibiotikum der Wahl stellt Amoxicillin dar. Für Erwachsene werden zwei Gramm und bei Kindern 50 Milligramm pro Kilogramm Körpergewicht empfohlen. Bei einer Penicillinallergie kann Clindamycin verabreicht werden, für Erwachsene mit einer Dosierung von 600 Milligramm und für Kinder mit 15 Milligramm pro Kilogramm Körpergewicht. Die orale Einnahme des Antibiotikums erfolgt 30 bis 60 Minuten vor dem dentalen Eingriff (Tabelle 3).
Welche Patienten haben ein erhöhtes Risikoprofil?
Für einige Patienten stellt eine Bakteriämie ein Risiko dar. Beispiele für fokale Infektionen nach zahnärztlicher Intervention sind Gehirnabszesse (mit einer Wahrscheinlichkeit von 1 zu 1 Million zahnärztliche Behandlungen) oder eine bakterielle Endokarditis. Das Risiko nach einem zahnärztlichen Eingriff an einer bakteriellen Endokarditis zu erkranken, liegt für gesunde Patienten bei 1 zu 14,2 Millionen zahnärztliche Behandlungen, für Patienten mit einer bereits durchgemachten Endokarditis bei 1 zu 95.000 und bei Patienten mit Herzklappenersatz bei 1 zu 114.000 zahnärztliche Behandlungen [Pallasch et al., 2003] (Weitere Informationen im Beitrag „Endokarditisprophylaxe“ dieser Fortbildung).
Indiziert ist eine antibiotische Abschirmung vor endodontischen Therapiemaßnahmen, die mit einem erhöhten Risiko für eine Bakteriämie assoziiert sind, bei [Moergel et al., 2021; Schäfer, 2019]:
Patienten mit Herzklappenersatz,
Zustand nach durchgemachter mikrobiell verursachter Endokarditis,
angeborenem komplexem Herzfehler mit Zyanose,
chirurgisch korrigiertem Herzfehler innerhalb der ersten sechs Monate postoperativ,
operativ behandeltem Herzfehler mit Implantation von Condutis oder residualem Defekt (turbulente Blutströmung) im Bereich des prothetischen Materials,
Patienten mit rekonstruierter Herzklappe unter Verwendung von alloplastischem Material in den ersten sechs Monaten nach der Operation,
Niereninsuffizienz Grad V (Dialyse-pflichtig),
organtransplantierten Patienten unter immunsupprimierender Medikation (lebenslang),
Patienten nach Radiatio-Therapie im Kieferbereich zeitlebens (mindestens 24 Stunden vor der Therapie beginnen und gegebenenfalls drei Tage postoperative Antibiotikagabe, sofern es bei der Wurzelkanalbehandlung zu einer Überinstrumentierung gekommen ist),
Patienten unter Bisphosphonat-Medikation mit erhöhtem Risiko (i.v.-Gabe oder Bisphosphonat-Medikation länger als drei Jahre).
Zusammenfassung
Bei odontogenen Infektionen können Antibiotika indikationsbezogen eingesetzt werden, wenn eine Ausbreitungstendenz des Abszesses vorliegt.
Zur antiresorptiven Therapie und bei Zahntraumata nach einer lateralen Dislokations-Verletzung oder einer Avulsion sind Antibiotika indikationsbezogen systemisch und lokal empfehlenswert.
Eine prophylaktische Antibiotikagabe ist bei Patienten mit speziellem Risikoprofil zur Vermeidung einer Bakteriämie indiziert.
Die lokale Anwendung von Antibiotika-haltigen medikamentösen Einlagen kann zur Resorptionsprophylaxe nach dentalen Traumata indiziert sein.
Desinfizierende Spüllösungen mit Antibiotikazusatz sind einem konventionellen Spülprotokoll unterlegen. Medikamentöse Einlagen mit zwei oder drei verschiedenen Antibiotika bei der regenerativen endodontischen Behandlung sind nicht mehr als das Vorgehen der ersten Wahl anzusehen.
Mit dem Wissen um den richtigen Indikationsbereich im zahnärztlichen Alltag kann die Verabreichung von Antibiotika deutlich reduziert werden. Angesichts des Risikos zunehmender Resistenzen gegenüber Antibiotika ist es wichtig zu wissen, wann sie eingesetzt werden können, sollten oder müssen.
Literaturliste
Abbott PV. Systemic release of corticosteroids following intra-dental use. Int Endod J 1992;25:189-91.
Al-Ahmad A, Ameen H, Pelz K. Antibiotic resistance and capacity for biofilm formation of different bacteria isolated from endodontic infections associated with root-filled teeth. J Endod 2014; 40, 223–30.
Al-Nawas B, Eickholz P, Hülsmann M. Antibiotika in der Zahnmedizin; Quintessenz Verlag, Berlin; 2021.
Al-Nawas B, Ziegler A, Halling F. Antimikrobielle Wirkstoffe in Therapie und Prophylaxe. In: Al-Nawas B, Eickholz M, Hülsmann M (Hrsg.) Antibiotika in der Zahnmedizin. Quintessenz, Berlin, 2021.
Al-Nawas N, Karbach J. S3 Leitlinie: Odontogene Infektionen. 2016; www.awmf.org/uploads/tx_szleitlinien/007-006l_S3_Odontogene_Infektionen_2017-12-abgelaufen.pdf).
American Association of Endodontists (AAE) Clinical considerations for a regenerative procedure revised 4/1/2018.
Athanassiadis B, Abbott PV, George N, Walsh LJ. An in vitro study of the antimicrobial activity of some endodontic medicaments and their bases using an agar well diffusion assay. Aust Dent J 2009;54:141-6.
Bundesamt für Verbraucherschutz und Lebensmittelsicherheit, e.V. P-E-GfrC. GERMAP 2015 – Bericht über den Antibiotikaverbrauch und die Verbreitung von Antibiotikaresistenzen in der Human- und Veterinärmedizin in Deutschland. Antiinfectives Intelligence, Rheinbach 2016.
Hauman CH, Love RM. Biocompatibility of dental materials used in contemporary endodontic therapy: a review. Part 1. Intracanal drugs and substances. Int Endod J 2003;36:75-85.
Eckert AW, Just L, Wilhelms D, Schubert J. Odontogene Infektionen - Teil I: Zur Wertigkeit der Erregerbestimmung bei odontogenen Infektionen in der klinischen Routine. Wien Med Wochenschr. 2012;162:316-20.
European Society of Endodontology. Quality guidelines for endodontic treatment: consensus report for the European Society of Endodontology. Int Endod J 2006;39: 921-30.
Fouad AF, Rivera EM, Walton RE. Penicillin as a supplement in resolving the localized acute apical abscess. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1996; 81:590-5.
Galler KM. Revitalisierung. In: Hülsmann M, Schäfer E (Hrsg.) Probleme in der Endodontie; Quintessenz, Berlin; 2. Auflage 2019.
Galler KM, Buchalla W, Hiller KA, Federlin M, Eidt A, Schiefersteiner M, Schmalz G. Influence of root canal disinfectants on growth factor release from dentin. J Endod. 2015;41:363-8.
Heider J, Al-Nawas B.Odontogene Infektionen. In: Al-Nawas B, Eickholz P, Hülsmann M (Hrsg.) Antibiotika in der Zahnmedizin. Quintessenz, Berlin, 2021.
Henry M, Reader A, Beck M. Effect of penicillin on postoperative endodontic pain and swelling in symptomatic necrotic teeth. J Endod. 2001;27:117-23.
Hülsmann M, Schäfer E. Probleme in der Desinfektion. In: Hülsmann M, Schäfer E (Hrsg.) Probleme in der Endodontie; Quintessenz, Berlin; 2. Auflage, 2019.
Hülsmann M, Roth A, Schäfer E. Ledermix und Co.: Antibiotikahaltige Spüllösungen und medikamentöse Einlagen in der Endodontie. In: Al-Nawas B, Eickholz P, Hülsmann M (Hrsg.) Antibiotika in der Zahnmedizin. Quintessenz, Berlin, 2021.
Hussein RJ, Krohn R, Wilms G. Systemische adjuvante Antibiotikagabe bei Wurzelkanalbehandlung, Zahnextraktion und Notfallleistungen in der zahnärztlichen Versorgung bei gesetzlich versicherten in Deutschland. Dtsch Zahnärztl Z 2018;73: 22-28.
Kakehasi S, Stanley HR, Fitzgerald RJ. The effects of surgical exposures of dental pulps in germ-free and conventional laboratory rats. Oral Surg Oral Med Oral Pathol. 1965; 20:340-9.
Kim ST, Abbott PV, McGinley P. The effects of Ledermix paste on discolouration of immature teeth. Int Endod J. 2000;33:233-7.
Kirakozova et. al. Effect of intracanal corticosteroids on healing of replanted dog teeth after extended dry times. J Endod 2009;35:663-7.
Krastl G, Weiger R, Filippi A. Primärversorgung nach Zahntraumata: MUSS-SOLL- Kann. In: Zahntrauma Therapieoptionen für die Praxis, Quintessenz, Berlin; 2020.
Longman LP, Preston AJ, Martin MV, Wilson NH. Endodontics in the adult patient: the role of antibiotics. J Dent 2000;28:539-48.
Moergel M, Wolff T, Grötz KA. Antibiotika beim zahnärztlichen Risikopatient. In: Al-Nawas B, Eickholz P, Hülsmann M, (Hrsg.) Antibiotika in der Zahnmedizin. Quintessenz Verlag Berlin, 2021.
Murray CA, Saunders WP. Root canal treatment and general health: a review of the literature. Int Endod J. 2000;33:1-18.
Naghavi et. al. Antimicrobial Resistance Collaborators. Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. Lancet. 2022;399:629-655.
Pasquantonio G, Condò S, Cerroni L, Bikiqu L, Nicoletti M, Prenna M, Ripa S. Antibacterial activity of various antibiotics against oral streptococci isolated in the oral cavity. Int J Immunopathol Pharmacol. 2012;25:805-9.
Schäfer E. Allgemeinmedizinische Probleme. In: Hülsmann M, Schäfer E (Hrsg.) Probleme in der Endodontie; Quintessenz, Berlin; 2. Auflage 2019.
Schäfer E, Vahedi B, Bengs B, Krastl G. Wissenschaftliche Mitteilung der Deutsche Gesellschaft für Endodontologie und zahnärztliche Traumatologie (DGET), Dtsch Zahnärztl Z 021; 3: 182–7.
Segura-Egea JJ, Gould K, Şen BH, Jonasson P, Cotti E, Mazzoni A, Sunay H, Tjäderhane L, Dummer PMH. Antibiotics in Endodontics: a review. Int Endod J 2017;50:1169-84.
Segura-Egea JJ, Martín-González J, Jiménez-Sánchez MDC, Crespo-Gallardo I, Saúco-Márquez JJ, Velasco-Ortega E. Worldwide pattern of antibiotic prescription in endodontic infections. Int Dent J 2017;67:197-205.
Segura-Egea JJ, Gould FK, Sen BH, Jonasson P, Cotti E, Mazzoni A, Sunay H, Tjäderhane L, Dummer PMH. ESE Position Statement: Antibiotika in der Endodontie. In: Al-Nawas B, Eickholz P, Hülsmann M, (Hrsg.) Antibiotika in der Zahnmedizin. Quintessenz, Berlin, 2021.
Siren EK, Haapasalo MP, Ranta K, Salmi P, Kerosuo EN. Microbiological findings and clinical treatment procedures in endodontic cases selected for microbiological investigation. Int Endod J. 1997;30:91-5.
Siqueira JF Jr, Rôças IN. Present status and future directions: Microbiology of endodontic infections. Int Endod J (im Druck).
Siqueira JF. Systemic antibiotics in endodontics. In: Treatment of endodontic infections. Quintessence, Berlin, 2011:383-396.
Sonoyama W, Liu Y, Yamaza T, Tuan RS, Wang S, Shi S, Huang GT. Characterization of the apical papilla and its residing stem cells from human immature permanent teeth: a pilot study. J Endod 2008; 34:166-71.
Tepel J, Darwisch el Sawaf M, Hoppe W. Reaction of inflamed periapical tissue to intracanal medicaments and root canal sealers. Endod Dent Traumatol 1994;10:233-8.
Tent PA, Juncar RI, Onisor F, Bran S, Harangus A, Juncar M. The pathogenic microbial flora and its antibiotic susceptibility pattern in odontogenic infections. Drug Metab Rev 2019;5:340-55.
Widbiller M, Galler KM. Antibiotika in der regenerativen Endodontie. In: Al-Nawas B, Eickholz P, Hülsmann M, (Hrsg.) Antibiotika in der Zahnmedizin. Quintessenz, Berlin, 2021.