Antibiotikaresistenzen – die stille Pandemie
Vor drei Jahren veröffentlichte die WHO eine Liste der zehn größten globalen Gesundheitsbedrohungen. Darin vertreten: antimikrobielle Resistenzen beziehungsweise multiresistente Erreger (MRE) [WHO, 2019]. Allein 2019 waren MRE für weltweit 1,27 Millionen Todesfälle direkt verantwortlich und mit weiteren 3,68 Millionen zumindest assoziiert [Murray et al., 2022]. Das Problem betrifft dabei nicht nur Entwicklungsländer, sondern auch sogenannte High-Income-Länder (Hochlohnländer) wie Deutschland. In diesen verursachen MRE circa 11,3 Todesfälle pro 100.000 Einwohner, je ein Viertel davon gehen allein auf das Konto von Staphylococcus aureus und Escherichia coli [Murray et al., 2022].
Als MRE bezeichnet man meist bakterielle Mikroorganismen, gegen die viele gängige Antibiotika nicht (mehr) ausreichend wirksam sind. Im grampositiven Spektrum sind als wichtigste Vertreter der Methicillin-resistente Staphylococcus aureus (MRSA) und Vancomycin-resistente Enterococcus faecalis und faecium (VRE) hervorzuheben.
Multiresistente gramnegative Bakterien werden speziesübergreifend als 3- oder 4-MRGN (MultiResistente GramNegative) bezeichnet. Sie sind gegen drei beziehungsweise vier der klinisch relevanten Antibiotikagruppen – Peniclline, Cephalosporine, Fluorchinolone und/oder Carbapeneme – resistent. Wichtige Vertreter sind unter anderem Escherichia coli, Klebsiella pneumoniae und Acinetobacter baumannii.
Eine Mitte 2021 veröffentlichte Auswertung der Antibiotika-Resistenz-Surveillance (ARS) [Meinen et al., 2021] in Verbindung mit dem Arzneiverordnungsreport 2020 [Schwabe, 2020] zeigt die aktuelle Situation bei odontogenen Infektionen in Deutschland: Auch wenn diese Infektionen häufig polymikrobiell sind, die am häufigsten isolierten Erreger sind Streptococcus spp. (33 bis 36 Prozent) und Staphylococcus spp. (12 bis 21 Prozent), gefolgt von Prevotella spp. (6 bis 8 Prozent) und Klebsiella spp. (5 Prozent). Das im niedergelassenen zahnmedizinischen Bereich mit Abstand am häufigsten eingesetzte Antibiotikum ist Amoxicillin (47,9 Prozent), gefolgt von Clindamycin (22,7 Prozent).
Amoxicillin-Resistenzen bei Streptokokken sind in Praxis-Isolaten relativ selten (1,4 Prozent), allerdings deutlich häufiger bei Klinik-Isolaten (6,9 Prozent) nachweisbar. Gegen Clindamycin sind sogar 18 Prozent beziehungsweise 19,4 Prozent der Streptokokken resistent. Noch problematischer ist die Resistenzsituation bei Staphylococcus aureus (9 bis 12 Prozent aller Isolate), dieser ist häufig gegen Amoxicillin (65 Prozent), Clindamycin (17 Prozent) und Makrolide (17 Prozent) resistent, was die Therapieoptionen zunehmend limitiert. Bei Klebsiella pneumoniae sind besonders kritische Carbapenem-Resistenzen in den untersuchten Isolaten glücklicherweise eine Seltenheit (0 Prozent in Praxen, 0,13 Prozent in Kliniken).
Nichtsdestotrotz geben insbesondere die hohen Resistenzraten gegen Clindamycin Anlass zur Sorge. Eines der Hauptprobleme ist der teilweise unreflektierte Einsatz von Antibiotika, sei es in der Human- und Zahnmedizin oder in der Veterinärmedizin.
Ein klassisches Beispiel sind Antibiotika bei viralen Atemwegserkrankungen. Seit Jahren korreliert die Menge verschriebener Antibiotikadosen mit der Häufigkeit grippaler Infekte, obwohl diese hierbei nicht indiziert sind [Yaacoub et al., 2021]. Auch in der Zahnmedizin werden allzu oft Antibiotika dort verschrieben, wo sie nicht benötigt werden. Viele odontogene Infektionen werden primär chirurgisch-interventionell behandelt und bedürfen nur bei Ausbreitungstendenz oder Risikofaktoren einer antibiotischen Therapie [Al-Nawas und Karbach, 2017]. Sogar über die Hälfte aller Antibiotikaverschreibungen sollen ohne entsprechende Indikation erfolgen [Cope et al., 2016; Patrick und Kandiah, 2018; Teoh et al., 2019; Suda et al., 2019; Hubbard et al., 2022].
Die falsche Anwendung von Antibiotika ist aus mehreren Gründen problematisch: Zum einen werden Nebenwirkungen wie allergische Reaktionen, gastrointestinale Beschwerden und Clostridioides-difficile-Infektionen unnötig in Kauf genommen [Shehab et al., 2008; Hansen et al., 2019]. Zum anderen steigt der Selektionsdruck auf die Bakterien, was bereits auf Ebene des einzelnen Patienten zu einer Zunahme von MRE führt [Costelloe et al., 2010].
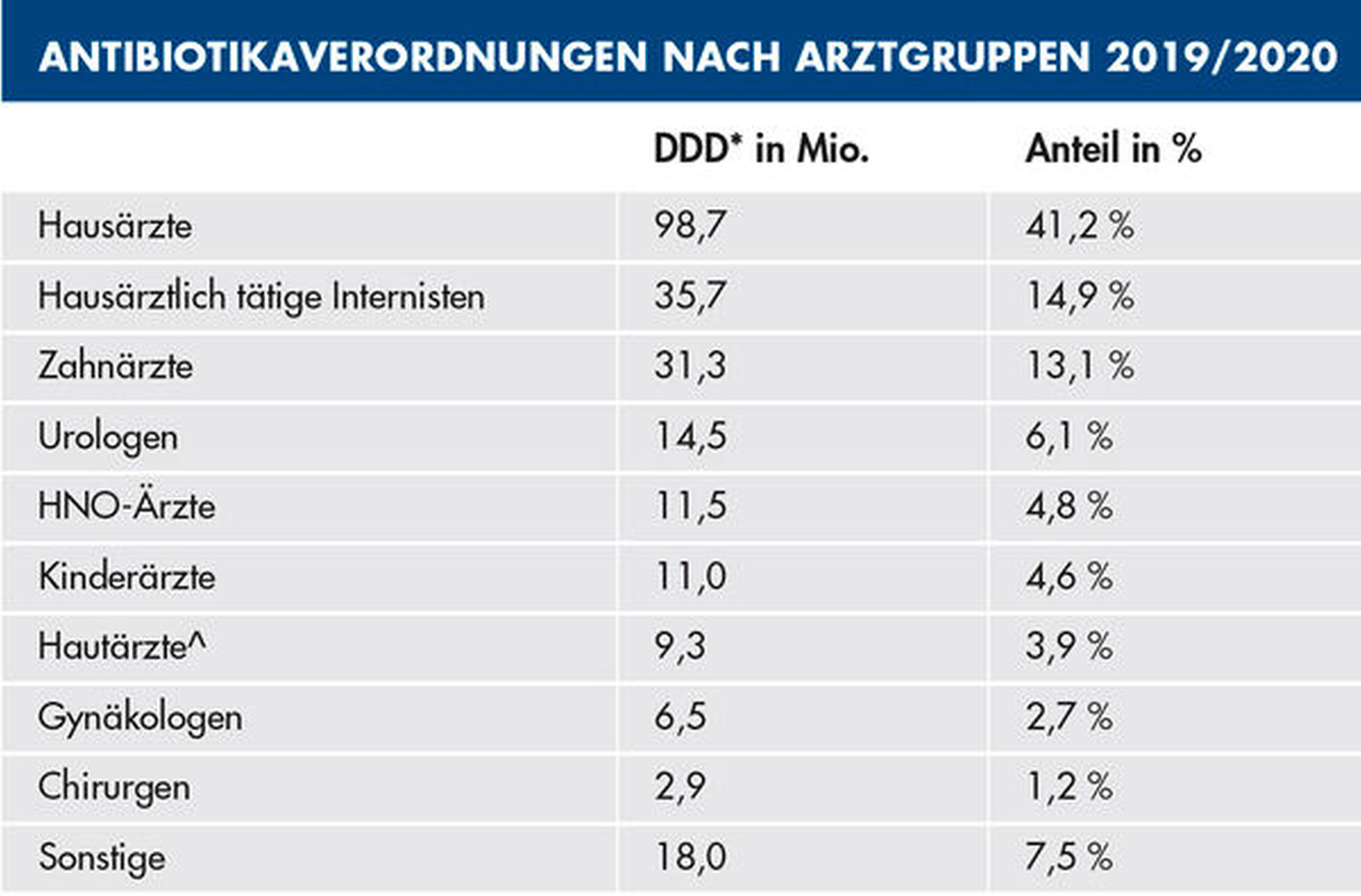
In der Corona-Pandemie stieg der ohnehin schon hohe Antibiotikaverbrauch sogar noch weiter an [Shah et al., 2020]. Derzeit entfallen knapp 13 Prozent des gesamten Antibiotikaverbrauchs im GKV-Bereich allein auf die Zahnmedizin (Tabelle) [WIdO, 2021]. Das unterstreicht die Wichtigkeit, die dieser im Kampf gegen die MRE-Pandemie zukommt. Gerade jetzt sind Antibiotic-Stewardship-Programme wichtiger denn je, dadurch können der Antibiotikaverbrauch gesenkt und die Zielgenauigkeit der Antibiotikaanwendungen deutlich gesteigert werden [Gross et al., 2019; Milani et al., 2019; Teoh et al., 2021]. So können uns auch in Zukunft Antibiotika als wirksames Therapieinstrument erhalten bleiben.
Literaturliste
Al-Nawas B, Karbach J (2017) S3-Leitlinie Odontogene Infektionen.
Birgand G, Charani E, Ahmad R, Bonaconsa C, Mbamalu O, Nampoothiri V, Surendran S, Weiser TG, Holmes A, Mendelson M, Singh S, researchers As (2022) Interventional research to tackle antimicrobial resistance in Low Middle Income Countries in the era of the COVID-19 pandemic: lessons in resilience from an international consortium. Int J Infect Dis 117:174-178. doi:10.1016/j.ijid.2022.02.013
Cope AL, Francis NA, Wood F, Chestnutt IG (2016) Antibiotic prescribing in UK general dental practice: a cross-sectional study. Community Dent Oral Epidemiol 44 (2):145-153. doi:10.1111/cdoe.12199
Costelloe C, Metcalfe C, Lovering A, Mant D, Hay AD (2010) Effect of antibiotic prescribing in primary care on antimicrobial resistance in individual patients: systematic review and meta-analysis. BMJ 340:c2096. doi:10.1136/bmj.c2096
Gross AE, Hanna D, Rowan SA, Bleasdale SC, Suda KJ (2019) Successful Implementation of an Antibiotic Stewardship Program in an Academic Dental Practice. Open Forum Infectious Diseases 6 (3). doi:10.1093/ofid/ofz067
Hansen MP, Scott AM, McCullough A, Thorning S, Aronson JK, Beller EM, Glasziou PP, Hoffmann TC, Clark J, Del Mar CB (2019) Adverse events in people taking macrolide antibiotics versus placebo for any indication. Cochrane Database Syst Rev 1:CD011825. doi:10.1002/14651858.CD011825.pub2
Hubbard CC, Evans CT, Calip GS, Zhou J, Rowan SA, Suda KJ (2022) Appropriateness of Antibiotic Prophylaxis Before Dental Procedures, 2016-2018. Am J Prev Med. doi:10.1016/j.amepre.2021.11.004
Meinen A, Reuss A, Willrich N, Feig M, Noll I, Eckmanns T, Al-Nawas B, Markwart R (2021) Antimicrobial Resistance and the Spectrum of Pathogens in Dental and Oral-Maxillofacial Infections in Hospitals and Dental Practices in Germany. Frontiers in Microbiology 12. doi:10.3389/fmicb.2021.676108
Milani RV, Wilt JK, Entwisle J, Hand J, Cazabon P, Bohan JG (2019) Reducing inappropriate outpatient antibiotic prescribing: normative comparison using unblinded provider reports. BMJ Open Quality 8 (1):e000351. doi:10.1136/bmjoq-2018-000351
Murray CJL, Ikuta KS, Sharara F, Swetschinski L, Robles Aguilar G, Gray A, Han C, Bisignano C, Rao P, Wool E, Johnson SC, Browne AJ, Chipeta MG, Fell F, Hackett S, Haines-Woodhouse G, Kashef Hamadani BH, Kumaran EAP, McManigal B, Agarwal R, Akech S, Albertson S, Amuasi J, Andrews J, Aravkin A, Ashley E, Bailey F, Baker S, Basnyat B, Bekker A, Bender R, Bethou A, Bielicki J, Boonkasidecha S, Bukosia J, Carvalheiro C, Castañeda-Orjuela C, Chansamouth V, Chaurasia S, Chiurchiù S, Chowdhury F, Cook AJ, Cooper B, Cressey TR, Criollo-Mora E, Cunningham M, Darboe S, Day NPJ, De Luca M, Dokova K, Dramowski A, Dunachie SJ, Eckmanns T, Eibach D, Emami A, Feasey N, Fisher-Pearson N, Forrest K, Garrett D, Gastmeier P, Giref AZ, Greer RC, Gupta V, Haller S, Haselbeck A, Hay SI, Holm M, Hopkins S, Iregbu KC, Jacobs J, Jarovsky D, Javanmardi F, Khorana M, Kissoon N, Kobeissi E, Kostyanev T, Krapp F, Krumkamp R, Kumar A, Kyu HH, Lim C, Limmathurotsakul D, Loftus MJ, Lunn M, Ma J, Mturi N, Munera-Huertas T, Musicha P, Mussi-Pinhata MM, Nakamura T, Nanavati R, Nangia S, Newton P, Ngoun C, Novotney A, Nwakanma D, Obiero CW, Olivas-Martinez A, Olliaro P, Ooko E, Ortiz-Brizuela E, Peleg AY, Perrone C, Plakkal N, Ponce-de-Leon A, Raad M, Ramdin T, Riddell A, Roberts T, Robotham JV, Roca A, Rudd KE, Russell N, Schnall J, Scott JAG, Shivamallappa M, Sifuentes-Osornio J, Steenkeste N, Stewardson AJ, Stoeva T, Tasak N, Thaiprakong A, Thwaites G, Turner C, Turner P, van Doorn HR, Velaphi S, Vongpradith A, Vu H, Walsh T, Waner S, Wangrangsimakul T, Wozniak T, Zheng P, Sartorius B, Lopez AD, Stergachis A, Moore C, Dolecek C, Naghavi M (2022) Global burden of bacterial antimicrobial resistance in 2019: a systematic analysis. The Lancet 399 (10325):629-655. doi:10.1016/s0140-6736(21)02724-0
Patrick A, Kandiah T (2018) Resistance to change: how much longer will our antibiotics work? Faculty Dental Journal 9 (3):103-111
Schwabe UL, Wolf-Dieter (2020) Arzneiverordnungs-Report 2020. Springer, Berlin, Heidelberg. doi:10.1007/978-3-662-62168-4
Shah S, Wordley V, Thompson W (2020) How did COVID-19 impact on dental antibiotic prescribing across England? Br Dent J 229 (9):601-604. doi:10.1038/s41415-020-2336-6
Shehab N, Patel PR, Srinivasan A, Budnitz DS (2008) Emergency department visits for antibiotic-associated adverse events. Clin Infect Dis 47 (6):735-743. doi:10.1086/591126
Suda KJ, Calip GS, Zhou J, Rowan S, Gross AE, Hershow RC, Perez RI, McGregor JC, Evans CT (2019) Assessment of the Appropriateness of Antibiotic Prescriptions for Infection Prophylaxis Before Dental Procedures, 2011 to 2015. JAMA Netw Open 2 (5):e193909. doi:10.1001/jamanetworkopen.2019.3909
Teoh L, Marino RJ, Stewart K, McCullough MJ (2019) A survey of prescribing practices by general dentists in Australia. BMC Oral Health 19 (1):193. doi:10.1186/s12903-019-0882-6
Teoh L, Stewart K, Marino RJ, McCullough MJ (2021) Improvement of dental prescribing practices using education and a prescribing tool: A pilot intervention study. British Journal of Clinical Pharmacology 87 (1):152-162. doi: doi.org/10.1111/bcp.14373
Wissenschaftliches Institut der AOK (WldO): Der GKV-Arzneimittelmarkt: Klassifikation, Methodik und Ergebnisse 2021, Berlin 2021, doi: dx.doi.org/10.4126/FRL01-006429816
Yaacoub S, Lanoy E, Hider-Mlynarz K, Saleh N, Maison P (2021) Trend of antibiotic consumption and its association with influenza-like illnesses in France between 2004 and 2018. Eur J Public Health 31 (6):1137-1143. doi:10.1093/eurpub/ckab143




