Vitamin D und seine Relevanz für die Zahnmedizin
Als Vitamin D wird eine Gruppe von fettlöslichen Vitaminen bezeichnet, die sogenannten Calciferole, die in unterschiedlichen Formen auftreten: In Form von Vitamin D2 (Ergocalciferol) kommt es überwiegend in pflanzlichen Nahrungsmitteln und Speisepilzen vor. Vitamin D3 (Cholecalciferol oder Calciol) hingegen befindet sich in allen nichtpflanzlichen Eukaryoten und ist daher physiologisch im Menschen aufzufinden. Das für die Knochengesundheit und zahlreiche andere Vorgänge im Körper wichtige Vitamin D3 wird beim Menschen zu 80 bis 90 Prozent unter dem Einfluss von UV-B-Sonnenlicht in der Haut synthetisiert und kann zu einem kleineren Teil auch über die Nahrung aus Fettfischen, mit Vitamin D angereicherter Margarine und Eigelb und in wesentlich geringeren Mengen als Vitamin D2 aus pflanzlichen Quellen (Pilze) aufgenommen werden [Holick et al., 2007]. Vitamin D3 kann im Körper durch die Anlagerung von Hydroxygruppen in eine Speicherform (Calcidiol) überführt werden – so gelingt es dem Organismus, „Versorgungslücken“ durch mangelnde Lichtexposition auszugleichen. Je nach Hydroxylierung befindet sich das Vitamin D in einem aktiven oder nicht aktiven Zustand beziehungsweise in einer seiner Vorstufen.
Synthese
Vitamin D ist ein Steroidhormon, das in der Haut synthetisiert wird (Abbildung 1), wenn die Sonneneinstrahlung mit Wellenlängen von 290 bis 315 nm) ausreichend ist. Unter dem Einfluss dieser UV-B-Strahlen wird in der Haut aus 7-Dehydrocholesterin (7-DHC) Prävitamin D3 gebildet und dann zu Vitamin D3 isomerisiert. Ein Trägerprotein transportiert Vitamin D3 in die Leber. Dort wird es enzymatisch hydroxyliert, wobei 25-Hydroxyvitamin-D3 (25(OH)D3, Calcidiol) entsteht [Lehmann, 2005]. Darauf wird das 25(OH)D3 in die Niere überführt, wo es zum metabolisch aktiven Vitamin 1α,25-Hydroxyvitamin-D3 (Calcitriol) umgewandelt wird. Neben den Nieren gibt es eine Vielzahl von Geweben, die eine lokale 1-α-Hydroxylase besitzen, einschließlich Knochen, Plazenta, Prostata, Keratinozyten, Makrophagen, T-Lymphozyten, dendritischen Zellen, mehreren Krebszellen und der Nebenschilddrüse [Gröber et al., 2013]. Übermäßige Sonneneinstrahlung hingegen führt dazu, dass Prävitamin D3 und Vitamin D3 zu inaktiven Fotoprodukten abgebaut werden, wodurch eine übermäßige Produktion des Sonnenvitamins in der Haut verhindert wird.
Der Hauptanteil des Vitamin-D-Bedarfs wird in der Mehrheit der Bevölkerung durch die körpereigene Synthese abgedeckt und nicht über die Aufnahme mit der Nahrung [Calvo et al., 2005]. Dies legt nahe, dass die Vitamin-D3-Produktion von der Exposition ausreichenden Sonnenlichts abhängt. Die Stärke der auf die Haut treffenden Strahlen wird von dem jeweiligen Breitengrad und den vorherrschenden Wetterbedingungen beeinflusst. Dementsprechend kann die Strahlung für die Synthese ausreichend oder mangelhaft sein. Während des Jahres schwanken diese Faktoren und führen dazu, dass in Europa saisonal in den sonnenreichen Sommermonaten deutlich höhere Vitamin -D-Serumspiegel vorliegen. In Ländern auf der Nordhalbkugel mit einem Breitengrad von größer als 40° N (nördlich von Madrid) ist die Sonnenstrahlung in den Monaten von Oktober bis März nicht ausreichend, um die Synthese von Vitamin D3 zu initiieren. Daher ist ein großer Anteil der europäischen Bevölkerung auf die Aufnahme von Vitamin D über die Nahrung und körpereigene Vorräte angewiesen, um einen ausreichend hohen Vitamin-D-Serumspiegel auch in sonnenschwachen Monaten aufrechtzuerhalten [O‘Conner et al., 2011].
Weitere Gründe für eine verminderte kutane Synthese von Vitamin D3 und damit einen verringerten Vitamin-D-Serumspiegel sind lange Aufenthalte in geschlossenen Räumen, die vermehrte Verwendung von Sonnenschutzprodukten zum Schutz vor Hautkrebs oder Kosmetika, die sich ebenfalls negativ auf eine ausreichende Sonnenexposition der Haut auswirken, eine dunkle Hautpigmentierung, hohes Alter, Bettlägerigkeit und das Tragen einer Ganzkörperverschleierung [Cashman et al., 2014]. Aus diesen Gründen muss ein angemessenes Maß an ausreichend hoher Sonnenexposition gefunden werden, um genug Vitamin D3 synthetisieren zu können, ohne das Risiko eines Sonnenbrands einzugehen.
Eine weitere Herausforderung besteht darin, dass es nur wenige natürliche Nahrungsquellen gibt, die genügend Vitamin D liefern (fetter Seefisch, Lebertran, Eier und Speisepilze, sehr begrenzt Milch- und Käseprodukte). Grundsätzlich ist die Aufnahme von Vitamin D über die Nahrung nicht ausreichend, um die saisonal schwächere Sonneneinstrahlung während der Wintermonate auszugleichen. Durchschnittlich reicht ein Aufenthalt von 15 bis 20 Minuten in direkter Sonnenstrahlung aus, um die Vitamin-D3-Synthese von 10.000 Internationalen Einheiten (IE) zu erreichen [Krause et al., 1998], wobei stärker pigmentierte Menschen weniger Vitamin D in der gleichen Zeit produzieren als schwächer pigmentierte [Holick et al., 2004].
Wirkung
Vitamin D spielt eine wichtige Rolle bei der Calcium- und Phosphat-Homöostase, dem Mineralhaushalt und reguliert den Knochenstoffwechsel [Halfon et al., 2015]. Das unter dem Einfluss von niedrigen Serumphos-phatspiegeln und Parathormon in der Niere verstärkt gebildete aktive Vitamin D3 stimuliert die Resorption von Calcium und Phosphat aus dem Darm und reduziert deren Ausscheidung im Urin. Darüber hinaus fördert Calcitriol über verschiedene Mechanismen die Mineralisierung des Knochens (Abbildung 2).
Die Wirkung von Vitamin D auf die Osteoklasten ist umstritten [Allard et al., 2015]. Es wird von inhibierenden [Sakai et al., 2009] und aktivierenden [Atkins et al., 2003] Effekten auf die Osteoklastenentwicklung berichtet. Einerseits führt Vitamin D zu einer erhöhten Produktion von RANKL (Receptor Activator of NF-κB Ligand) und Expression der mRNA von Osteocalcin durch Osteoblasten, das die Heranreifung und Aktivierung von Osteoklasten positiv beeinflusst [Atkins et al., 2003]. Andererseits wird beschrieben, dass der Vitamin-D-Rezeptor (VDR) in Kombination mit Vitamin D die Wirkung von RANKL behindert. Als Folge werden die Osteoklastengenese und die Knochenresorption der Osteoklasten gehemmt [Takasu et al., 2006]. Außerdem führt Vitamin D zu einer verringerten Expression von NFATc1 und zu einer erhöhten Expression von Interferon-β (INF-β), was zu einer Verhinderung der Osteoklastengenese und -differenzierung führt [Sakai et al., 2009]. In Bezug auf die Knochenresorption spielt Vitamin D tendenziell eine inhibierende Rolle [Takasu et al., 2006]. Die Calcidiol-Speicherform des Vitamin D (25-Hydroxyvitamin-D) hingegen hat eher einen stimulierenden Einfluss auf die Differenzierung von Osteoklasten [Kogawa et al., 2010]. Es kann von Osteoklasten zum aktiven Vitamin D synthetisiert werden. In diesem Zusammenhang ist eine erhöhte Expression von NFATc1, einem Schlüsselfaktor der Osteoklastentranskription, zu beobachten. Ebenso erhöht sich die Konzentration von Ephrin-b2, dem Osteoklastenfusionsfaktor. Jedoch hat die Anwesenheit von 25-Hydroxyvitamin-D eine reduzierende Eigenschaft auf die Knochenresorption der Osteoklasten [Kogawa et al., 2010]. Vitamin D erhöht nach der Bindung an den Vitamin-D-Receptor-RXR (VDR-RXR) die Expression von epithelialen Calcium-Kanälen und Calcium-bindenden Proteinen und die intestinale Aufnahme von Phosphat und Calcium [Christakos et al., 2011]. Umgekehrt hemmt Vitamin D die Synthese und Sekretion von Parathormon (PTH – Nebenschilddrüsenhormon, das den Calciumspiegel im Blutplasma reguliert) über die Aktivierung des VDR und Enzyms CYP27B1 [Ritter et al., 2006].
Neben den Effekten auf den Knochen finden sich insbesondere aus experimentellen Untersuchungen und epidemiologischen Assoziationsstudien zahlreiche Hinweise dafür, dass niedrige Vitamin-D-Spiegel mit zahlreichen anderen extraossären Effekten assoziiert sind. So weisen experimentelle Daten daraufhin, dass Vitamin D eine Rolle bei der Regulation der Insulinrezeptorexpression und Insulinsekretion spielen könnte [Zeitz et al., 2003]. Außerdem werden positive Auswirkungen auf das Zentralnervensystem, das endokrine System und das Immunsystem sowie auf die Zelldifferenzierung und das Zellwachstum diskutiert [Gil et al., 2018]. Ob Vitamin D einen positiven Effekt auf das Herz-Kreislauf-System hat, bleibt weitestgehend umstritten [Pilz et al., 2016].
Vitamin-D-Mangel
Ein Vitamin-D-Mangel ist in unseren Breiten in der Regel auf eine zu geringe körpereigene Synthese im Zusammenhang mit einer unzureichenden Sonnenexposition und/oder einer nachlassenden Syntheseleistung der Haut im Alter zurückzuführen. Ein anhaltender schwerer Vitamin-D-Mangel führt zu einer Demineralisierung des Knochens mit dem Krankheitsbild der Rachitis beim Kind oder der Osteomalazie beim Erwachsenen. Die niedrige Konzentration an Vitamin D führt zu einer abnehmenden Effizienz der intestinalen Resorption von Kalzium und Phosphat in der Nahrung, was zu einem erhöhten Spiegel an zirkulierendem PTH (Parathormon) führt [Lips et al., 2006]. Der sekundäre Hyperparathyreoidismus erhöht den Calciumserumspiegel in einen suboptimalen Bereich und führt zur Demineralisierung des Knochens, indem durch eine erhöhte Osteoklastenaktivität das Calcium aus dem Skelett mobilisiert und die Ausscheidung von Phosphat in der Niere erhöht wird. Die Knochendichte verringert sich, womit Osteopenie und -porose begünstigt werden. Ein weiteres Ergebnis des sekundären Hyperparathyreoidismus ist die Phosphaturie, die zu einem normalen oder niedrigen Serumphosphatspiegel führt. Daraus resultiert ein Ungleichgewicht im Phosphat-Calcium-Produkt, was ein Mineralisierungsdefizit im Skelett entstehen lässt [Gröber et al., 2013].
Insbesondere bei kleinen Kindern, die wenig Mineralien im Skelett haben, können aufgrund dieses Defekts verschiedene Skelettdeformationen verursacht werden, die allgemein als Rachitis bekannt sind [Gordon et al., 2008]. Bei erwachsenen Patienten, die eine größere Knochenmasse haben und deren Epiphysenfugen geschlossen sind, finden sich in der Regel keine Skelettdeformationen und es kommt zu dem als Osteomalazie bekannten Mineralisierungsdefekt mit Entwicklung einer unkalzifizierten Knochenmatrix, verminderter Knochendichte, Muskelschwäche und Knochenschmerzen [Plotnikoff et al., 2003]. Der mit Vitamin-D-Mangel assoziierte katabole Stoffwechsel kann zu osteoporotischen Frakturen und beeinträchtigter Frakturheilung führen [Brinker et al., 2007]. Vitamin D ist nicht nur für die Physiologie des Knochens relevant, sondern auch für die Physiologie von Muskel-, Binde- und Nervengewebe und Immunzellen. Eine mit Vitamin D assoziierte Muskelschwäche hat einen starken Einfluss auf ältere Patienten und erhöht die Anzahl von Stürzen [Bischoff-Ferrari et al., 2009], was zu einem höheren Risiko für Frakturen führt.
Darüber hinaus ist ein Vitamin-D-Mangel mit vielen chronischen Erkrankungen wie Autoimmunerkrankungen (Multiple Sklerose, Typ-1-Diabetes), entzündlichen Darmerkrankungen (Morbus Crohn), Infektionen (insbesondere der oberen Atemwege), Immunschwäche, Herz-Kreislauf-Erkrankungen (Bluthochdruck, Herzinsuffizienz, plötzlicher Herztod), Krebs (Darmkrebs, Brustkrebs, Non-Hodgkin-Lymphom) und neurokognitiven Störungen (Alzheimer-Krankheit) [Schöttker et al., 2013] assoziiert. Ein niedriger Vitamin-D-Spiegel im Serum wird auch mit Erkrankungen wie Parkinson und Arthritis in Verbindung gebracht. Ob der niedrige Vitamin-D-Spiegel im Serum ein begünstigender Faktor oder lediglich ein Symptom dieser extraossären Krankheiten ist, konnte allerdings durch Interventionsstudien bisher nicht endgültig geklärt werden [Autier et al., 2014].
Parodontitis und Vitamin-D- Mangel
Parodontale Erkrankungen zeigen eine signifikante Korrelation mit niedrigen 25(OH)-Vitamin-D-Spiegeln. Dieser Sachverhalt lässt darauf schließen, dass ein unzureichender Vitamin-D-Spiegel am Voranschreiten einer parodontalen Erkrankung [Laky et al., 2017] und der chronischen Form der Parodontitis beteiligt sein könnte [Antonoglou et al., 2015]. Ob sich die Wirkung dabei jeweils nur auf die Immunzellen, das Gewebe, die Mikroorganismen [Grenier et al., 2016] oder mehrere Elemente bezieht, ist nicht geklärt. In Tierversuchen bei an Parodontitis (PA) und Diabetes erkrankten Mäusen zeigte sich, dass der gingivale Epithelproteinspiegel von VDR und PTPN2 mit dem 25Hydroxyvitamin-D-Spiegel steigt. Bei einem niedrigen Spiegel sinkt der VDR-Spiegel. Das Protein NF-κB hingegen wird bei angemessenen 25Hydroxyvitamin-D3-Spiegel signifikant weniger produziert. Bei lediglich PA-erkrankten Mäusen führte ein suffizienter 25Hydroxyvitamin-D3-Spiegel zu einer verringerten Expression der phosphorylierten Januskinasen 1 (pJAK1) [Li et al., 2013].
In experimentellen Untersuchungen kann Vitamin D auf Mikroorganismen wie P. gingivalis, F. nucleatum, A. actinomycetemcomitans, S. moorei, S. mutans, die an der Entstehung einer Parodontitis beteiligt sind, je nach Konzentration inhibierend oder bakterizid wirken. Vitamin D hemmt das Wachstum von P. gingivalis durch die signifikant verringerte Expression von Virulenzfaktorgenen (VFG). Betroffen sind die VFG fimA, hagA, hagB, rgpA, rgpB und kgp, die bei der Bakterienkolonisation, Deaktivierung der Wirtverteidigungsmechanismen, Gewebezerstörung und Nahrungsakquise beteiligt sind. Zudem kann Vitamin D dosisabhängig die Aktivierung von NF-κB durch P. gingivalis inhibieren [Grenier et al., 2016].
Nach der Bindung an den VDR entfaltet Vitamin D seine Wirkung unter anderem in den myeloiden Zellen des Immunsystems. Damit geht eine erhöhte Expression des Gens für β-defensin 4A (DEFB4A) und Cathelicidin einher [Gombart et al., 2005]. Auf T-Lymphozyten wirkt Vitamin D durch eine verringerte Proliferation und eine geringere Produktion von IL2 und IFN-γ inhibierend [Cippitelli et al., 1998]. Ein Mangel an Vitamin D kann zu Defiziten all dieser positiven Entwicklungen führen. Bekannt ist außerdem, dass in Anwesenheit von Vitamin D im PA-Spalt weniger Entzündungsmediatoren und Zytokine wie IL-8 und CCL2 vorkommen [Andrukhov et al., 2014]. Auch eine erhöhte Expression der mRNA von Osteopontin und Osteocalcin sowie eine erhöhte Aktivität der alkalischen Phosphatase wurde bei humanen parodontalen Fibroblasten unter Zugabe von Vitamin D beobachtet. In der Folge verringert sich die Entzündung und die Gewebedestruktion [Nebel et al., 2015]. Studien zeigen, dass die Substitution von Vitamin D und Calcium einen positiven Effekt auf die unterstützende parodontale Therapie (UPT) hat [Garcia et al., 2011].
Herausgefunden wurde, dass Menschen mit einer stärker pigmentierten Haut, die dadurch häufig an einem Vitamin-D-Mangel leiden, ebenfalls vermehrt eine schlechte parodontale Gesundheit aufweisen können [Rosen et al., 2011]. Ein niedriger Vitamin-D-Spiegel wird mit einer größeren Wahrscheinlichkeit assoziiert, insgesamt an Zahnverlust zu leiden [Zhan et al., 2014].
Vitamin D und Osseointegration von Implantaten
Der positive Einfluss von Vitamin D auf den Knochenstoffwechsel und den Mineralhaushalt könnte auch in der Zahnarztpraxis genutzt werden. So kann vermutet werden, dass in Analogie zu entsprechenden Tierversuchen bei Patienten mit einem ausreichend hohen Vitamin-D-Spiegel im Vergleich zu Patienten mit Vitamin-D-Mangel, mit einer erfolgreicheren Therapie und einer verbesserten Osseointegration von dentalen Implantaten gerechnet werden kann [Kelly et al., 2009]. In Tierexperimenten konnte gezeigt werden, dass insbesondere bei Tieren mit Vorerkrankungen wie chronischer Niereninsuffizienz, Diabetes mellitus oder Osteoporose die Implantate bei Vitamin-D-Substitution besser osseointegriert waren als bei erkrankten Tieren ohne Substitution [Liu et al., 2014; Wu et al., 2013; Zhou et al., 2012]. Eine Substitution von Vitamin D, Magnesium und Calcium bei ausreichend versorgten gesunden Tieren hingegen führte nicht zu einer verbesserten Osseointegration im Vergleich zu nicht substituierten gesunden Tieren [Pimentel et al., 2016]. Die im Tierversuch gesehenen Mechanismen könnten auch auf den Menschen übertragbar sein: Einzelne Fallberichte bringen einen frühen Implantatverlust mit einem mangelhaften Vitamin-D-Serumspiegel in Verbindung [Fretwurst et al., 2020; Bryce et al., 2014].
Vitamin D und Kariesprophylaxe
In den 1920er- und 1930er-Jahren wurden zahlreiche Forschungsarbeiten durchgeführt, die eine Vitamin-D-Substitution mit einer reduzierten Kariesinzidenz in Verbindung gebracht haben. Bis 2013 wurde diesem Thema wenig Beachtung geschenkt. Ein systematisches Review mit Metaanalyse von Hujoel et al., in dem diverse Studien aus dem frühen 20. Jahrhundert berücksichtigt wurden, legte nahe, dass die Substitution von Vitamin D mit einer Reduktion des Kariesrisikos von 47 Prozent assoziiert war. Zudem hat es gezeigt, dass die Quelle des Vitamin D (Substitution von Vitamin D2, Vitamin D3 oder körpereigenes Vitamin D3 nach UV-Lichtexposition) keinen signifikanten Einfluss auf die Reduktion des Kariesrisikos hatte [Hujoel et al., 2013]. Zwei Studien konnten zeigen, dass Kinder, die in einem Klassenzimmer mit Vollspektrum-Licht unterrichtet wurden, einen signifikant niedrigeren Anstieg des DMFS-Scores hatten beziehungsweise eine signifikant niedrigere Kariesinzidenz an Sechsjahresmolaren, verglichen mit Kindern, die während der gleichen Zeit mit konventionellem Licht beleuchtet wurden [Hargreaves et al., 1989; Mayron et al., 1975].
Vorangegangene Tierstudien haben bei Hamstern ebenfalls eine signifikante Reduktion der Kariesinzidenz nach Bestrahlung mit ultraviolettem Licht festgestellt [Plathner et al., 1959]. Die kariesprotektiven Effekte von ultraviolettem Licht, die in den Studien gezeigt werden konnten, sind möglicherweise auf eine vermehrte endogene Synthese von Vitamin D zurückzuführen. Aufgrund des Studiendesigns konnte jedoch keine Kausalität von Vitamin D und Kariesschutz bewiesen werden. Moderne Studien, die bei der Diagnostik über das Bestimmen der 25(OH)-Vitamin-D-Serumspiegelkonzentration verfügten, konnten zeigen, dass bei Kindern mit einem höheren 25(OH)-Vitamin-D-Serumspiegel eine signifikant verringerte Rate an zahnärztlichen Behandlungen unter Narkose durchgeführt wurden, im Vergleich zu Kindern mit niedrigeren Serumspiegeln. [Dudding et al., 2015] Außerdem konnte bei Kindern mit einem 25(OH)-Vitamin-D-Serumspiegel von über 50 nmol/L eine signifikant verringerte Kariesinzidenz festgestellt werden [Schroth et al., 2015]. Zu einem ähnlichen Ergebnis kamen Carvalho Silva et al., jedoch hatten die Kinder bei einem Wert von unter 75 nmol/L bereits ein signifikant höheres Risiko, eine Karies im bleibenden Gebiss zu haben [Carvalho Silva et al. 2021].
Neben den zuvor beschriebenen kariesprotektiven Effekten von Vitamin D wurde ebenso eine signifikant verringerte Rate von Molaren-Inzisiven-Hypomineralisationen (MIH) an bleibenden Zähnen bei Kindern mit höheren 25(OH)-Vitamin-D-Serumspiegeln festgestellt [Kühnisch et al., 2015].
Wann liegt ein Vitamin-D- Mangel vor?
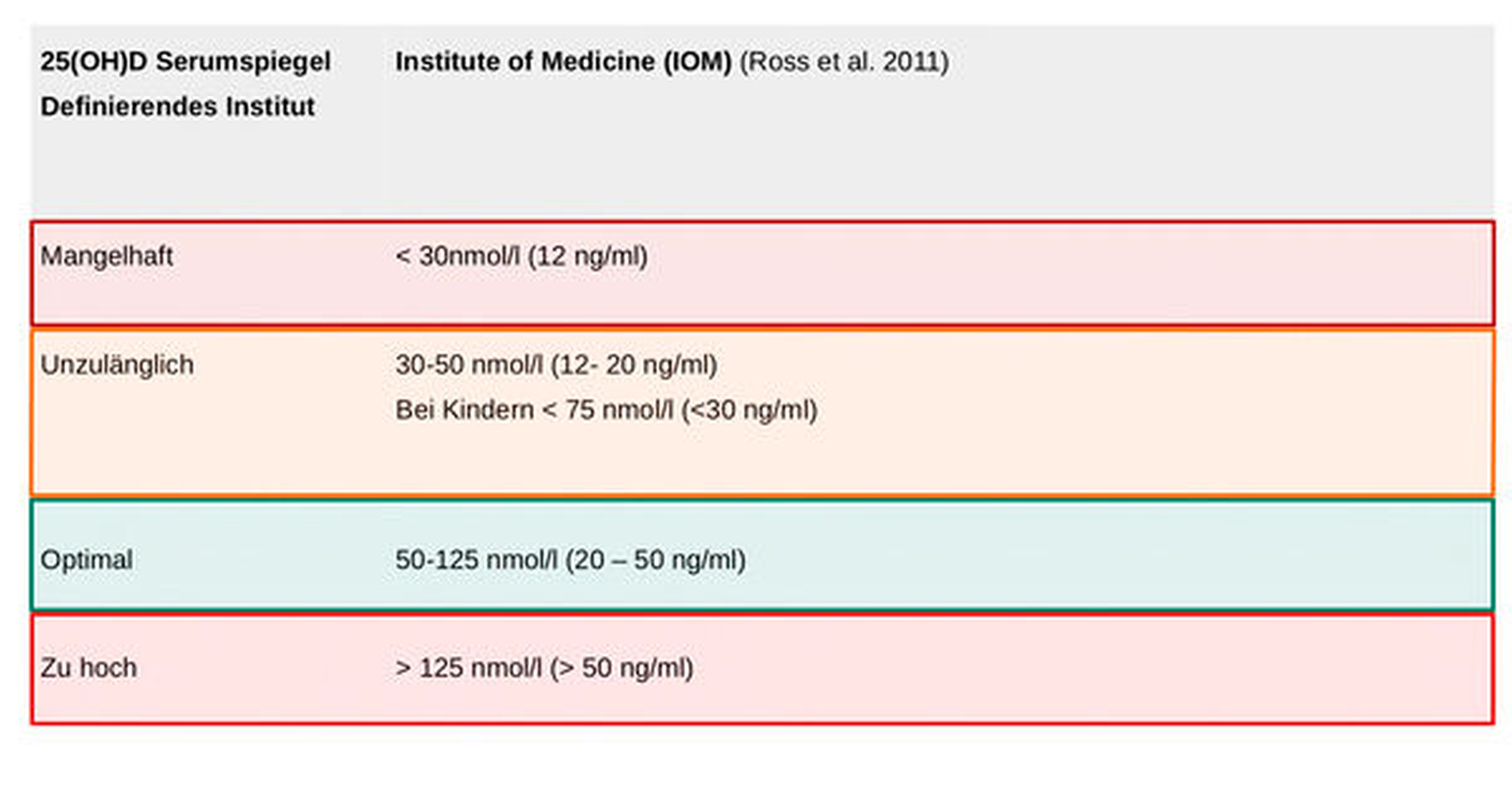
Serum 25 (OH) D (1 ng/ml = 2,5 nmol/l) ist das Barometer für die medizinische Laborbewertung des Vitamin-D-Status (Abbildung 3). Ein Blut-25(OH)-Vitamin-D-Serumspiegel unter 25 nmol/l gilt als ‚mangelhaft‘, da er mit der Entwicklung einer Rachitis in Verbindung gebracht wird [Holick et al., 2007]. Darüber hinaus gibt es nur wenig Übereinstimmung darüber, wie hoch ein ‚normaler‘ Blut-Vitamin-D-Spiegel sein sollte; eine Vereinbarung oder Standarddefinition fehlt [Cashman et al., 2017]. Die fehlende Übereinstimmung führt international zu unterschiedlichen Definitionen und einer breiten Palette von Bewertungen hinsichtlich des Vitamin-D-Status‘, beispielsweise zu Begriffen wie „Mangel“, „Unzulänglichkeit“, „Angemessenheit“ und „optimal“.
Ungefähr 20 bis 100 Prozent der älteren US-amerikanischen, kanadischen und europäischen Männer und Frauen haben gemäß der Definition des amerikanischen Institute of Medicine (IOM) einen Vitamin-D-Mangel [Holick et al., 2007]. Kinder, junge und mittlere Erwachsene haben das gleiche Risiko, an Vitamin-D-Mangel oder -insuffizienz zu leiden. Außerdem besteht ein allgemeiner Konsens darüber, dass postmenopausale und ältere Bevölkerungsgruppen weltweit häufig unzureichende Vitamin-D-Serumspiegel aufweisen [Hilger et al., 2014]. 80 Prozent der Jugendlichen aus neun europäischen Ländern, darunter auch Deutschland, wiesen einen suboptimalen 25(OH)-D-Wert auf. 27 Prozent hatten einen Mangel (27,5–49,9 nmol/l) und 15 Prozent hatten einen starken Mangel (< 27,5 nmol/l) an 25(OH)-Vitamin-D [Singh et al., 2006].
Es besteht somit eine große Wahrscheinlichkeit, unter einem Vitamin-D-Mangel oder einer suboptimalen Vitamin-D-Versorgung zu leiden, unabhängig vom Alter. Denn neben Babys, Kleinkindern, Jugendlichen, Schwangeren und Stillenden, jungen Frauen [Singh et al., 2006] und Senioren (65+) [Crowe et al., 2011] leiden häufig auch Personen, die wenig bis gar keinem Sonnenlicht ausgesetzt [Cashman et al., 2014] oder stark pigmentiert sind [Holick et al., 2004] unter einem verringerten Vitamin-D-Spiegel. Hinzu kommen Veganer und Vegetarier [Crowe et al., 2011], Menschen mit Adipositas, einem hohen Body-Mass-Index (BMI) [Souberbielle et al., 2006] und einer eingeschränkten oder monotonen Ernährung.
Insbesondere Menschen, die sich aus sozialen oder gesundheitlichen Gründen kaum oder gar nicht im Freien aufhalten und der Sonneneinstrahlung aussetzen (können), sind bezüglich einer Vitamin-D-Unterversorgung gefährdet und könnten von einer Vitamin-D-Substitution profitieren. Kleinkinder und Babys können im Hinblick auf ihren zukünftigen intraoralen Status auch von einer systematischen Vitamin-D-Substitution profitieren, da Vitamin D nicht nur die Entwicklung der Knochen, sondern auch die Entwicklung der Zähne, der Milchzähne und der bleibenden Zähne beeinflusst. Die Vitamin-D-Substitution hat das Potenzial, diese Entwicklung zu unterstützen und eine Rolle bei der Kariesprophylaxe zu spielen [Hujoel et al., 2013; Hellwig et al., 2013; Hamberg et al., 1971].
Supplementierung
Neben den positiven Effekten auf die Knochengesundheit werden einer Vitamin-D-Substitution zahlreiche extraossäre positive Effekte zugeschrieben, die allerdings bisher auch in großen Metaanalysen von Substitutionsstudien nicht eindeutig belegt werden konnten [Kahwati et al., 2021]. So werden senkende Auswirkungen auf die Krebsmortalität, respiratorische Infekte und die Erkrankung an Diabetes mellitus Typ 2 postuliert [Charoenngam et al., 2019], ebenso positive Effekte auf den Gemütszustand, die mentale Gesundheit [Penckofer et al., 2017], die Lebensqualität, die körperliche Leistungsfähigkeit und die Reduktion von oxidativem Stress [Manoy et al., 2017].
Während die Substitution bei einem nachgewiesenen Vitamin-D-Mangel und bei Patienten mit hohem Risiko für einen Vitamin-D-Mangel wie zum Beispiel bei Patienten aus Pflegeheimen weitgehend unumstritten ist, gehen aufgrund der nach wie vor ungenügenden und widersprüchlichen Datenlage die Meinungen der Fachgesellschaften bezüglich einem Screening und einer allgemeinen Vitamin-D-Substitution von „gesunden Bevölkerungsgruppen“ zum Teil noch weit auseinander. So wird ein allgemeines Screening von den meisten Fachgesellschaften nicht empfohlen [Kahwati et al., 2021] und im Fall einer Substitution eher zu einer niedrigeren täglichen Dosierung geraten, da sich die Hinweise für zum Teil negative Effekte besonders hoher Dosen oder von Bolusgaben eher verdichten [Appel et al., 2021; Pham et al., 2021].
Das Institute of Medicine empfiehlt eine Basissubstitution von 400 internationalen Einheiten (IE) Vitamin D pro Tag für alle Bevölkerungs- und Altersgruppen. Für Kinder ab dem ersten Lebensjahr sowie für stillende und schwangere Frauen, Jugendliche und Erwachsene bis zum Alter von 70 Jahren gilt die empfohlene Tagesdosis von 600 IE Vitamin D. Für Personen ab 71 Jahren und Menschen mit einer stärkeren Hautpigmentierung wurde empfohlen, 800 IE Vitamin D pro Tag zu ergänzen. Die Höchstdosis liegt für Säuglinge bei 1.000 IE pro Tag und bei 4.000 IE pro Tag für Kinder ab neun Jahren und darf unter keinen Umständen überschritten werden [Staff et al., 2020]. Die Überschreitung geht mit einer Toxizität und einer verringerten Knochendichte einher [Burt et al., 2019].
Bei der oralen Vitamin-D-Substitution zur Behandlung/Prophylaxe eines Vitamin-D-Mangels ist Vitamin D3 (Colecalciferol) der mit Vitamin D2 vorzuziehen, da es effektiver den 25(OH)-Vitamin-D-Wert steigert [Tripkovic et al., 2012]. Darüber hinaus wurde postuliert, dass die Vitamin-D-Substitution bei Menschen mit einem Vitamin-D-Mangel stärkere positive (extraossäre) Effekte aufweist als bei Menschen mit bereits optimalem Vitamin-D-Serumspiegel [Charoenngam et al., 2019]. Hierauf haben nicht zuletzt auch Tierversuche in Hinblick auf die Osseointegration von Implantaten hingewiesen [Pimentel et al., 2016].
Besonders ältere Menschen, die in stationären oder ambulanten Einrichtungen gepflegt wurden, profitierten von einer Vitamin-D-Substitution, die mit einer Senkung des Frakturrisikos einherging [Bischoff-Ferrari et al., 2005]. Für Menschen ohne spezifische Risikofaktoren für einen Vitamin-D-Mangel ist eine Vitamin-D-Substitution zur Osteoporoseprophylaxe nicht sinnvoll [Reid et al., 2014]. Eine Substitution führt bei gesunden Patienten weder zu einer Verbesserung der Knochendichte noch zu einer Senkung des Frakturrisikos [Jackson et al., 2006].
Im Hinblick auf Effekte einer Supplementierung auf den Erfolg von Implantatversorgungen wurde in Tierversuchen festgestellt, dass Tiere mit Vorerkrankungen, die den Knochenstoffwechsel beeinträchtigen, nach einer Supplementierung eine verbesserte Osseointegration vorwiesen – im Gegensatz zu vorerkrankten Tieren ohne Supplementierung [Wu et al., 2013; Liu et al., 2014; Nakamura et al., 2008]. Vitamin D kann dabei auch lokal zugeführt werden, indem das Implantat damit beschichtet wird. Es gibt verschiedene Strategien, um das Vitamin D auf das Implantat aufzutragen. Diese Verfahren haben jedoch in mehreren Tierversuchsstudien keine signifikant verbesserte Osseointegration der Implantate gezeigt [Satué et al., 2017; Naito et al., 2014; Salmó et al., 2016].
Fazit
Zusammenfassend lässt sich feststellen, dass der Vitamin-D-Serumspiegel auch in der Zahnarztpraxis eine wichtige Rolle spielt, weil er bei der Einschätzung der Therapie und ihrer Erfolgschancen, der Prognose der Therapieerfolge und der Optimierung der Therapie hilfreich sein kann. Zusätzlich wird der Vitamin-D-Serumspiegel als ein ätiologischer Faktor für verschiedene systemische und orale Erkrankungen diskutiert. Um einem Vitamin-D-Mangel und der Entstehung etwaiger Krankheiten entgegenzuwirken, wird Menschen mit erhöhtem Risiko für einen Vitamin-D-Mangel empfohlen, den Vitamin-D-Status zu ermitteln und gemäß dem Ergebnis zu substituieren – insbesondere in Monaten mit schwächerer Sonneneinstrahlung. Es ergeben sich positive Belege für Menschen, die an Demenz, chronischer Niereninsuffizienz, Krebs, Depression, Antriebslosigkeit, Zahnverlust, Parodontitis oder Osteoporose leiden. Auch Menschen im höheren Alter, mit starker Pigmentierung, einseitiger Ernährung, wenig Sonnenexposition, Stillende, Schwangere und Babys bis zum zweiten Lebensjahr profitieren davon. Die positiven Wirkungen auf zahnmedizinische Therapien macht die Substitution bei Vitamin-D-Mangel auch für Zahnarztpraxen interessant.
Literaturliste
Aaron JE, Stasiak L, Gallagher JC, Longton EB, Nicholson M, Anderson J, u. a. FREQUENCY OF OSTEOMALACIA AND OSTEOPOROSIS IN FRACTURES OF THE PROXIMAL FEMUR. The Lancet. 16. Februar 1974;303(7851):229–33.
Albandar JM, Brunelle JA, Kingman A. Destructive Periodontal Disease in Adults 30 Years of Age and Older in the United States, 1988-1994. Journal of Periodontology. 1999;70(1):13–29.
Allard L, Demoncheaux N, Machuca-Gayet I, Georgess D, Coury-Lucas F, Jurdic P, u. a. Biphasic Effects of Vitamin D and FGF23 on Human Osteoclast Biology. Calcif Tissue Int. 1. Juli 2015;97(1):69–79.
Alkalay D, Shany S, Dekel S. Serum and bone vitamin D metabolites in elective patients and patients after fracture. The Journal of Bone and Joint Surgery British volume. 1. Januar 1989;71-B(1):85–7.
Andrukhov O, Andrukhova O, Hulan U, Tang Y, Bantleon H-P, Rausch-Fan X. Both 25-Hydroxyvitamin-D3 and 1,25-Dihydroxyvitamin-D3 Reduces Inflammatory Response in Human Periodontal Ligament Cells. PLOS ONE. 28. Februar 2014;9(2):e90301.
Antonoglou GN, Knuuttila M, Niemelä O, Raunio T, Karttunen R, Vainio O, u. a. Low serum level of 1,25(OH)2D is associated with chronic periodontitis. Journal of Periodontal Research. 2015;50(2):274–80.
Appel LJ, Michos ED, Mitchell CM, Blackford AL, Sternberg AL, Miller ER, u. a. The Effects of Four Doses of Vitamin D Supplements on Falls in Older Adults: A Response-Adaptive, Randomized Clinical Trial. Ann Intern Med. Februar 2021;174(2):145–56.
Ärzteblatt DÄG Redaktion Deutsches. Vitamin-D-Substitution: Bewusster Umgang gefordert [Internet]. Deutsches Ärzteblatt. 2012 [zitiert 3. Oktober 2020]. Verfügbar unter: www.aerzteblatt.de/archiv/121884/Vitamin-D-Substitution-Bewusster-Umgang-gefordert.
Atkins GJ, Kostakis P, Pan B, Farrugia A, Gronthos S, Evdokiou A, u. a. RANKL Expression Is Related to the Differentiation State of Human Osteoblasts. Journal of Bone and Mineral Research. 2003;18(6):1088–98.
Autier P, Boniol M, Pizot C, Mullie P. Vitamin D status and ill health: a systematic review. The Lancet Diabetes & Endocrinology. 1. Januar 2014;2(1):76–89.
Bischoff-Ferrari HA, Willett WC, Wong JB, Giovannucci E, Dietrich T, Dawson-Hughes B. Fracture Prevention With Vitamin D Supplementation: A Meta-analysis of Randomized Controlled Trials. JAMA. 11. Mai 2005;293(18):2257–64.
Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB, Orav JE, Stuck AE, Theiler R, u. a. Fall prevention with supplemental and active forms of vitamin D: a meta-analysis of randomised controlled trials. BMJ [Internet]. 1. Oktober 2009 [zitiert 11. März 2020];339. Verfügbar unter: www.bmj.com/content/339/bmj.b3692
Brinker M, O’Connor D, Monla Y, Earthman T. Metabolic and Endocrine Abnormalities in Patients With Nonunions. Journal of Orthopaedic Trauma. September 2007;21(8):557–70.
Bryce G, MacBeth N. Vitamin D deficiency as a suspected causative factor in the failure of an immediately placed dental implant: a case report. J R Nav Med Serv. 2014;100(3):328–32.
Burt LA, Billington EO, Rose MS, Raymond DA, Hanley DA, Boyd SK. Effect of High-Dose Vitamin D Supplementation on Volumetric Bone Density and Bone Strength: A Randomized Clinical Trial. JAMA. 27 2019;322(8):736–45.
Calvo MS, Whiting SJ, Barton CN. Vitamin D Intake: A Global Perspective of Current Status. J Nutr. 1. Februar 2005;135(2):310–6.
Carvalho Silva C, Gavinha S, Manso MC, Rodrigues R, Martins S, Guimarães JT, Santos AC, Melo P. Serum Levels of Vitamin D and Dental Caries in 7-Year-Old Children in Porto Metropolitan Area. Nutrients. 2021 Jan 7;13(1):166. doi: 10.3390/nu13010166. PMID: 33430295; PMCID: PMC7825719.
Cashman KD, Kiely M. Recommended dietary intakes for vitamin D: where do they come from, what do they achieve and how can we meet them? Journal of Human Nutrition and Dietetics. 2014;27(5):434–42.
Chapuy MC, Schott AM, Garnero P, Hans D, Delmas PD, Meunier PJ. Healthy elderly French women living at home have secondary hyperparathyroidism and high bone turnover in winter. EPIDOS Study Group. J Clin Endocrinol Metab. 1. März 1996;81(3):1129–33.
Charoenngam N, Shirvani A, Holick MF. The ongoing D-lemma of vitamin D supplementation for nonskeletal health and bone health. Current Opinion in Endocrinology, Diabetes and Obesity. Dezember 2019;26(6):301–5.
Christakos S, Dhawan P, Porta A, Mady LJ, Seth T. Vitamin D and Intestinal Calcium Absorption. Mol Cell Endocrinol. 5. Dezember 2011;347(1–2):25–9.
Christakos S. Recent Advances in Our Understanding of 1,25-Dihydroxyvitamin D3 Regulation of Intestinal Calcium Absorption. Arch Biochem Biophys. 1. Juli 2012;523(1):73–6.
Cippitelli M, Santoni A. Vitamin D3: a transcriptional modulator of the interferon-γ gene. European Journal of Immunology. 1998;28(10):3017–30.
Crowe FL, Steur M, Allen NE, Appleby PN, Travis RC, Key TJ. Plasma concentrations of 25-hydroxyvitamin D in meat eaters, fish eaters, vegetarians and vegans: results from the EPIC–Oxford study. Public Health Nutrition. Februar 2011;14(2):340–6.
DeLuca HF. The vitamin D story: a collaborative effort of basic science and clinical medicine. FASEB J. 1. März 1988;2(3):224–36.
Dudding, Tom et al. “Re-Examining the Association between Vitamin D and Childhood Caries.” PloS one vol. 10,12 e0143769. 21 Dec. 2015, doi:10.1371/journal.pone.0143769.
Flanagan D, Mancini M. Bimaxillary full arch fixed dental implant supported treatment for a patient with renal failure and secondary hyperparathyroidism and osteodystrophy. J Oral Implantol. April 2015;41(2):e36-43.
Fretwurst T, Grunert S, Woelber JP, Nelson K, Semper-Hogg W. Vitamin D deficiency in early implant failure: two case reports. Int J Implant Dent [Internet]. 25. November 2016 [zitiert 4. Februar 2020];2. Verfügbar unter: www.ncbi.nlm.nih.gov/pmc/articles/PMC5124022/
Garcia MN, Hildebolt CF, Miley DD, Dixon DA, Couture RA, Spearie CLA, u. a. One-Year Effects of Vitamin D and Calcium Supplementation on Chronic Periodontitis. Journal of Periodontology. 2011;82(1):25–32.
Gil Á, Plaza-Diaz J, Mesa MD. Vitamin D: Classic and Novel Actions. ANM. 2018;72(2):87–95.
Gombart AF, Borregaard N, Koeffler HP. Human cathelicidin antimicrobial peptide (CAMP) gene is a direct target of the vitamin D receptor and is strongly up-regulated in myeloid cells by 1,25-dihydroxyvitamin D3. The FASEB Journal. 2005;19(9):1067–77.
Gordon CM, Williams AL, Feldman HA, May J, Sinclair L, Vasquez A, u. a. Treatment of Hypovitaminosis D in Infants and Toddlers. J Clin Endocrinol Metab. Juli 2008;93(7):2716–21.
Grant WB, Tangpricha V. Vitamin D. Dermatoendocrinol. 1. April 2012;4(2):81–3.
Great Britain, Scientific Advisory Committee on Nutrition. Update on vitamin D. Norwich: TSO (The Stationery Office); 2007.
Greene-Finestone LS, Berger C, de Groh M, Hanley DA, Hidiroglou N, Sarafin K, u. a. 25-Hydroxyvitamin D in Canadian adults: biological, environmental, and behavioral correlates. Osteoporos Int. Mai 2011;22(5):1389–99.
Grenier D, Morin M-P, Fournier‐Larente J, Chen H. Vitamin D inhibits the growth of and virulence factor gene expression by Porphyromonas gingivalis and blocks activation of the nuclear factor kappa B transcription factor in monocytes. Journal of Periodontal Research. 2016;51(3):359–65.
Gröber U, Mücke R, Adamietz IA, Holzhauer P, Kisters K, Büntzel J, u. a. Komplementärer Einsatz von Antioxidanzien und Mikronährstoffen in der Onkologie: Update 2013. Onkologe. Februar 2013;19(2):136–43.
Gröber U, Prof. Dr. med. Holick MF. Vitamin D - Die Heilkraft des Sonnenvitamins. Wissenschaftliche Verlagsgesellschaft Stuttgart; Auflage: 2., durchgesehene und akt. Auflage 2013 (15. Mai 2013); 2013.
Gröber U, Spitz J, Reichrath J, Kisters K, Holick MF. Vitamin D. Dermatoendocrinol. 1. Juni 2013;5(3):331–47.
Halfon M, Phan O, Teta D. Vitamin D: A Review on Its Effects on Muscle Strength, the Risk of Fall, and Frailty. Biomed Res Int [Internet]. 2015 [zitiert 7. Februar 2020];2015. Verfügbar unter: www.ncbi.nlm.nih.gov/pmc/articles/PMC4427016/
Hamberg L. CONTROLLED TRIAL OF FLUORIDE IN VITAMIN DROPS FOR PREVENTION OF CARIES IN CHILDREN. The Lancet. 27. Februar 1971;297(7696):441–2.
Hargreaves JA, Thompson GW. Ultraviolet light and dental caries in children. Caries Res. 1989;23(5):389-92. doi: 10.1159/000261214. PMID: 2766329.
Heaney RP. Functional indices of vitamin D status and ramifications of vitamin D deficiency. Am J Clin Nutr. 1. Dezember 2004;80(6):1706S-1709S.
E. Hellwig, U. Schiffner, A. Schulte. S2k-Leitlinie „Fluoridierungsmaßnahmen zurKariesprophylaxe“. AWMF online; 2013.
Hilger J, Friedel A, Herr R, Rausch T, Roos F, Wahl DA, u. a. A systematic review of vitamin D status in populations worldwide. British Journal of Nutrition. Januar 2014;111(1):23–45.
Holick MF. Vitamin D Deficiency. New England Journal of Medicine. 19. Juli 2007;357(3):266–81.
Holick MF. Sunlight and vitamin D for bone health and prevention of autoimmune diseases, cancers, and cardiovascular disease. Am J Clin Nutr. 1. Dezember 2004;80(6):1678S-1688S.
Holick MF. Resurrection of vitamin D deficiency and rickets. J Clin Invest. 1. August 2006;116(8):2062–72.
Holick MF, Siris ES, Binkley N, Beard MK, Khan A, Katzer JT, u. a. Prevalence of Vitamin D Inadequacy among Postmenopausal North American Women Receiving Osteoporosis Therapy. J Clin Endocrinol Metab. 1. Juni 2005;90(6):3215–24.
Holick MF. High Prevalence of Vitamin D Inadequacy and Implications for Health. Mayo Clinic Proceedings. 1. März 2006;81(3):353–73.
Holick MF, Binkley NC, Bischoff-Ferrari HA, Gordon CM, Hanley DA, Heaney RP, u. a. Evaluation, Treatment, and Prevention of Vitamin D Deficiency: an Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 1. Juli 2011;96(7):1911–30.
Holick MF. Vitamin D Deficiency. New England Journal of Medicine. 19. Juli 2007;357(3):266–81.
Hujoel PP. Vitamin D and dental caries in controlled clinical trials: systematic review and meta-analysis. Nutr Rev. 1. Februar 2013;71(2):88–97.
Institute of Medicine (US) Standing Committee on the Scientific Evaluation of Dietary Reference Intakes. Dietary Reference Intakes for Calcium, Phosphorus, Magnesium, Vitamin D, and Fluoride [Internet]. Washington (DC): National Academies Press (US); 1997 [zitiert 28. Juli 2020]. (The National Academies Collection: Reports funded by National Institutes of Health). Verfügbar unter: www.ncbi.nlm.nih.gov/books/NBK109825/
Itonaga I, Sabokbar A, Neale SD, Athanasou NA. 1,25-Dihydroxyvitamin D3 and Prostaglandin E2 Act Directly on Circulating Human Osteoclast Precursors. Biochemical and Biophysical Research Communications. 22. Oktober 1999;264(2):590–5.
Jundell I Hanson R Sandberg T. Stoffwechsel im Zahnschmelz und Prophylaxe gegen Zahncaries German]. Acta Paediatr. 1938;23:141.
Kahwati LC, LeBlanc E, Weber RP, Giger K, Clark R, Suvada K, u. a. Screening for Vitamin D Deficiency in Adults: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 13. April 2021;325(14):1443–63.
Kelly J, Lin A, Wang CJ, Park S, Nishimura I. Vitamin D and Bone Physiology: Demonstration of Vitamin D Deficiency in an Implant Osseointegration Rat Model. Journal of Prosthodontics. 1. August 2009;18(6):473–8.
Kogawa M, Findlay DM, Anderson PH, Ormsby R, Vincent C, Morris HA, u. a. Osteoclastic Metabolism of 25(OH)-Vitamin D3: A Potential Mechanism for Optimization of Bone Resorption. Endocrinology. 1. Oktober 2010;151(10):4613–25.
Kogawa M, Anderson PH, Findlay DM, Morris HA, Atkins GJ. The metabolism of 25-(OH)vitamin D3 by osteoclasts and their precursors regulates the differentiation of osteoclasts. The Journal of Steroid Biochemistry and Molecular Biology. 1. Juli 2010;121(1):277–80.
Krause R, Bühring M, Hopfenmüller W, Holick MF, Sharma AM. Ultraviolet B and blood pressure. The Lancet. 29. August 1998;352(9129):709–10.
Kühnisch J, Thiering E, Heinrich-Weltzien R, Hellwig E, Hickel R, Heinrich J. Fluoride/vitamin D tablet supplementation in infants-effects on dental health after 10 years. Clin Oral Investig. 2017 Sep;21(7):2283-2290. doi: 10.1007/s00784-016-2021-y. Epub 2016 Dec 7. PMID: 27928689.
Kühnisch J, Thiering E, Kratzsch J, Heinrich-Weltzien R, Hickel R, Heinrich J; GINIplus study group; LISAplus study group. Elevated serum 25(OH)-vitamin D levels are negatively correlated with molar-incisor hypomineralization. J Dent Res. 2015 Feb;94(2):381-7. doi: 10.1177/0022034514561657. Epub 2014 Dec 10. PMID: 25503610; PMCID: PMC4438736.
Laky M, Bertl K, Haririan H, Andrukhov O, Seemann R, Volf I, u. a. Serum levels of 25-hydroxyvitamin D are associated with periodontal disease. Clin Oral Invest. 1. Juni 2017;21(5):1553–8.
Lehmann B. The Vitamin D3 Pathway in Human Skin and its Role for Regulation of Biological Processes. Photochemistry and Photobiology. 2005;81(6):1246–51.
Li H, Xie H, Fu M, Li W, Guo B, Ding Y, u. a. 25-hydroxyvitamin D3 ameliorates periodontitis by modulating the expression of inflammation-associated factors in diabetic mice. Steroids. 1. Februar 2013;78(2):115–20.
Lips P, Hosking D, Lippuner K, Norquist JM, Wehren L, Maalouf G, u. a. The prevalence of vitamin D inadequacy amongst women with osteoporosis: an international epidemiological investigation. Journal of Internal Medicine. 2006;260(3):245–54.
Liu W, Zhang S, Zhao D, Zou H, Sun N, Liang X, u. a. Vitamin D Supplementation Enhances the Fixation of Titanium Implants in Chronic Kidney Disease Mice. PLoS One [Internet]. 21. April 2014 [zitiert 3. Februar 2020];9(4). Verfügbar unter: www.ncbi.nlm.nih.gov/pmc/articles/PMC3994107/
Maestro B, Molero S, Bajo S, Dávila N, Calle C. Transcriptional activation of the human insulin receptor gene by 1,25-dihydroxyvitamin D3. Cell Biochemistry and Function. 2002;20(3):227–32.
Malabanan AO, Turner AK, Holick MF. Severe Generalized Bone Pain and Osteoporosis in a Premenopausal Black Female: Effect of Vitamin D Replacement. Journal of Clinical Densitometry. 1. Juni 1998;1(2):201–4.
Manoy P, Yuktanandana P, Tanavalee A, Anomasiri W, Ngarmukos S, Tanpowpong T, u. a. Vitamin D Supplementation Improves Quality of Life and Physical Performance in Osteoarthritis Patients. Nutrients [Internet]. 26. Juli 2017 [zitiert 25. August 2020];9(8). Verfügbar unter: www.ncbi.nlm.nih.gov/pmc/articles/PMC5579593/
Mayron L, Ott JN, Amontree E, et al. Light, radiation, and dental caries. Incidence of dental caries in school children as a function of light quality and radiation shielding. Acad Ther. 1975;10:441–448.
Miley DD, Garcia MN, Hildebolt CF, Shannon WD, Couture RA, Spearie CLA, u. a. Cross-Sectional Study of Vitamin D and Calcium Supplementation Effects on Chronic Periodontitis. Journal of Periodontology. 2009;80(9):1433–9.
Mohr SB, Gorham ED, Alcaraz JE, Kane CI, Macera CA, Parsons JK, u. a. Does the evidence for an inverse relationship between serum vitamin D status and breast cancer risk satisfy the Hill criteria? Dermatoendocrinol. 1. April 2012;4(2):152–7.
Naito Y, Jimbo R, Bryington MS, Vandeweghe S, Chrcanovic BR, Tovar N, u. a. The Influence of 1α.25-Dihydroxyvitamin D3 Coating on Implant Osseointegration in the Rabbit Tibia. J Oral Maxillofac Res [Internet]. 1. Oktober 2014 [zitiert 5. Februar 2020];5(3). Verfügbar unter: www.ncbi.nlm.nih.gov/pmc/articles/PMC4219862/
Nebel D, Svensson D, Arosenius K, Larsson E, Jönsson D, Nilsson B-O. 1α,25-dihydroxyvitamin D3 promotes osteogenic activity and downregulates proinflammatory cytokine expression in human periodontal ligament cells. Journal of Periodontal Research. 2015;50(5):666–73.
NEJM. Calcium plus Vitamin D Supplementation and the Risk of Fractures | NEJM [Internet]. [zitiert 26. August 2020]. Verfügbar unter: www.nejm.org/doi/10.1056/NEJMoa055218
O’Connor A, Benelam B. An update on UK Vitamin D intakes and status, and issues for food fortification and supplementation. Nutrition Bulletin. 2011;36(3):390–6.
Office of Dietary Supplements - Vitamin D [Internet]. [zitiert 4. März 2020]. Verfügbar unter: ods.od.nih.gov/factsheets/VitaminD-HealthProfessional/
Penckofer S, Byrn M, Adams W, Emanuele MA, Mumby P, Kouba J, u. a. Vitamin D Supplementation Improves Mood in Women with Type 2 Diabetes. Journal of Diabetes Research [Internet]. 2017 [zitiert 25. August 2020];2017. Verfügbar unter: www.ncbi.nlm.nih.gov/pmc/articles/PMC5610883/
Pham H, Waterhouse M, Baxter C, Romero BD, McLeod DSA, Armstrong BK, u. a. The effect of vitamin D supplementation on acute respiratory tract infection in older Australian adults: an analysis of data from the D-Health Trial. The Lancet Diabetes & Endocrinology. 1. Februar 2021;9(2):69–81.
Pilz S, Verheyen N, Grübler MR, Tomaschitz A, März W. Vitamin D and cardiovascular disease prevention. Nature Reviews Cardiology. Juli 2016;13(7):404–17.
Pimentel SP, Casarin RC, Ribeiro FV, Cirano FR, Rovaris K, Haiter F, u. a. Impact of micronutrients supplementation on bone repair around implants: microCT and counter-torque analysis in rats. J Appl Oral Sci. 2016;24(1):45–51.
C. H. Plathner and H. Taatz, „Untersuchungen über die Kariesanfalligkeit bei Syrischen Goldhamstern unter dem Einfluss von Höhensonne und Kohlenhydraten,“ Deutsche Zahn- Mund- und Kieferheilkunde 30(1959): 121-126.
Plotnikoff GA, Quigley JM. Prevalence of Severe Hypovitaminosis D in Patients With Persistent, Nonspecific Musculoskeletal Pain. Mayo Clinic Proceedings. 1. Dezember 2003;78(12):1463–70.
Pludowski P, Holick MF, Pilz S, Wagner CL, Hollis BW, Grant WB, u. a. Vitamin D effects on musculoskeletal health, immunity, autoimmunity, cardiovascular disease, cancer, fertility, pregnancy, dementia and mortality—A review of recent evidence. Autoimmunity Reviews. 1. August 2013;12(10):976–89.
Reid IR, Bolland MJ, Grey A. Effects of vitamin D supplements on bone mineral density: a systematic review and meta-analysis. The Lancet. 11. Januar 2014;383(9912):146–55.
Ritter CS, Armbrecht HJ, Slatopolsky E, Brown AJ. 25-Hydroxyvitamin D3 suppresses PTH synthesis and secretion by bovine parathyroid cells. Kidney International. 2. August 2006;70(4):654–9.
RKI - Gesundheit A-Z - Antworten des Robert Koch-Instituts auf häufig gestellte Fragen zu Vitamin D [Internet]. [zitiert 10. März 2020]. Verfügbar unter: www.rki.de/SharedDocs/FAQ/Vitamin_D/Vitamin_D_FAQ-Liste.html
Rosen CJ. Vitamin D Insufficiency. New England Journal of Medicine. 20. Januar 2011;364(3):248–54.
Ross AC, Manson JE, Abrams SA, Aloia JF, Brannon PM, Clinton SK, u. a. The 2011 Report on Dietary Reference Intakes for Calcium and Vitamin D from the Institute of Medicine: What Clinicians Need to Know. J Clin Endocrinol Metab. Januar 2011;96(1):53–8.
Salomó‐Coll O, Val JEM-S de, Ramírez‐Fernandez MP, Hernández‐Alfaro F, Gargallo‐Albiol J, Calvo‐Guirado JL. Topical applications of vitamin D on implant surface for bone-to-implant contact enhance: a pilot study in dogs part II. Clinical Oral Implants Research. 2016;27(7):896–903.
Sakai S, Takaishi H, Matsuzaki K, Kaneko H, Furukawa M, Miyauchi Y, u. a. 1-Alpha, 25-dihydroxy vitamin D3 inhibits osteoclastogenesis through IFN-beta-dependent NFATc1 suppression. J Bone Miner Metab. 19. Mai 2009;27(6):643.
Satué M, Monjo M, Ronold HJ, Lyngstadaas SP, Ramis JM. Titanium implants coated with UV-irradiated vitamin D precursor and vitamin E: in vivo performance and coating stability. Clinical Oral Implants Research. 2017;28(4):424–31
Schöttker B, Haug U, Schomburg L, Köhrle J, Perna L, Müller H, u. a. Strong associations of 25-hydroxyvitamin D concentrations with all-cause, cardiovascular, cancer, and respiratory disease mortality in a large cohort study. Am J Clin Nutr. 1. April 2013;97(4):782–93.
Schroth RJ, Rabbani R, Loewen G, Moffatt ME. Vitamin D and Dental Caries in Children. J Dent Res. 2016 Feb;95(2):173-9. doi: 10.1177/0022034515616335. Epub 2015 Nov 9. PMID: 26553883.
Segersten U, Correa P, Hewison M, Hellman P, Dralle H, Carling T, u. a. 25-Hydroxyvitamin D3-1α-Hydroxylase Expression in Normal and Pathological Parathyroid Glands. J Clin Endocrinol Metab. 1. Juni 2002;87(6):2967–72.
Singh RJ, Taylor RL, Reddy GS, Grebe SKG. C-3 Epimers Can Account for a Significant Proportion of Total Circulating 25-Hydroxyvitamin D in Infants, Complicating Accurate Measurement and Interpretation of Vitamin D Status. J Clin Endocrinol Metab. 1. August 2006;91(8):3055–61.
Souberbielle J-C, Friedlander G, Kahan A, Cormier C. Evaluating vitamin D status. Implications for preventing and managing osteoporosis and other chronic diseases. Joint Bone Spine. 1. Mai 2006;73(3):249–53.
Staff N. IOM Updates Guidance on Vitamin D, Calcium [Internet]. [zitiert 4. März 2020]. Verfügbar unter: www.aafp.org/news/health-of-the-public/20101201iomrpt-vitdcal.html
Stamp TCB, Haddad JG, Twigg CA. COMPARISON OF ORAL 25-HYDROXYCHOLECALCIFEROL, VITAMIN D, AND ULTRAVIOLET LIGHT AS DETERMINANTS OF CIRCULATING 25-HYDROXYVITAMIN D. The Lancet. 25. Juni 1977;309(8026):1341–3.
Takasu H, Sugita A, Uchiyama Y, Katagiri N, Okazaki M, Ogata E, u. a. c-Fos protein as a target of anti-osteoclastogenic action of vitamin D, and synthesis of new analogs. J Clin Invest. 1. Februar 2006;116(2):528–35.
Tripkovic L, Lambert H, Hart K, Smith CP, Bucca G, Penson S, u. a. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis123. Am J Clin Nutr. Juni 2012;95(6):1357–64.
van Schoor NM, Lips P. Worldwide vitamin D status. Best Practice & Research Clinical Endocrinology & Metabolism. 1. August 2011;25(4):671–80.
Vandersteenhoven JJ, DeLustro FA, Bell NH, Turner RT. Osteoinduction by implants of demineralized allogeneic bone matrix is diminished in vitamin D-deficient rats. Calcif Tissue Int. Januar 1988;42(1):39–45.
Vitamin D | American Journal of Physiology-Renal Physiology [Internet]. [zitiert 7. Februar 2020]. Verfügbar unter: journals.physiology.org/doi/full/10.1152/ajprenal.00336.2004
Wacker M, Holick MF. Vitamin D—Effects on Skeletal and Extraskeletal Health and the Need for Supplementation. Nutrients. 10. Januar 2013;5(1):111–48.
Wang T-T, Nestel FP, Bourdeau V, Nagai Y, Wang Q, Liao J, u. a. Cutting Edge: 1,25-Dihydroxyvitamin D3 Is a Direct Inducer of Antimicrobial Peptide Gene Expression. The Journal of Immunology. 1. September 2004;173(5):2909–12.
Wu Y, Yu T, Yang X, Li F, Ma L, Yang Y, u. a. Vitamin D3 and insulin combined treatment promotes titanium implant osseointegration in diabetes mellitus rats. Bone. 1. Januar 2013;52(1):1–8.
Wiley Online Library, New insights into the mechanisms of vitamin D action - Christakos - 2003 - Journal of Cellular Biochemistry - Wiley Online Library [Internet]. [zitiert 7. Februar 2020]. Verfügbar unter: onlinelibrary.wiley.com/doi/full/10.1002/jcb.10423
Yong E. Vitamin D position statement. Vitamin D. :6.
Zeitz U, Weber K, Soegiarto DW, Wolf E, Balling R, Erben RG. Impaired insulin secretory capacity in mice lacking a functional vitamin D receptor. The FASEB Journal. 2003;17(3):1–14.
Zhan Y, Samietz S, Holtfreter B, Hannemann A, Meisel P, Nauck M, u. a. Prospective Study of Serum 25-hydroxy Vitamin D and Tooth Loss: Journal of Dental Research [Internet]. 14. Mai 2014 [zitiert 21. Juli 2020]; Verfügbar unter: journals.sagepub.com/doi/10.1177/0022034514534985
Zhou C, Li Y, Wang X, Shui X, Hu J. 1,25Dihydroxy vitamin D3 improves titanium implant osseointegration in osteoporotic rats. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology. 1. November 2012;114(5, Supplement):S174–8.
Zittermann A, Iodice S, Pilz S, Grant WB, Bagnardi V, Gandini S. Vitamin D deficiency and mortality risk in the general population: a meta-analysis of prospective cohort studies. Am J Clin Nutr. 1. Januar 2012;95(1):91–100.