Erstmanifestation eines Morbus Crohn im Unterkiefervestibulum
Ein 24-jähriger Patient in reduziertem Allgemein- und Ernährungszustand stellte sich nach Überweisung durch seinen Hauszahnarzt erstmalig in unserer Spezialsprechstunde für Mundschleimhauterkrankungen vor. Der Patient berichtete über etwas mehr als fünf Wochen bestehende Schmerzen im Bereich zweier offener Stellen im rechten und im linken Unterkiefer. Durch die Schmerzen, die sich beim Essen und Trinken intensivierten, sei es zuletzt auch zu einer verminderten Nahrungsaufnahme gekommen.
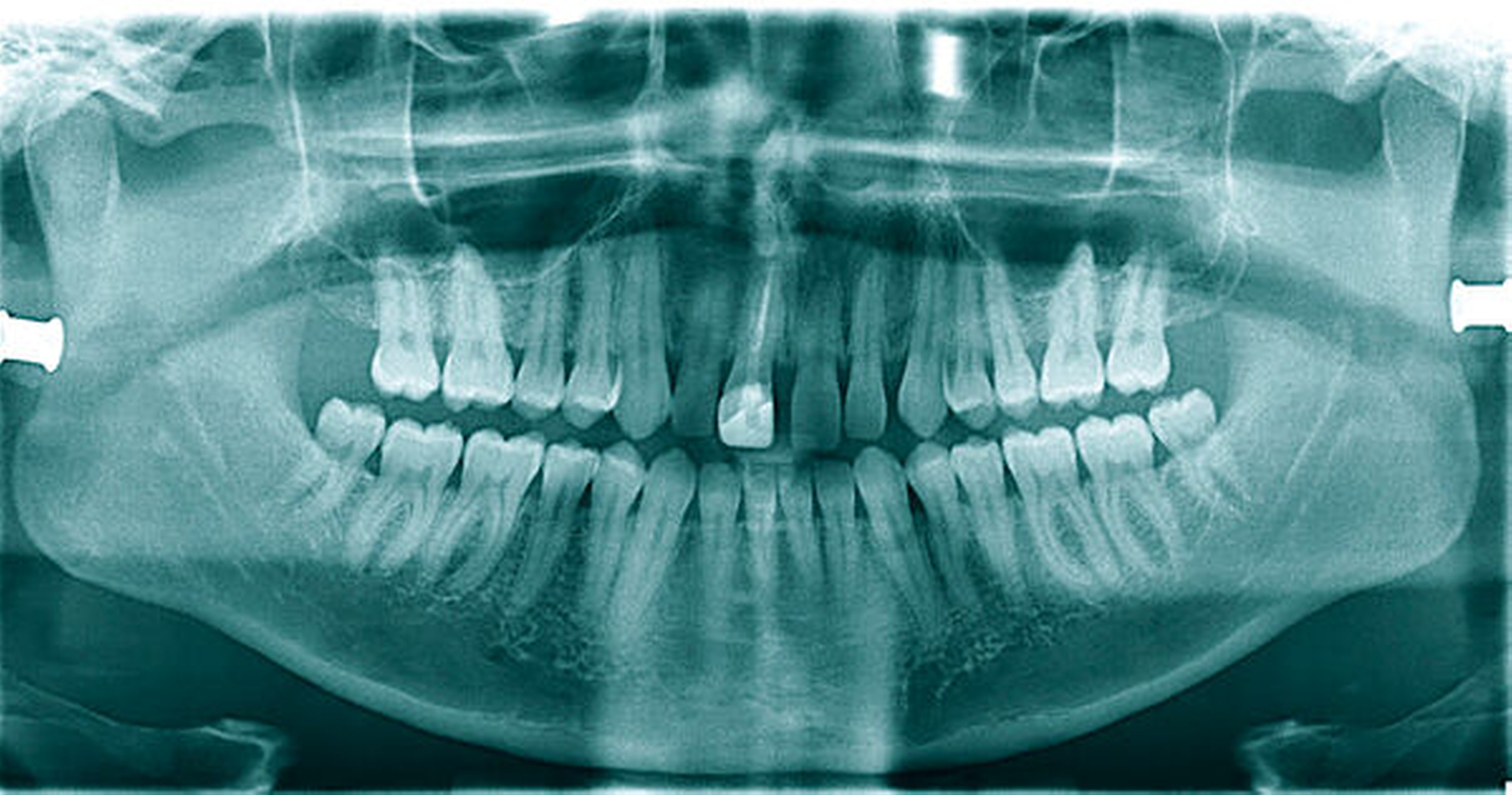
In der klinischen Untersuchung zeigte sich im Bereich der Umschlagfalte des Unterkiefervestibulums auf beiden Seiten jeweils eine langstreckige ulzeröse Schleimhautveränderung. Auf der linken Seite war die Veränderung deutlich stärker ausgeprägt als rechts. Rechts reichte die circa 4 cm x 0,5 cm messende, ulzeröse Läsion von regio 34 bis in regio 38, zentral mit stark mazeriertem Gewebe und Verlust der Oberflächenintegrität. In der Tiefe ließ sich bis auf das darunter liegende Periost sondieren, es zeigte sich kein freiliegendes Os. Rechts zeigte sich ein weniger eindrucksvolles Bild durch eine deutlich oberflächlichere und kleinere Fibrin-belegte Läsion (Abbildungen 1 und 2). Die Veränderungen im Bereich der Umschlagfalten tasteten sich weich, ohne indurierten Randwall. Es zeigte sich kein Austritt von Pus, und auch keine nennenswerte Schwellung. Die beiden Ulzera waren auf Palpation schmerzhaft. Die restliche Mund- und Rachenschleimhaut erschien – soweit einsehbar – reizlos und intakt. Die Mundhygiene des Patienten erschien adäquat, bei einem konservierend versorgten Gebiss. In der angefertigten Panoramaschichtaufnahme ergaben sich kein morphologisches Korrelat und kein dentogener Fokus für die beiden schmerzhaften Läsionen (Abbildung 3).
Anamnestisch bestanden zu diesem Zeitpunkt keine Vorerkrankungen, es wurde keine Dauermedikation eingenommen und auch die Risikoanamnese hinsichtlich Nikotin- und Alkoholabusus zeigte sich negativ. Ebenso waren bei der Erstvorstellung keine Allergien oder Unverträglichkeiten bekannt. Im Rahmen einer gezielten Anamneseerhebung berichtete der junge Mann schließlich, bereits seit Jahren an rezidivierenden, starken und krampfartigen Bauchschmerzen zu leiden. Im zeitlichen Zusammenhang mit den Bauchschmerzen sei es auch zu Durchfällen gekommen. Innerhalb der vergangenen Wochen habe er zudem außergewöhnlich starken Nachtschweiß und einen rasanten Gewichtsverlust bemerkt.
Aufgrund des klinischen Befunds, der geschilderten Beschwerden und der fehlenden Risikofaktoren für etwaige Differenzialdiagnosen wurde von unserer Seite der dringende Verdacht einer extraintestinalen Manifestation einer chronisch entzündlichen Darmerkrankung geäußert und die Indikation zur histologischen Sicherung gestellt. Die Entnahme einer Probe erfolgte im Sinne einer Inzisionsbiopsie im Bereich des linken Unterkiefervestibulums und verlief komplikationslos.
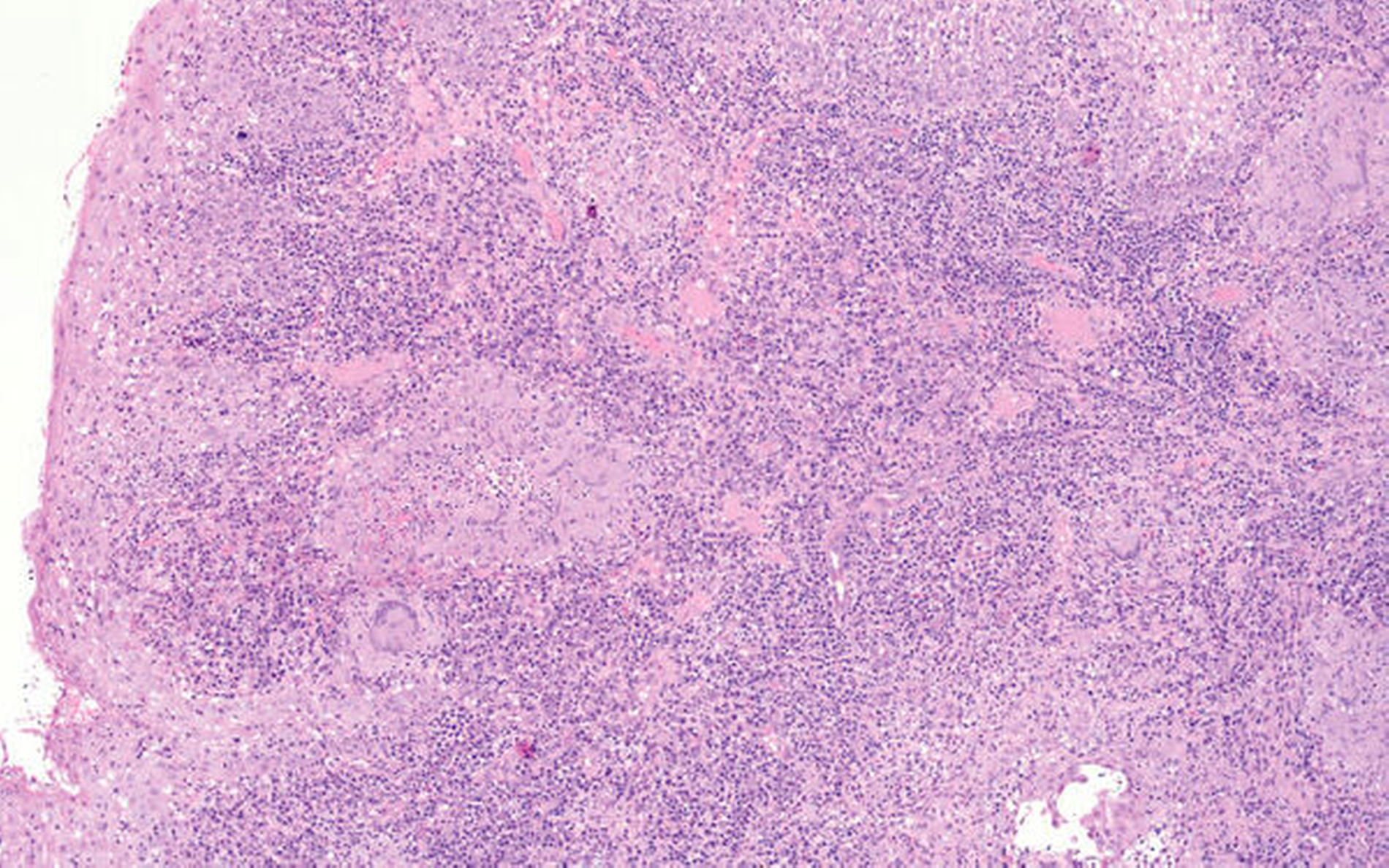
Die histopathologische Begutachtung ergab eine reaktiv veränderte plattenepitheliale Schleimhaut mit granulomatöser Entzündung mit mehrkernigen Riesenzellen und florider Ulzeration sowie zahlreichen Plasmazellen, keine verkäsenden Nekrosen und keine Malignität (Abbildung 4). Im Nachbericht konnte eine Pilzinfektion ausgeschlossen werden. Nach Rücksprache mit den Kollegen des Pathologischen Instituts der Universitätsklinik Erlangen sollte zusätzlich der Ausschluss einer infektiösen Genese erfolgen. Läge eine solche nicht vor, wäre der Befund mit einer oralen Manifestation eines Morbus Crohn zu vereinbaren. Durch einen Wundabstrich konnten lediglich Keime der normalen Mundflora nachgewiesen und somit eine infektiöse Genese ausgeschlossen werden.
Aufgrund des Ergebnisses aus der histopathologischen Untersuchung erfolgte eine Anbindung des Patienten an die Spezialsprechstunde für chronisch-entzündliche Darmerkrankungen der Medizinischen Klinik 1 des Universitätsklinikums Erlangen. Hier wurde die Diagnostik vervollständigt, unter anderem durch eine Gastroskopie, eine Koloskopie und eine Kernspintomografie. Nach Bestätigung der Diagnose Morbus Crohn erfolgte die Einleitung einer Systemtherapie: initial durch Prednisolongabe und darauffolgend die intravenöse Gabe von Infliximab (TNF-Blocker) alle acht Wochen.
Ein halbes Jahr nach Beginn der Systemtherapie stellte sich der Patient in unserer Hochschulambulanz zur Verlaufskontrolle vor. Der junge Mann befand sich in einem deutlich gebesserten Allgemeinzustand. Zu den vorbekannten gastrointestinalen Beschwerden sei es seit der Therapieeinleitung kaum noch gekommen. Die Läsionen der Mundschleimhaut sind dem Patienten zufolge bereits nach der zweiten Gabe des TNF-Blockers vollständig abgeklungen und seither nicht mehr aufgetreten. Auch zu Schmerzen im Bereich der Mundschleimhaut sei es seither nicht mehr gekommen. Im klinischen Befund bei der Verlaufskontrolle zeigte sich eine reizlose und intakte Mundschleimhaut und die beiden Initialläsionen waren vollständig ausgeheilt (Abbildungen 5 und 6). Die Systemtherapie wird bisher ohne Nebenwirkungen vertragen und es erfolgt weiterhin eine engmaschige internistische Anbindung.
Diskussion
Die chronisch-entzündlichen Darmerkrankungen (CED) sind multifaktorielle, idiopathische Erkrankungen, die durch eine diffuse Entzündung der Darmschleimhaut gekennzeichnet sind. Die Inzidenz für Morbus Crohn (MC) in Deutschland liegt bei 6,6 pro 100.000 Einwohner mit einer Prävalenz von etwa 100 bis 200 pro 100.000 Einwohner [Preiß et al., 2014]. Für die Colitis Ulcerosa (CU) geht man von einer höheren Prävalenz von 160 bis 200 pro 100.000 Einwohner aus und die Inzidenz liegt bei bis zu 3,9 pro 100.00 Einwohner [Dignass et al., 2011]. Faktoren, die die Entstehung von CED beeinflussen, können umweltbedingt (Rauchen oder schlechte Ernährung), genetisch bedingt oder auf eine unterschiedliche Immunreaktion zurückzuführen sein. Diese Krankheiten sind mit einer gestörten Immunreaktion der Darmschleimhaut auf ansonsten harmlose Antigene verbunden. Mit stetig steigenden Zahlen an Erkrankungen stellt diese Krankheit ein ernstes Problem dar.
Die Leitsymptome wie blutiger Durchfall, Übelkeit, Erbrechen und Appetitlosigkeit können in einigen Fällen auch zu einem schlechten geistigen und körperlichen Wohlbefinden führen [Piras et al., 2017; Papageorgiou et al., 2017]. In der Literatur wird derzeit der Einfluss der lokalen mikrobiologischen Darmflora, eine begünstigte Erhöhung der Zuckeraufnahme durch Lebensmittel oder ernährungsbedingtes Fehlverhalten diskutiert. Dendritische Zellen und Makrophagen der Darmschleimhaut weisen eine erhöhte Expression von Toll-like-Rezeptoren (TLR2, TLR4 und CD40) sowie des Chemokinrezeptors CCR7 auf, was zu einer verstärkten entzündlichen Reaktion durch die Freisetzung von proinflammatorischen Zytokinen wie Tumornekrosefaktor TNF-α, IL-1, IL-6 und IL-18 führt.
Fazit für die Praxis
Mangel- beziehungsweise Fehlernährung begünstigt die CED-Entstehung.
Veränderungen in der Mundhöhle können als Erstmanifestation auftreten.
CED selbst kann die Mundhöhle, aber auch den Zahnhalteapparat direkt affektieren.
Eine immunsuppressive Therapie hat unter Umständen Auswirkungen auf Zähne und Zahnhalteapparat.
Unklare, therapieresistente Mundschleimhautveränderungen ohne pathologische Diagnose mit entsprechender intestinaler Anamnese müssen interdisziplinär mit Gastroenterologen behandelt werden.
CED können gleichermaßen indirekte und direkte Auswirkungen in der Mundhöhle, respektive auf den Zahnhalteapparat und die Zähne, haben. Indirekte Veränderungen manifestieren sich als Folge der immunsuppressiven Medikation oder auch der Mangelabsorption beziehungsweise Mangel-/Fehlernährung. Dadurch kommt es auch zu kariösen Veränderungen an den Zähnen oder zur Schädigung der parodontalen Fasern [Tan et al., 2017; de Vries et al., 2018]. Eine immunsuppressive Therapie und die Auswirkungen auf den parodontalen Zustand sind bereits untersucht worden und haben gezeigt, dass die parodontale Entzündung bei immunsupprimierten Patienten im Vergleich zu nicht immunsupprimierten Patienten abnimmt. In den vergangenen Jahrzehnten wurden vor allem monoklonale Antikörper (zum Beispiel Infliximab) entwickelt, die sich als wirksam für die Behandlung von CED erwiesen haben. Aber auch andere Immunsuppressiva und Medikamente kommen bei CED-Patienten infrage:
Steroide
Aminosalizylate-5-ASA (Sulfasalazin, Mesalazin) insbesondere für die CU
Zytostatika: zum Beispiel Azathioprin oder Methotrexat
Monoklonale Antikörper, sogenannte Biologika: zum Beispiel Infliximimab, Adalimumab
Die Parodontitis (PA) als solche ist definiert als eine entzündliche Erkrankung, bei der ein ins Dysbiotische gekipptes Mikrobiom zu einer Entzündungsreaktion führt. Auch hier sind eine Vielzahl von Entzündungsmediatoren an der Entzündungsreaktion im Sulcus und dem letztlich stattfindenden Knochenabbau beteiligt (pro-inflammatorische Zytokine IL-1β, -2, -4,6-8 und Matrixmetalloproteasen MMP-7, -8, -9) [Buchbender et al., 2022]. Klinische Studien bei CED-Patienten zeigen teilweise auch eine Erhöhung der spezifischen parodontalen Parameter, weshalb geschlussfolgert wird, dass diese Patientengruppe ein erhöhtes Risiko trägt, Zähne frühzeitiger zu verlieren [Buchbender et al., 2022]. Die Immunantwort, respektive die Entzündungsreaktion im Sulcus des Zahnes, muss also wie bei einer parodontalen Reaktion über inflammatorische Marker vermittelt sein.
Um unter anderem diesen Zusammenhang zu klären, stellen die CED und deren Zusammenhang mit der Mundgesundheit einen interdisziplinären Forschungsschwerpunkt unserer Klinik dar. In einer unserer Pilotstudien konnte bereits gezeigt werden, dass sich die Expressionslevel von einzelnen Interleukinen und Matrixmetalloproteasen (IL-10 und MMP-7) zwischen CED-Patienten und gesunden Probanden signifikant unterscheiden [Buchbender et al., 2022]. Um die klinische Relevanz dieser Ergebnisse darzustellen und weitere Zusammenhänge zu beleuchten, wird aktuell eine größere Kohorte mit weiteren Untersuchungsgruppen analysiert.
Direkte Veränderungen, die durch die CED selbst als direkte Folge der intestinalen Entzündung verursacht werden, betreffen im Wesentlichen die Mundschleimhaut. Diese imponieren klinisch spezifisch und charakteristisch als „Kopfsteinpflaster“-Mukosa, als Pyostomatitis vegetans oder als eine orale Granulomatosis einer CED [Katsanos und Papadakis, 2017] oder unspezifisch als Fisteln, Apthoiden Läsionen, Cheilitis, Gingivitis, Stomatitis oder auch als Burning-mouth-Syndrom [Katsanos und Papadakis, 2017]. CED sind durch Koexistenzen von einer Vielzahl an oralen Manifestationen charakterisiert (5 bis 50 Prozent) [Podolsky, 1991; Baumgart und Sandborn, 2012], wobei diese in MC-Patienten mit einer Prävalenz von 20 bis 50 Prozent auftreten und in fünf bis zehn Prozent der Patienten die Erstmanifestation als orale „kopfsteinartige“ Mukosa imponiert [Fatahzadeh et al., 2009]. Im hier vorliegenden Fall kann die klinische Veränderung im Vestibulum einer ausgeprägten „kopfsteinpflasterartigen“ Mukosa zugeordnet werden, weswegen – wie beschrieben – spezielle anamnestische Fragen erhoben werden mussten und der Verdacht auf Morbus Crohn gefestigt wurde.
Literaturliste
1. Preiß JC, Bokemeyer B, Buhr HJ, Dignaß A, Häuser W, Hartmann F, et al. Aktualisierte S3-Leitlinie – „Diagnostik und Therapie des Morbus Crohn“ 2014. Z Gastroenterol. 2014; 52 (12): 1431-84.
2. Dignass A, Preiß JC, Aust DE, Autschbach F, Ballauff A, Barretton G, et al. Aktualisierte Leitlinie zur Diagnostik und Therapie der Colitis ulcerosa 2011 – Ergebnisse einer Evidenzbasierten Konsensuskonferenz. Z Gastroenterol. 2011; 49 (09): 1276-341.
3. Piras V, Usai P, Mezzena S, Susnik M, Ideo F, Schirru E, et al. Prevalence of Apical Periodontitis in Patients with Inflammatory Bowel Diseases: A Retrospective Clinical Study. J Endod. 2017; 43 (3): 389-94.
4. Papageorgiou SN, Hagner M, Nogueira AV, Franke A, Jager A, Deschner J. Inflammatory bowel disease and oral health: systematic review and a meta-analysis. J Clin Periodontol. 2017; 44 (4): 382-93.
5. Tan CX, Brand HS, de Boer NK, Forouzanfar T. Gastrointestinal diseases and their oro-dental manifestations: Part 2: Ulcerative colitis. Br Dent J. 2017; 222 (1): 53-7.
6. de Vries SAG, Tan CXW, Bouma G, Forouzanfar T, Brand HS, de Boer NK. Salivary Function and Oral Health Problems in Crohn's Disease Patients. Inflamm Bowel Dis. 2018; 24 (6): 1361-7.
7. Hajishengallis G. Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol. 2015; 15 (1): 30-44.
8. Buchbender M, Fehlhofer J, Proff P, Most T, Ries J, Hannig M, et al. Expression of inflammatory mediators in biofilm samples and clinical association in inflammatory bowel disease patients-a preliminary study. Clin Oral Investig. 2022; 26 (2): 1217-28.
9. Katsanos KH, Papadakis KA. Inflammatory Bowel Disease: Updates on Molecular Targets for Biologics. Gut Liver. 2017; 11 (4): 455-63.
10. Podolsky DK. Inflammatory bowel disease (2). N Engl J Med. 1991; 325 (14): 1008-16.
11. Baumgart DC, Sandborn WJ. Crohn's disease. Lancet. 2012; 380 (9853): 1590-605.
12. Fatahzadeh M, Schwartz RA, Kapila R, Rochford C. Orofacial Crohn's disease: an oral enigma. Acta Dermatovenerol Croat. 2009; 17 (4): 289-300.









