Die Regeneration der Pulpa
Umschlossen von Schmelz und Dentin befindet sich im Inneren des Zahnes das Weichgewebe der Zahnpulpa. Dieses besteht aus dem an das Dentin angrenzenden Odontoblastensaum, der von polaren, terminal differenzierten und hochspezialisierten Zellen gebildet wird, des Weiteren aus Fibroblasten, Stammzellen, verschiedenen Zellen des Immunsystems sowie Nervfasern, Blut- und Lymphgefäßen. Während der Zahnentwicklung bilden die Odontoblasten Dentin, wobei Zellfortsätze im Hartgewebe verbleiben, was dem Dentin die tubuläre Struktur verleiht und dieses zu einem vitalen Gewebe macht. Die Dentinbildung gilt als primäre Funktion der Pulpa, das Gewebe erfüllt jedoch weitere wichtige Aufgaben.
Da Schmelz und Dentin durch organische Säuren von in der Mundhöhle vorhandenen Mikroorganismen, die sich im Biofilm organisieren, demineralisiert und zerstört werden können, besitzt die Pulpa etliche Abwehrmechanismen gegen Bakterien. Dabei nehmen die Odontoblasten, ähnlich wie epitheliale Zellen an anderen Stellen des Körpers, eine Barrierefunktion ein. Einerseits sind sie in der Lage, Bestandteile von Bakterien über spezifische Rezeptoren zu erkennen und diese Information an benachbarte Immunzellen wie dendritische Zellen weiterzugeben, andererseits besitzen sie ein Repertoire von Abwehrmechanismen – unter anderem bilden sie antibakterielle Peptide sowie Proteine, die bakterielle Toxine neutralisieren, sowie Stickstoffmonoxid oder andere für Bakterien schädliche Substanzen. Odontoblasten initiieren somit auch die Immunantwort, die sie im weiteren Verlauf sowohl abschwächen als auch verstärken können [Hahn und Liewehr, 2007].
Zudem geht man davon aus, dass Odontoblasten wesentlich an der Schmerzleitung beteiligt sind. Nervfasern verlaufen mit den Odontoblastenfortsätzen in den Dentintubuli, diese wiederum besitzen Querverbindungen, die eine Kommunikation der Zellen untereinander ermöglichen [Magloire et al., 2009]. Die Stimulation afferenter Nervfasern führt zur Ausschüttung von Neuropeptiden und Neurotransmittern, die eine Vasodilatation bedingen und somit aktiv zum Entzündungsgeschehen beitragen [Byers und Närhi, 1999].
Eine weitere wichtige Funktion der Pulpa ist die Ausbildung der Zahnwurzel. Dabei instruieren die Zellen der Hertwig’schen Epithelscheide (HES) die Zellen der apikalen Papille, die zu Odontoblasten differenzieren und Wurzeldentin und -pulpa bilden [Huang et al., 2008]. Erst etwa drei Jahre nach dem Durchbruch eines Zahnes in die Mundhöhle ist das Wurzelwachstum abgeschlossen, dann bilden sich die HES und die apikale Papille zurück. Kommt es innerhalb dieses Zeitfensters zur Pulpanekrose oder zur Schädigung der HES, so arretiert das Wurzelwachstum und es bleibt – je nach Zeitpunkt des Traumas – ein Zahn mit mehr oder weniger dünnen und frakturanfälligen Wurzelwänden zurück, was wesentliche Auswirkungen auf die Langzeitprognose hat.
Vitalerhaltende Maßnahmen
Entsteht eine kariöse Läsion, so folgt frühzeitig eine Entzündungsreaktion in der Pulpa, die mit dem Fortschreiten der Karies an Intensität zunimmt. Bei einer tiefen Dentinkaries mit dünner verbleibender Restdentinstärke sollte die indirekte Überkappung erwogen werden, die einerseits durch die Applikation eines Überkappungsmaterials die Tertiärdentinbildung anregt, andererseits einen direkten Kontakt der in den Dentinadhäsiven enthaltenen toxischen Monomere, der durch Diffusion über die Dentintubuli stattfindet [Schweikl et al., 2017], in Pulpanähe verhindert. Wird die Pulpa im Rahmen der Exkavation im Gesunden eröffnet, kann die direkte Überkappung durchgeführt werden, wobei nach Prüfung des Pulpastatus ein Überkappungsmaterial direkt auf das exponierte Gewebe aufgetragen wird.
Bei Eröffnung der Pulpa im Kariösen sollte als vitalerhaltende Maßnahme die partielle oder die vollständige Pulpotomie durchgeführt werden. Dabei ist nach dem Abtragen vom entzündeten Pulpagewebe auf die Blutstillung zu achten. Als Überkappungsmaterial kann Kalziumhydroxid zum Einsatz kommen, in direktem Kontakt mit der Pulpa bieten hydraulische Kalziumsilikatzemente jedoch höhere Erfolgsquoten [Cao et al., 2016]. Die Vitalerhaltung sollte stets angestrebt werden. Auch nach dentalem Trauma mit Eröffnung der Pulpa ist die Pulpotomie (partiell oder vollständig) eine valide Methode zur Vitalerhaltung, in diesem Fall ist aufgrund der fehlenden Vorschädigung durch einen kariösen Prozess mit einer hohen Erfolgssicherheit von über 95 Prozent nach drei Jahren auszugehen [Hecova et al., 2010]. Derzeit wird die Erweiterung der Indikationsstellung vitalerhaltender Maßnahmen auch auf Zähne mit Anzeichen einer irreversiblen Pulpitis erwogen, dazu sei auf die beiden zuletzt veröffentlichten Wissenschaftlichen Mitteilungen zu vitalerhaltenden Maßnahmen hingewiesen [Dammaschke et al., 2019; Krastl et al., 2021].
Regeneration und Reparatur
Während das „regenerative Potenzial“ der Pulpa gemeinhin als hoch eingeschätzt wird, zeigen histologische Untersuchungen, dass es nach vital-erhaltenden Maßnahmen nicht zu einer Restitutio ad integrum und somit nicht zu einer echten Regeneration, also zur Wiederherstellung der ursprünglichen Architektur und Funktion des Pulpagewebes kommt. Die Odontoblasten gehen durch die Gewebeschädigung verloren und werden meist durch flache, fibroblastenähnliche Zellen ersetzt. Das neu gebildete Hartgewebe weist entweder eine irreguläre tubuläre Struktur auf oder diese fehlt gänzlich – die Struktur erscheint amorph und es sind Zelleinschlüsse zu beobachten [Ricucci et al., 2017]. Somit kommt es nach der therapeutischen Intervention zur Ausheilung durch Reparatur, wobei das ursprüngliche Gewebe durch ein ektopisches ersetzt wird. Bei adäquater Durchführung vitalerhaltender Maßnahmen bleiben die entsprechend behandelten Zähne jedoch in der Regel symptom- und entzündungsfrei.
Revitalisierung
Kommt es aufgrund ausgedehnter kariöser Läsionen oder nach Trauma zur Pulpanekrose des betroffenen Zahnes, so wird die Wurzelkanalbehandlung eingeleitet. Während die Erfolgsquoten wurzelkanalbehandelter Zähne bei der Primärbehandlung über 90 Prozent betragen [Burns et al., 2022], ist im eingangs erläuterten Sonderfall eines Zahnes mit nicht abgeschlossenem Wurzelwachstum die Situation ungünstiger. Aufgrund der dünnen Dentinwände, dem weit offenen Foramen apicale und – je nach Stadium der Wurzelentwicklung – der trichterförmigen Konfiguration des apikalen Wurzeldrittels ist die herkömmliche Wurzelkanalaufbereitung und -obturation nicht möglich. Während über Jahrzehnte mit wechselnden Kalziumhydroxid-Einlagen zur Induktion einer apikalen Hartgewebsbarriere gearbeitet wurde, ist diese Methode heute nicht mehr als das Verfahren der Wahl anzusehen. Durch den alkalischen pH-Wert von Kalziumhydroxid kommt es bei mehrwöchiger Kontaktzeit zur Degradation des Kollagengerüsts im Dentin, was zu einer deutlichen Herabsetzung der mechanischen Festigkeit und zu einer erhöhten Frakturanfälligkeit dieser Zähne führt [Bakland und Andreasen, 2012].
Als valide Behandlungsmethode ist die apikale Barrieretechnik (auch apikaler Verschluss oder apikaler Plug) anzusehen. Dabei wird nach entsprechender Desinfektion ein hydraulischer Kalziumsilikatzement (zum Beispiel Mineral Trioxid Aggregat) über den Wurzelkanal kontrolliert nach apikal transportiert und in direktem Kontakt mit dem apikalen Gewebe platziert. Da hydraulische Kalziumsilikatzemente sehr gut gewebeverträglich sind, im feuchten Milieu aushärten und durch die Freisetzung von Kalziumhydroxid die Hartgewebsbildung induzieren [Koutroulis et al., 2019], sind sie für diese Anwendung besonders gut geeignet. Die apikale Barrieretechnik ist technisch anspruchsvoll, erzielt aber meist zuverlässig die Ausheilung der Gewebe und somit gute Erfolgsquoten [Torabinejad et al., 2019]. Während nach einiger Zeit röntgenologisch ein apikaler Hartgewebsverschluss beobachtet werden kann, bleibt ein weiteres Wurzelwachstum oder eine Stabilisierung der Wurzelwände durch Apposition von Hartgewebe jedoch aus. Somit bleibt die Frakturanfälligkeit des betroffenen Zahnes in Abhängigkeit vom Stadium des Wurzelwachstums zum Zeitpunkt der Pulpanekrose bestehen, was die Langzeitprognose mehr oder weniger deutlich einschränken kann. Insbesondere im Fall jugendlicher Zähne wäre somit eine Regeneration der Pulpa mit nachfolgender Dentinapposition und dem Abschluss des Wurzelwachstums sehr wünschenswert.
Zur Behandlung von Zähnen mit nicht abgeschlossenem Wurzelwachstum und Pulpanekrose ist neben der apikalen Barrieretechnik seit einigen Jahren ein weiteres Verfahren von den endodontologischen Fachgesellschaften empfohlen und detailliert beschrieben: die sogenannte Revitalisierung. Bei dieser Technik wird nach sorgfältiger Desinfektion des Wurzelkanals durch Manipulation der periapikalen Gewebe eine Einblutung in den Wurzelkanal erzeugt. Das so entstehende Blutkoagel dient als Leitschiene für die Neubildung von Gewebe, weswegen sich der Begriff „Revitalisierung“ etabliert hat.
Nomenklatur
Die Revitalisierung geht zurück auf erste Fallberichte, die zu Beginn der 2000er-Jahre publiziert wurden. Dabei wurde nach der erläuterten Vorgehensweise ein Abschluss des Wurzelwachstums bei Zähnen mit zuvor weit offenem Foramen apicale beobachtet. Es folgten weitere Fallberichte, dann Kohortenstudien, schließlich kontrollierte klinische Studien und daraus abgeleitet systematische Übersichtsarbeiten und Metaanalysen. Empfehlungen der European Society of Endodontology (ESE) gibt es seit 2016 [ESE, 2016], von der American Association of Endodontists (AAE) bereits seit 2011, diese wurden aber inzwischen mehrfach überarbeitet [AAE, 2021]. Die Nomenklatur zu diesem Vorgehen ist jedoch uneinheitlich. In den ersten Fallberichten und Fallserien wurde der Begriff der „Revaskularisation“ verwendet. Dieser stammte aus der dentalen Traumatologie und bezog sich auf avulsierte und replantierte Zähne mit weit offenem Foramen apicale, bei denen eine spontane Neubildung von Gewebe im Wurzelkanal beobachtet wurde. Dies wurde in entsprechenden Tierstudien in den 1970er-Jahren bestätigt, wobei die Blutgefäßneubildung histologisch nachgewiesen wurde – daher „Revaskularisation“. Diese Gewebseinsprossung in den Wurzelkanal funktioniert aber nur unzuverlässig und nicht vorhersagbar. Nachdem das neu gebildete Gewebe im Wurzelkanal nicht ausschließlich aus Blutgefäßen besteht, wurde der Begriff verlassen zugunsten der „Regenerative Endodontic Procedures (REP)“. Dies ist darauf zurückzuführen, dass zunächst davon ausgegangen wurde, dass nach dem Erzeugen der Einblutung tatsächlich eine echte Regeneration der Pulpa induziert werden könnte, was man daraus ableitete, dass in den anfangs veröffentlichten Fallberichten ein Abschluss des Wurzelwachstums beobachtet wurde. Dies wurde durch molekularbiologische Untersuchungen gestützt, in denen Oberflächenmarker mesenchymaler Stammzellen im intrakanalären Blut im Vergleich zu Blut aus der Armvene um ein Vielfaches erhöht waren [Lovelace et al., 2011].
Tierexperimentelle Studien und publizierte Fallberichte, in denen Zähne infolge von Misserfolg nach Revitalisierung extrahiert und histologisch untersucht werden konnten, zeigten jedoch, dass das neu gebildete Gewebe ektopischer Natur ist [da Silva et al., 2010; Wang et al., 2010] – was zunächst zu Ernüchterung über die Möglichkeiten dieser neuen Behandlungsmethode führte. Bald jedoch wurde die Erwartungshaltung adjustiert, wie im Folgenden ausgeführt wird.
Indikationsstellung und klinisches Vorgehen
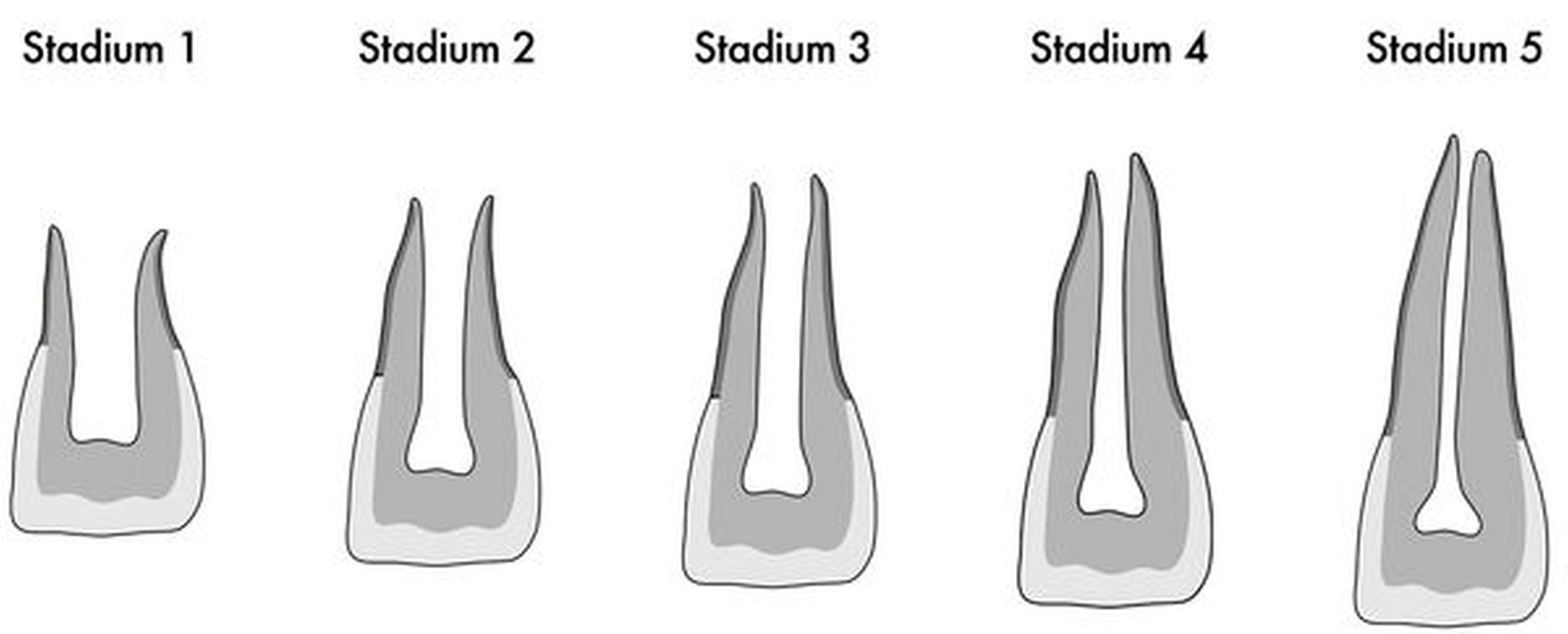
Die folgenden Empfehlungen sind weitgehend und sofern nicht anderweitig gekennzeichnet der Stellungnahme der ESE entnommen [ESE, 2016]. Die Indikation zur Revitalisierung kann bei Zähnen mit nicht abgeschlossenem Wurzelwachstum und Pulpanekrose gestellt werden. Diese Konstellation tritt insgesamt selten ein, wird meist infolge eines dentalen Traumas beobachtet und betrifft somit überwiegend die Frontzähne des Oberkiefers. Eine bereits bestehende periapikale Läsion oder Fistelung stellt kein Ausschlusskriterium dar. Somit weisen der apikale Verschluss und die Revitalisierung dieselbe Indikationsstellung auf. Patienten können umso mehr von der Revitalisierung profitieren, je weniger weit fortgeschritten das Wurzelwachstum ist. Bei guter Compliance der Patienten sollte der Revitalisierung bei den Stadien I – III der Wurzelentwicklung nach Cvek (Abbildung 2) der Vorzug gegeben werden, beim Stadium IV sind Revitalisierung und apikaler Verschluss als gleichwertig anzusehen [Kim et al., 2018].
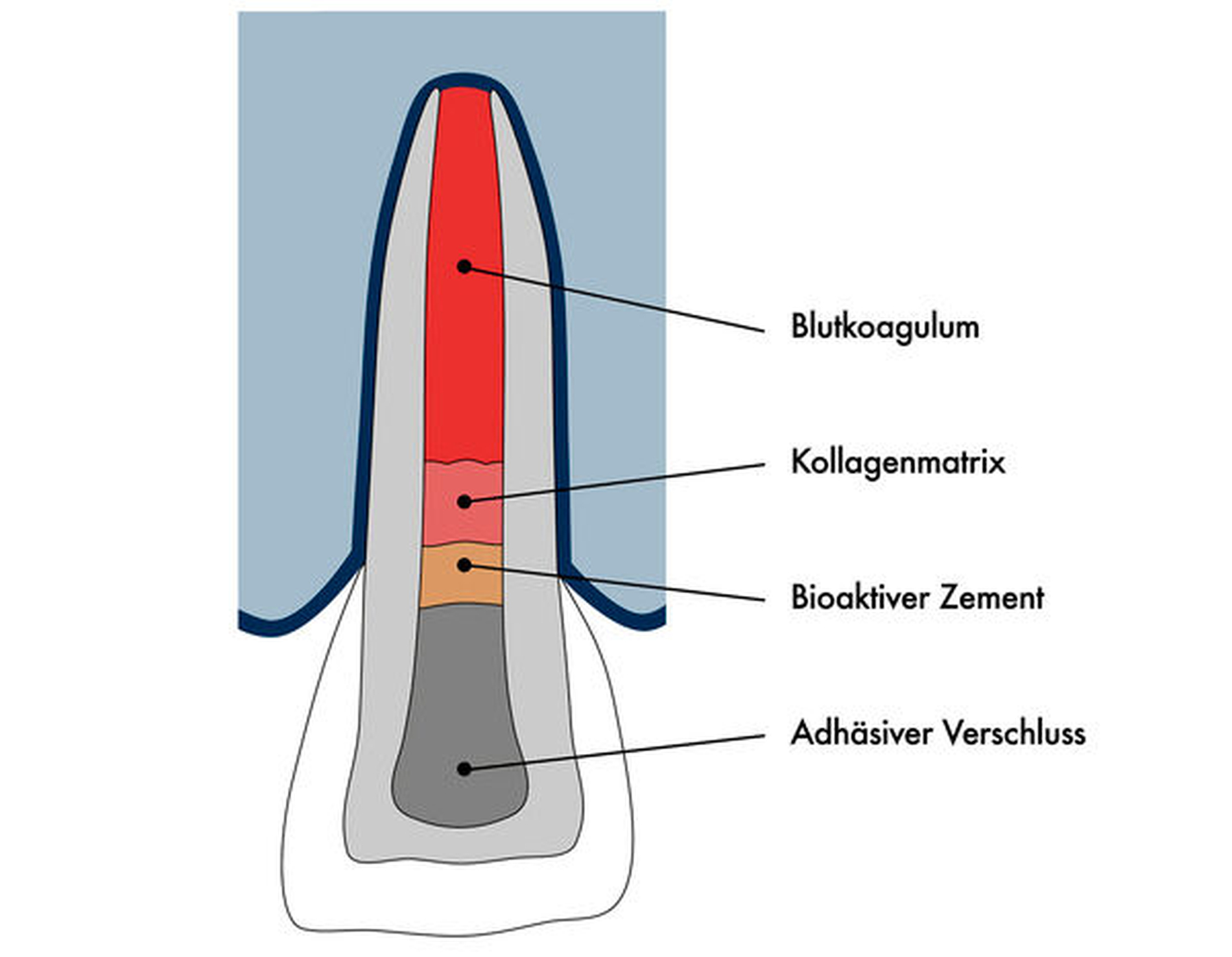
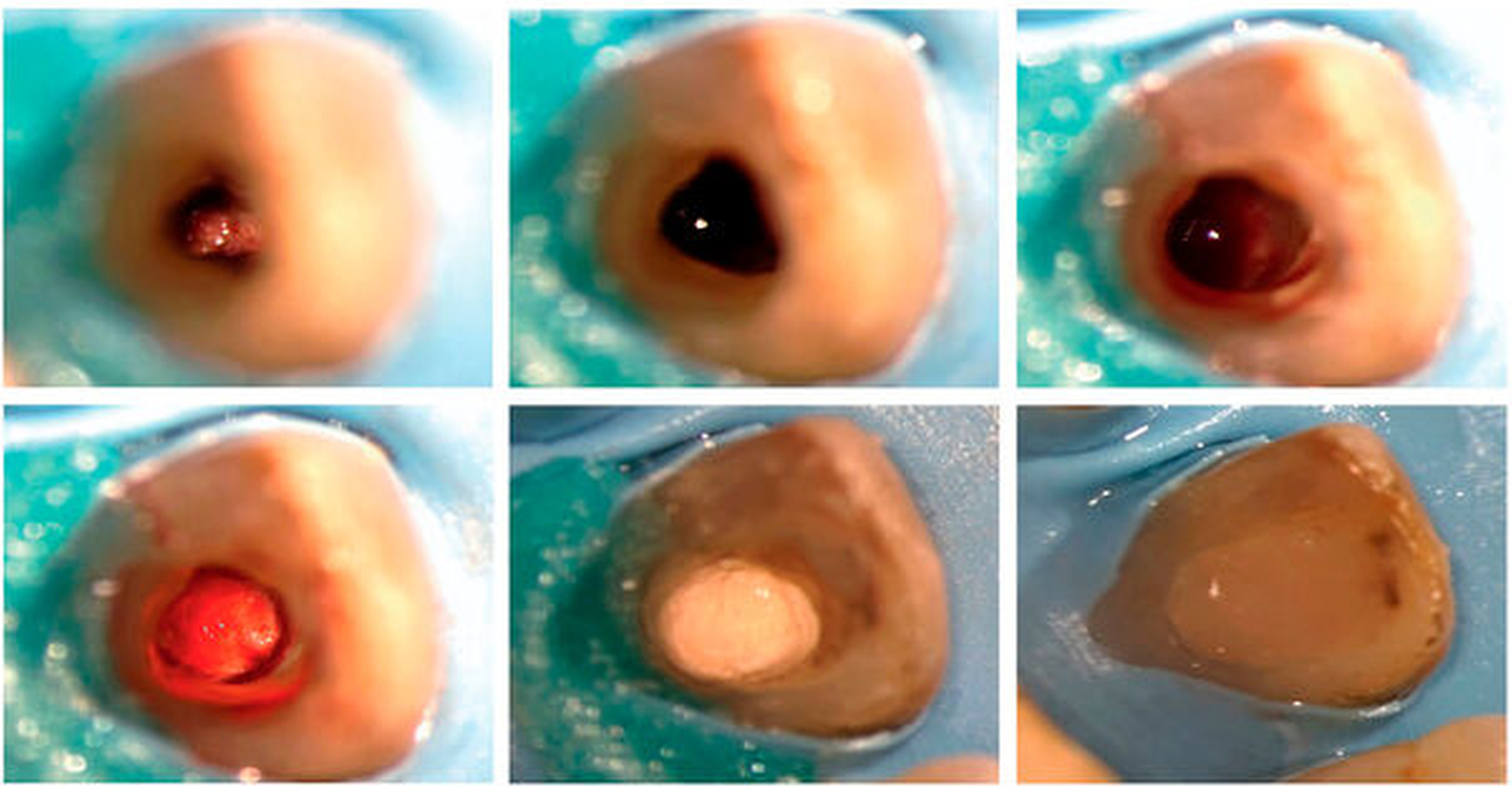
Das klinische Vorgehen zur Revitalisierung nach dem Protokoll der ESE beinhaltet nach umfassender Diagnostik in der ersten Sitzung die Eröffnung des Zahnes unter Kofferdam, gefolgt von sorgfältiger Desinfektion durch Spülung mit Natriumhypochlorit (NaOCl) in niedriger Konzentration von ein bis drei Prozent. Eine mechanische Bearbeitung der Kanalwand sollte möglichst vermieden werden, um eine Schwächung dünner Wurzelwände zu vermeiden. Für die medikamentöse Einlage sollte ein nicht-zahnverfärbendes Kalziumhydroxid-Präparat verwendet werden. In der zweiten Sitzung sollten der Zahn beschwerde- und symptomfrei und ein eventuell bestehender Fistelgang geschlossen sein, andernfalls wird die antibakterielle Therapie mittels Natriumhypochlorit und medikamentöser Einlage fortgeführt. Nach Anästhesie, optimalerweise ohne Vasokonstriktor, wird der Zahn unter Kofferdam wieder eröffnet und mit 17-prozentiger EDTA-Lösung gespült, wobei überschüssige Flüssigkeit nachfolgend mittels Papierspitzen entfernt wird. Anschließend wird durch Überinstrumentieren mit einer Handfeile, die in einer rotierenden oder pickenden Bewegung eingesetzt werden kann, eine Einblutung in den Kanal erzeugt (Abbildung 3). Das Blutkoagulum kann mit einem Kollagenpräparat abgedeckt werden, das als Widerlager dient, um in der Folge das Einbringen eines hydraulischen Kalziumsilikatzements zu erleichtern. Der Zahn sollte abschließend adhäsiv und bakteriendicht verschlossen werden (Abbildung 4). Röntgenaufnahmen sollten prä- sowie postoperativ angefertigt werden, in der Nachuntersuchung nach drei, sechs, zwölf, 18 und 24 Monaten. Die erfolgreiche Behandlung ist erkennbar am Abklingen beziehungsweise Ausbleiben von Beschwerden und Entzündungszeichen, periapikale Läsionen sollten ausheilen. Wünschenswert ist eine positive Reaktion auf die Sensibilitätsprobe, die nach Revitalisierung in etwa 55 Prozent der Fälle festzustellen ist [Diogenes et al., 2013]. Eine Zunahme der Wurzellänge und -dicke ist in etwa zwei Dritteln der Fälle zu beobachten, jedoch nicht vorhersagbar [Torabinejad et al., 2017]. Ein Ausbleiben der weiteren Mineralisation ist dabei nicht als Misserfolg zu werten.
Die Entscheidung, ob mittels apikalem Verschluss oder Revitalisierung vorgegangen werden soll, ist individuell zu treffen, wobei die Compliance des Patienten, das Stadium der Wurzelentwicklung und die Erfahrung des Behandlers zu berücksichtigen sind. Während die Revitalisierung technisch einfacher durchführbar ist als der apikale Verschluss, so ist das Erzeugen der Einblutung trotz Anästhesie gelegentlich schmerzhaft. Daher sollte in der ersten Sitzung die Kooperationsfähigkeit des jungen Patienten abgeschätzt werden. Ein Vorteil der Revitalisierung liegt darin, dass aufgrund der geringen Manipulation der Gewebe bei Misserfolg eine Wiederholung der Behandlung ebenso möglich ist wie der anschließende apikale Verschluss [Chaniotis, 2017].
Ergebnisse nach Revitalisierung
Die Ergebnisse der ersten Fallberichte zur Revitalisierung mündeten in der Erwartung, mit diesem Verfahren eine echte Pulparegeneration zu erzeugen. Bei Zähnen mit nicht abgeschlossenem Wurzelwachstum sind Stammzellen in der sogenannten „apikalen Papille“ vorhanden [Sonoyama et al., 2008], sie bilden Wurzelpulpa und -dentin, bis diese Stammzellnische mit Abschluss des Wurzelwachstums schließlich verloren geht (Abbildung 5). Somit wurde angenommen, dass durch das Einströmen von Blut aus dem periapikalen Bereich Stammzellen in den Kanal eingeschwemmt werden, die dann zur Regeneration führen [Lovelace et al., 2011]. Ergebnisse aus tierexperimentellen sowie aus klinischen Studien zeigten jedoch in den Folgejahren, dass es meist zur Bildung von ektopischen Geweben im Wurzelkanal kommt, insbesondere von fibrösem Gewebe, Zement oder Knochen [da Silva et al., 2010; Wang et al., 2010].
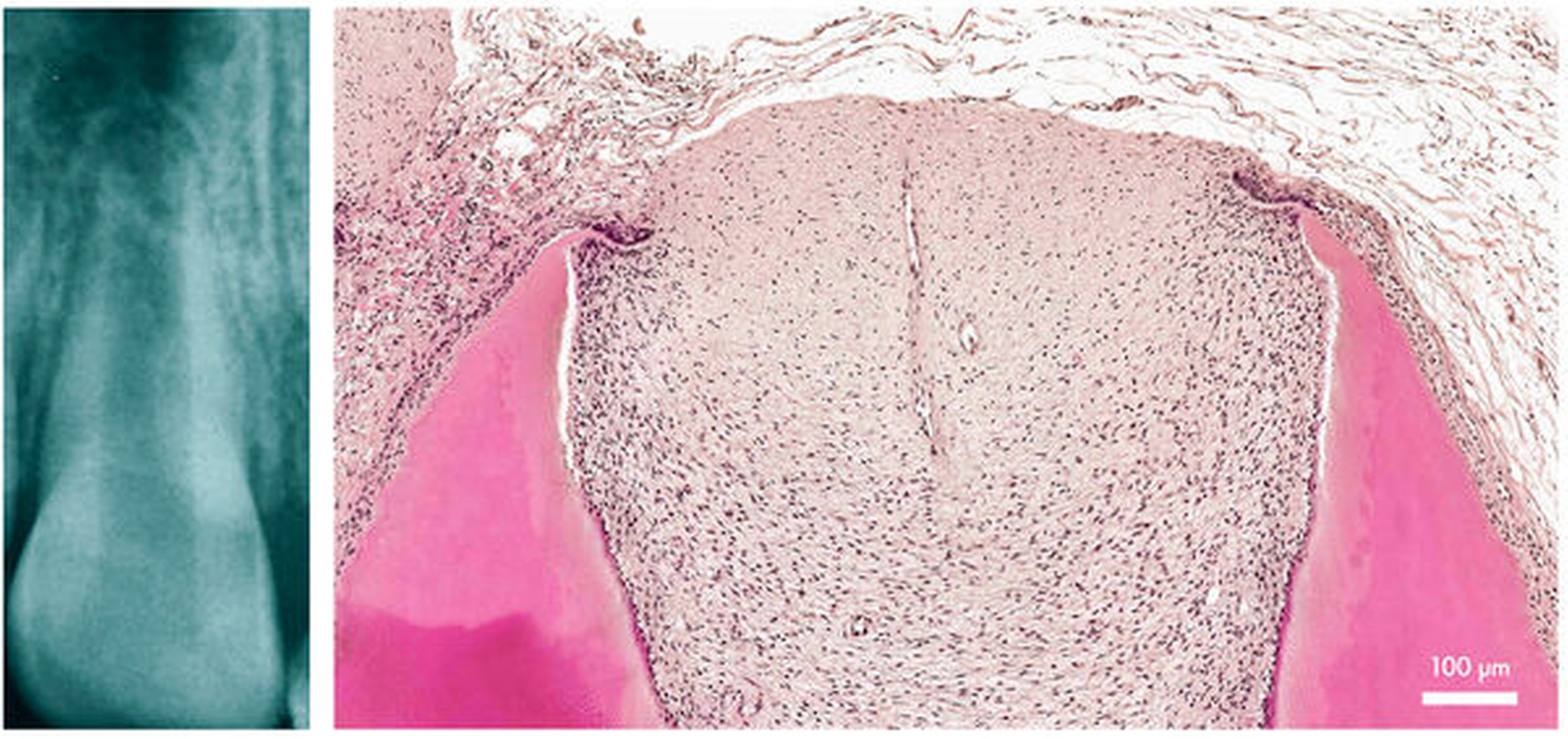
Heute nimmt man an, dass es nur zur echten Regeneration kommen kann, wenn Restpulpagewebe im Wurzelkanal verblieben ist [Saoud et al., 2015; Austah et al., 2018], was bei Anomalien wie dem Dens evaginatus, der häufig in Fallberichten zur Revitalisierung beschrieben war, und sogar bei ausgeprägteren periapikalen Läsionen vorzukommen scheint [Banchs und Trope, 2004]. Nichtsdestotrotz kann die Revitalisierung zur Bildung eines immunkompetenten Gewebes im Wurzelkanal und somit zur „biologischen Wurzelkanalfüllung“ führen, auch ist die Stärkung dünner und frakturanfälliger Wurzelwände durch Anlagerung von Hartgewebe zwar schlecht vorhersagbar, tritt aber deutlich häufiger ein als nach dem apikalen Plug [Torabinejad et al., 2017].
Tissue Engineering der Zahnpulpa
Die Isolation mesenchymaler Stammzellen aus verschiedenen Zahngeweben einschließlich der Zahnpulpa eröffnete Möglichkeiten für die Kultivierung dieser Zellen zum Zweck der Geweberegeneration. Dazu wurde auch auf dem Gebiet der Trägermaterialien intensiv geforscht, um geeignete Trägermaterialien zu entwickeln und um Möglichkeiten zu schaffen, Wachstums- und Differenzierungsfaktoren zu inkorporieren und kontrolliert wieder freizusetzen. Während zunächst in Zahnscheibenmodellen im Tierversuch gearbeitet wurde [Cordeiro et al., 2005], ging man bald darauf zu Dentinzylinder- und Zahnwurzelmodellen über [Galler et al., 2011; Rosa et al., 2013]. In einem häufig genutzten Modell wurde das Lumen von Pulpakammer oder Wurzelkanal mit Trägermaterial und Stammzellen gefüllt und die Konstrukte wurden subkutan am Rücken immundefizienter Mäuse implantiert. Unterschiedliche Studien wiesen die Bildung eines vaskularisierten pulpaähnlichen Gewebes nach, ebenso wie die Neubildung von tubulärem Dentin [Cordeiro et al., 2005; Galler et al., 2011; Rosa et al., 2013; Widbiller et al., 2018]. Weiterführende Untersuchungen zeigten, dass nach Transplantation von Pulpastammzellen in den leeren Wurzelkanal, zum Beispiel bei Hunden, wieder neues Pulpagewebe gebildet wird, das durch Anschluss ans periapikale Gefäßnetzwerk versorgt wird [Iohara et al., 2009; Nakashima und Iohara, 2011].
Das Prinzip der Stammzelltransplantation zur Regeneration der Pulpa ist mittlerweile in aufwendigen klinischen Studien erprobt worden. Eine aktuellere Untersuchung konnte zeigen, dass es nach Entnahme und Expansion pulpaler Stammzellen aus Milcheckzähnen mit nachfolgender autologer Transplantation in bleibende Zähne, die nach Zahntrauma eine Pulpanekrose entwickelt hatten, zum Abschluss des Wurzelwachstums an den behandelten Zähnen kommt [Xuan et al., 2018]. In der Kontrollgruppe wurde ein apikaler Verschluss mit MTA eingebracht, wonach keine Dimensionsänderungen der Wurzelwände beobachtet wurden. Die Zähne wurden klinisch und röntgenologisch mittels DVT engmaschig nachkontrolliert. In einem Fall wurde der behandelte Zahn extrahiert und histologisch untersucht, dabei zeigte sich ein pulpaähnliches Gewebe mit Odontoblastensaum im Wurzelkanal [Xuan et al., 2018]. Während die beschriebenen Studien zur Pulparegeneration fundamentale Beiträge zur Entwicklung regenerativer Konzepte leisten, bleiben solche Ansätze für die Praxis aufgrund des beträchtlichen Aufwands, der Auflagen und der dadurch entstehenden enormen Kosten unrealistisch.
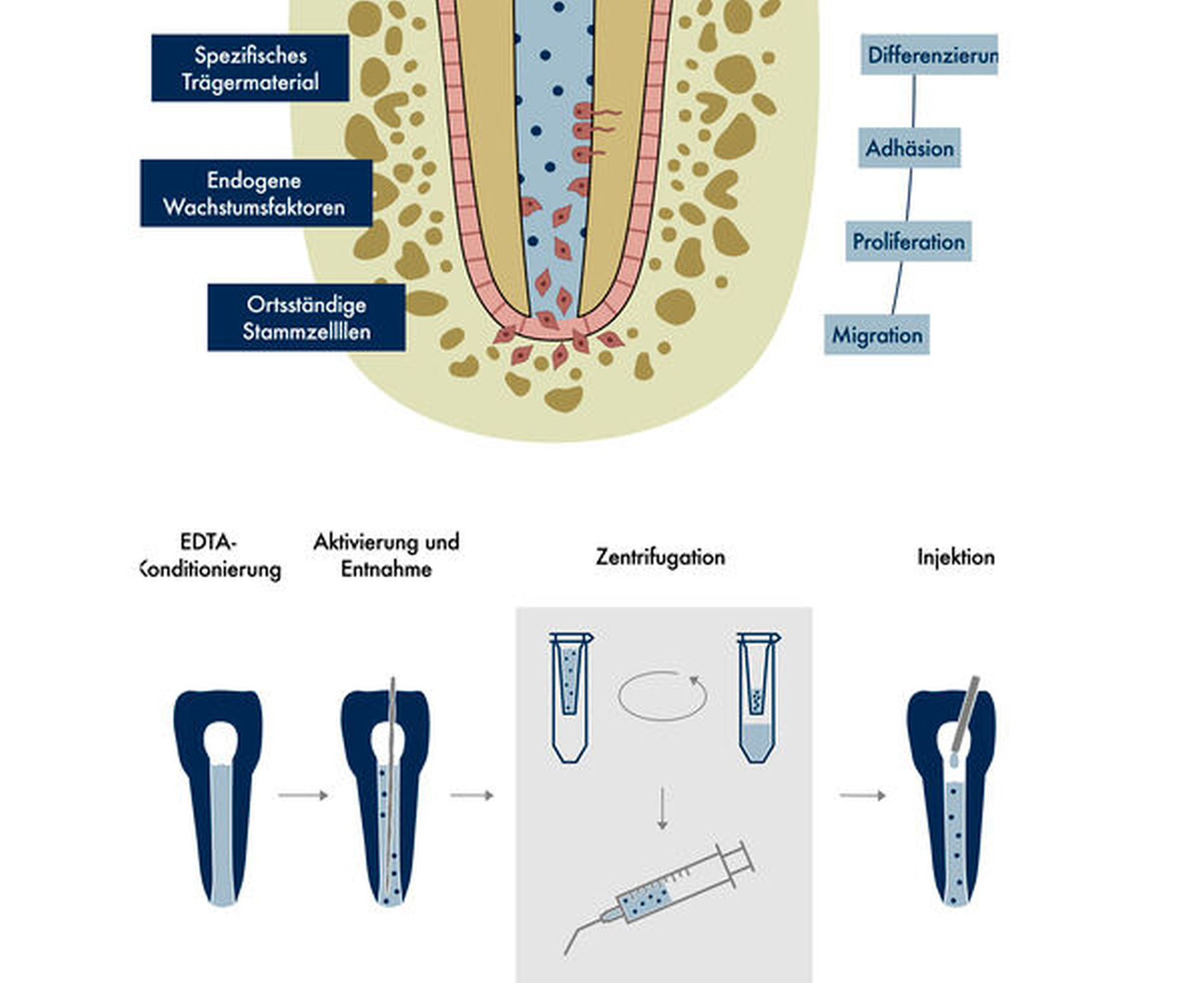
Eine Alternative könnten primär zellfreie Konzepte nach dem Prinzip des Cell Homing bieten. Dabei werden für einen Anwendungsbereich speziell entwickelte und darauf abgestimmte Trägermaterialien eingesetzt, die mit chemotaktischen Faktoren beladen sind, um ortsständige Stammzellen – in diesem Fall aus der periapikalen Region – zur Migration zu bringen und in den Wurzelkanal zu locken (Abbildung 6a). Durch weitere Signalmoleküle wie Wachstums- und Differenzierungsfaktoren können diese Stammzellen proliferieren, differenzieren und neues Gewebe bilden, wobei das Trägermaterial als Stützgerüst abgebaut und durch die extrazelluläre Matrix der Zellen ersetzt wird. Die bioaktiven Faktoren beziehungsweise Proteine können im Falle der Pulparegeneration aus dem Dentin der Wurzelkanalwand gewonnen werden (Abbildung 6b). Durch die Verwendung demineralisierender Lösungen wie EDTA, das routinemäßig auch zur Entfernung der Schmierschicht bei der konventionellen Wurzelkanalbehandlung zum Einsatz kommt, können diese Proteine aus dem Dentin des Wurzelkanals herausgelöst werden, wobei eine unterstützende Aktivierung der Spüllösung mittels Ultraschall deren Menge erhöht [Widbiller et al., 2017]. Nach Entnahme der Spüllösung aus dem Wurzelkanal kann durch Zentrifugation eine mit Wachstumsfaktoren angereicherte Lösung erzeugt werden [Widbiller et al., 2022]. In einer Analyse des organischen Dentinanteils wurden über 800 Proteine nachgewiesen, von denen 54 Signalmoleküle sind [Widbiller et al., 2019]. Untersuchungen in der Zellkultur konnten bestätigen, dass das Proteingemisch aus dem Dentin stark chemotaktisch auf Pulpastammzellen wirkt und deren Differenzierung und Mineralisation induziert [Widbiller et al., 2018]. Ein erster Arbeitsablauf für ein klinisches Vorgehen wurde wie folgt skizziert: Nach der Aufbereitung und Desinfektion des Wurzelkanals wird mehrmals mit EDTA gespült und dieses aktiviert, die Lösung wird aus dem Wurzelkanal entnommen und durch Zentrifugation konzentriert, dann mit einem Trägermaterial vermischt und in den Kanal zurückgegeben (Abbildung 6) [Widbiller et al., 2022].
Ausblick
Im Bereich der Vitalerhaltung ist es vorstellbar, dass sich die Pulpotomie als valide Behandlungsmethode auch bei irreversibler Pulpitis etabliert.
Die Revitalisierung wird als klinische Behandlungsmethode weiter ausgelotet. In Zukunft sollte vermehrt ein Augenmerk darauf gerichtet werden, wie verschiedene Verletzungsmuster nach Zahntrauma, die nicht nur das Endodont, sondern auch das Parodont, die Hertwig’sche Epithelscheide sowie die apikale Papille in unterschiedlicher Ausprägung betreffen, die Heilung nach Revitalisierung beeinflussen, um die Indikationsstellung möglicherweise enger fassen und die Prognose besser bewerten zu können. Fragestellungen, die sich nach abgeschlossener Revitalisierung ergeben, betreffen meist die langfristige Zahnerhaltung sowie die Möglichkeit der kieferorthopädischen Bewegung solcher vorgeschädigten Zähne. Das Prinzip der Revitalisierung wird mittlerweile auf Zähne mit abgeschlossenem Wurzelwachstum ausgeweitet: Untersuchungen zum Erzeugen einer Einblutung in den Wurzelkanal bei erwachsenen Patienten zeigen, dass nach ausreichender Desinfektion die biologische Wurzelkanalfüllung funktionieren kann, wobei Zwei-Jahres-Nachuntersuchungen die Ausheilung periapikaler Läsionen nachweisen [Saoud et al., 2016].
Die in der Forschung bereits fortgeschrittenen Konzepte zum Cell Homing könnten bald in klinischen Pilotstudien zum Einsatz kommen. Somit ist zu erwarten, dass regenerative und reparative Verfahren zur Wiederherstellung oder Ausheilung von Gewebestrukturen in näherer Zukunft vermehrt Eingang ins endodontische Behandlungsspektrum finden werden.
Literaturliste
American Association of Endodontists (AAE). Clinical Considerations for a Regenerative Procedure. [Revised 4/1/2018]https://f3f142zs0k2w1kg84k5p9i1o-wpengine.netdna-ssl.com/specialty/wp-content/uploads/sites/2/2018/06/ConsiderationsForRegEndo_AsOfApril2018.pdf
Austah O, Joon R, Fath WM, Chrepa V, Diogenes A, Ezeldeen M et al. Comprehensive Characterization of 2 Immature Teeth Treated with Regenerative Endodontic Procedures. J Endod. 44: 1802-1811 (2018).
Banchs F, Trope M. Revascularization of immature permanent teeth with apical periodontitis: new treatment protocol? J Endod. 30: 196–200 (2004).
Bakland LK, Andreasen JO. Will mineral trioxide aggregate replace calcium hydroxide in treating pulpal and periodontal healing complications subsequent to dental trauma? A review. Dent Traumatol. 28: 25-32 (2012).
Burns LE, Kim J, Wu Y, Alzwaideh R, McGowan R, Sigurdsson A.Outcomes of primary root canal therapy: An updated systematic review of longitudinal clinical studies published between 2003 and 2020. Int Endod J. 55: 714-731 (2022).
Byers MR, Närhi MV. Dental injury models: experimental tools for understanding neuroinflammatory interactions and polymodal nociceptor functions. Crit Rev Oral Biol Med. 10: 4-39 (1999).
Cao Y, Bogen G, Lim J, Shon WJ, Kang MK. Bioceramic Materials and the Changing Concepts in Vital Pulp Therapy. J Calif Dent Assoc. 44: 278-290 (2016).
Chaniotis A. Treatment Options for Failing Regenerative Endodontic Procedures: Report of 3 Cases. J Endod. 43: 1472-1478 (2017).
Cordeiro MM, Dong Z, Kaneko T, Zhang Z, Miyazawa M, Shi S, et al. Dental pulp tissue engineering with stem cells from exfoliated deciduous teeth. J Endod. 34: 962–9 (2008).
Dammaschke T, Galler K, Krastl G: Aktuelle Empfehlungen zur Vitalerhaltung der Pulpa. Wissenschaftliche Mitteilung der Deutschen Gesellschaft für Endodontologie und zahnärztliche Traumatologie (DGET). Dtsch Zahnärztl Z. 74: 54–63 (2019).
da Silva LA, Nelson-Filho P, da Silva RA, Flores DS, Heilborn C, Johnson JD et al. Revascularization and periapical repair after endodontic treatment using apical negative pressure irrigation versus conventional irrigation plus triantibiotic intracanal dressing in dogs' teeth with apical periodontitis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 109: 779-87 (2010).
Diogenes A, Henry MA, Teixeira FB, Hargreaves KM. An update on clinical regenerative endodontics. Endod Top. 28:2-23 (2013).
Galler KM, D'Souza RN, Federlin M, Cavender AC, Hartgerink JD, Hecker S, et al. Dentin conditioning codetermines cell fate in regenerative endodontics. J Endod. 37: 1536–41 (2011).
Galler KM, Krastl G, Simon S, Van Gorp G, Meschi N, Vahedi B et al. European Society of Endodontology position statement: Revitalization procedures. Int Endod J. 49: 717-23 (2016).
Hahn CL, Liewehr FR. Update on the adaptive immune responses of the dental pulp. J Endod. 33: 773-81 (2007).
Hecova H, Tzigkounakis V, Merglova V, Netolicky J. A retrospective study of 889 injured permanent teeth. Dent Traumatol. 26: 466-475 (2010).
Huang GT, Sonoyama W, Liu Y, Liu H, Wang S, Shi S.The hidden treasure in apical papilla: the potential role in pulp/dentin regeneration and bioroot engineering. J Endod. 34: 645-51 (2008).
Iohara K, Zheng L, Ito M, Ishizaka R, Nakamura H, Into T, et al. Regeneration of dental pulp after pulpotomy by transplantation of CD31(-)/CD146(-) side population cells from a canine tooth. Regen Med. 4:377–85 (2009).
Kim SG, Malek M, Sigurdsson A, Lin LM, Kahler B. Regenerative endodontics: a comprehensive review. Int Endod J. 51: 1367-1388 (2018).
Koutroulis A, Kuehne SA, Cooper PR, Camilleri J. The role of calcium ion release on biocompatibility and antimicrobial properties of hydraulic cements. Sci Rep. 9: 19019 (2019).
Krastl G, Galler K, Dammaschke T, Schäfer E. Ist die Pulpotomie eine valide Behandlungsoption bei irreversibler Pulpitis? . Wissenschaftliche Mitteilung der Deutschen Gesellschaft für Endodontologie und zahnärztliche Traumatologie (DGET). Dtsch Zahnärztl Z. 2: 80-87 (2021).
Lovelace TW, Henry MA, Hargreaves KM, Diogenes A. Evaluation of the delivery of mesenchymal stem cells into the root canal space of necrotic immature teeth after clinical regenerative endodontic procedure. J Endod. 37: 133-8 (2011).
Magloire H, Couble ML, Thivichon-Prince B, Maurin JC, Bleicher F. Odontoblast: a mechano-sensory cell. J Exp Zool B Mol Dev Evol. 5; 312B: 416-24 (2009).
Nakashima M, Iohara K. Regeneration of dental pulp by stem cells. Adv Dent Res. 23: 313–9 (2011).
Ricucci D, Loghin S, Lin LM, Spangberg LS, Tay FR: Is hard tissue formation in the dental pulp after the death of the primary odontoblasts a regenerative or a reparative process? J Dent. 42: 1156–1170 (2014).
Rosa V, Zhang Z, Grande RH, Nör JE. Dental pulp tissue engineering in full-length human root canals. J Dent Res. 92: 970-5 (2013).
Saoud TM, Martin G, Chen Y-HM, Chen K-L, Chen C-A, Songtrakul K, et al. Treatment of mature permanent teeth with necrotic pulps and apical periodontitis using regenerative endodontic procedures: a case series. J Endod. 42: 57–65 (2016).
Saoud TM, Zaazou A, Nabil A, Moussa S, Aly HM, Okazaki K et al. Histological observations of pulpal replacement tissue in immature dog teeth after revascularization of infected pulps. Dent Traumatol 2015; 31: 243-9 (2015).
Schweikl H, Buchalla W, Krifka S. Cell responses to cariogenic microorganisms and dental resin materials-Crosstalk at the dentin-pulp interface? Dent Mater. 33: 514-524 (2017).
Sonoyama W, Liu Y, Yamaza T, Tuan RS, Wang S, Shi S, Huang GT. Characterization of the apical papilla and its residing stem cells from human immature permanent teeth: a pilot study. J Endod. 34:166-71 (2008).
Torabinejad M, Nosrat A, Verma P, Udochukwu O. Regenerative Endodontic Treatment or Mineral Trioxide Aggregate Apical Plug in Teeth with Necrotic Pulps and Open Apices: A Systematic Review and Meta-analysis. J Endod. 43: 1806-1820 (2017).
Wang X, Thibodeau B, Trope M, Lin LM, Huang GT. Histologic characterization of regenerated tissues in canal space after the revitalization/revascularization procedure of immature dog teeth with apical periodontitis. J Endod. 36: 56-63 (2010).
Widbiller M, Driesen RB, Eidt A, Lambrichts I, Hiller K-A, Buchalla W, et al. Cell homing for pulp tissue engineering with endogenous dentin matrix proteins. J Endod. 44: 956–962.e2 (2018).
Widbiller M, Eidt A, Hiller KA, Buchalla W, Schmalz G, Galler KM. Ultrasonic activation of irrigants increases growth factor release from human dentine. Clin Oral Investig. 21: 879-888 (2017).
Widbiller M, Eidt A, Wölflick M, Lindner SR, Schweikl H, Hiller KA, Buchalla W, Galler KM. Interactive effects of LPS and dentine matrix proteins on human dental pulp stem cells. Int Endod J. 51: 877-888 (2018).
Widbiller M, Rosendahl A, Wölflick M, Linnebank M, Welzenbach B, Hiller KA, Buchalla W, Galler KM. Isolation of Endogenous TGF-β1 from Root Canals for Pulp Tissue Engineering: A Translational Study. Biology (Basel). 11: 227 (2021).
Widbiller M, Schweikl H, Bruckmann A, Rosendahl A, Hochmuth E, Lindner SR, Buchalla W, Galler KM. Shotgun Proteomics of Human Dentin with Different Prefractionation Methods.Sci Rep. 9: 4457 (2019).
Xuan K, Li B, Guo H, Sun W, Kou X, He X, et al. Deciduous autologous tooth stem cells regenerate dental pulp after implantation into injured teeth. Sci Transl Med. 10: eaaf3227 (2018).
Umschlossen von Schmelz und Dentin befindet sich im Inneren des Zahnes das Weichgewebe der Zahnpulpa. Dieses besteht aus dem an das Dentin angrenzenden Odontoblastensaum, der von polaren, terminal differenzierten und hochspezialisierten Zellen gebildet wird, des Weiteren aus Fibroblasten, Stammzellen, verschiedenen Zellen des Immunsystems sowie Nervfasern, Blut- und Lymphgefäßen. Während der Zahnentwicklung bilden die Odontoblasten Dentin, wobei Zellfortsätze im Hartgewebe verbleiben, was dem Dentin die tubuläre Struktur verleiht und dieses zu einem vitalen Gewebe macht. Die Dentinbildung gilt als primäre Funktion der Pulpa, das Gewebe erfüllt jedoch weitere wichtige Aufgaben.
Da Schmelz und Dentin durch organische Säuren von in der Mundhöhle vorhandenen Mikroorganismen, die sich im Biofilm organisieren, demineralisiert und zerstört werden können, besitzt die Pulpa etliche Abwehrmechanismen gegen Bakterien. Dabei nehmen die Odontoblasten, ähnlich wie epitheliale Zellen an anderen Stellen des Körpers, eine Barrierefunktion ein. Einerseits sind sie in der Lage, Bestandteile von Bakterien über spezifische Rezeptoren zu erkennen und diese Information an benachbarte Immunzellen wie dendritische Zellen weiterzugeben, andererseits besitzen sie ein Repertoire von Abwehrmechanismen – unter anderem bilden sie antibakterielle Peptide sowie Proteine, die bakterielle Toxine neutralisieren, sowie Stickstoffmonoxid oder andere für Bakterien schädliche Substanzen. Odontoblasten initiieren somit auch die Immunantwort, die sie im weiteren Verlauf sowohl abschwächen als auch verstärken können [Hahn und Liewehr, 2007].
Zudem geht man davon aus, dass Odontoblasten wesentlich an der Schmerzleitung beteiligt sind. Nervfasern verlaufen mit den Odontoblastenfortsätzen in den Dentintubuli, diese wiederum besitzen Querverbindungen, die eine Kommunikation der Zellen untereinander ermöglichen [Magloire et al., 2009]. Die Stimulation afferenter Nervfasern führt zur Ausschüttung von Neuropeptiden und Neurotransmittern, die eine Vasodilatation bedingen und somit aktiv zum Entzündungsgeschehen beitragen [Byers und Närhi, 1999].
Eine weitere wichtige Funktion der Pulpa ist die Ausbildung der Zahnwurzel. Dabei instruieren die Zellen der Hertwig’schen Epithelscheide (HES) die Zellen der apikalen Papille, die zu Odontoblasten differenzieren und Wurzeldentin und -pulpa bilden [Huang et al., 2008]. Erst etwa drei Jahre nach dem Durchbruch eines Zahnes in die Mundhöhle ist das Wurzelwachstum abgeschlossen, dann bilden sich die HES und die apikale Papille zurück. Kommt es innerhalb dieses Zeitfensters zur Pulpanekrose oder zur Schädigung der HES, so arretiert das Wurzelwachstum und es bleibt – je nach Zeitpunkt des Traumas – ein Zahn mit mehr oder weniger dünnen und frakturanfälligen Wurzelwänden zurück, was wesentliche Auswirkungen auf die Langzeitprognose hat.
Vitalerhaltende Maßnahmen
Entsteht eine kariöse Läsion, so folgt frühzeitig eine Entzündungsreaktion in der Pulpa, die mit dem Fortschreiten der Karies an Intensität zunimmt. Bei einer tiefen Dentinkaries mit dünner verbleibender Restdentinstärke sollte die indirekte Überkappung erwogen werden, die einerseits durch die Applikation eines Überkappungsmaterials die Tertiärdentinbildung anregt, andererseits einen direkten Kontakt der in den Dentinadhäsiven enthaltenen toxischen Monomere, der durch Diffusion über die Dentintubuli stattfindet [Schweikl et al., 2017], in Pulpanähe verhindert. Wird die Pulpa im Rahmen der Exkavation im Gesunden eröffnet, kann die direkte Überkappung durchgeführt werden, wobei nach Prüfung des Pulpastatus ein Überkappungsmaterial direkt auf das exponierte Gewebe aufgetragen wird.
Bei Eröffnung der Pulpa im Kariösen sollte als vitalerhaltende Maßnahme die partielle oder die vollständige Pulpotomie durchgeführt werden. Dabei ist nach dem Abtragen vom entzündeten Pulpagewebe auf die Blutstillung zu achten. Als Überkappungsmaterial kann Kalziumhydroxid zum Einsatz kommen, in direktem Kontakt mit der Pulpa bieten hydraulische Kalziumsilikatzemente jedoch höhere Erfolgsquoten [Cao et al., 2016]. Die Vitalerhaltung sollte stets angestrebt werden. Auch nach dentalem Trauma mit Eröffnung der Pulpa ist die Pulpotomie (partiell oder vollständig) eine valide Methode zur Vitalerhaltung, in diesem Fall ist aufgrund der fehlenden Vorschädigung durch einen kariösen Prozess mit einer hohen Erfolgssicherheit von über 95 Prozent nach drei Jahren auszugehen [Hecova et al., 2010]. Derzeit wird die Erweiterung der Indikationsstellung vitalerhaltender Maßnahmen auch auf Zähne mit Anzeichen einer irreversiblen Pulpitis erwogen, dazu sei auf die beiden zuletzt veröffentlichten Wissenschaftlichen Mitteilungen zu vitalerhaltenden Maßnahmen hingewiesen [Dammaschke et al., 2019; Krastl et al., 2021].
Regeneration und Reparatur
Während das „regenerative Potenzial“ der Pulpa gemeinhin als hoch eingeschätzt wird, zeigen histologische Untersuchungen, dass es nach vital-erhaltenden Maßnahmen nicht zu einer Restitutio ad integrum und somit nicht zu einer echten Regeneration, also zur Wiederherstellung der ursprünglichen Architektur und Funktion des Pulpagewebes kommt. Die Odontoblasten gehen durch die Gewebeschädigung verloren und werden meist durch flache, fibroblastenähnliche Zellen ersetzt. Das neu gebildete Hartgewebe weist entweder eine irreguläre tubuläre Struktur auf oder diese fehlt gänzlich – die Struktur erscheint amorph und es sind Zelleinschlüsse zu beobachten [Ricucci et al., 2017]. Somit kommt es nach der therapeutischen Intervention zur Ausheilung durch Reparatur, wobei das ursprüngliche Gewebe durch ein ektopisches ersetzt wird. Bei adäquater Durchführung vitalerhaltender Maßnahmen bleiben die entsprechend behandelten Zähne jedoch in der Regel symptom- und entzündungsfrei.
Revitalisierung
Kommt es aufgrund ausgedehnter kariöser Läsionen oder nach Trauma zur Pulpanekrose des betroffenen Zahnes, so wird die Wurzelkanalbehandlung eingeleitet. Während die Erfolgsquoten wurzelkanalbehandelter Zähne bei der Primärbehandlung über 90 Prozent betragen [Burns et al., 2022], ist im eingangs erläuterten Sonderfall eines Zahnes mit nicht abgeschlossenem Wurzelwachstum die Situation ungünstiger. Aufgrund der dünnen Dentinwände, dem weit offenen Foramen apicale und – je nach Stadium der Wurzelentwicklung – der trichterförmigen Konfiguration des apikalen Wurzeldrittels ist die herkömmliche Wurzelkanalaufbereitung und -obturation nicht möglich. Während über Jahrzehnte mit wechselnden Kalziumhydroxid-Einlagen zur Induktion einer apikalen Hartgewebsbarriere gearbeitet wurde, ist diese Methode heute nicht mehr als das Verfahren der Wahl anzusehen. Durch den alkalischen pH-Wert von Kalziumhydroxid kommt es bei mehrwöchiger Kontaktzeit zur Degradation des Kollagengerüsts im Dentin, was zu einer deutlichen Herabsetzung der mechanischen Festigkeit und zu einer erhöhten Frakturanfälligkeit dieser Zähne führt [Bakland und Andreasen, 2012].
Als valide Behandlungsmethode ist die apikale Barrieretechnik (auch apikaler Verschluss oder apikaler Plug) anzusehen. Dabei wird nach entsprechender Desinfektion ein hydraulischer Kalziumsilikatzement (zum Beispiel Mineral Trioxid Aggregat) über den Wurzelkanal kontrolliert nach apikal transportiert und in direktem Kontakt mit dem apikalen Gewebe platziert. Da hydraulische Kalziumsilikatzemente sehr gut gewebeverträglich sind, im feuchten Milieu aushärten und durch die Freisetzung von Kalziumhydroxid die Hartgewebsbildung induzieren [Koutroulis et al., 2019], sind sie für diese Anwendung besonders gut geeignet. Die apikale Barrieretechnik ist technisch anspruchsvoll, erzielt aber meist zuverlässig die Ausheilung der Gewebe und somit gute Erfolgsquoten [Torabinejad et al., 2019]. Während nach einiger Zeit röntgenologisch ein apikaler Hartgewebsverschluss beobachtet werden kann, bleibt ein weiteres Wurzelwachstum oder eine Stabilisierung der Wurzelwände durch Apposition von Hartgewebe jedoch aus. Somit bleibt die Frakturanfälligkeit des betroffenen Zahnes in Abhängigkeit vom Stadium des Wurzelwachstums zum Zeitpunkt der Pulpanekrose bestehen, was die Langzeitprognose mehr oder weniger deutlich einschränken kann. Insbesondere im Fall jugendlicher Zähne wäre somit eine Regeneration der Pulpa mit nachfolgender Dentinapposition und dem Abschluss des Wurzelwachstums sehr wünschenswert.
Zur Behandlung von Zähnen mit nicht abgeschlossenem Wurzelwachstum und Pulpanekrose ist neben der apikalen Barrieretechnik seit einigen Jahren ein weiteres Verfahren von den endodontologischen Fachgesellschaften empfohlen und detailliert beschrieben: die sogenannte Revitalisierung. Bei dieser Technik wird nach sorgfältiger Desinfektion des Wurzelkanals durch Manipulation der periapikalen Gewebe eine Einblutung in den Wurzelkanal erzeugt. Das so entstehende Blutkoagel dient als Leitschiene für die Neubildung von Gewebe, weswegen sich der Begriff „Revitalisierung“ etabliert hat.
Nomenklatur
Die Revitalisierung geht zurück auf erste Fallberichte, die zu Beginn der 2000er-Jahre publiziert wurden. Dabei wurde nach der erläuterten Vorgehensweise ein Abschluss des Wurzelwachstums bei Zähnen mit zuvor weit offenem Foramen apicale beobachtet. Es folgten weitere Fallberichte, dann Kohortenstudien, schließlich kontrollierte klinische Studien und daraus abgeleitet systematische Übersichtsarbeiten und Metaanalysen. Empfehlungen der European Society of Endodontology (ESE) gibt es seit 2016 [ESE, 2016], von der American Association of Endodontists (AAE) bereits seit 2011, diese wurden aber inzwischen mehrfach überarbeitet [AAE, 2021]. Die Nomenklatur zu diesem Vorgehen ist jedoch uneinheitlich. In den ersten Fallberichten und Fallserien wurde der Begriff der „Revaskularisation“ verwendet. Dieser stammte aus der dentalen Traumatologie und bezog sich auf avulsierte und replantierte Zähne mit weit offenem Foramen apicale, bei denen eine spontane Neubildung von Gewebe im Wurzelkanal beobachtet wurde. Dies wurde in entsprechenden Tierstudien in den 1970er-Jahren bestätigt, wobei die Blutgefäßneubildung histologisch nachgewiesen wurde – daher „Revaskularisation“. Diese Gewebseinsprossung in den Wurzelkanal funktioniert aber nur unzuverlässig und nicht vorhersagbar. Nachdem das neu gebildete Gewebe im Wurzelkanal nicht ausschließlich aus Blutgefäßen besteht, wurde der Begriff verlassen zugunsten der „Regenerative Endodontic Procedures (REP)“. Dies ist darauf zurückzuführen, dass zunächst davon ausgegangen wurde, dass nach dem Erzeugen der Einblutung tatsächlich eine echte Regeneration der Pulpa induziert werden könnte, was man daraus ableitete, dass in den anfangs veröffentlichten Fallberichten ein Abschluss des Wurzelwachstums beobachtet wurde. Dies wurde durch molekularbiologische Untersuchungen gestützt, in denen Oberflächenmarker mesenchymaler Stammzellen im intrakanalären Blut im Vergleich zu Blut aus der Armvene um ein Vielfaches erhöht waren [Lovelace et al., 2011].
Tierexperimentelle Studien und publizierte Fallberichte, in denen Zähne infolge von Misserfolg nach Revitalisierung extrahiert und histologisch untersucht werden konnten, zeigten jedoch, dass das neu gebildete Gewebe ektopischer Natur ist [da Silva et al., 2010; Wang et al., 2010] – was zunächst zu Ernüchterung über die Möglichkeiten dieser neuen Behandlungsmethode führte. Bald jedoch wurde die Erwartungshaltung adjustiert, wie im Folgenden ausgeführt wird.
Indikationsstellung und klinisches Vorgehen
Die folgenden Empfehlungen sind weitgehend und sofern nicht anderweitig gekennzeichnet der Stellungnahme der ESE entnommen [ESE, 2016]. Die Indikation zur Revitalisierung kann bei Zähnen mit nicht abgeschlossenem Wurzelwachstum und Pulpanekrose gestellt werden. Diese Konstellation tritt insgesamt selten ein, wird meist infolge eines dentalen Traumas beobachtet und betrifft somit überwiegend die Frontzähne des Oberkiefers. Eine bereits bestehende periapikale Läsion oder Fistelung stellt kein Ausschlusskriterium dar. Somit weisen der apikale Verschluss und die Revitalisierung dieselbe Indikationsstellung auf. Patienten können umso mehr von der Revitalisierung profitieren, je weniger weit fortgeschritten das Wurzelwachstum ist. Bei guter Compliance der Patienten sollte der Revitalisierung bei den Stadien I – III der Wurzelentwicklung nach Cvek (Abbildung 2) der Vorzug gegeben werden, beim Stadium IV sind Revitalisierung und apikaler Verschluss als gleichwertig anzusehen [Kim et al., 2018].

Das klinische Vorgehen zur Revitalisierung nach dem Protokoll der ESE beinhaltet nach umfassender Diagnostik in der ersten Sitzung die Eröffnung des Zahnes unter Kofferdam, gefolgt von sorgfältiger Desinfektion durch Spülung mit Natriumhypochlorit (NaOCl) in niedriger Konzentration von ein bis drei Prozent. Eine mechanische Bearbeitung der Kanalwand sollte möglichst vermieden werden, um eine Schwächung dünner Wurzelwände zu vermeiden. Für die medikamentöse Einlage sollte ein nicht-zahnverfärbendes Kalziumhydroxid-Präparat verwendet werden. In der zweiten Sitzung sollten der Zahn beschwerde- und symptomfrei und ein eventuell bestehender Fistelgang geschlossen sein, andernfalls wird die antibakterielle Therapie mittels Natriumhypochlorit und medikamentöser Einlage fortgeführt. Nach Anästhesie, optimalerweise ohne Vasokonstriktor, wird der Zahn unter Kofferdam wieder eröffnet und mit 17-prozentiger EDTA-Lösung gespült, wobei überschüssige Flüssigkeit nachfolgend mittels Papierspitzen entfernt wird. Anschließend wird durch Überinstrumentieren mit einer Handfeile, die in einer rotierenden oder pickenden Bewegung eingesetzt werden kann, eine Einblutung in den Kanal erzeugt (Abbildung 3). Das Blutkoagulum kann mit einem Kollagenpräparat abgedeckt werden, das als Widerlager dient, um in der Folge das Einbringen eines hydraulischen Kalziumsilikatzements zu erleichtern. Der Zahn sollte abschließend adhäsiv und bakteriendicht verschlossen werden (Abbildung 4). Röntgenaufnahmen sollten prä- sowie postoperativ angefertigt werden, in der Nachuntersuchung nach drei, sechs, zwölf, 18 und 24 Monaten. Die erfolgreiche Behandlung ist erkennbar am Abklingen beziehungsweise Ausbleiben von Beschwerden und Entzündungszeichen, periapikale Läsionen sollten ausheilen. Wünschenswert ist eine positive Reaktion auf die Sensibilitätsprobe, die nach Revitalisierung in etwa 55 Prozent der Fälle festzustellen ist [Diogenes et al., 2013]. Eine Zunahme der Wurzellänge und -dicke ist in etwa zwei Dritteln der Fälle zu beobachten, jedoch nicht vorhersagbar [Torabinejad et al., 2017]. Ein Ausbleiben der weiteren Mineralisation ist dabei nicht als Misserfolg zu werten.


Die Entscheidung, ob mittels apikalem Verschluss oder Revitalisierung vorgegangen werden soll, ist individuell zu treffen, wobei die Compliance des Patienten, das Stadium der Wurzelentwicklung und die Erfahrung des Behandlers zu berücksichtigen sind. Während die Revitalisierung technisch einfacher durchführbar ist als der apikale Verschluss, so ist das Erzeugen der Einblutung trotz Anästhesie gelegentlich schmerzhaft. Daher sollte in der ersten Sitzung die Kooperationsfähigkeit des jungen Patienten abgeschätzt werden. Ein Vorteil der Revitalisierung liegt darin, dass aufgrund der geringen Manipulation der Gewebe bei Misserfolg eine Wiederholung der Behandlung ebenso möglich ist wie der anschließende apikale Verschluss [Chaniotis, 2017].
Ergebnisse nach Revitalisierung
Die Ergebnisse der ersten Fallberichte zur Revitalisierung mündeten in der Erwartung, mit diesem Verfahren eine echte Pulparegeneration zu erzeugen. Bei Zähnen mit nicht abgeschlossenem Wurzelwachstum sind Stammzellen in der sogenannten „apikalen Papille“ vorhanden [Sonoyama et al., 2008], sie bilden Wurzelpulpa und -dentin, bis diese Stammzellnische mit Abschluss des Wurzelwachstums schließlich verloren geht (Abbildung 5). Somit wurde angenommen, dass durch das Einströmen von Blut aus dem periapikalen Bereich Stammzellen in den Kanal eingeschwemmt werden, die dann zur Regeneration führen [Lovelace et al., 2011]. Ergebnisse aus tierexperimentellen sowie aus klinischen Studien zeigten jedoch in den Folgejahren, dass es meist zur Bildung von ektopischen Geweben im Wurzelkanal kommt, insbesondere von fibrösem Gewebe, Zement oder Knochen [da Silva et al., 2010; Wang et al., 2010].

Heute nimmt man an, dass es nur zur echten Regeneration kommen kann, wenn Restpulpagewebe im Wurzelkanal verblieben ist [Saoud et al., 2015; Austah et al., 2018], was bei Anomalien wie dem Dens evaginatus, der häufig in Fallberichten zur Revitalisierung beschrieben war, und sogar bei ausgeprägteren periapikalen Läsionen vorzukommen scheint [Banchs und Trope, 2004]. Nichtsdestotrotz kann die Revitalisierung zur Bildung eines immunkompetenten Gewebes im Wurzelkanal und somit zur „biologischen Wurzelkanalfüllung“ führen, auch ist die Stärkung dünner und frakturanfälliger Wurzelwände durch Anlagerung von Hartgewebe zwar schlecht vorhersagbar, tritt aber deutlich häufiger ein als nach dem apikalen Plug [Torabinejad et al., 2017].
Tissue Engineering der Zahnpulpa
Die Isolation mesenchymaler Stammzellen aus verschiedenen Zahngeweben einschließlich der Zahnpulpa eröffnete Möglichkeiten für die Kultivierung dieser Zellen zum Zweck der Geweberegeneration. Dazu wurde auch auf dem Gebiet der Trägermaterialien intensiv geforscht, um geeignete Trägermaterialien zu entwickeln und um Möglichkeiten zu schaffen, Wachstums- und Differenzierungsfaktoren zu inkorporieren und kontrolliert wieder freizusetzen. Während zunächst in Zahnscheibenmodellen im Tierversuch gearbeitet wurde [Cordeiro et al., 2005], ging man bald darauf zu Dentinzylinder- und Zahnwurzelmodellen über [Galler et al., 2011; Rosa et al., 2013]. In einem häufig genutzten Modell wurde das Lumen von Pulpakammer oder Wurzelkanal mit Trägermaterial und Stammzellen gefüllt und die Konstrukte wurden subkutan am Rücken immundefizienter Mäuse implantiert. Unterschiedliche Studien wiesen die Bildung eines vaskularisierten pulpaähnlichen Gewebes nach, ebenso wie die Neubildung von tubulärem Dentin [Cordeiro et al., 2005; Galler et al., 2011; Rosa et al., 2013; Widbiller et al., 2018]. Weiterführende Untersuchungen zeigten, dass nach Transplantation von Pulpastammzellen in den leeren Wurzelkanal, zum Beispiel bei Hunden, wieder neues Pulpagewebe gebildet wird, das durch Anschluss ans periapikale Gefäßnetzwerk versorgt wird [Iohara et al., 2009; Nakashima und Iohara, 2011].
Das Prinzip der Stammzelltransplantation zur Regeneration der Pulpa ist mittlerweile in aufwendigen klinischen Studien erprobt worden. Eine aktuellere Untersuchung konnte zeigen, dass es nach Entnahme und Expansion pulpaler Stammzellen aus Milcheckzähnen mit nachfolgender autologer Transplantation in bleibende Zähne, die nach Zahntrauma eine Pulpanekrose entwickelt hatten, zum Abschluss des Wurzelwachstums an den behandelten Zähnen kommt [Xuan et al., 2018]. In der Kontrollgruppe wurde ein apikaler Verschluss mit MTA eingebracht, wonach keine Dimensionsänderungen der Wurzelwände beobachtet wurden. Die Zähne wurden klinisch und röntgenologisch mittels DVT engmaschig nachkontrolliert. In einem Fall wurde der behandelte Zahn extrahiert und histologisch untersucht, dabei zeigte sich ein pulpaähnliches Gewebe mit Odontoblastensaum im Wurzelkanal [Xuan et al., 2018]. Während die beschriebenen Studien zur Pulparegeneration fundamentale Beiträge zur Entwicklung regenerativer Konzepte leisten, bleiben solche Ansätze für die Praxis aufgrund des beträchtlichen Aufwands, der Auflagen und der dadurch entstehenden enormen Kosten unrealistisch.
Eine Alternative könnten primär zellfreie Konzepte nach dem Prinzip des Cell Homing bieten. Dabei werden für einen Anwendungsbereich speziell entwickelte und darauf abgestimmte Trägermaterialien eingesetzt, die mit chemotaktischen Faktoren beladen sind, um ortsständige Stammzellen – in diesem Fall aus der periapikalen Region – zur Migration zu bringen und in den Wurzelkanal zu locken (Abbildung 6a). Durch weitere Signalmoleküle wie Wachstums- und Differenzierungsfaktoren können diese Stammzellen proliferieren, differenzieren und neues Gewebe bilden, wobei das Trägermaterial als Stützgerüst abgebaut und durch die extrazelluläre Matrix der Zellen ersetzt wird. Die bioaktiven Faktoren beziehungsweise Proteine können im Falle der Pulparegeneration aus dem Dentin der Wurzelkanalwand gewonnen werden (Abbildung 6b). Durch die Verwendung demineralisierender Lösungen wie EDTA, das routinemäßig auch zur Entfernung der Schmierschicht bei der konventionellen Wurzelkanalbehandlung zum Einsatz kommt, können diese Proteine aus dem Dentin des Wurzelkanals herausgelöst werden, wobei eine unterstützende Aktivierung der Spüllösung mittels Ultraschall deren Menge erhöht [Widbiller et al., 2017]. Nach Entnahme der Spüllösung aus dem Wurzelkanal kann durch Zentrifugation eine mit Wachstumsfaktoren angereicherte Lösung erzeugt werden [Widbiller et al., 2022]. In einer Analyse des organischen Dentinanteils wurden über 800 Proteine nachgewiesen, von denen 54 Signalmoleküle sind [Widbiller et al., 2019]. Untersuchungen in der Zellkultur konnten bestätigen, dass das Proteingemisch aus dem Dentin stark chemotaktisch auf Pulpastammzellen wirkt und deren Differenzierung und Mineralisation induziert [Widbiller et al., 2018]. Ein erster Arbeitsablauf für ein klinisches Vorgehen wurde wie folgt skizziert: Nach der Aufbereitung und Desinfektion des Wurzelkanals wird mehrmals mit EDTA gespült und dieses aktiviert, die Lösung wird aus dem Wurzelkanal entnommen und durch Zentrifugation konzentriert, dann mit einem Trägermaterial vermischt und in den Kanal zurückgegeben (Abbildung 6) [Widbiller et al., 2022].

Ausblick
Im Bereich der Vitalerhaltung ist es vorstellbar, dass sich die Pulpotomie als valide Behandlungsmethode auch bei irreversibler Pulpitis etabliert.
Die Revitalisierung wird als klinische Behandlungsmethode weiter ausgelotet. In Zukunft sollte vermehrt ein Augenmerk darauf gerichtet werden, wie verschiedene Verletzungsmuster nach Zahntrauma, die nicht nur das Endodont, sondern auch das Parodont, die Hertwig’sche Epithelscheide sowie die apikale Papille in unterschiedlicher Ausprägung betreffen, die Heilung nach Revitalisierung beeinflussen, um die Indikationsstellung möglicherweise enger fassen und die Prognose besser bewerten zu können. Fragestellungen, die sich nach abgeschlossener Revitalisierung ergeben, betreffen meist die langfristige Zahnerhaltung sowie die Möglichkeit der kieferorthopädischen Bewegung solcher vorgeschädigten Zähne. Das Prinzip der Revitalisierung wird mittlerweile auf Zähne mit abgeschlossenem Wurzelwachstum ausgeweitet: Untersuchungen zum Erzeugen einer Einblutung in den Wurzelkanal bei erwachsenen Patienten zeigen, dass nach ausreichender Desinfektion die biologische Wurzelkanalfüllung funktionieren kann, wobei Zwei-Jahres-Nachuntersuchungen die Ausheilung periapikaler Läsionen nachweisen [Saoud et al., 2016].
Die in der Forschung bereits fortgeschrittenen Konzepte zum Cell Homing könnten bald in klinischen Pilotstudien zum Einsatz kommen. Somit ist zu erwarten, dass regenerative und reparative Verfahren zur Wiederherstellung oder Ausheilung von Gewebestrukturen in näherer Zukunft vermehrt Eingang ins endodontische Behandlungsspektrum finden werden.
Literaturliste
American Association of Endodontists (AAE). Clinical Considerations for a Regenerative Procedure. [Revised 4/1/2018]https://f3f142zs0k2w1kg84k5p9i1o-wpengine.netdna-ssl.com/specialty/wp-content/uploads/sites/2/2018/06/ConsiderationsForRegEndo_AsOfApril2018.pdf
Austah O, Joon R, Fath WM, Chrepa V, Diogenes A, Ezeldeen M et al. Comprehensive Characterization of 2 Immature Teeth Treated with Regenerative Endodontic Procedures. J Endod. 44: 1802-1811 (2018).
Banchs F, Trope M. Revascularization of immature permanent teeth with apical periodontitis: new treatment protocol? J Endod. 30: 196–200 (2004).
Bakland LK, Andreasen JO. Will mineral trioxide aggregate replace calcium hydroxide in treating pulpal and periodontal healing complications subsequent to dental trauma? A review. Dent Traumatol. 28: 25-32 (2012).
Burns LE, Kim J, Wu Y, Alzwaideh R, McGowan R, Sigurdsson A.Outcomes of primary root canal therapy: An updated systematic review of longitudinal clinical studies published between 2003 and 2020. Int Endod J. 55: 714-731 (2022).
Byers MR, Närhi MV. Dental injury models: experimental tools for understanding neuroinflammatory interactions and polymodal nociceptor functions. Crit Rev Oral Biol Med. 10: 4-39 (1999).
Cao Y, Bogen G, Lim J, Shon WJ, Kang MK. Bioceramic Materials and the Changing Concepts in Vital Pulp Therapy. J Calif Dent Assoc. 44: 278-290 (2016).
Chaniotis A. Treatment Options for Failing Regenerative Endodontic Procedures: Report of 3 Cases. J Endod. 43: 1472-1478 (2017).
Cordeiro MM, Dong Z, Kaneko T, Zhang Z, Miyazawa M, Shi S, et al. Dental pulp tissue engineering with stem cells from exfoliated deciduous teeth. J Endod. 34: 962–9 (2008).
Dammaschke T, Galler K, Krastl G: Aktuelle Empfehlungen zur Vitalerhaltung der Pulpa. Wissenschaftliche Mitteilung der Deutschen Gesellschaft für Endodontologie und zahnärztliche Traumatologie (DGET). Dtsch Zahnärztl Z. 74: 54–63 (2019).
da Silva LA, Nelson-Filho P, da Silva RA, Flores DS, Heilborn C, Johnson JD et al. Revascularization and periapical repair after endodontic treatment using apical negative pressure irrigation versus conventional irrigation plus triantibiotic intracanal dressing in dogs' teeth with apical periodontitis. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 109: 779-87 (2010).
Diogenes A, Henry MA, Teixeira FB, Hargreaves KM. An update on clinical regenerative endodontics. Endod Top. 28:2-23 (2013).
Galler KM, D'Souza RN, Federlin M, Cavender AC, Hartgerink JD, Hecker S, et al. Dentin conditioning codetermines cell fate in regenerative endodontics. J Endod. 37: 1536–41 (2011).
Galler KM, Krastl G, Simon S, Van Gorp G, Meschi N, Vahedi B et al. European Society of Endodontology position statement: Revitalization procedures. Int Endod J. 49: 717-23 (2016).
Hahn CL, Liewehr FR. Update on the adaptive immune responses of the dental pulp. J Endod. 33: 773-81 (2007).
Hecova H, Tzigkounakis V, Merglova V, Netolicky J. A retrospective study of 889 injured permanent teeth. Dent Traumatol. 26: 466-475 (2010).
Huang GT, Sonoyama W, Liu Y, Liu H, Wang S, Shi S.The hidden treasure in apical papilla: the potential role in pulp/dentin regeneration and bioroot engineering. J Endod. 34: 645-51 (2008).
Iohara K, Zheng L, Ito M, Ishizaka R, Nakamura H, Into T, et al. Regeneration of dental pulp after pulpotomy by transplantation of CD31(-)/CD146(-) side population cells from a canine tooth. Regen Med. 4:377–85 (2009).
Kim SG, Malek M, Sigurdsson A, Lin LM, Kahler B. Regenerative endodontics: a comprehensive review. Int Endod J. 51: 1367-1388 (2018).
Koutroulis A, Kuehne SA, Cooper PR, Camilleri J. The role of calcium ion release on biocompatibility and antimicrobial properties of hydraulic cements. Sci Rep. 9: 19019 (2019).
Krastl G, Galler K, Dammaschke T, Schäfer E. Ist die Pulpotomie eine valide Behandlungsoption bei irreversibler Pulpitis? . Wissenschaftliche Mitteilung der Deutschen Gesellschaft für Endodontologie und zahnärztliche Traumatologie (DGET). Dtsch Zahnärztl Z. 2: 80-87 (2021).
Lovelace TW, Henry MA, Hargreaves KM, Diogenes A. Evaluation of the delivery of mesenchymal stem cells into the root canal space of necrotic immature teeth after clinical regenerative endodontic procedure. J Endod. 37: 133-8 (2011).
Magloire H, Couble ML, Thivichon-Prince B, Maurin JC, Bleicher F. Odontoblast: a mechano-sensory cell. J Exp Zool B Mol Dev Evol. 5; 312B: 416-24 (2009).
Nakashima M, Iohara K. Regeneration of dental pulp by stem cells. Adv Dent Res. 23: 313–9 (2011).
Ricucci D, Loghin S, Lin LM, Spangberg LS, Tay FR: Is hard tissue formation in the dental pulp after the death of the primary odontoblasts a regenerative or a reparative process? J Dent. 42: 1156–1170 (2014).
Rosa V, Zhang Z, Grande RH, Nör JE. Dental pulp tissue engineering in full-length human root canals. J Dent Res. 92: 970-5 (2013).
Saoud TM, Martin G, Chen Y-HM, Chen K-L, Chen C-A, Songtrakul K, et al. Treatment of mature permanent teeth with necrotic pulps and apical periodontitis using regenerative endodontic procedures: a case series. J Endod. 42: 57–65 (2016).
Saoud TM, Zaazou A, Nabil A, Moussa S, Aly HM, Okazaki K et al. Histological observations of pulpal replacement tissue in immature dog teeth after revascularization of infected pulps. Dent Traumatol 2015; 31: 243-9 (2015).
Schweikl H, Buchalla W, Krifka S. Cell responses to cariogenic microorganisms and dental resin materials-Crosstalk at the dentin-pulp interface? Dent Mater. 33: 514-524 (2017).
Sonoyama W, Liu Y, Yamaza T, Tuan RS, Wang S, Shi S, Huang GT. Characterization of the apical papilla and its residing stem cells from human immature permanent teeth: a pilot study. J Endod. 34:166-71 (2008).
Torabinejad M, Nosrat A, Verma P, Udochukwu O. Regenerative Endodontic Treatment or Mineral Trioxide Aggregate Apical Plug in Teeth with Necrotic Pulps and Open Apices: A Systematic Review and Meta-analysis. J Endod. 43: 1806-1820 (2017).
Wang X, Thibodeau B, Trope M, Lin LM, Huang GT. Histologic characterization of regenerated tissues in canal space after the revitalization/revascularization procedure of immature dog teeth with apical periodontitis. J Endod. 36: 56-63 (2010).
Widbiller M, Driesen RB, Eidt A, Lambrichts I, Hiller K-A, Buchalla W, et al. Cell homing for pulp tissue engineering with endogenous dentin matrix proteins. J Endod. 44: 956–962.e2 (2018).
Widbiller M, Eidt A, Hiller KA, Buchalla W, Schmalz G, Galler KM. Ultrasonic activation of irrigants increases growth factor release from human dentine. Clin Oral Investig. 21: 879-888 (2017).
Widbiller M, Eidt A, Wölflick M, Lindner SR, Schweikl H, Hiller KA, Buchalla W, Galler KM. Interactive effects of LPS and dentine matrix proteins on human dental pulp stem cells. Int Endod J. 51: 877-888 (2018).
Widbiller M, Rosendahl A, Wölflick M, Linnebank M, Welzenbach B, Hiller KA, Buchalla W, Galler KM. Isolation of Endogenous TGF-β1 from Root Canals for Pulp Tissue Engineering: A Translational Study. Biology (Basel). 11: 227 (2021).
Widbiller M, Schweikl H, Bruckmann A, Rosendahl A, Hochmuth E, Lindner SR, Buchalla W, Galler KM. Shotgun Proteomics of Human Dentin with Different Prefractionation Methods.Sci Rep. 9: 4457 (2019).
Xuan K, Li B, Guo H, Sun W, Kou X, He X, et al. Deciduous autologous tooth stem cells regenerate dental pulp after implantation into injured teeth. Sci Transl Med. 10: eaaf3227 (2018).





