Parodontale Regeneration
Hauptziel der parodontalen Therapie ist es, die durch einen parodontal-pathogenen Biofilm verursachte Infektion zu behandeln, die Entzündung zu beseitigen und weitere Attachment- und Knochenverluste zu stoppen oder zu verlangsamen, um letztendlich Zahnverlust zu verhindern. Eine erfolgreiche Behandlung zeigt sich klinisch durch eine Verringerung der Taschensondierungstiefen und eine Abnahme der Sondierungsblutung sowie die Wiederherstellung von Verhältnissen, die wirksame Mundhygienemaßnahmen ermöglichen. Diese klinischen Verbesserungen sollten idealerweise mit einem klinischen Attachmentgewinn und einer röntgenologischen Knochenauffüllung einhergehen [Sanz et al., 2020].
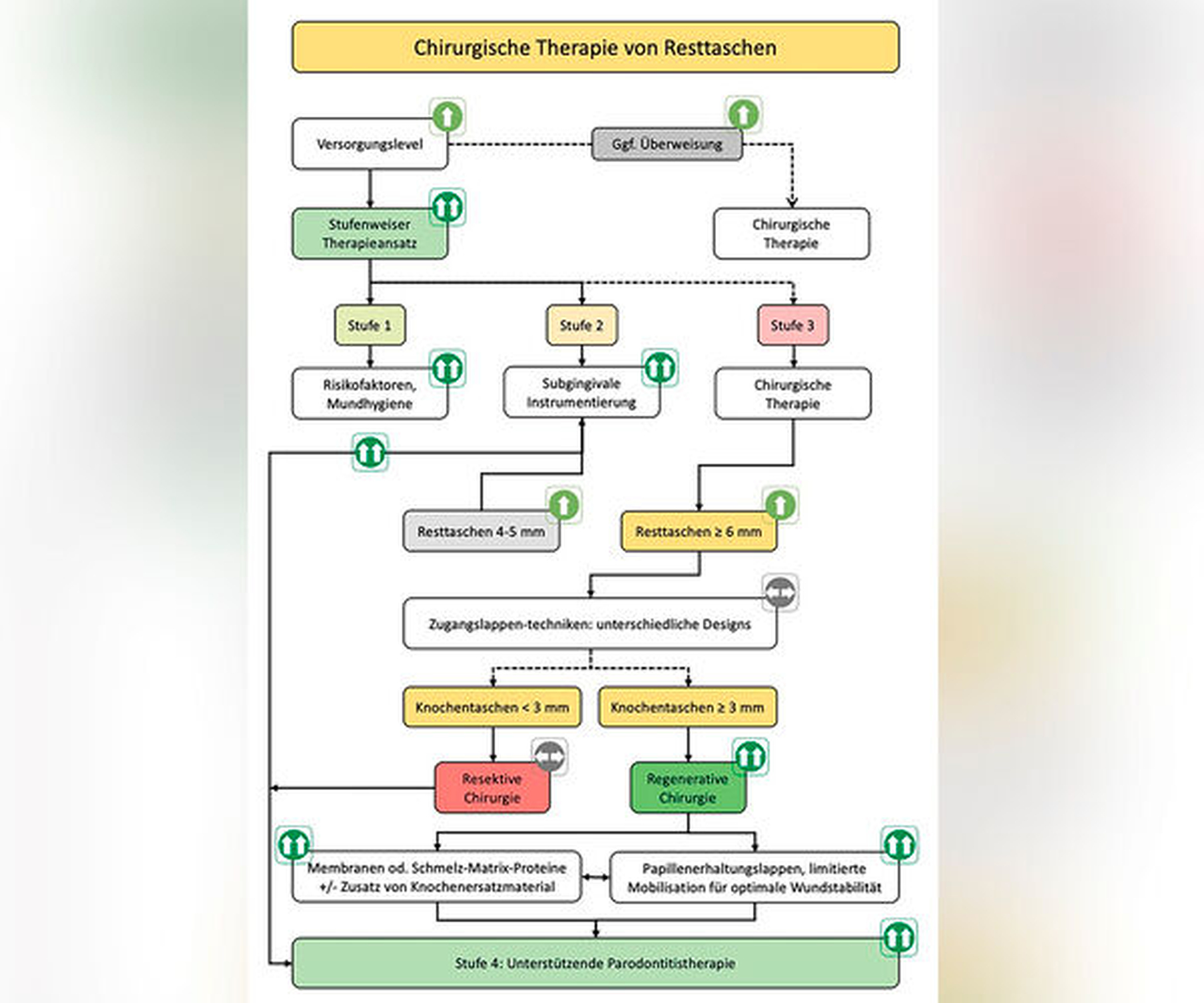
Auch wenn die konventionelle Parodontaltherapie – bestehend aus subgingivaler Instrumentierung und gegebenenfalls chirurgischem Zugang, einschließlich verschiedener Arten von Zugangslappenoperationen oder geweberesektiven Techniken – in der Regel zu deutlichen klinischen Verbesserungen führt, können entweder Resttaschen bestehen bleiben oder aber die Heilung ist mit signifikanten Attachmentverlusten und deutlichen Weichteilrezessionen verbunden. Es hat sich gezeigt, dass tiefe Restsondierungstiefen bei behandelten Patienten das Risiko für das Fortschreiten der Parodontitis deutlich erhöhen [Matuliene et al., 2008]. Darüber hinaus sind tiefe Resttaschen bei vertikalen Defekten oder Furkationsbeteiligungen der Grade II und III mit einem erhöhten Risiko für Zahnverlust assoziiert [Helal et al., 2019; Nibali et al., 2016]. Folglich ist eines der klinisch wichtigsten Ziele der Parodontaltherapie die Reduzierung oder vollständige Beseitigung von tiefen Taschen (≥ 6 mm) bei Vertikaldefekten und die Reduzierung oder vollständige Beseitigung von Furkationsdefekten.
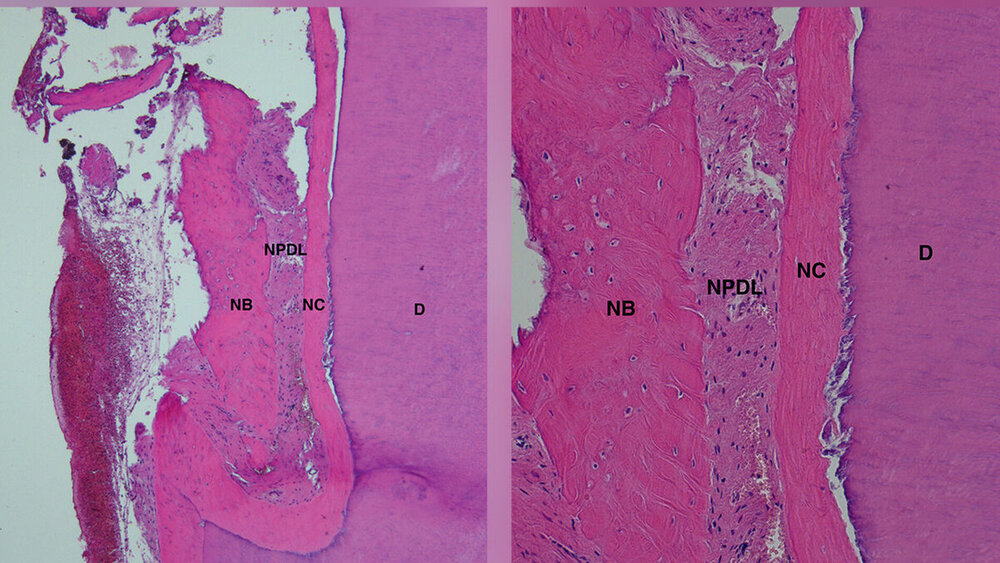
Idealerweise sollte diese Behandlung nicht nur zu klinischen Verbesserungen führen, sondern auch zu einem Defektverschluss durch parodontale Regeneration. Diese ist definiert als die Neubildung von Wurzelzement, Desmodont und Alveolarknochen an einer zuvor Plaque-exponierten Wurzeloberfläche in einer parodontalen Läsion (Abbildung 1).
Im Unterschied dazu verläuft die parodontale Wundheilung nach konventioneller Therapie (subgingivale Instrumentierung oder Zugangslappenoperation) im Sinne einer Reparation mit der Ausbildung eines langen Saumepithels an der Wurzeloberfläche. Dies kann durchaus auch mit einer Knochenapposition einhergehen, allerdings ist der Zahn nicht funktionell über im Wurzelzement inserierende Fasern an diesem Knochen befestigt. Der ultimative Nachweis einer parodontalen Regeneration kann nur histologisch über eine Blockbiopsie erbracht werden [Machtei et al., 1997]. Exemplarische Humanhistologien liegen für unterschiedliche regenerative Techniken/Biomaterialien insbesondere für vertikale Defekte und in kleiner Anzahl auch für Furkationsdefekte vor [Sculean et al., 2015; Laugisch et al., 2019].
Aus diesen Gründen wird in der aktuellen S3-Leitlinie zur PAR-Therapie der Stadien I – III in bestimmten Situationen im Rahmen der chirurgischen Phase der Therapie (Stufe 3) ausdrücklich die Anwendung regenerativer Therapieverfahren empfohlen [Sanz et al., 2020; AWMF]. Die Begründung für die Integration regenerativer/rekonstruktiver Protokolle ins Gesamtbehandlungskonzept wird durch Erkenntnisse aus einer Vielzahl von randomisierten, kontrollierten klinischen Studien (RCTs) gestützt, die im Vergleich zu herkömmlichen Behandlungen, wie zum Beispiel der Zugangslappenoperation, im Allgemeinen größere klinische Verbesserungen nach solchen Ansätzen zeigten [Nibali et al., 2020; Jepsen et al., 2020]. Auch kann die regenerative Parodontalchirurgie im Vergleich zu herkömmlichen oder taschenresektiven chirurgischen Maßnahmen überlegene ästhetische Ergebnisse bieten.
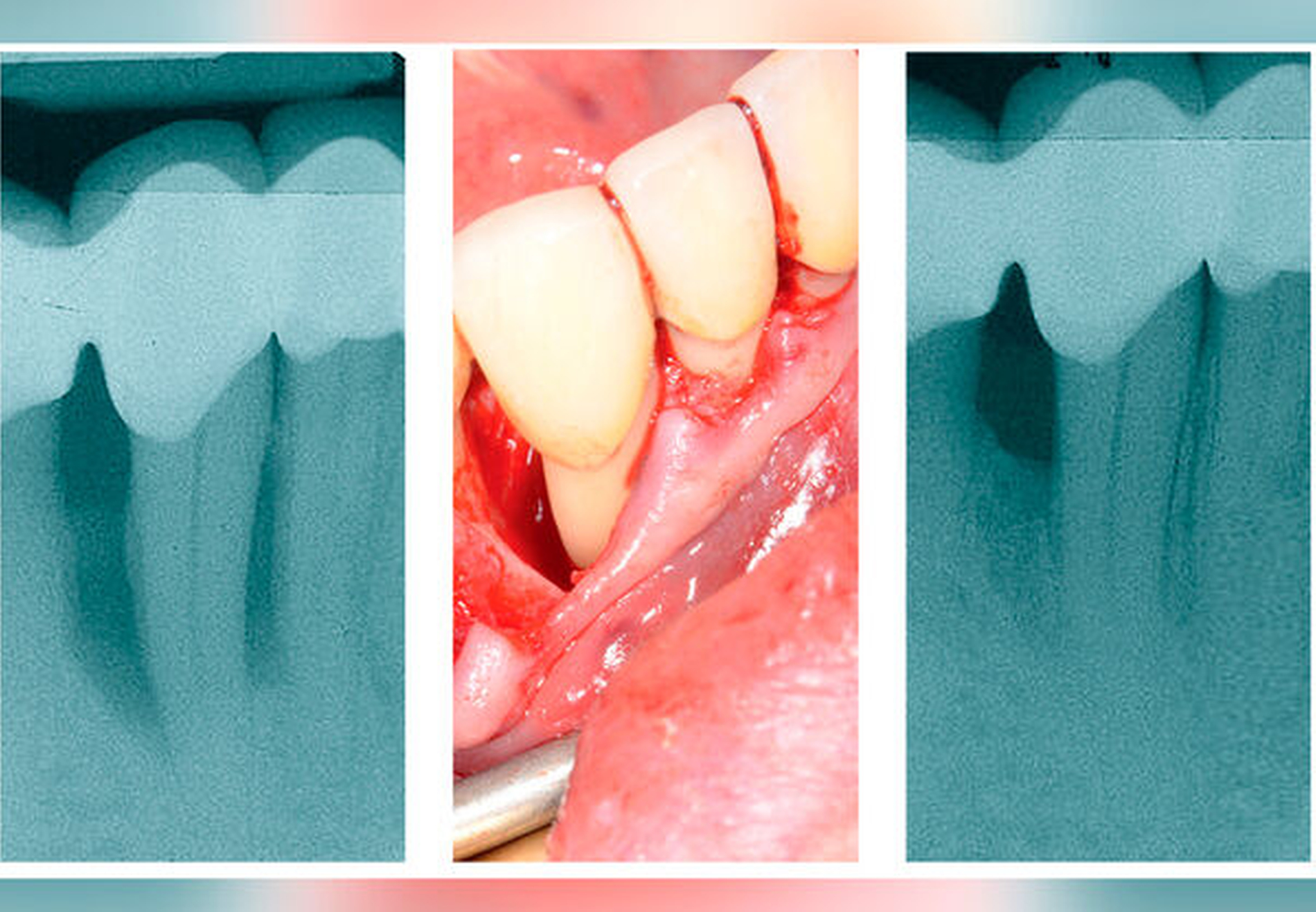
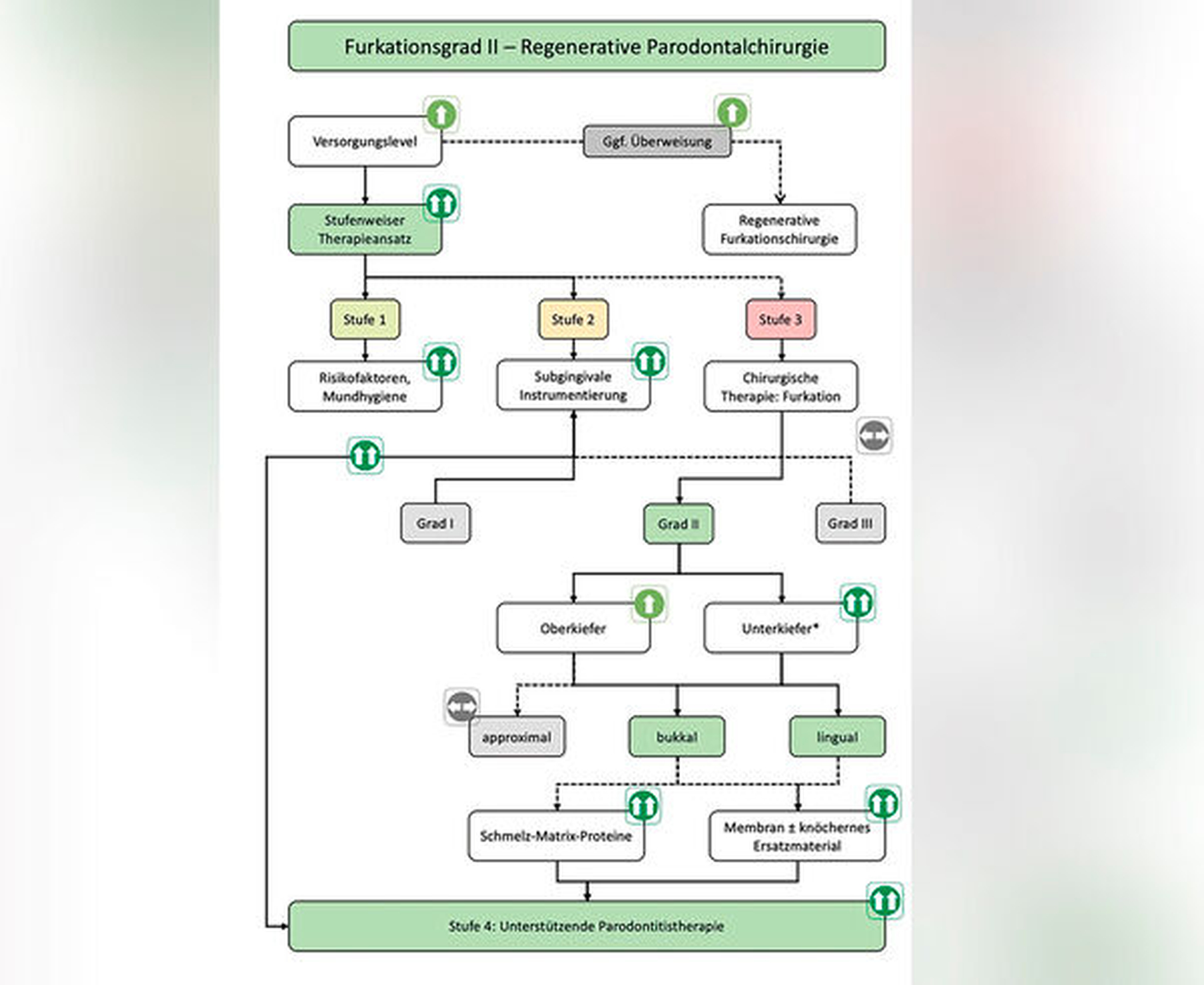
Leitliniengemäße Indikationen für einen regenerativen parodontalchirurgischen Eingriff in der Therapiestufe 3 sind tiefe residuale Taschen nach den Therapiestufen 1 und 2 in Verbindung mit vertikalen Defekten von ≥ 3 mm (röntgenologischer beziehungsweise knöcherner) Tiefe (Tabelle 1, Abbildung 2) und Grad-II-Furkationsdefekte im Unterkiefer (bukkal und lingual) und im Oberkiefer (bukkal) (Tabelle 3, Abbildung 3). Eine neue S3-Leitlinie zur Therapie der Parodontitis im Stadium IV [Herrera et al., 2022] empfiehlt sogar regenerative parodontal-chirurgische Maßnahmen bei Zähnen, die aufgrund von weit fortgeschrittenen vertikalen Defekten pathologische Zahnwanderungen erlitten haben und eine KFO-Therapie benötigen. Basierend auf ganz aktuellen klinischen Studien [Tietmann et al., 2021; Jepsen et al., 2021] wird empfohlen, bereits vier Wochen beziehungsweise drei Monate nach der regenerativen Operation mit der kieferorthopädischen Zahnbewegung zu beginnen.
In den vergangenen Jahrzehnten hat sich gezeigt, dass verschiedene chirurgische Protokolle die parodontale Regeneration fördern und die klinischen Ergebnisse bei vertikalen und bei Furkationsdefekten der Klasse II verbessern können [Cortellini & Tonetti, 2015; Kao et al., 2015; Sanz et al., 2015; Miron et al., 2016]. Dazu gehören Lappenoperationen in Kombination mit:
Implantation von Knochentransplantaten/Knochenersatzmaterialien
Membrantechniken (gesteuerte Geweberegeneration = GTR)
Schmelzmatrixderivat (EMD) (Abbildung 4)
Kombinationen der oben genannten Optionen
Auch hier gibt die S3-Leitlinie dezidierte Empfehlungen, welche Kriterien bei der Auswahl des Biomaterials eine Rolle spielen sollten [Sanz et al., 2020]: „Behandler sollen die Wahl des spezifischen Biomaterials zur Unterstützung der Regeneration von Knochentaschen (oder Furkationsbefall Grad II) auf Basis der Erfüllung aller folgender Kriterien fällen [Proceedings of the World Workshop in Periodontics, Lindhe et al., 1996]:
Verfügbarkeit stichhaltiger präklinischer Studien, die plausible Mechanismen aufzeigen, die zu parodontaler Regeneration führen;
histologische Nachweise der Regeneration für die spezifische Anwendung an humanen Präparaten;
Evidenz für die Wirksamkeit in übertragbaren, qualitativ hochwertigen RCTs.
Es existieren Biomaterialien, die alle oben genannten Kriterien erfüllen. Allerdings muss darauf hingewiesen werden, dass es Produkte gibt, die zwar CE-gekennzeichnet oder FDA- autorisiert sind (FDA – Food and Drug Administration, USA), jedoch nicht allen geforderten Kriterien entsprechen.“
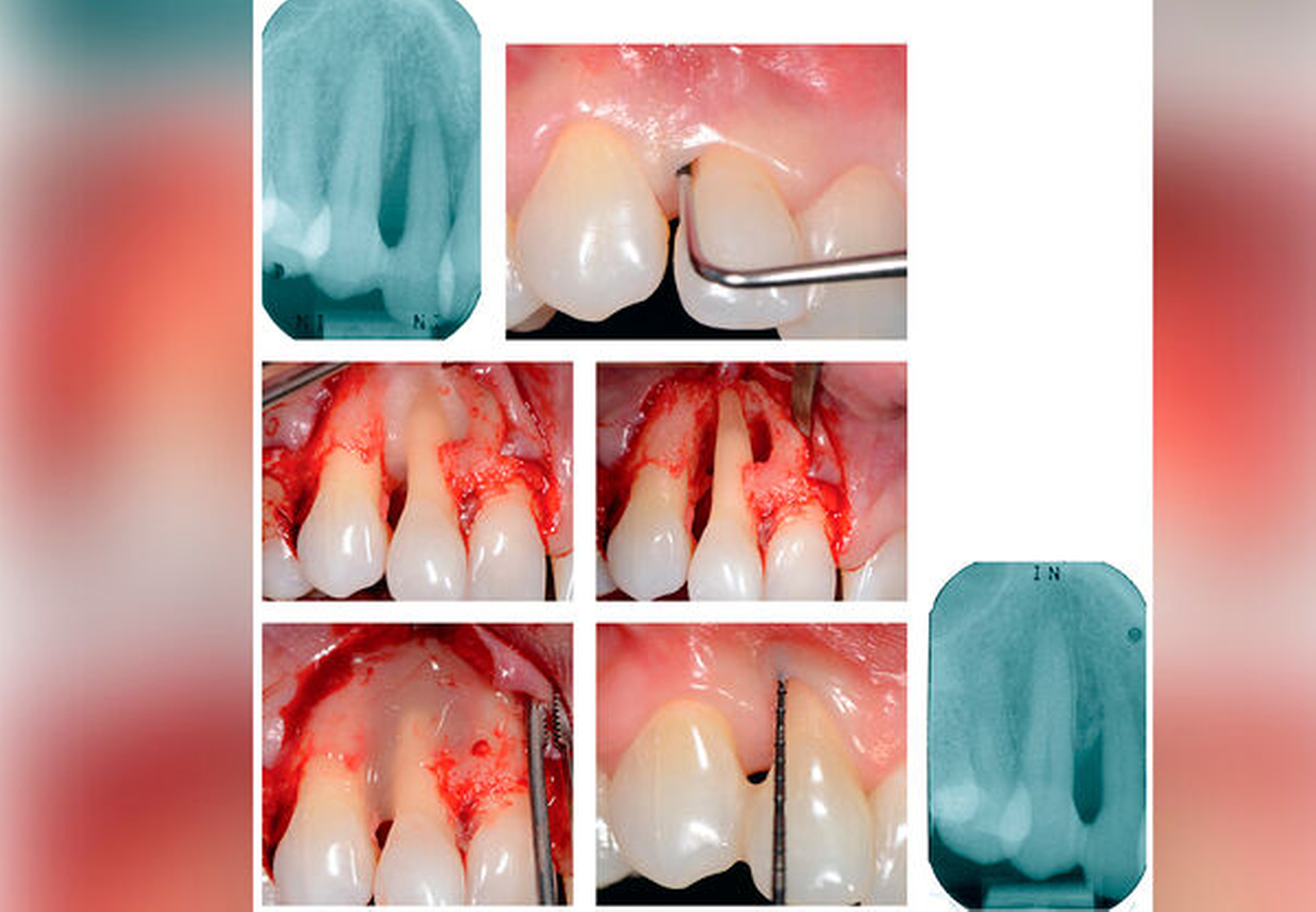
Hier ist eine kritische Haltung der Anwender gefragt, da bislang nur einige Knochen(-ersatz)materialien – autologer Knochen, allogener (DFDBA)-Knochen von der Knochenbank und bestimmte xenogene Knochenersatzmaterialien – sowie (nicht-) resorbierbare Membranen und EMD allen oben genannten Kriterien genügen.
Erkenntnisse aus präklinischen und klinischen Studien haben gezeigt, dass aus biologischer Sicht die folgenden Faktoren für die parodontale Regeneration von entscheidender Bedeutung sind:
Wundstabilität, um eine ungestörte Adhäsion und Reifung des Blutkoagulums auf der instrumentierten Wurzeloberfläche zu ermöglichen;
Raumbereitstellung, um die Bildung und Reifung von parodontalem Gewebe zu ermöglichen;
Ungestörter Heilungsverlauf (zum Beispiel ohne bakterielle Infektion), um die Reifung neu gebildeter Gewebe zu unterstützen.
Diese Erkenntnisse haben unmittelbare Bedeutung und Auswirkung für das klinisch-operative Vorgehen von der Inzision und Lappenpräparation, der defektangepassten Wahl des Biomaterials bis hin zum Nahtverschluss und der postoperativen Nachsorge.
Kombinationstherapien
Mehrere experimentelle und klinische Studien haben gezeigt, dass das Ausmaß der regenerativen Parodontaltherapie durch den verfügbaren Platz unter dem mukoperiostalen Lappen begrenzt wird. Insbesondere bei sogenannten „non-contained“, aufgrund der Defektmorphologie nicht-stützenden vertikalen Defekten wurden verschiedene Kombinationsprotokolle vorgeschlagen, einschließlich der Verwendung von Knochentransplantaten oder -ersatzmaterialien in Kombination mit GTR oder EMD. Erkenntnisse aus präklinischen und klinischen Studien deuten darauf hin, dass Kombinationsansätze bestimmte Vorteile bei nicht-stützenden oder großen vertikalen Knochendefekten und Grad-II-Furkationen bieten können. Der Hauptgrund für die Verwendung von Knochentransplantaten oder -ersatzmaterialien besteht darin, die Raumbereitstellung und Stützung der Weichgewebe sicherzustellen, während die parodontale Regeneration mit einer Membran oder mit EMD gefördert wird. Auch ist zu bedenken, dass jede Kombinationstherapie die Kosten der Operation deutlich erhöht.
Wachstums- und Differenzierungsfaktoren und autologe Blutkonzentrate
In den vergangenen Jahrzehnten wurden eine Vielzahl von Wachstums- und Differenzierungsfaktoren (Growth and Differentiation Factors = GDFs), wie die aus Blutplättchen gewonnenen Wachstumsfaktoren (PDGF), Fibroblastenwachstumsfaktoren (a/b FGF) und morphogenetische Knochenproteine (BMPs), und verschiedene Formulierungen autologer Blutkonzentrate auf ihr Potenzial zur Unterstützung der parodontalen Wundheilung und -regeneration zumeist in experimentellen, präklinischen aber auch in klinischen Studien untersucht [Stavropoulos & Wikesjö, 2012]. Dies hat beispielsweise in den USA zur Zulassung eines Präparats bestehend aus einem rekombinanten, also gentechnisch hergestellten, humanen PDGF-BB auf einem beta-Tricalciumphosphat-Träger geführt. Allerdings ist nicht damit zu rechnen, dass diese Produkte in absehbarer Zeit in Europa zur Verfügung stehen werden.
Deshalb hat sich das Interesse erneut den autolog gewonnenen Thrombozytenkonzentraten, die zahlreiche Wachstumsfaktoren enthalten, zugewendet [siehe auch den Beitrag von Blatt und Naujokat in diesem Fortbildungsteil, zm 15–16/2022]. Dieses „Platelet-Rich-Fibrin“ hat aktuellen Untersuchungen und Metaanalysen zufolge durchaus das Potenzial, die parodontale Wundheilung und -regeneration zu fördern. So haben systematische Reviews die klinischen Ergebnisse nach der zusätzlichen Anwendung von PRF allein oder aber in Kombination mit beispielsweise Knochentransplantaten im Vergleich zur einfachen Zugangslappenoperation bewertet [Nibali et al., 2020; Miron et al., 2021]. Die Ergebnisse haben statistisch signifikant klinische Verbesserungen bei Verwendung von PRF gezeigt, was auf den positiven Effekt dieses Ansatzes auf die parodontale Wundheilung hinweist. Es gibt derzeit allerdings noch keinen humanhistologischen Nachweis für eine parodontale Regeneration nach der Anwendung von PRF. Deshalb und aufgrund der begrenzten Zahl klinischer Studien ist die Verwendung von PRF noch nicht in die aktuelle Leitlinienempfehlung zur regenerativen Parodontaltherapie eingegangen. Auch wenn aus biologischer Sicht die Verwendung autologer Blutkonzentrate von großem Interesse ist, sind weitere histologische und kontrollierte klinische Studien erforderlich, um ihren Nutzen gegenüber den bereits etablierten Protokollen zu bewerten.
Faktoren für die klinische Entscheidungsfindung
Es wurde gezeigt, dass mehrere Faktoren wie eine unzureichende Mundhygiene, das Rauchen und eine stark erhöhte Zahnbeweglichkeit die Ergebnisse der regenerativen Therapie negativ beeinflussen. Daher sollten neben der Kontrolle der Mundhygiene und des Raucherstatus auch die mobilen Zähne (Grad 2 und 3) vor der regenerativen Behandlung geschient werden. Es hat sich auch gezeigt, dass endodontisch behandelte Zähne keine Kontraindikation für einen regenerativen Ansatz darstellen, sofern die Wurzelkanalbehandlung von guter Qualität ist [Cortellini & Tonetti, 2015].
Bei Furkationsbefall Grad II ist es abhängig von der Lokalisation des Furkationsdaches in Relation zum umgebenden Knochenniveau operationstechnisch zunehmend schwieriger, stabile Wundverhältnisse als Voraussetzung für eine parodontale Regeneration zu schaffen. Darüber hinaus gibt es modifizierende Defektfaktoren in Bezug auf Hart- und Weichgewebe, wie Rezessionen, gingivaler Phänotyp, das zusätzliche Vorhandensein eines vertikalen Defekts, die Nähe eines Restaurationsrandes zum Furkationseingang und die Enge des Furkationseingangs für die Instrumentierung, die zur Komplexität beitragen [Jepsen et al., 2021].
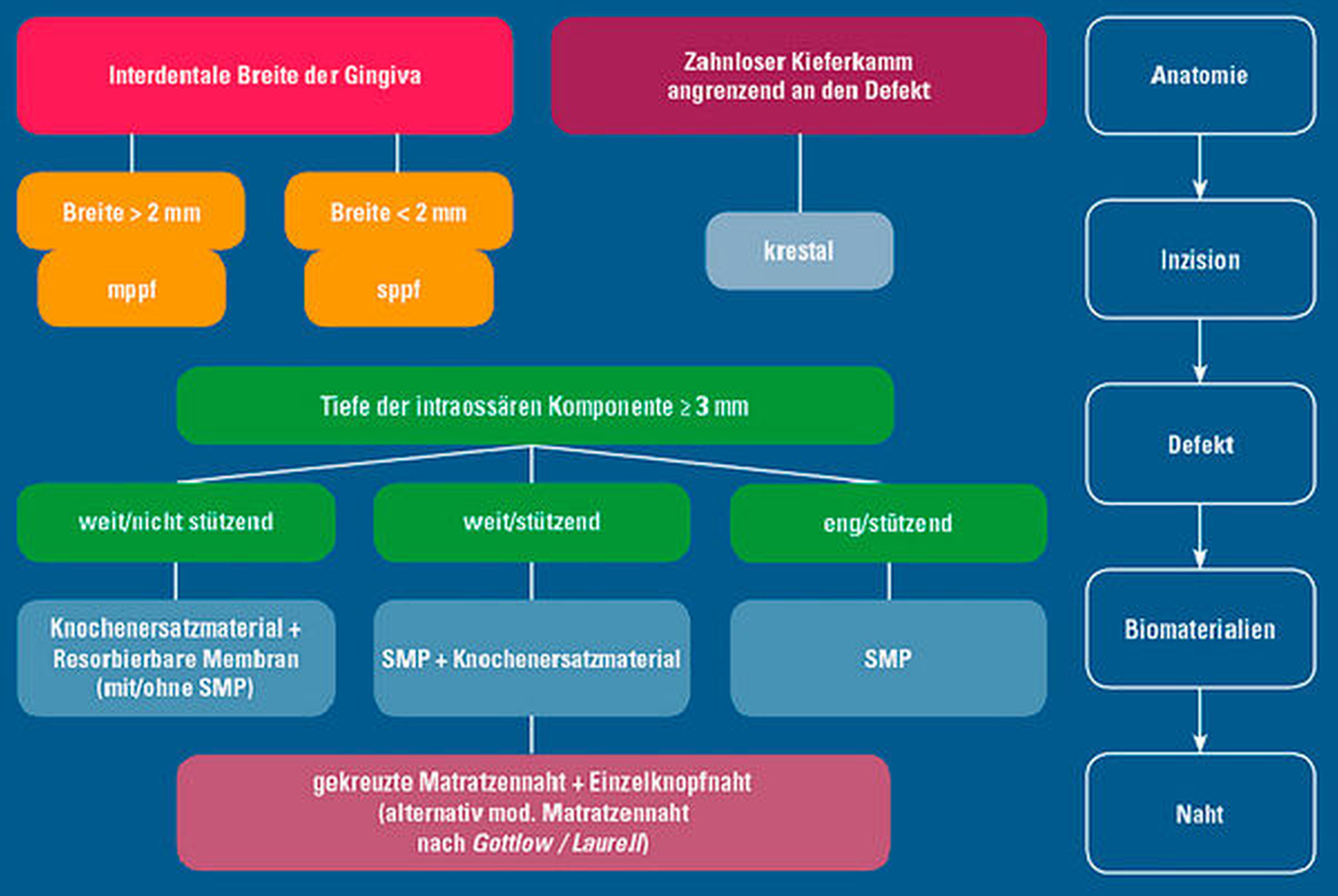
Die geeignete Lappenbildung bei regenerativer Therapie der zumeist interdental gelegenen vertikalen Defekte – einschließlich verschiedener Papillen-erhaltender Techniken wie dem modifizierten oder vereinfachten Papillen-Erhaltungslappen (mppf/sppf), des „Single-Flap-Approaches“ beziehungsweise minimalinvasiver Operationstechniken (MIST und modified MIST) – und der Einsatz von mikrochirurgischen Instrumenten und optimaler Vergrößerungshilfen gewährleisten den Zugang zum Defekt und die gründliche Entfernung von Konkrementen und Biofilm von den Wurzeloberflächen [Cortellini & Tonetti, 2015]. Gleichzeitig minimiert dies das Risiko einer Traumatisierung der Weichteile. Die Beherrschung dieser operativen Techniken ist eine wichtige Voraussetzung für die erfolgreiche Durchführung regenerativer Maßnahmen und erfordert ein besonderes Training. Das wird in der aktuellen S3-Leitlinie betont.
Die Entscheidung für die Auswahl des geeigneten regenerativen Materials oder verschiedener Kombinationen wird nach sorgfältiger Bewertung der Defektanatomie getroffen (Abbildung 6), um die Raumbereitstellung und Wundstabilität zu gewährleisten. Die Wahl der geeigneten Nahttechnik mit feinem Nahtmaterial zur Erzielung eines spannungsfreien primären Wundverschlusses, eine strikte postoperative Infektionskontrolle durch Anwendung von Antiseptika wie zum Beispiel Chlorhexidin und der Verzicht auf eine mechanische Zahnreinigung mit Zahnbürsten in den ersten postoperativen Wochen sind obligatorische Schritte, die die frühe Wundheilung und damit die Endergebnisse entscheidend beeinflussen. Hingegen gibt es keine Hinweise dafür, dass eine adjuvante systemische Antibiotikagabe das seltene Auftreten postoperativer Infektionen verringern oder die Ergebnisse regenerativer Parodontaltherapie verbessern kann. Sie sollte dementsprechend im Sinne eines AntibioticStewardship keineswegs routinemäßig erfolgen [Nibali et al., 2021; Cosgarea & Jepsen, 2022].
Langzeitergebnisse
Die klinischen Verbesserungen nach regenerativer Behandlung können in den meisten behandelten Bereichen langfristig erhalten bleiben, vorausgesetzt die Patienten rauchen nicht, halten hohe Mundhygienestandards ein und nehmen regelmäßig an einer unterstützenden Parodontaltherapie (UPT) teil. Dies haben zahlreiche Langzeitstudien bis zu 20 Jahre nach regenerativer Therapie vertikaler Defekte dokumentieren können [Sculean et al., 2008; Figuero et al., 2014; Stavropoulos et al., 2021; Cortellini et al., 2017; Cortellini et al., 2020; Bröseler et al., 2019; Petsos et al., 2019]. Positive, aber deutlich weniger Daten aus Langzeitstudien liegen für Furkationen vor [Eickholz et al., 2006; Figuero et al., 2014].
Fazit
Zusammenfassend ist festzustellen, dass regenerative parodontalchirurgische Techniken eine evidenzbasiert anerkannt wichtige Rolle im parodontalen Behandlungskonzept spielen und insbesondere bei weit fortgeschrittenen Defekten die Prognose der betroffenen Zähne deutlich verbessern können. Deren erfolgreiche Anwendung bedarf allerdings eines intensiven Trainings und sie sollten nur bei hoch motivierten Patienten mit guter Adhärenz durchgeführt werden.
Literaturliste
Blatt S, Naujokat H: PRF: Biologie und Wirkungsweise, Indikationen, klinische Anwendung, in ZM 15-16/2022 Bröseler F, Tietmann C, Hinz A-K, Jepsen S. (2017) Long-term results of periodontal regenerative therapy: A retrospective practice-based cohort study. J Clin Periodontol 44, 520–529.
Cortellini P, Tonetti MS (2015) Clinical concepts for regenerative therapy in intrabony defects. Periodontol 2000, 68: 282-307.
Cortellini, P., Buti, J., Pini Prato, G., & Tonetti, M. S. (2017). Periodontal regeneration compared with access flap surgery in human intra-bony defects 20-year follow-up of a randomized clinical trial: Tooth retention, periodontitis recurrence and costs. J Clin Periodontol, 44, 58–66
Cortellini P, Stalpers G, Mollo A, Tonetti MS. (2020) Periodontal regeneration versus extraction and dental implant or prosthetic replacement of teeth severely compromised by attachment loss to the apex: A randomized controlled clinical trial reporting 10-year outcomes, survival analysis and mean cumulative cost of recurrence. J Clin Periodontol 47, 768–776.
Cosgarea R, Jepsen K: Antibiotikatherapie in der Parodontologie, ZM 11/2022
Egelberg, J. (1987) Regeneration and repair of periodontal tissues. J Periodontal Res 22, 233-242.
Eickholz P, Pretzl B, Holle R, Kim TS. (2006) Long-term results of guided tissue regeneration therapy with non-resorbable and bioabsorbable barriers. III. Class II furcations after 10 years.
J Periodontol 77, 88–94.
Figueira EA, de Assis AO, Montenegro SC et al. (2014) Long-term periodontal tissue outcome in regenerated infrabony and furcation defects: a systematic review. Clin Oral Investig 18, 1881–1892.
Hägi, T.T., Laugisch, O., Ivanovic, A., Sculean, A. (2012) Regenerative Parodontaltherapie. Quintessenz 63, 1161–1169.
Helal, O., Göstemeyer, G., Krois, J., Fawzy El-Sayed, K., Graetz, C., Schwendicke, F. (2019). Predictors for tooth loss in periodontitis patients: Systematic review and meta‐analysis. J Clin Periodontol 46, 699-712.
Herrera, D., Sanz, M., Kebschull, M., Jepsen, S., Sculean, A., Berglundh, T., Papapanou, P. N., Chapple, I., Tonetti, M.S. & EFP Workshop Participants and Methodological Consultant.
(2022). Treatment of stage IV periodontitis: The EFP S3 level clinical practice guideline. Journal of Clinical Periodontol 49 (Suppl 24),124-171.
Jepsen, S., Terheyden, H. (2000) Wachstums- und Differenzierungsfaktoren in der Regeneration parodontaler Gewebe. ZM /2000
Jepsen, S., Gennai, S., Hirschfeld, J., Kalemaj, Z., Buti, J. & Graziani, F. (2020) Regenerative surgical treatment of furcation defects: A systematic review and Bayesian network meta-analysis of randomized clinical trials. J Clin Periodontol 47 (Suppl 22), 352-374.
Jepsen K, Dommisch H, Jepsen S (2021) Regenerative Chirurgie von Furkationsdefekten. Parodontologie 32, 147–160.
Jepsen, K., Tietmann, C., Kutschera, E., Wüllenweber, P., Jäger, A., Cardaropoli, D., Gaveglio, L., Sanz Sanchez, I., Martin, C., Fimmers, R., & Jepsen, S. (2021). The effect of timing of orthodontic therapy on the outcomes of regenerative periodontal surgery in patients with stage IV periodontitis: A multicenter randomized trial. Journal of Clinical Periodontol 48, 1282-1292.
Kao RT, Nares S, Reynolds MA (2015) Periodontal regeneration - intrabony defects: a systematic review from the AAP Regeneration Workshop. J Periodontol 86, Suppl: S77-104.
Laugisch, O., Cosgarea, R., Nikou, G. Nikolidakis , D., Donos, N. Salvi, GE., Stavropoulos, A., Jepsen, S., Sculean, A. (2019). Histologic evidence of periodontal regeneration in furcation defects: a systematic review. Clin Oral Invest 23, 2861–2906.
Lindhe, J., Schallhorn, R., Bowers, R., Garrett, S., Becker, B., Cortellini, P., Ferris, R., Karring, T., McClain, P., O'Neal, R., Rosenberg, E., Somerman, M., Wikesjö, U. & Yukna, R. (1996) Consensus report. Periodontal regeneration around natural teeth. Ann Periodontol 1, 667-670.
Machtei EE. (1997) Outcome variables in the study of periodontal regeneration. Ann Periodontol 2, 229–239.
Matuliene G, Pjetursson BE, Salvi GE, Schmidlin K, Brägger U, Zwahlen M, Lang NP (2008)
Influence of residual pockets on progression of periodontitis and tooth loss: results after 11 years of maintenance. J Clin Periodontol 35, 685-695.
Miron RJ, Sculean A, Cochran DL, Froum S, Zucchelli G , Nemcovsky C, Donos N, Lyngstadaas SP, Deschner J, Dard M, Stavropoulos A, Zhang Y, Trombelli L, Kasaj A Shirakata Y, Cortellini P, Tonetti M, Rasperini G Jepsen S, Bosshardt DD. (2016) Twenty years of enamel matrix derivative: the past, the present and the future. J Clin Periodontol 43, 668-683.
Miron RJ, Moraschini V, Fujioka-Kobayashi M, Zhang Y, Kawase T, Cosgarea R, Jepsen S, Bishara M, Canullo L, Shirakata Y, Gruber R, Ferenc D, Calasans-Maia MD, Wang HL, Sculean A. (2021) Use of platelet-rich fibrin for the treatment of periodontal intrabony defects: a systematic review and meta-analysis. Clin Oral Investig 25, 2461-2478.
Nibali, L., Zavattini, A., Nagata, K., Di Iorio, A., Lin, G.-H., Needleman, I., Donos, N. (2016) Tooth loss in molars with and without furcation involvement - a systematic review and meta-analysis. J Clin Periodontol 43, 156–166.
Nibali, L., Koidou, V. P., Nieri, M., Barbato, L., Pagliaro, U. & Cairo, F. (2020) Regenerative surgery versus access flap for the treatment of intra-bony periodontal defects: A systematic review and meta-analysis. J Clin Periodontol 47 (Suppl 22), 320-351.
Nibali L, Buti J, Barbato L, Cairo F, Graziani F, Jepsen S. (2021) Adjunctive Effect of Systemic Antibiotics in Regenerative/Reconstructive Periodontal Surgery-A Systematic Review with Meta-Analysis. Antibiotics (Basel) Dec 22;11(1):8. doi: 10.3390/antibiotics11010008.
PMID: 35052886 Papapanou PN, Wennström JL. (1991) The angular bony defect as indicator of further alveolar bone loss. J Clin Periodontol 18:317-322.
Petsos H, Ratka-Krüger P, Neukranz E, Raetzke P, Eickholz P, Nickles K. (2019) Infrabony defects 20 years after open flap debridement and guided tissue regeneration. J Clin Periodontol 46, 552-563
Polimeni G, Xiropaidis AV, Wikesjö UM. (2006) Biology and principles of periodontal wound healing/regeneration. Periodontol 2000 41, 30-47.
Sanz M, Jepsen K, Eickholz P, Jepsen S. (2015) Clinical concepts for regenerative therpy in furcations. Periodontol 2000 68, 308-332.
Sanz, M., Herrera, D., Kebschull, M., Chapple, I., Jepsen, S., Berglundh, T., Sculean, A., Tonetti, M. S., Participants, E. F. P. W. & Methodological, C. (2020) Treatment of stage I-III periodontitis-The EFP S3 level clinical practice guideline. J Clin Periodontol 47 (Suppl 22), 4-60.
Sculean A, Nikolidakis D, Nikou G, Ivanovic A, Chapple ILC, Stavropoulos A. (2015) Biomaterials for promoting periodontal regeneration in human intrabony defects: a systematic review. Periodontol 2000 68, 182-216.
Sculean, A., Kiss, A., Miliauskaite, A., Schwarz, F., Arweiler, N. B., & Hannig, M. (2008). Ten-year results following treatment of intra-bony defects with enamel matrix proteins an guided tissue regeneration. J Clin Periodontol 35, 817–824.
Siciliano VI, Andreuccetti G, Siciliano AI, Blasi A, Sculean A, Salvi GE. (2011) Clinical outcomes after treatment of non-contained intrabony defects with enamel matrix derivative or guided tissue regeneration: a 12-month randomized controlled clinical trial. J Periodontol 82, 62-71.
Stavropoulos A, Wikesjö UME (2012) Growth and differentiation factors for periodontal regeneration: a review on factors with clinical testing, J Periodont Res 47, 545-553.
Stavropoulos A, Bertl K, Spineli LM, Sculean A, Cortellini P, Tonetti M. (2021) Medium- and long-term clinical benefits of periodontal regenerative/reconstructive procedures in intrabony defects: Systematic review and network meta-analysis of randomized controlled clinical studies. J Clin Periodontol 48, 410-430.
Tietmann, C., Bröseler, F., Axelrad, T., Jepsen, K. & Jepsen, S. (2021) Regenerative periodontal surgery and orthodontic tooth movements in stage IV periodontitis: A retrospective practice-based cohort study. Journal of Clinical Periodontol 48, 668-678.