Wurzelkaries – Prävention und individualisierte Therapiestrategien
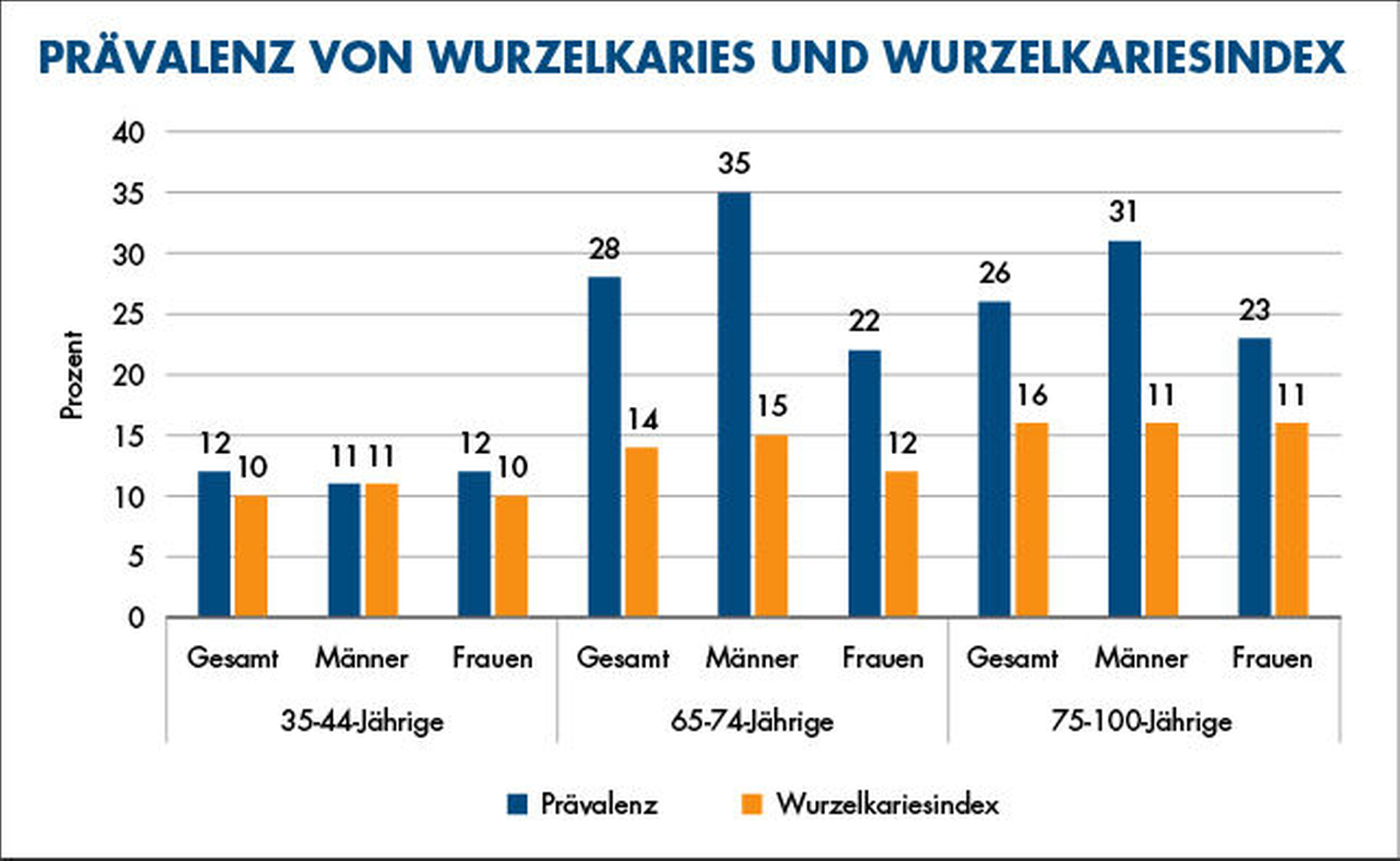
Die Daten der letzten Mundgesundheitsstudie [Jordan und Micheelis, 2016] zeigen, dass elf Prozent der 35- bis 44-Jährigen und 28 Prozent der 65- bis 74-Jährigen von Wurzelkaries betroffen sind. Wenngleich die Prävalenz von Wurzelkaries in der älteren Altersgruppe deutlich höher ist, ist die Anzahl der von Karies betroffenen Wurzeloberflächen an der Gesamtzahl freiliegender Wurzeloberflächen ähnlich (Abbildung 1). Das bedeutet, dass das Kariesrisiko der Wurzeloberflächen offenbar mit dem Alter nicht wesentlich zunimmt. Damit ist Wurzelkaries keine Erkrankung des Alters, sondern vielmehr eine Erkrankung freiliegender Wurzeloberflächen.
Prof. Dr. Carolina Ganẞ
Poliklinik für Zahnerhaltungskunde, Sektion Kariologie,
Medizinisches Zentrum für
Zahn-, Mund- und Kieferheilkunde, Philipps-Universität Marburg und Universitätsklinikum Gießen und Marburg
Georg-Voigt-Str. 3,
35039 Marburg
ganss@staff.uni-marburg.de
1982–1987: Studium der Zahnmedizin an der Philipps-Universität Marburg
1988–1992: Wissenschaftliche Mitarbeiterin, Abteilung für Zahnerhaltungskunde, Medizinisches Zentrum für Zahn-, Mund- und Kieferheilkunde, Philipps-Universität Marburg
1992: Promotion, Philipps-Universität Marburg
1992–2022: Oberärztin,
Poliklinik für Zahnerhaltungskunde und Präventive Zahnheilkunde, Medizinisches Zentrum für Zahn-, Mund- und Kieferheilkunde, Justus-Liebig-Universität Gießen2003: Habilitation, Justus-Liebig-Universität Gießen
2008: apl. Professur, Justus-Liebig-Universität Gießen
seit 2022: Leitung Sektion Kariologie, Poliklinik für Zahnerhaltung, Medizinisches Zentrum für Zahn-, Mund- und Kieferheilkunde der Philipps-Universität Marburg
seit 2022: Professur Kariologie des Alterns, Philipps-Universität Marburg
Forschungsschwerpunkte: Prävention und nicht-invasive Therapie von Zahnhartsubstanzerkrankungen, Beobachtungs- und Interventionsstudien zum Mundhygieneverhalten, Plaquemonitoring
Wurzelkaries als Erkrankung freiliegender Wurzeloberflächen ist – wie koronale Karies auch – Resultat einer mikrobiellen Dysbiose, die altersunabhängig in einen weniger oder nicht pathogenen Zustand rückgeführt werden kann, wenn geeignete Präventionsmaßnahmen etabliert werden können. Wurzelkaries kann ebenso wie koronale Karies arretiert und damit in einen inaktiven Zustand überführt werden.
Charakteristik der Wurzeloberfläche
Das Wurzeldentin ist ein vitales Gewebe, das etwa zu 70 Prozent aus Mineral, zu 18 Prozent aus organischen Komponenten und zu 12 Prozent aus Wasser besteht. Es ist von Tubuli durchzogen, in denen sich Odontoblastenfortsätze sowie Nervenfasern befinden. Die Tubuli sind von dem relativ dicht mineralisierten peritubulären Dentin umgeben. Das intertubuläre Dentin ist dagegen weniger dicht mineralisiert (Abbildung 2). Der mineralische Anteil besteht aus Hydroxylapatit, das in kleineren Kristalliten zwischen und in den Kollagenfibrillen lokalisiert ist. Das Wurzeldentin ist durch die Dentintubuli relativ permeabel und kann leicht von Mikroorganismen besiedelt werden.
Bei der Entstehung von Wurzelkaries kommt es unterhalb eines kariogenen Biofilms zunächst zur Diffusion von Säuren ins Dentin und zur Demineralisation. Dabei wird der mineralische Anteil aufgelöst, während der organische Anteil erhalten bleibt. Kollagen wird durch Säureeinwirkungen, wie sie in der Mundhöhle vorkommen, nicht abgebaut (Abbildung 3). Sobald die organische Matrix vollständig entmineralisiert ist, folgt in einem zweiten Schritt deren Degradation durch proteolytische Enzyme und damit der vollständige Verlust des Dentingewebes. Im Gegensatz dazu kann vollständig oder teilweise mineralisiertes Kollagen nicht enzymatisch abgebaut werden und sollte auch auf der Zahnoberfläche belassen werden.
Insgesamt kann Dentin leichter entmineralisiert werden als Schmelz [Ogaard et al., 1988], da die Kristallite kleiner sind und das Gewebe permeabler ist. Allerdings kann sich die Demineralisationsrate mit der Zeit verlangsamen, da die organische Matrix zu einem gewissen Grad ein Diffusionshindernis darstellt [Ogaard et al., 1988].
Im initialen Stadium der Wurzelkaries können (ähnlich wie im Schmelz) ein Läsionskörper und eine pseudointakte Oberflächenschicht entstehen [Nyvad et al., 1997]. Aufgrund der histologischen Struktur des Dentins erfolgt jedoch schon früh eine bakterielle Invasion. Meist findet dadurch zunächst eine Ausdehnung nach lateral und erst nach Einbruch der Oberfläche eine Tiefenausdehnung statt [Nyvad et al., 1997].
Insgesamt unterscheidet sich der Kariesprozess im Dentin elementar von dem im Schmelz. Schmelz ist ein nahezu vollständig aus dicht gepackten Hydroxylapatitkristallen bestehendes avitales und relativ wenig permeables Gewebe, bei dem De- und Remineralisationsprozesse an der Grenzfläche zum Biofilm dem jeweiligen Löslichkeitsgleichgewicht folgen und leicht durch Fluoridionen beeinflusst werden können. Auch bei Dentin kann Fluorid positive Effekte entfalten, es sind jedoch höhere Fluoridkonzentrationen erforderlich, um den Mineralverlust unter kariogenen Bedingungen zu verringern [ten Cate et al., 1998].
Risikoindikatoren
Zunächst ist plausibel, eine schlechte Mundhygiene, eine kariogene Ernährung, unangepasste Fluoridanwendungen und weitere Faktoren wie Mundtrockenheit oder Zahnersatz als Risikoindikatoren für Wurzelkaries anzunehmen. Eine systematische Übersichtsarbeit aus dem Jahr 2020 [Zhang et al., 2020b] zeigt solche Zusammenhänge jedoch nicht unbedingt auf (Tabelle 1). In die Studie gingen 44 Publikationen aus verschiedenen Ländern mit insgesamt über 78.000 Personen ein. Einfache statistisch signifikante Zusammenhänge finden sich am ehesten zum Alter (höhere Prävalenz von Wurzelkaries in höherem Alter), zum Einkommen (geringere Prävalenz von Wurzelkaries bei höherem Einkommen), zum Rauchen (höhere Prävalenz von Wurzelkaries bei Rauchern) und zur Mundhygiene (höhere Prävalenz von Wurzelkaries bei schlechter Mundhygiene).
Allerdings überschätzen einfache Analysen solche Zusammenhänge. Rauchen beispielsweise kann ein Confounder (Störfaktor) für ungenügende Mundhygiene oder für Parodontalerkrankungen sein und damit verzerrend auf die entsprechenden Einzelzusammenhänge wirken. Werden die Daten entsprechend adjustiert, werden die erwähnten Zusammenhänge deutlich schwächer und es lassen sich kaum mehr eindeutige Risikoindikatoren identifizieren (Tabelle 1). Anzumerken ist jedoch auch, dass hier Personen unterschiedlicher Altersgruppen und mit sehr heterogenen sozialen Umfeldern und Versorgungskontexten eingeschlossen wurden, die Studien aus drei Jahrzehnten stammen und die Erhebungskriterien sehr unterschiedlich waren.
Daher lohnt sich der Blick auf die Analyse nationaler Daten. Schwendicke und Koautoren [Schwendicke et al., 2018] haben die drei Deutschen Mundgesundheitsstudien (DMS III, IV und V) umfassend analysiert und konnten Geschlecht, Alter, koronale Karies, Anzahl der Zähne mit Sondierungstiefen von ≥ 4 mm sowie die Zahnputzhäufigkeit als signifikante Risikoindikatoren identifizieren. Dass die Zahnputzhäufigkeit dabei negativ mit dem Risiko für Wurzelkaries assoziiert war, ist ein interessanter Befund. Die Autoren vermuten, dass regelmäßiges Zähneputzen den Zahnerhalt verbessert und damit mehr Zähne „at risk“ bestehen. Dieser kontraintuitive Zusammenhang wurde aber auch in der erwähnten systematischen Übersichtsarbeit [Zhang et al., 2020b] gefunden (Tabelle 1).
Diagnostik
Wurzelkaries kann alle Bereiche der Wurzeloberfläche betreffen und ist in der Regel an Plaqueretentionstellen etwa im Bereich des Gingivarandes, der Kronenränder, der Einziehungen der Wurzeloberfläche oder des Interdentalraums lokalisiert. Zur klinischen Diagnostik sollte zunächst Plaque möglichst vollständig entfernt werden, um interdentale Bereiche einsehen und aussagefähig sondieren zu können. Während die Oral- und die Vestibulärflächen relativ einfach zu befunden sind, sollten die Interdentalräume unter guter Trockenlegung und Ausleuchtung beurteilt werden. Bei ausgedehnten Rezessionen ist die Diagnostik auch interdental gut möglich (Abbildung 4).
Sollten die interdentalen Bereiche der Wurzeloberfläche nicht einsehbar sein, sind Bissflügelaufnahmen hilfreich. Allerdings müssen kariöse Läsionen von Artefakten, sogenannten „Burn-out-Effekten“, unterschieden werden. Darunter versteht man eine Aufhellung im Zahnhalsbereich, die durch die relativ geringere Abschwächung von Röntgenstrahlung im Bereich des nur durch Gingiva bedeckten Zahnareals und durch die interdental geringere Masse des Zahnes entstehen kann. Da die Voraussetzung für die Entstehung von Wurzelkaries eine freiliegende Wurzeloberfläche ist, bilden Aufhellungen im Röntgenbild, die mit Rezessionen des Knochens vergesellschaftet sind, ein relativ sicheres Kriterium für Wurzelkaries (Abbildung 5). Die Röntgendiagnose sollte klinisch durch Sondierung der relevanten Areale verifiziert werden.
Für die Therapieentscheidung ist es essenziell, zwischen aktiven und inaktiven Läsionen zu unterscheiden (Abbildung 6). Die Farbe der Läsion ist zwar kein verlässliches Diagnosekriterium, aktive Wurzelkaries hat aber eher eine gelbliche oder hellbraune Farbe, ist in der Regel von Plaque bedeckt und fühlt sich bei mäßigem Sondieren weich oder ledrig an. Solche Läsionen bedürfen einer Intervention. Inaktive oder arretierte Läsionen haben in der Regel eine dunklere Farbe, sind meist plaquefrei und fühlen sich bei Sondieren hart an. Inaktive Wurzelkaries braucht keine weitere Intervention, auch wenn sie kavitiert, aber reinigungsfähig ist. Die Patientinnen und Patienten sollten jedoch über solche Befunde aufgeklärt werden.
Das Monitoring von Wurzelkaries ist speziell im Rahmen der nicht-invasiven Therapie hilfreich. Neben der klinischen und der röntgenologischen Diagnostik kann hier möglicherweise die Laserfluoreszenz ein geeignetes Tool darstellen [Mitchell et al., 2021, Zhang et al., 2009].
Primärprävention und nicht-invasive Therapie
Wenn Wurzelkaries als die Erkrankung exponierter Wurzeloberflächen betrachtet wird, sollten primärpräventive Maßnahmen bereits im jungen Alter darauf abzielen, Rezessionen und den Abbau der Interdentalpapillen so weit wie möglich zu vermeiden und so lange wie möglich hinauszuzögern. Dazu gehört eine möglichst effektive und atraumatische Mundhygiene.
Sobald jedoch Wurzeloberflächen exponiert sind, sollte über das Risiko für Wurzelkaries und die resultierenden Folgeprobleme informiert und spätestens jetzt eine adäquate Mundhygiene etabliert werden. Bei den regelmäßigen zahnärztlichen Untersuchungen sollte unbedingt darauf geachtet werden, ob sich individuelle Risikoindikatoren für Wurzelkaries einstellen. Dazu gehören beispielsweise Allgemeinerkrankungen oder Medikationen, die Auswirkungen auf die Mundhöhle, besonders auf den Speichelfluss haben, sowie motorische, visuelle oder kognitive Einschränkungen.
Sollte Wurzelkaries diagnostiziert werden, bestimmen neben den genannten patientenbezogenen Faktoren auch lokale Aspekte wie Kariesaktivität (aktiv/inaktiv) Schweregrad (lokalisiert/generalisiert; initial/Kavitation/pulpanah), Lokalisation (anterior/posterior; Glattfläche/interdental, marginal/weiter koronal, sub-/supragingival) die Therapieentscheidung.
Grundsätzlich sollte eine individualisierte Behandlungsplanung auf einer individuellen Risikofaktoren- und Complianceanalyse basieren. Möglicherweise können Risikofaktoren wie beispielsweise eine Speichelfluss-reduzierende Medikation verändert werden.
Wurzelkaries kann durch geeignete nicht- oder minimalinvasive Maßnahmen oftmals arretiert werden, selbst wenn bereits eine Kavitation vorliegt [Burrow und Stacey, 2017] und bedarf dann keiner restaurativen Therapie [Paris et al., 2020]. Voraussetzung dafür ist, dass die Patientinnen und Patienten eine hinreichende Plaquefreiheit erreichen und die entsprechenden Bereiche der Mundhygiene zugänglich sind. Letzteres ist bei Glattflächenläsionen und approximalen Läsionen in Verbindung mit deutlichen Rezessionen meist der Fall. Kavitierte Bereiche können mit Hand- oder rotierenden Instrumenten eingeebnet werden, so dass sie besser zu reinigen sind. Geringfügig erweichte, potenziell remineralisierbare Areale sollten dabei jedoch nicht entfernt werden, um die Möglichkeit des Erhalts eines gewissen Anteils an Zahnsubstanz nicht von vornherein auszuschließen.
Die etablierten Bausteine der allgemeinen Kariesprävention sind auch für die Prävention und die nicht-invasive Therapie der Wurzelkaries relevant, wenn auch mit einigen Besonderheiten, auf die im Folgenden eingegangen wird. Tabelle 2 fasst individualisierte Präventionsmaßnahmen zusammen.
Mundhygiene
Die Verbesserung und idealerweise die Optimierung der Mundhygiene ist der erste und wichtigste Baustein in der Prävention und Therapie von Wurzelkaries. Zu beachten ist, dass eine unzureichende Mundhygiene im Sinne von klinisch sichtbarer Plaque oder größeren Plaqueansammlungen kein spezifisches Phänomen älterer Personen ist, sondern durchgängig in allen Altersgruppen zu beobachten ist (Abbildung 7) [Micheelis und Schiffner, 2006]. Bei Personen in Altersheimen ohne zahnärztliche Betreuung scheint der Anteil derjenigen, die klinisch sichtbare Plaque oder größere Plaqueansammlungen aufweisen, zwar höher, aber auch in solchen Einrichtungen gibt es eine ausgedehnte Spannbreite von Mundhygienefähigkeiten. Wenn Heime zahnärztlich betreut und Schulungsmaßnahmen für das Personal durchgeführt werden, kann sich die Mundhygienesituation deutlich verbessern [Bleiel et al., 2022; Jager et al., 2009].
Insgesamt gibt es jedoch nur wenige Studien, die sich mit der Frage befassen, wie die Mundhygiene älterer Menschen verbessert werden kann. Die Ergebnisse sind dabei eher entmutigend. Eine gewisse Effektivität zeigten die Verwendung von Chlorhexidin und das Kaugummikauen, sowie professionelles Bürsten und Mundhygieneübungen mit Demonstration. Die erreichten Verbesserungen halten oftmals aber nur kurzfristig an [Ruiz Nunez et al., 2022]. Eine alle zwei Wochen professionell durchgeführte Mundhygiene kann die Plaque- und Blutungsindizes zwar etwas verbessern, allerdings bleibt die Umsetzung in den Heimen aufgrund der limitierten Ressourcen schwierig [Barbe et al., 2019]. Neben Einschränkungen auf der pflegerischen Seite kommt patientenseitig hinzu, dass viele Patientinnen und Patienten mit zunehmendem Alter duldsamer gegenüber mangelhaften Zuständen im Allgemeinen und auch in der Mundhöhle werden – und deshalb Veränderungen und Beschwerden oft erst sehr spät kommunizieren. Dies führt dazu, dass die Notwendigkeit, die Mundhygiene pflegerisch zu unterstützen, oftmals zu wenig ins Bewusstsein gelangt.
Angesichts der Schwierigkeit, die Mundhygiene im höheren Alter und speziell bei beginnenden Einschränkungen zu verbessern, wird deutlich, dass der Fokus viel mehr auf die Optimierung der Mundhygiene im jüngeren Alter gelegt werden muss. Eine regelmäßige positive Motivation von Patientinnen und Patienten jeglichen Alters scheint sich positiv auf das Verhältnis zur Mundhöhle und damit auch auf die Bereitschaft zur Ausführung der Mundhygiene auszuwirken [Mueller et al., 2022]. Es sollte daher kontinuierlich ein gutes Arzt-Patienten-Verhältnis angestrebt werden, um die positive Besetzung der Mundhöhle und damit eine gute Mundhygienebereitschaft zu erreichen.
Ernährung
Der dentale Biofilm ist kein statisches Gebilde, sondern ein Ökosystem, in dem eine Vielzahl von Bakterienspezies ein Habitat finden. Dieses Habitat kann je nach Substratzufuhr kariogene Mikroorganismen fördern oder inhibieren. So kann die häufige Zufuhr von Kohlehydraten zur Selektion und Proliferation von kariogenen Mikroorganismen und damit zur Ausbildung einer besonders kariogenen Plaque führen, umgekehrt führt die Reduktion von Zuckerimpulsen zur Dominanz nicht kariogener Mikroorganismen [Takahashi und Nyvad, 2016].
Daher trägt auch eine zahngesunde Ernährung zur Vermeidung von Wurzelkaries bei. Allerdings sollte immer bedacht werden, dass die Lust an angenehmen Geschmackserlebnissen speziell im Alter einen wesentlichen Beitrag zum generellen, aber auch intraoralen Wohlbefinden leistet. Weiterhin ist die Ernährung vielfach von der Lebenssituation abhängig. Während uneingeschränkte Personen ihre Ernährung selbst bestimmen, wird sie mit zunehmenden Einschränkungen mehr und mehr fremdbestimmt. Deshalb sollte die Ernährungsberatung den individuellen Kontext erfassen und idealerweise nach einer Ernährungsanalyse – etwa nach genauer Ernährungsanamnese mit Ernährungstagebuch – und unter Einbeziehung von unterstützenden oder pflegenden Personen erfolgen. Wichtig ist auch, spezielle Gewohnheiten zu erfragen, beispielsweise zur Linderung von Trockenheitsgefühlen, zu Snacks, Trinkgewohnheiten und Zwischenmahlzeiten.
Ziel sollte es sein, häufige und lange anhaltende Zuckerimpulse zu vermeiden und die Zuckermenge insgesamt zu reduzieren, da beides die Kariogenität der Plaque beeinflussen kann [Head et al., 2017]. Zum Beispiel sollte das Lutschen von zuckerhaltigen Bonbons bei Mundtrockenheit, etwa sogar in der Nacht, unbedingt vermieden werden. Unabhängig vom Alter kann Dehydrierung zu einem verminderten Speichelfluss führen [Oliver et al., 2008], daher sollte auf eine ausreichende Flüssigkeitszufuhr durch zuckerfreie Getränke geachtet werden.
Neben Zucker kann auch prozessierte Stärke kariogen sein, jedoch – zumindest im Schmelz – in wesentlich geringerem Maß [Hartles und Lawton, 1957]. Im Dentin hingegen kann die Verstoffwechselung prozessierter Stärke und die damit verbundene Säurebildung zu deutlichen Demineralisationen führen [Lingstrom et al., 1994], so dass dieser Ernährungskomponente in der Ernährungsberatung bei freiliegenden Wurzeloberflächen besondere Beachtung geschenkt werden sollte. In Kombination mit Zucker erhöht sich das kariogene Potenzial von Stärke erheblich [Souza et al., 2018]. Solche Produkte können lange in Interdentalräumen verbleiben, Zucker freisetzen und somit das Kariesrisiko deutlich erhöhen [Kashket et al., 1996].
Wo immer möglich sollte auf zuckerfreie Produkte, beispielsweise zuckerfreie Bonbons oder Kaugummis, zurückgegriffen werden. Für süße Snacks, etwa Kekse, können salzige Produkte ohne prozessierte Stärke, beispielsweise Nüsse, eine Alternative sein. Ebenso können Zuckerersatzstoffe zum Süßen eine gute, nicht kariogene Alternative zu Haushaltszucker darstellen. Sie werden nicht in die Glykolyse eingeschleust und führen daher im Biofilm nicht zu einem pH-Wert-Abfall. Inwieweit ernährungsbezogene Strategien, die die Ökologie des Biofilms beeinflussen könnten, beispielsweise in Form von Probiotika, zur Prävention von Wurzelkaries beitragen können, ist unklar. Wenn sich solche Maßnahmen ohne Aufwand umsetzen lassen, können diese ergänzend versucht werden. Für zuckerfreie Kaugummis zur Speichelstimulation bei einer Speicheldrüsenhypofunktion gibt es bislang keine Evidenz [Salum et al., 2018].
Betont werden muss, dass der Ernährungssituation eine umso größere Bedeutung zukommt, je schlechter die Mundhygienemaßnahmen verbessert werden können.
Fluoride
Fluoride sind auch zur Prävention und zur nicht-invasiven Therapie von Wurzelkaries unentbehrlich. Generell können Läsionen durch die Anwendung fluoridhaltiger Zahnpasten arretiert werden, wenn gleichzeitig eine gute Plaquekontrolle möglich ist.
Bislang sind im Zusammenhang mit Wurzelkaries nur wenige Studien zu Effekten verschiedener Fluoridverbindungen, verschieden konzentrierten Produkten und verschiedenen Applikationsformen publiziert. Da diese außerdem unterschiedlichen Studienprotokollen folgen, beispielsweise in Bezug auf die Anwendungshäufigkeiten, die Kontrollgruppen oder Begleitinterventionen, kommen systematische Übersichtsarbeiten zu etwas uneinheitlichen Ergebnissen [Chan et al., 2022, Castelo et al., 2021, Zhang et al., 2020a, Urquhart et al., 2019, Wierichs und Meyer-Lückel, 2015]. Während NaF-Lacke unterschiedlich bewertet werden, scheint eine relativ einheitliche Evidenz für Silberdiamminfluorid (SDF) und 5.000 ppm Fluoridzahnpaste zu bestehen. SDF führt zu einer sehr hohen Ablagerung von CaF2-ähnlichen Präzipitaten (Reservoir für Fluoridionen) sowie zur Bildung von Silberphosphathaltigen Präzipitaten. Weiterhin haben Silberionen eine antibakterielle Wirksamkeit. In der Zusammenschau erklären diese Wirkweisen den guten therapeutischen Effekt. SDF hat jedoch den Nachteil, dass sich dunkle Verfärbungen einstellen, was die Anwendung auf das Seitenzahngebiet oder auf Personen, für die das ästhetische Erscheinungsbild weniger von Bedeutung ist, reduziert.
Die hochkonzentrierte Fluoridzahnpaste muss rezeptiert werden, was die Compliance zumindest für die dauernde Anwendung möglicherweise einschränkt. Sie zeigt jedoch eine sehr gute Effektivität sowohl in der Arretierung einer bestehenden aktiven Wurzelkaries als auch in der Prävention neuer kariöser Läsionen. Weiterhin können Fluoridlacke und -gele sinnvolle Alternativen darstellen, auch wenn keine eindeutige Evidenz für deren Wirksamkeit besteht. Für die Effektivität von fluoridhaltigen Mundspüllösungen ist die Evidenz ebenfalls nicht eindeutig, allerdings konnten einzelne Studien zeigen, dass die Verwendung einer 500-ppm-haltigen Mundspüllösung neue Läsionen verhindern kann.
Eine weitere, sehr einfache Methode, die Fluoridmenge in der Mundhöhle zu erhöhen, ist, nach dem Zähneputzen nur auszuspucken und nicht auszuspülen. Es konnte gezeigt werden, dass die Fluoridmenge in der Plaque besonders nach der Anwendung von 5.000-ppm-Zahnpasten bis zu 30 Minuten erhöht sein kann, wenn nach dem Zähneputzen nicht ausgespült, sondern nur ausgespuckt wurde [Nordstrom und Birkhed, 2009]. Im Zusammenhang mit Wurzelkaries konnte das Verhalten nach dem Zähneputzen sogar als Risikoindikator identifiziert werden.
Restaurative Therapie
Eine restaurative Therapie ist angezeigt, wenn die Arretierung der Läsionen mit noninvasiven Maßnahmen nicht gelingt, aufgrund deren Ausdehnung nicht angezeigt ist oder wenn ästhetische Aspekte im Vordergrund stehen. Betont werden muss, dass die Füllungstherapie immer von Prophylaxemaßnahmen begleitet werden sollte [Meyer-Lückel et al., 2019].
Die Kavitätenpräparation und die Materialauswahl hängen von der Lokalisation der Läsion sowie von den Behandlungsmöglichkeiten ab. Bei Patientinnen und Patienten ohne eingeschränkte Behandlungsmöglichkeit kommen die üblichen restaurativen Verfahren zum Einsatz.
Der Zugang zu approximalen Läsionen sollte, wenn immer möglich, von interdental versucht werden (beispielsweise im Fall von Abbildung 4). Wenn dies nicht möglich ist, erfolgt die Präparation von koronal, was jedoch oftmals erhebliche Opfer gesunder Zahnhartsubstanz erfordert. Die Versorgung der resultierenden tiefen approximalen Bereiche ist oftmals herausfordernd, zu den Behandlungstechniken sei auf die entsprechende Literatur verwiesen (beispielsweise [Muscholl, 2022]).
Restaurative Hauptprobleme sind oft die subgingivale Ausdehnung oder die Präsenz zirkulärer Defekte. Beides erschwert die Matrizentechnik sehr, so dass man mit adhäsiven Restaurationen an Grenzen stößt. Viele dieser Fälle, gerade wenn Patienten einen schlechten Allgemeinzustand haben und keine langen Mundöffnungszeiten garantieren, kann man nur kompromissbehaftet lösen, zum Beispiel mit Glasionomerzement [Paris et al., 2020]. Wenn sich der Kreis des Lebens schließt, findet man sich als Behandler in einer Situation wieder, die stark der Kinderbehandlung ähnelt. Abschließend bleibt festzuhalten, dass in solchen Situationen die Intensivierung sinnvoller Präventionsmaßnahmen oft wichtiger ist als eine „schöne“ Füllung [Paris et al., 2020]. Geht man solche Fälle ausschließlich restaurativ an, wird man nicht selten scheitern und aus dem „Re-Restaurations-Hamsterrad“ schwer entkommen.
Abbildung 8 beschreibt einen Behandlungsablauf bei einer präexistenten Restauration an Zahn 23 mit deutlich sichtbarer Sekundärkaries zervikal und approximal (Abbildung 8a). Nach der Entfernung der alten Restauration (acht Jahre) zeigt sich das ganze schwer zu restaurierende Ausmaß des Defekts (Abbildung 8b).
Auf den ersten Blick ist klar, dass eine effektive Matrizentechnik hier schwierig wird, dass aber freies Schichten aufgrund der Nähe zur Gingiva ebenfalls keine gute Idee darstellt. Zur Kariesexkavation favorisieren wir schallschwingende, einseitig belegte Instrumente, die in der Regel keine Blutung provozieren, selbst wenn sie subgingival eingesetzt werden (Abbildungen 8c und 8d).
In solchen Fällen mit kaum zu kontrollierenden subgingivalen Rändern greifen wir vermehrt auf Stahlmatrizen zurück, die zervikal selbst bei extremen Fällen wie hier noch stabil nach subgingival geschoben werden können, die meist aber mit dem Finger fixiert werden müssen (Abbildung 8e). Bei dieser Technik ist es hilfreich, zunächst den subgingivalen Anteil mit einem gut fließenden Flowable zu füllen (Abbildung 8f), dann die Matrize abzunehmen, nachzufinieren, das Komposit sandzustrahlen und den breit angeschrägten Schmelz mit Phosphorsäure zu ätzen.
Dann wird der gesamte Bondingprozess wiederholt. Die erste Schicht zervikal steht zunächst nach labial über, dieser Kragen kann aber leicht mit einer Finierflamme wieder reduziert werden. Als Schichttechnik bietet sich im weiter koronalen Anteil an, die Fläche mit Flow zur besseren Benetzung auszukleiden, danach den Kern der Restauration aus modellierbarem Komposit zu gestalten und die oberste Schicht wieder aus Universal-Flow zu modellieren, weil dadurch eine blasenfreie Oberfläche erzielt werden kann (Abbildungen 8g und 8h).
Bei Fällen wie dem hier gezeigten ist die Ausarbeitung meist durch die erhebliche Zahnlänge erschwert, da man oft mit dem Kopf des Winkelstücks mit dem koronalen Anteil des Zahnes kollidiert. Hier ist alles erlaubt, was hilft, dieses Dilemma zu umschiffen. In diesem Fall hat es mit einem knospenförmigen Arkansasstein und Polierbürstchen gut funktioniert. Abbildung 8i zeigt die fertige Füllung.
Fazit
Wurzelkaries ist eine Zahnerkrankung die auftreten kann, sobald Wurzeloberflächen exponiert sind. Sie ist daher keine Erkrankung des Alters, sondern eine Erkrankung freiliegender Wurzeloberflächen. Da Wurzelkaries oftmals schwierig zu therapieren ist, treten die Primärprävention von Rezessionen und der Erhalt der Interdentalpapillen als Primärprävention von Wurzelkaries in den Vordergrund. Patientinnen und Patienten mit freiliegenden Wurzeloberflächen sollten über das Risiko von Wurzelkaries informiert werden und frühzeitig die Mundhygiene optimieren. Wenn Wurzelkaries vorliegt, sind individualisierte Strategien zur Arretierung der Läsionen, der Füllungstherapie sowie zur Prävention neuer Läsionen angezeigt.
Literaturliste
BARBE, A. G., KOTTMANN, H. E., DERMAN, S. H. M. & NOACK, M. J. 2019. Efficacy of regular professional brushing by a dental nurse for 3 months in nursing home residents-A randomized, controlled clinical trial. Int J Dent Hyg, 17, 327-335.
BLEIEL, D., NITSCHKE, I., NOACK, M. J. & BARBE, A. G. 2022. Impact of care level, setting and accommodation costs on a newly developed oral care nursing plan format for elderly patients with care needs - Results from a cross-sectional study. Int J Dent Hyg, 20, 543-552.
BURROW, M. F. & STACEY, M. A. 2017. Management of Cavitated Root Caries Lesions: Minimum Intervention and Alternatives. Monogr Oral Sci, 26, 106-114.
CASTELO, R., ATTIK, N., CATIRSE, A., PRADELLE-PLASSE, N., TIRAPELLI, C. & GROSGOGEAT, B. 2021. Is there a preferable management for root caries in middle-aged and older adults? A systematic review. Br Dent J.
CHAN, A. K. Y., TAMRAKAR, M., JIANG, C. M., TSANG, Y. C., LEUNG, K. C. M. & CHU, C. H. 2022. Clinical evidence for professionally applied fluoride therapy to prevent and arrest dental caries in older adults: A systematic review. J Dent, 125, 104273.
HARTLES, R. L. & LAWTON, F. E. 1957. Experimental dental caries in the albino rat; incidence of caries in animals maintained on powdered purified diets containing either 67% sucrose or 67% potato starch. Br J Nutr, 11, 13-8.
HEAD, D., D, A. D. & MARSH, P. D. 2017. In silico modelling to differentiate the contribution of sugar frequency versus total amount in driving biofilm dysbiosis in dental caries. Sci Rep, 7, 17413.
JAGER, S., KOSTER-SCHMIDT, A., SCHADE, M. & HEUDORF, U. 2009. [Oral hygiene in nursing home residents. Impact of an oral health education programme for the nursing personnel on the residents' oral health]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz, 52, 927-35.
JORDAN, A. R. & MICHEELIS, W. 2016. Fünfte Deutsche Mundgesundheitsstudie, Köln, Deutscher Zahnärzteverlag.
KASHKET, S., ZHANG, J. & VAN HOUTE, J. 1996. Accumulation of fermentable sugars and metabolic acids in food particles that become entrapped on the dentition. J Dent Res, 75, 1885-91.
LINGSTROM, P., BIRKHED, D., RUBEN, J. & ARENDS, J. 1994. Effect of frequent consumption of starchy food items on enamel and dentin demineralization and on plaque pH in situ. J Dent Res, 73, 652-60.
MEYER-LUECKEL, H., MACHIULSKIENE, V. & GIACAMAN, R. A. 2019. How to Intervene in the Root Caries Process? Systematic Review and Meta-Analyses. Caries Res, 53, 599-608.
MICHEELIS, W. & SCHIFFNER, U. 2006. Vierte Deutsche Mundgesundheitsstudie (DMS IV), Köln, Deutscher Zahnärzteverlag.
MITCHELL, C., ZAKU, H., MILGROM, P., MANCL, L. & PRINCE, D. B. 2021. The accuracy of laser fluorescence (DIAGNOdent) in assessing caries lesion activity on root surfaces, around crown margins, and in furcations in older adults. BDJ Open, 7, 14.
MUELLER, M., SCHORLE, S., VACH, K., HARTMANN, A., ZEECK, A. & SCHLUETER, N. 2022. Relationship between dental experiences, oral hygiene education and self-reported oral hygiene behaviour. PLoS One, 17, e0264306.
MUSCHOLL, C. W., D. 2022. The two-step direct composite restoration (R2 restoration) – a current review. Deutsche Zahnärztliche Zeitschrift International, 4, 125-133.
NORDSTROM, A. & BIRKHED, D. 2009. Fluoride retention in proximal plaque and saliva using two NaF dentifrices containing 5,000 and 1,450 ppm F with and without water rinsing. Caries Res, 43, 64-9.
NYVAD, B., TEN CATE, J. M. & FEJERSKOV, O. 1997. Arrest of root surface caries in situ. J Dent Res, 76, 1845-53.
OGAARD, B., ROLLA, G. & ARENDS, J. 1988. In vivo progress of enamel and root surface lesions under plaque as a function of time. Caries Res, 22, 302-5.
OLIVER, S. J., LAING, S. J., WILSON, S., BILZON, J. L. & WALSH, N. P. 2008. Saliva indices track hypohydration during 48h of fluid restriction or combined fluid and energy restriction. Arch Oral Biol, 53, 975-80.
PARIS, S., BANERJEE, A., BOTTENBERG, P., BRESCHI, L., CAMPUS, G., DOMEJEAN, S., EKSTRAND, K., GIACAMAN, R. A., HAAK, R., HANNIG, M., HICKEL, R., JURIC, H., LUSSI, A., MACHIULSKIENE, V., MANTON, D., JABLONSKI-MOMENI, A., SANTAMARIA, R., SCHWENDICKE, F., SPLIETH, C. H., TASSERY, H., ZANDONA, A., ZERO, D., ZIMMER, S. & OPDAM, N. 2020. How to Intervene in the Caries Process in Older Adults: A Joint ORCA and EFCD Expert Delphi Consensus Statement. Caries Res, 54, 1-7.
RUIZ NUNEZ, M. D. R., DA LUZ RAULINO, M., GOULART CASTRO, R. & SCHAEFER FERREIRA DE MELLO, A. L. 2022. Dental plaque control strategies for the elderly population: A scoping review. Int J Dent Hyg, 20, 167-181.
SALUM, F. G., MEDELLA-JUNIOR, F. A. C., FIGUEIREDO, M. A. Z. & CHERUBINI, K. 2018. Salivary hypofunction: An update on therapeutic strategies. Gerodontology, 35, 305-316.
SCHWENDICKE, F., KROIS, J., SCHIFFNER, U., MICHEELIS, W. & JORDAN, R. A. 2018. Root caries experience in Germany 1997 to 2014: Analysis of trends and identification of risk factors. J Dent, 78, 100-105.
SOUZA, S. E., SAMPAIO, A. A., DEL BEL CURY, A. A., CAVALCANTI, Y. W., RICOMINI FILHO, A. P. & CURY, J. A. 2018. Starch Combined with Sucrose Provokes Greater Root Dentine Demineralization than Sucrose Alone. Caries Res, 52, 323-330.
TAKAHASHI, N. & NYVAD, B. 2016. Ecological Hypothesis of Dentin and Root Caries. Caries Res, 50, 422-31.
TEN CATE, J. M., DAMEN, J. J. & BUIJS, M. J. 1998. Inhibition of dentin demineralization by fluoride in vitro. Caries Res, 32, 141-7.
URQUHART, O., TAMPI, M. P., PILCHER, L., SLAYTON, R. L., ARAUJO, M. W. B., FONTANA, M., GUZMAN-ARMSTRONG, S., NASCIMENTO, M. M., NOVY, B. B., TINANOFF, N., WEYANT, R. J., WOLFF, M. S., YOUNG, D. A., ZERO, D. T., BRIGNARDELLO-PETERSEN, R., BANFIELD, L., PARIKH, A., JOSHI, G. & CARRASCO-LABRA, A. 2019. Nonrestorative Treatments for Caries: Systematic Review and Network Meta-analysis. J Dent Res, 98, 14-26.
WIERICHS, R. J. & MEYER-LUECKEL, H. 2015. Systematic review on noninvasive treatment of root caries lesions. J Dent Res, 94, 261-71.
ZHANG, J., SARDANA, D., LI, K. Y., LEUNG, K. C. M. & LO, E. C. M. 2020a. Topical Fluoride to Prevent Root Caries: Systematic Review with Network Meta-analysis. J Dent Res, 99, 506-513.
ZHANG, J., SARDANA, D., WONG, M. C. M., LEUNG, K. C. M. & LO, E. C. M. 2020b. Factors Associated with Dental Root Caries: A Systematic Review. JDR Clin Trans Res, 5, 13-29.
ZHANG, W., MCGRATH, C. & LO, E. C. 2009. A comparison of root caries diagnosis based on visual-tactile criteria and DIAGNOdent in vivo. J Dent, 37, 509-13.























