Oraler Lichen planus – ein praxisorientierter Leitfaden für einfache bis schwierige Fälle
Potenziell maligne Mundschleimhautveränderungen umfassen eine Vielzahl von Erkrankungen, die die Schleimhäute des Mundes in unterschiedlichem Schweregrad betreffen. Diese Läsionen können entzündlich, infektiös oder neoplastisch sein, manifestieren sich klinisch oft als schmerzhafte Ulzerationen, Retikulationen und/oder Erosionen und haben eine erhebliche Auswirkung auf die Lebensqualität. Bei Vorliegen einer potenziell malignen Mundschleimhautveränderung wird derzeit davon ausgegangen, dass nicht nur die einzelne visuell erkennbare Läsion im Fokus der Diagnostik stehen sollte, sondern das Krebsrisiko für alle Schleimhautareale erhöht ist und diese daher in ein Früherkennungsscreening einbezogen werden müssen [Kämmerer et al., 2017].
Solche Pathologien sind häufig nicht auf lokale Schleimhautschäden beschränkt, sondern können auch systemische Erkrankungen widerspiegeln und durch psychologische Faktoren wie Angst, Depression und Stress verschlimmert oder ausgelöst werden [Zhou und Lin, 2023]. Die genaue Diagnose und eine frühzeitige Behandlung sind entscheidend, um Komplikationen zu vermeiden und die Prognose zu verbessern.
Prävalenz und Relevanz in der zahnärztlichen Praxis
Potenziell maligne Mundschleimhautveränderungen sind in der zahnärztlichen Praxis häufig anzutreffen. Deren Prävalenz variiert je nach Region und nach Population. Zu den häufigsten potenziell malignen oralen Störungen gehören die Leukoplakie, die Erythroplakie, die orale submuköse Fibrose, die aktinische Cheilitis, der chronisch diskoidale Lupus erythematodes und der orale Lichen planus (OLP). Diese Läsionen werden oft klinisch oder durch eine Biopsie / mikroskopische Untersuchung diagnostiziert und sind aufgrund ihrer Variabilität in der Beurteilung eine Herausforderung [Liu et al., 2024].
In der zahnärztlichen Praxis sind diese Erkrankungen von großer Bedeutung, da sie oft chronisch sind, rezidivieren und die Lebensqualität der Patienten erheblich beeinträchtigen können. Eine frühzeitige Diagnose und eine effektive Behandlung sind entscheidend, um die Symptome zu lindern und mögliche Komplikationen zu vermeiden. Und nicht zuletzt trägt die genaue und frühzeitige Diagnose dieser Läsionen dazu bei, die Transformation zu malignen Erkrankungen zu verhindern [Heimes et al., 2021; Vinayahalingam et al., 2024]. Zahnärzte spielen eine zentrale Rolle bei der Erkennung dieser Erkrankungen und der Implementierung geeigneter Behandlungsstrategien.
Oraler Lichen planus
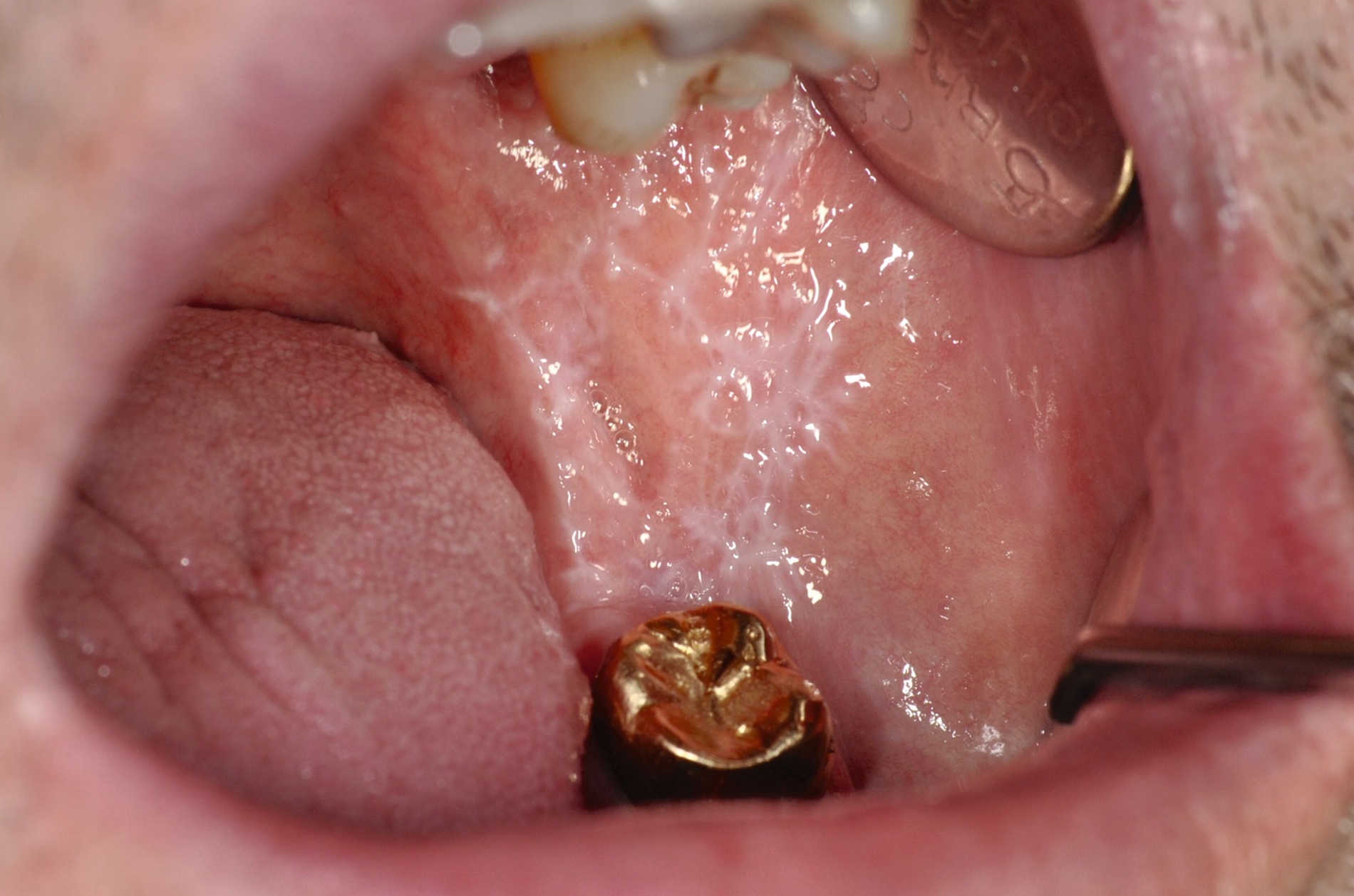
Der Lichen planus (LP) ist eine chronische, entzündliche Erkrankung, die Haut, Haare, Nägel und Schleimhäute (vor allem orale, genitale, ösophageale und okulare Schleimhäute) betreffen kann. Der Lichen planus der Mundschleimhaut (Oraler Lichen planus, OLP) stellt eine Unterform des LP dar. Es handelt sich um eine Erkrankung mit variierenden klinischen Erscheinungsformen wie retikulären, papulären, plaqueartigen, atrophischen, erosiven und ulzerativen Läsionen, die die Schleimhäute des Mundes betrifft und potenziell maligne Transformationen aufweisen kann [Ram Kumar et al., 2024] (Abbildungen 2 und 3). Der OLP kann asymptomatisch verlaufen oder sich durch Schmerzen, Brennen und Ulzerationen manifestieren. Eine frühzeitige Diagnose und effektive Managementstrategien sind entscheidend für die Verbesserung der Lebensqualität der betroffenen Patienten [Piyarathne et al., 2024].
Epidemiologie, Pathogenese und Risikofaktoren
Der OLP betrifft etwa 0,2 Prozent bis 5 Prozent der Bevölkerung, wobei Frauen häufiger betroffen sind als Männer [Al Ramil et al., 2023; Zhou und Lin, 2023]; das Erkrankungsalter liegt vornehmlich zwischen 30 und 60 Jahren. Etwa 60 Prozent der Patienten mit kutanem LP entwickeln auch orale Läsionen, und 20 Prozent der OLP-Patienten haben gleichzeitig weitere Schleimhautläsionen [Mansouri et al., 2024]. Die Prävalenz des OLP variiert weltweit und die Ätiologie bleibt weitgehend unbekannt. Verschiedenen Quellen zufolge sollen jedoch Autoimmunmechanismen eine wichtige Rolle spielen [Al Ramil et al., 2023; Piyarathne et al., 2024]. So wird die Pathogenese von OLP mit der Apoptose von Epithel-Basalzellen durch CD8+-zytotoxische T-Zellen in Verbindung gebracht, die durch endogene oder exogene Antigene induziert wird [Al Ramil et al., 2023]. Histologisch sind OLP-Läsionen durch ein bandartiges lymphozytäres Infiltrat im Subepithel und eine Degeneration in der Basalzellschicht gekennzeichnet [Yim et al., 2024].
Insgesamt wird derzeit angenommen, dass eine Kombination aus genetischer Veranlagung, Immunstörungen, Umweltfaktoren und möglichen Auslösern wie bestimmten Medikamenten oder systemischen Erkrankungen verantwortlich ist [Ram Kumar et al., 2024]. Auch psychologische Einflüsse wie Angst und Depression werden vermutet [Zhou und Lin, 2023]. Die genaue Ursache kann nur schwer festgelegt werden, was die wirksame Behandlung und Bewältigung der Krankheitssymptome erschwert. Für OLP beträgt die durchschnittliche geschätzte maligne Transformationsrate 1,4 Prozent [Chaitanya et al., 2024; Vinayahalingam et al., 2024]. Faktoren, die das Risiko einer malignen Transformation weiter zu erhöhen scheinen, sind das Vorhandensein von epithelialer Dysplasie, Tabak- und Alkoholkonsum, die Lokalisation der Läsionen auf der Zunge, das Vorhandensein von atrophischen und erosiven Läsionen sowie eine Infektion mit dem Hepatitis-C-Virus [Thiem et al., 2017; Gonzalez-Moles und Ramos-Garcia, 2024] (Abbildung 4).
Einfache Fälle
Diagnostik in der Zahnarztpraxis
Der OLP manifestiert sich typischerweise durch weiße, netzartige Streifen (Wickham-Striae; Abbildung 6) und kann retikuläre (Abbildung 2), plaqueartige, papuläre, atrophische/erosive (Abbildung 3), ulzerative und bullöse Formen annehmen. Die häufigste Form des OLP ist die retikuläre Form, die sich durch ein netzartiges Muster auszeichnet. Alle Formen können schmerzhafte Ulzerationen und Erosionen umfassen, die das Essen und das Sprechen beeinträchtigen [Mansouri et al., 2024]. OLP-Läsionen treten häufig symmetrisch auf der buccalen Mukosa, der Zunge, den Lippen, der Gingiva, dem Gaumen und selten am Mundboden auf. Diese charakteristischen Merkmale können in der Regel durch eine visuelle Inspektion und die Anamneseerhebung identifiziert werden [Piyarathne et al., 2024]; bei Bedarf kann eine Bestätigung mittels Biopsie durchgeführt werden.
Da jedoch unklare Mundschleimhautveränderungen, deren überwiegender Anteil harmlos ist, bei bis zu 25 Prozent der Bevölkerung beobachtet werden können, wären Skalpellbiopsien auf breiter Front nicht nur unverhältnismäßig, sondern auch unrealistisch [Kämmerer et al., 2017]. Zur Diagnostik und zur Verlaufskontrolle malignitätsunverdächtiger OLP-Läsionen (geringes Entartungsrisiko) eignet sich in der Zahnarztpraxis insbesondere die wenig-invasive Bürstenbiopsie [Kämmerer et al., 2013], während andere visuelle Systeme momentan noch keine ausreichende Evidenz (vor allem im Sinne einer zu geringen Spezifität) aufweisen, um in der Praxisroutine zur Detektion (prä)maligner Läsionen genutzt zu werden [Kämmerer et al., 2015; Coll et al., 2022].
Bei der Bürstenbiopsie (als Bürstenabstrich von der Schleimhaut entsprechend BEMA-Pos. 05, GOZ-Pos. 6010 beziehungsweise GOÄ-Pos. Ä2002 abrechenbar; Abbildung 5) werden mit einer rigiden Bürste einzelne Zellen von der Läsion abgestrichen. Während einige Autoren die Bürstenbiopsie als äquivalent zur Skalpellbiopsie sehen [Babshet et al., 2011], zeigten andere eine – je nach dem untersuchten Kollektiv – im Vergleich zur Skalpellbiopsie niedrigere Sensitivität von 55 bis 89 Prozent und eine Spezifität von 82 bis 100 Prozent [Koch et al., 2011; Kämmerer et al., 2013].
Management und Therapie
Die mit Abstand wichtigste Methode zur Früherkennung oraler Karzinome ist die systematische Untersuchung der Mundschleimhaut (Inspektion und Palpation). Die aktuelle S2k-Leitlinie „Diagnostik und Management von Vorläuferläsionen des oralen Plattenepithelkarzinoms in der Zahn-, Mund- und Kieferheilkunde“ gibt an, dass initial mögliche mechanische Irritationen überprüft, eine Vitalitätsprobe der benachbarten Zähne zur Erfassung odontogener entzündlicher Ursachen sowie die Bestimmung parodontaler Parameter und Röntgenaufnahmen durchgeführt werden sollten [Hertrampf et al., 2019]. Wenn unter Ausschluss der oben genannten Parameter die Läsion persistiert und symptomatisch ist, umfassen initiale Maßnahmen die Anwendung topischer Kortikosteroide zur Linderung von Entzündungen. Diese Medikamente stellen die Standard-Erstlinientherapie bei dem floriden und/oder dem symptomatischen OLP dar, bieten starke entzündungshemmende und immunsuppressive Effekte und werden direkt auf die Läsionen aufgetragen, um Entzündungen zu reduzieren und die Heilung zu fördern [Ram Kumar et al., 2024; Wu et al., 2024]. Des Weiteren ist eine gute Mundhygiene entscheidend, um sekundäre Infektionen zu verhindern und die Heilung zu unterstützen. Patienten sollten über die Bedeutung der Vermeidung von auslösenden Faktoren wie scharfen Speisen und Stress informiert werden. Regelmäßige Kontrollen (bei klinisch homogenen, nicht malignitätsverdächtigen OLP-Läsionen alle vier Monate [Hertrampf et al., 2019]) sind notwendig, um den Verlauf der Erkrankung zu überwachen und Anpassungen in der Therapie vorzunehmen [Mansouri et al., 2024].
Überwachung und regelmäßige Kontrollen – Fallbeispiel
Ein 45-jähriger Patient ohne Nebenerkrankungen und ohne Risikofaktoren präsentiert sich mit asymptomatischen, netzartig-weißen Streifen auf der linken Wangenschleimhaut (Abbildung 6). Die klinische Diagnose eines oralen Lichen planus wird durch visuelle Inspektion gestellt. Der Patient wird regelmäßig alle vier Monate einbestellt und überwacht (Inspektion, Palpation, Bürstenbiopsie und lokale Anwendung von Kortikosteroiden bei Beschwerden).
Fortgeschrittene Fälle
Erweiterte Diagnostik
Fortgeschrittene Fälle weisen häufig kompliziertere klinische Merkmale auf und können durch eine stärkere Immunreaktion sowie das Vorhandensein von erosiven und atrophischen Läsionen gekennzeichnet sein. Oft ist eine detaillierte histopathologische Untersuchung erforderlich, um die Diagnose zu bestätigen und präkanzeröse/maligne Veränderungen auszuschließen. Immunhistochemische Tests können zusätzliche Informationen liefern und die Diagnose unterstützen. Differenzialdiagnosen umfassen Candida-Infektionen, Leukoplakie, Pemphigus vulgaris und andere autoimmunbedingte Erkrankungen. Wichtig bei einer solchen bioptischen Sicherung der Diagnose sind dabei die korrekte Auswahl der Biopsiestelle und die adäquate Handhabung des Gewebes, um ausreichend Material für die histopathologische Untersuchung zu gewinnen [Liu et al., 2024]. Das Risiko, ein orales Karzinom mittels einer Inzisionsbiopsie einer potenziell malignen Mundschleimhautveränderung zu übersehen, beträgt laut klinischen Studien sieben bis zehn Prozent [Chiesa et al., 1986; Holmstrup et al., 2007]. Insofern ist für die optimale diagnostische Sicherheit – wenn möglich – stets die Exzisionsbiopsie anzustreben [Hertrampf et al., 2019]. Bei stark auf Malignität verdächtigen Läsionen sind die Biopsie und die Gewebsuntersuchung optimalerweise an der für die spätere Therapie verantwortlichen Fachklinik durchzuführen. Die Anforderungen an die Skalpellbiospie (Abbildung 7) sind so komplex, dass sie in der zahnärztlichen Praxis oft nicht erfüllt werden können.
Fotodokumentationen über den Krankheitsverlauf können für jeden Fall eines OLP nützlich sein, um die Ausdehnung der Läsion(en) zu dokumentieren und Veränderungen im Verlauf der Behandlung zu überwachen.
Therapeutische Ansätze
Alternativ zur Anwendung von topischen Kortikosteroiden können in fortgeschrittenen Fällen auch intralesionale Kortikosteroidinjektionen und/oder systemische Kortikosteroide oder Immunmodulatoren wie Tacrolimus und Pimecrolimus in Erwägung gezogen werden. Allerdings sind insbesondere bei systemischer Kortikosteroidgabe die potenziellen Nebenwirkungen zu beachten [Ram Kumar et al., 2024]. Bei Unklarheit sollte eine Biopsie unter Lokalanästhesie durchgeführt werden, wobei das Anästhetikum in das gesunde Gewebe neben der Läsion injiziert werden sollte. Bei fortgeschrittenen Fällen oder großen, inhomogenen Läsionen kann es zu Probenentnahmefehlern oder einer Unterdiagnose kommen [Liu et al., 2024]. Eine enge Zusammenarbeit mit Dermatologen, Oralchirurgen/MKG-Chirurgen und anderen Fachdisziplinen ist notwendig, um eine umfassende Betreuung der Patienten sicherzustellen und optimale Behandlungsergebnisse zu erzielen [Piyarathne et al., 2024].
Management von Nebenwirkungen und Komorbiditäten
Eine sorgfältige Überwachung der Patienten ist notwendig, um Nebenwirkungen der Therapie zu erkennen und zu behandeln. Komorbiditäten wie Diabetes oder Bluthochdruck können durch die Therapie beeinflusst werden und erfordern besondere Aufmerksamkeit.
Fallbeispiel
Ein 60-jähriger Patient berichtet über brennende Schmerzen im Mundraum und zeigt weiße und erythematöse Läsionen an der Zunge und im vestibulären Oberkiefer (Abbildungen 8 und 9). Eine Biopsie bestätigt die Diagnose eines erosiven Lichen planus. Eine Kombination aus topischen und systemischen Kortikosteroiden wurde verordnet und der Patient bei Besserung der Symptome in die enge Nachsorge (alle zwei bis vier Monate) entlassen.
Komplexe Fälle: Spezialisierte Diagnostik und Behandlung
Atypische Präsentationen und schwer zu diagnostizierende Fälle
Komplexe Fälle können atypische Präsentationen aufweisen, die schwer zu diagnostizieren sind. Erweiterte diagnostische Methoden wie die Immunhistochemie und eine molekulare Diagnostik können erforderlich sein, um eine genaue Diagnose zu stellen. Solche Fälle umfassen auch Patienten mit ausgedehnten, schweren oder refraktären OLP-Läsionen, die auf übliche Behandlungsansätze nicht ansprechen. Diese Fälle erfordern oft eine multidisziplinäre Betreuung in spezialisierten Zentren.
Nutzung fortschrittlicher therapeutischer Methoden
Exosomen-basierte Therapien: Exosomen, kleine extrazelluläre Vesikel, spielen eine wichtige Rolle bei der Immunregulation und könnten zukünftig als diagnostische Biomarker und therapeutische Zielstrukturen dienen.
Gezielte Immunsuppressiva: Neue Ansätze, die auf spezifische molekulare Mechanismen der OLP-Pathogenese abzielen, sind vielversprechend und erfordern weitere Forschung [Ram Kumar et al., 2024]
Neue Therapien mit Biologika wie Tofacitinib zeigen vielversprechende Ergebnisse bei der Behandlung von resistenten OLP-Läsionen [Mansouri et al., 2024].
Neue Behandlungsmöglichkeiten wie JAK-Inhibitoren und IL-17-Inhibitoren sowie andere biologische Therapien werden untersucht.
Therapieansätze in spezialisierten Zentren
Systemische Therapien und innovative Behandlungsansätze wie Biologika können bei schwerwiegenden oder therapieresistenten Fällen notwendig sein. Eine Langzeitüberwachung und regelmäßige Kontrollen (Untersuchungsintervall maximal vier Monate [Hertrampf et al., 2019]) sind entscheidend, um eine maligne Transformation frühzeitig zu erkennen und zu behandeln [Piyarathne et al., 2024].
Bei fortgeschrittenen prämalignen oder malignen Läsionen sollte die Biopsie unter Berücksichtigung möglicher maligner Progression durchgeführt werden. Hier wird eine Exzisionsbiopsie empfohlen, um ausreichend Gewebematerial für eine genaue histopathologische Beurteilung zu erhalten; somit handelt es sich hier um Fälle, die am ehesten in einem klinischen Setting stattfinden sollten.
Behandlung von malignen Transformationen und Komplikationen
Bei Patienten mit einer malignen Transformation sind eine enge Zusammenarbeit mit Onkologen und eine invasive Therapie notwendig, um die Prognose zu verbessern.
Langzeitüberwachung und Nachsorge
Eine langfristige Nachsorge ist entscheidend, um Rückfälle zu verhindern und Komplikationen frühzeitig zu erkennen. Regelmäßige Kontrollen und eine kontinuierliche Anpassung der Therapie sind notwendig.
Fallbeispiel
Ein 70-jähriger Patient mit langjährigem, erosivem OLP zeigte deutliche Anzeichen einer malignen Transformation. Eine Inzisionsbiopsie nach einem Tumorstaging weist ein orales Plattenepithelkarzinom (cT4a, cN0, cM0) nach (Abbildungen 10 und 11). Im Anschluss fand die erforderliche chirurgische Therapie statt, in deren Folge eine Hemimaxillektomie und eine Rekonstruktion mit einem mikrovaskulär anastomosierten Fibulatransplantat notwendig wurden. Der Tumor mit einem Durchmesser von 3,5 cm, der den Knochen infiltrierte, konnte vollständig entfernt werden. Der Patient befindet sich fünf Jahre nach der Resektion in der klinischen Nachsorge und leidet periodisch unter weiteren Schüben seines OLP.
Diskussion
Bei unklaren Mundschleimhautveränderungen sollte neben der klinischen Untersuchung das individuelle Entartungsrisiko der Läsion durch Einbeziehung des Alters sowie der Risikofaktoren ermittelt werden, um daran die weiterführende und ergänzende Diagnostik, Therapie und Nachsorge auszurichten. Die Behandlung von OLP erfordert eine genaue Diagnostik und ein individuell angepasstes Therapieregime, basierend auf der Schwere und der Ausdehnung der Erkrankung. Die Diagnose des OLP kann aufgrund seiner ähnlichen Präsentation zu anderen oralen Erkrankungen herausfordernd sein. Zudem können Nebenwirkungen der Langzeittherapie und das Risiko einer malignen Transformation die Behandlung verkomplizieren [Hertrampf et al., 2019; Piyarathne et al., 2024]. Befundabhängig ist es oft sinnvoll, für die Biopsie an eine Tumorfachklinik zu überweisen, da erstens gerade die Identifikation der optimalen Biopsiestelle viel Erfahrung erfordert und zweitens durch die Biopsie das klinische Bild stark verändert wird. Letzteres erschwert die Beurteilung für den Nachbehandler zum Teil erheblich.
Fazit
Der OLP stellt eine signifikante Herausforderung in der zahnärztlichen Praxis dar, da er chronische Beschwerden verursachen kann, ohne dass derzeit die genaue Ursache bekannt ist oder gar therapiert werden kann. Auch aufgrund seiner potenziell malignen Transformation erfordert der OLP eine kontinuierliche zahnärztliche Überwachung. Eine strukturierte Herangehensweise an die Diagnose und die Behandlung von OLP, unterstützt durch regelmäßige Fortbildungen und eine interdisziplinäre Zusammenarbeit, kann die Behandlungsergebnisse verbessern und die Patientenversorgung optimieren.
Schlussfolgerungen für die zahnärztliche Praxis
Regelmäßige Schulungen und Fortbildungen für Zahnärzte können dazu beitragen, die Früherkennung und das Management von OLP zu verbessern. Eine enge Zusammenarbeit mit spezialisierten Zentren und anderen Fachdisziplinen ist ebenfalls wichtig, um die Lebensqualität der Patienten zu verbessern und das Risiko einer malignen Transformation zu minimieren.
Univ.-Prof. Dr. Dr. Peer W. Kämmerer, MA, FEBOMFS
Leitender Oberarzt / Stellvertretender Klinikdirektor
Klinik und Poliklinik für Mund-, Kiefer- und Gesichtschirurgie – Plastische Operationen, Universitätsmedizin Mainz
Augustusplatz 2, 55131 Mainz
peer.kaemmerer@unimedizin-mainz.de
2001–2007: Studium der Medizin an der Johannes-Gutenberg-Universität, Mainz sowie an der Universität Zürich, Schweiz
2004–2010: Studium der Zahnmedizin an der Johann Wolfgang Goethe-Universität, Frankfurt sowie an der Johannes-Gutenberg-Universität, Mainz
2007–2013: Assistenzarzt an der Klinik für Mund-, Kiefer- und Gesichtschirurgie an der Universitätsmedizin Mainz
2012/2013: Gastprofessor der Harvard Medical School, Boston, MA, USA
2014–2018: Oberarzt und später Stellvertretender Klinikdirektor der Klinik und Poliklinik für Mund-, Kiefer- und Plastische Gesichtschirurgie der Universitätsmedizin Rostock
2018–jetzt: Ernennung zum Leitenden Oberarzt / Stellvertretenden Klinikdirektor der Klinik und Poliklinik für Mund-, Kiefer- und plastische Gesichtschirurgie der Universitätsmedizin Mainz
Januar 2021: Ruf auf die W2-Professur für das Fach „Plastisch rekonstruktive Mund-, Kiefer- und Gesichtschirurgie“ an der Johannes Gutenberg-Universität Mainz
seit 2022 Wissenschaftlicher Beirat bei den Zahnärztlichen Mitteilungen
Literaturliste
Al Ramil AM, S Lamfoon and H Mawardi: Dental implants for patients with oral mucosal diseases: A narrative review and clinical guidance. Dent Med Probl 60:687-696, 2023.
Babshet M, K Nandimath, S Pervatikar and V Naikmasur: Efficacy of oral brush cytology in the evaluation of the oral premalignant and malignant lesions. J Cytol 28:165-172, 2011.
Chaitanya NC, S Chintada, SP Priya, NT Hashim, R Mohammed, MM Rahman, SR Shetty, NS Farghal and JSH Alyami: A New Scoring System of Oral Lichen Planus. J Pharm Bioallied Sci 16:S1022-S1032, 2024.
Chiesa F, L Sala, L Costa, D Moglia, M Mauri, S Podrecca, S Andreola, R Marchesini, G Bandieramonte, C Bartoli and et al.: Excision of oral leukoplakias by CO2 laser on an out-patient basis: a useful procedure for prevention and early detection of oral carcinomas. Tumori 72:307-312, 1986.
Coll Y, A Geddes and E Thomson: The light at the end of the tunnel? Can light-based tests increase the accuracy of our diagnoses of pre-cancerous/cancerous lesions? Evid Based Dent 23:16-17, 2022.
Gonzalez-Moles MA and P Ramos-Garcia: An Evidence-Based Update on the Potential for Malignancy of Oral Lichen Planus and Related Conditions: A Systematic Review and Meta-Analysis. Cancers (Basel) 16:2024.
Heimes D, LK Müller, A Schellin, H Naujokat, C Graetz, F Schwendicke, M Goedecke, B Beck-Broichsitter and PW Kämmerer: Consequences of the COVID-19 Pandemic and Governmental Containment Policies on the Detection and Therapy of Oral Malignant Lesions-A Retrospective, Multicenter Cohort Study from Germany. Cancers (Basel) 13:2021.
Hertrampf K, M Kunkel und Leitliniengruppe: Diagnostik und Management von Vorläuferläsionen des oralen Plattenepithelkarzinoms in der Zahn-, Mund- und Kieferheilkunde. AWMF-Registernummer: 007-092 2019.
Holmstrup P, P Vedtofte, J Reibel and K Stoltze: Oral premalignant lesions: is a biopsy reliable? J Oral Pathol Med 36:262-266, 2007.
Kämmerer PW, FP Koch, M Santoro, G Babaryka, S Biesterfeld, J Brieger and M Kunkel: Prospective, blinded comparison of cytology and DNA-image cytometry of brush biopsies for early detection of oral malignancy. Oral Oncol 49:420-426, 2013.
Kämmerer PW, T Morbach, D Schneider and J Liese: Diagnostik potenziell maligner Mundschleimhautveränderungen in der Zahnarztpraxis. wissen kompakt 3:105-120, 2017.
Kämmerer PW, RK Rahimi-Nedjat, T Ziebart, A Bemsch, C Walter, B Al-Nawas and FP Koch: A chemiluminescent light system in combination with toluidine blue to assess suspicious oral lesions-clinical evaluation and review of the literature. Clin Oral Investig 19:459-466, 2015.
Koch FP, M Kunkel, S Biesterfeld and W Wagner: Diagnostic efficiency of differentiating small cancerous and precancerous lesions using mucosal brush smears of the oral cavity--a prospective and blinded study. Clin Oral Investig 15:763-769, 2011.
Liu W, H Li and L Shi: Perspectives on oral tissue biopsy surgery for patients with oral premalignant and malignant lesions. J Dent Sci 19:1877-1879, 2024.
Mansouri P, MA Jafari, R Chalangari, M Roohaninasab and A Goodarzi: Successful Treatment of Erosive Lichen Planus With Tofacitinib: A Case Series and Review of the Literature. Clin Med Insights Case Rep 17:11795476241237350, 2024.
Piyarathne NS, SN Liyanage, R Rasnayaka, P Hettiarachchi, GAI Devindi, F Francis, D Dissanayake, R Ranasinghe, MBD Pavithya, IB Nawinne, RG Ragel and RD Jayasinghe: A comprehensive dataset of annotated oral cavity images for diagnosis of oral cancer and oral potentially malignant disorders. Oral Oncol 156:106946, 2024.
Ram Kumar RM, S Joghee and MK Puttaraju: Impact of exosomes in oral lichen planus: A review with insights into pathogenesis and biomarkers. J Dent Sci 19:1320-1327, 2024.
Thiem DGE, S Schneider, NT Venkatraman, VV Kumar, J Brieger, B Frerich and PW Kämmerer: Semiquantifiable angiogenesis parameters in association with the malignant transformation of oral leukoplakia. J Oral Pathol Med 46:710-716, 2017.
Vinayahalingam S, N van Nistelrooij, R Rothweiler, A Tel, T Verhoeven, D Tröltzsch, M Kesting, S Berge, T Xi, M Heiland and T Flügge: Advancements in diagnosing oral potentially malignant disorders: leveraging Vision transformers for multi-class detection. Clin Oral Investig 28:364, 2024.
Wu T, Y Bai, Y Jing and F Chen: What can we learn from treatments of oral lichen planus? Front Cell Infect Microbiol 14:1279220, 2024.
Yim IS, L Zhang, I Lin and DM Laronde: Controversies regarding oral lichen planus and lichenoid-dysplastic lesions. Can J Dent Hyg 58:98-105, 2024.
Zhou H and X Lin: Oral mucosal diseases and psychosocial factors: progress in related neurobiological mechanisms. J Int Med Res 51:3000605231218619, 2023.