Die Sonografie in der zahnärztlichen Praxis
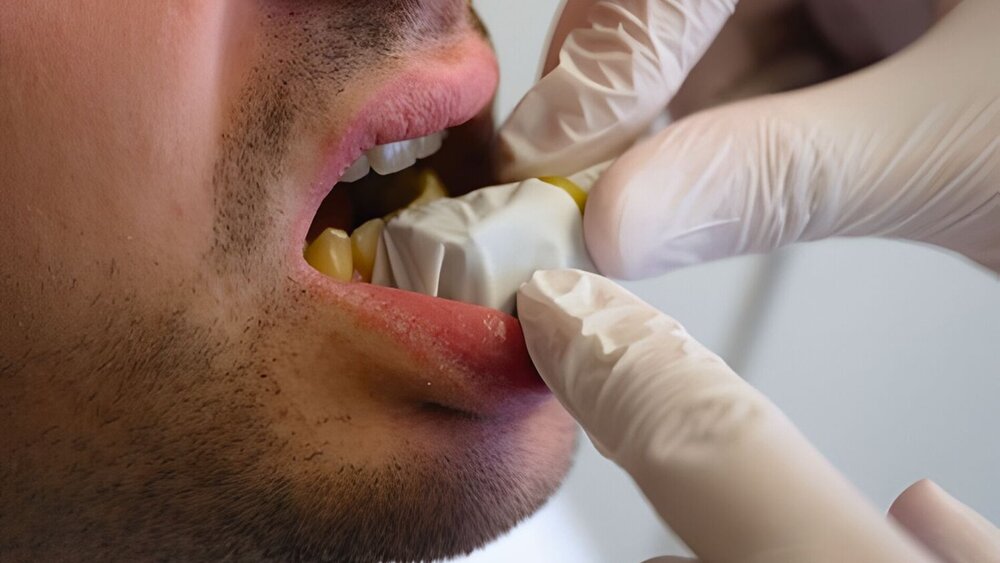
In den vergangenen Jahren sind neuartige Hochfrequenz-Ultraschallgeräte in die medizinische Anwendung eingeführt worden, mit denen die intraorale Anwendung ergonomisch gestaltet werden kann und die die anatomische Bestimmung des oralen Weichgewebes sowie der Hart- und Weichgewebsdimension an Zähnen und Implantaten ermöglichen [Bhaskar et al., 2018; Rodriguez Betancourt et al., 2023]. Insbesondere eine neuartige 30-MHz Sonde (L30-8-Sonde von Zonare/Mindray, Mountain View, CA, USA) hat sich als handliches und flexibles Instrument erwiesen: Die Sonde hat etwa die Größe einer Zahnbürste (30 mm ×18 mm × 12 mm) und kann problemlos intraoral verwendet werden (Abbildungen 1 und 2). Neben der anatomischen Darstellung kann damit auch eine funktionelle Sonografie des Weichgewebes durchgeführt werden. Die Beurteilung der dynamischen Gewebeperfusion und der Blutflussschwankungen des oralen Weichgewebes kann somit zur Differenzierung des Entzündungsgrads herangezogen werden.
In experimentellen und klinischen Studien wurden in den vergangenen Jahren die intraoralen Anwendungen von sonografischen Aufnahmen untersucht [Rodriguez Betancourt et al. 2023]. Dabei standen die anatomische Darstellung des krestalen Knochenniveaus und der Weichgewebsdimension an Zähnen und Implantaten im Fokus.
Die Ultraschall-Technik
Die Ultraschall(US)-Technik verwendet akustische Wellen, die eingekoppelt, im menschlichen Körper übertragen und dort dann zurückgestreut oder zum Sender reflektiert werden, wenn sie auf Gewebeschnittstellen treffen [Kripfgans & Chan et. al., 2021; Chifor et al., 2021]. US-Wellen entstehen durch den Einsatz von piezoelektrischen Materialien, die elektrische Energie in mechanische Schwingungen umwandeln.
Ein typisches US-Gerät nutzt einen sogenannten Transducer, der aus einem piezoelektrischen Kristall besteht. Wenn eine elektrische Spannung an diesen Kristall angelegt wird, ändert er seine Form. Er dehnt sich aus oder zieht sich zusammen. Die schnelle, wiederholte Änderung der Form erzeugt mechanische Schwingungen, die sich als Ultraschallwellen ausbreiten [Chan & Kripfgans, 2021]. Die in der Sonde (Schallkopf) erzeugten Wellen werden in kurzen gerichteten Impulsen in die zu untersuchende Region gesendet. Die durchlaufenen Gewebe setzen der Ausbreitung der Schallwellen einen unterschiedlichen Widerstand entgegen (Impedanz), was sich in einem ebenfalls differenzierten Reflexions- und Streuungsverhalten äußert (Echogenität).
Wenig echogen sind Flüssigkeiten wie Blut – sie werden im klassischen Ultraschallbild dunkel bis schwarz dargestellt. Knochen und Gase wie Luft reflektieren den Ultraschall stärker und erscheinen auf dem Monitor hell bis weiß. Die reflektierten und gestreuten Ultraschallwellen werden von der Sonde detektiert, dort in elektrische Signale umgewandelt und mittels einer Software für die bildliche Darstellung aufbereitet.
Insbesondere an den Grenzflächen zweier Gewebe mit unterschiedlicher Impedanz kommt es zu starken Reflexionen. Deshalb wird vor der Untersuchung mit der Sonde ein stark wasserhaltiges Gel auf die betreffenden Hautareale aufgetragen. Damit wird sichergestellt, dass die in der Sonde erzeugten Ultraschallwellen ohne ansonsten mögliche störende Lufteinschlüsse in den Körper gelangen („einkoppeln“) und später wieder empfangen werden können.
Der Bildinhalt der Monitordarstellung besteht aus Graustufenpixeln, deren Intensität einen Hinweis auf die quantitative Schallmenge gibt, die von jeder einzelnen anatomischen Stelle reflektiert oder zurückgestreut wird [Chan et al., 2018; Chan et al., 2017; Reda et al., 2021]. Der sogenannte B-Modus liefert einzelne oder mehrere anatomische 2-D-Bilder, die eine Visualisierung und eine räumliche Quantifizierung der Abmessungen und Positionen von Weich- und Hartgewebe sowie von Fremdstrukturen wie Implantaten, Transplantaten und anderen ermöglichen.
Als Welle unterliegt die Ausbreitung des Ultraschalls den aus der Wellenoptik bekannten Phänomenen der Reflexion, Brechung, Beugung, Streuung und Absorption, die durch die Eigenschaften des Mediums bestimmt werden, in dem sie sich ausbreitet. Weichgewebe eignet sich hervorragend für die US-Ausbreitung [Kripfgans & Chan et al., 2021]. In der Darstellung des Knochengewebes weisen hochfrequente sonografische Aufnahmen nur eine sehr geringe Durchdringung des Hartgewebes auf. Somit sind infraossäre Defekte am Zahn und am Implantat derzeit nicht zuverlässig beurteilbar, allerdings können das Knochenniveau und die Oberfläche der knöchernen Morphologie sehr gut dargestellt werden.
Neben der anatomischen Darstellung von oralen Strukturen kann die Sonografie auch funktionelle Bilder des Weichgewebes liefern. Diese Technik wird verwendet, um Farbflussbilder des Blutflusses im periimplantären Weichgewebe im Hinblick auf eine Differenzierung zwischen gesundem und erkranktem Gewebe zu untersuchen.
Der Ultraschall in der Zahnmedizin: Historische Wegmarken
Bereits vor über 60 Jahren wurde in der Zahnheilkunde eine experimentelle Ultraschall(US)-Studie mit einer 15-MHz-Sonde zur Darstellung der inneren Struktur von Zähnen durchgeführt [Baum et al., 1963]. Dieser frühe Versuch zeigte jedoch, dass die Bildschärfe und die Bildqualität nicht ausreichend für die routinemäßige klinische Diagnostik waren. Erst in den 1980er-Jahren, initiiert vom Institut für Biomedizinische Technik der Universität Stuttgart und von der Abteilung für Zahnerhaltung und Parodontologie der Universität Mainz, wurden weitere In-vitro-Untersuchungen zur Anwendung von US-Aufnahmen zur Bestimmung akustischer Kenngrößen von Schmelz, Dentin und Alveolarknochen durchgeführt [Irion et al., 1984, 1986; Löst et al., 1986a]. Zum ersten Mal konnte in US-Aufnahmen die Höhe des krestalen Knochenrandes an Zähnen von bukkal und oral bestimmt werden [Löst et al., 1986b, 1988].
Einige Jahre später wurde in Deutschland auf Grundlage einer fortschrittlichen Bildgebungstechnologie und Softwareentwicklung ein kommerzielles US-Gerät für die intraorale klinische Diagnose entwickelt (SDM®, Fa. Krupp Medizintechnik, Essen). Dieses Gerät fand Anwendung in der klinischen Forschung zur Messung von Zahnfrakturen, von Kiefer- und Gesichtsfrakturen sowie von parodontalen Knochendefekten [Müller et al., 1999, 2007; Müller und Könönen, 2005]. Besonders vielversprechend waren die klinischen Studien zur Bestimmung der Höhe und der Breite des parodontalen Weichgewebes. Leider wurde in den darauffolgenden Jahren in Deutschland die US-Technik in der Zahnmedizin nicht weiterentwickelt. Diese Stagnation könnte verschiedene Ursachen haben, etwa fehlende Investitionen in Forschung und Entwicklung oder ein mangelndes Interesse an der Integration neuer Technologien in die zahnmedizinische Praxis.
Die US-Technik wurde in den vergangenen Jahren in den USA weiterentwickelt. Durch den Einsatz von hochauflösenden, kleineren und flexibleren US-Sonden ist es nun möglich, in der Mundhöhle einen hohen Weichgewebekontrast zu erzielen und die Hartgewebetopografie präzise zu beurteilen. Zudem wird die Darstellung des Blutflusses im Weichgewebe visualisiert, was neue diagnostische Möglichkeiten eröffnet. Aktuell wird der Einsatz von Künstlicher Intelligenz (KI) untersucht, um komplexe Muster automatisch zu erkennen und eine quantitative Bewertung von US-Bildgebungsdaten durchzuführen. Diese Entwicklungen könnten die zahnmedizinische Diagnostik erheblich verbessern und die Effizienz der Behandlungen steigern.
Darstellung von Hart- und Weichgewebe
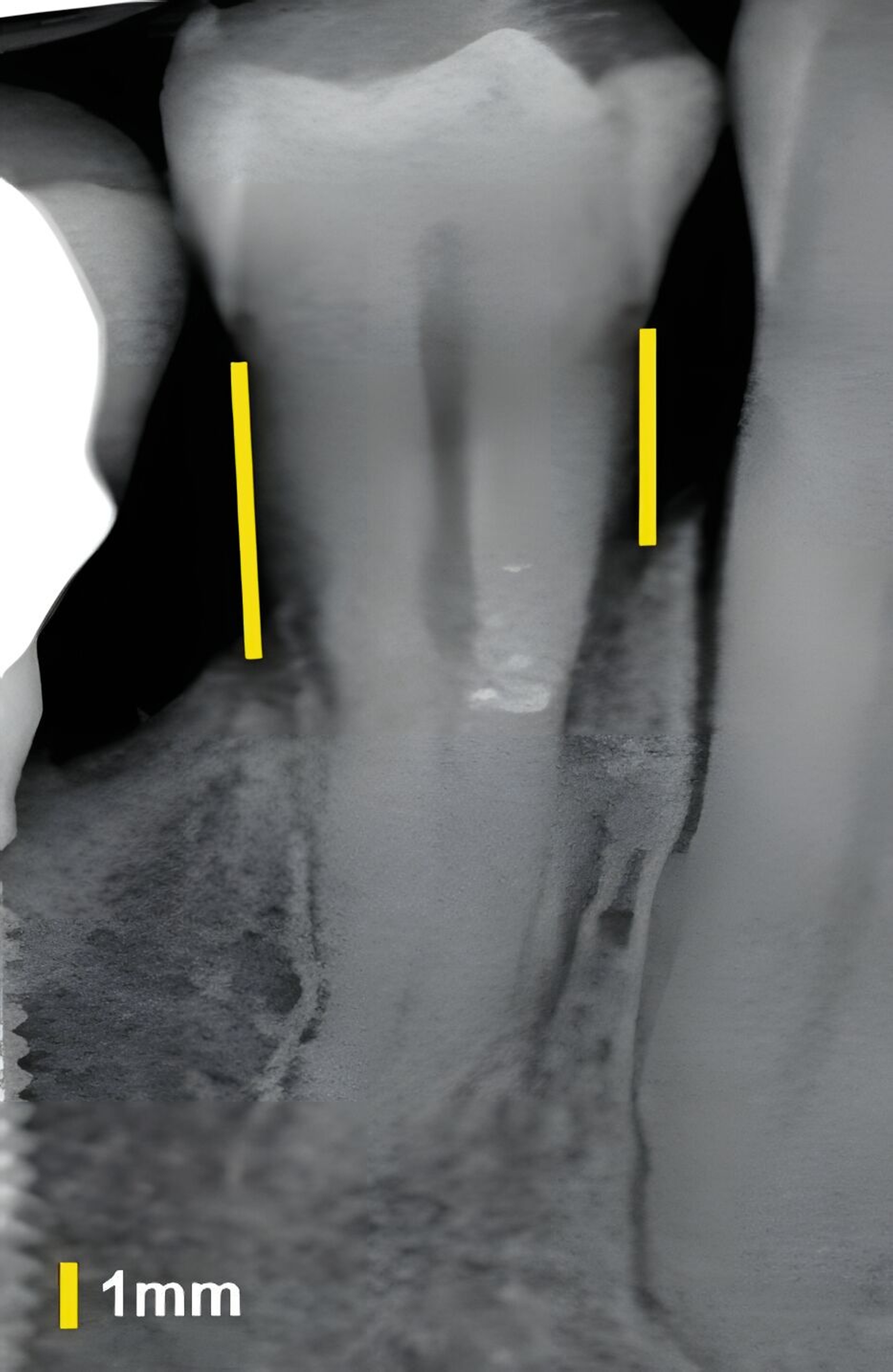
Die US-Diagnostik des Weichgewebes um Zähne und Implantate hat in den vergangenen Jahren erhebliche Fortschritte gemacht. Insbesondere ist die sonografische Differenzierung zwischen Weich- und Hartgewebe erst durch hochfrequente US-Sonden verlässlich möglich. In experimentellen und klinischen Studien wurde die Anwendung einer hochauflösenden und bildgebenden 25-MHz/30-MHz-US-Sonde (ZS3, L25-8 und L30-8, Mindray, Mountain View, CA, USA) zur Differenzierung des parodontalen und des periimplantären Weichgewebes untersucht.
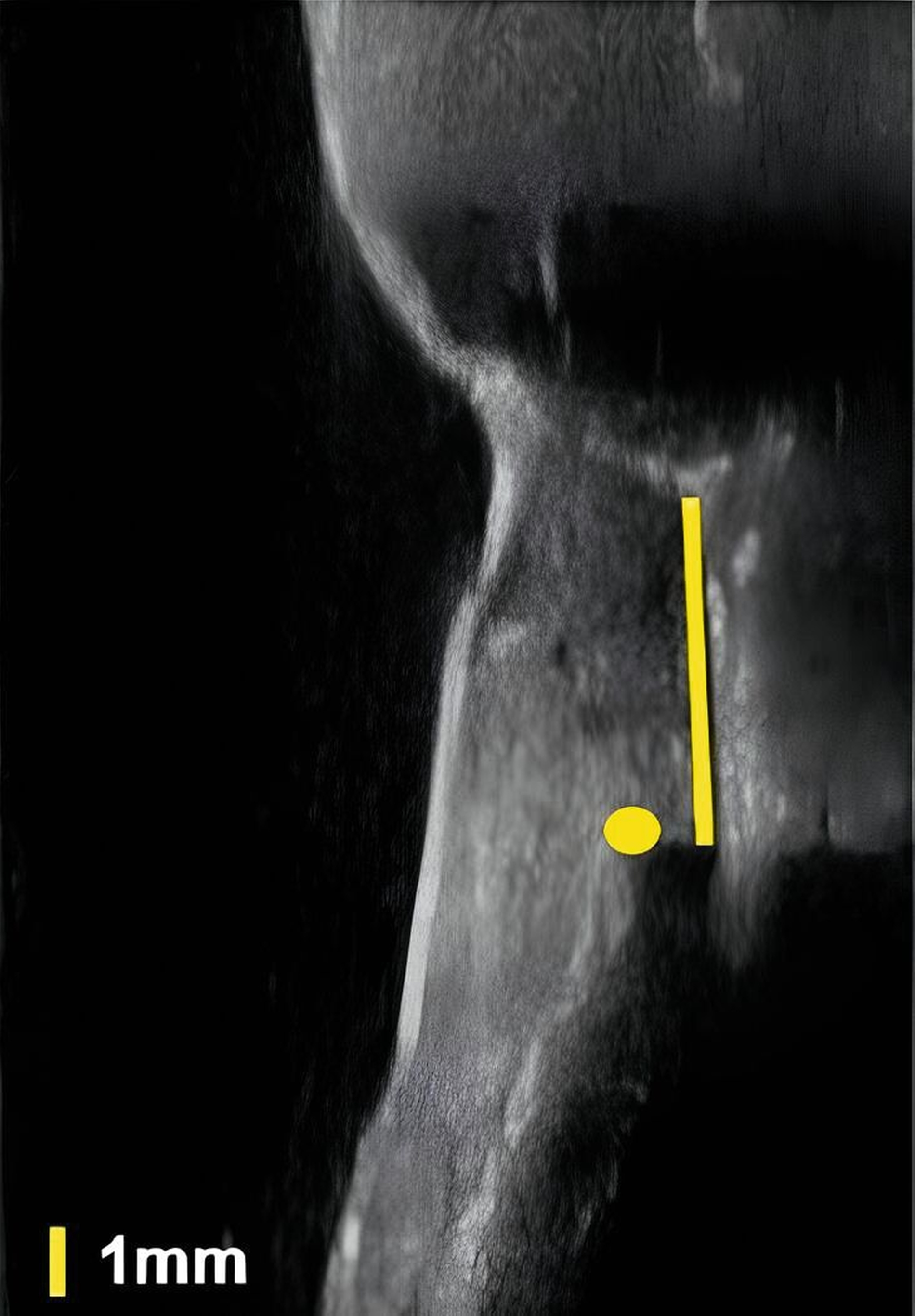
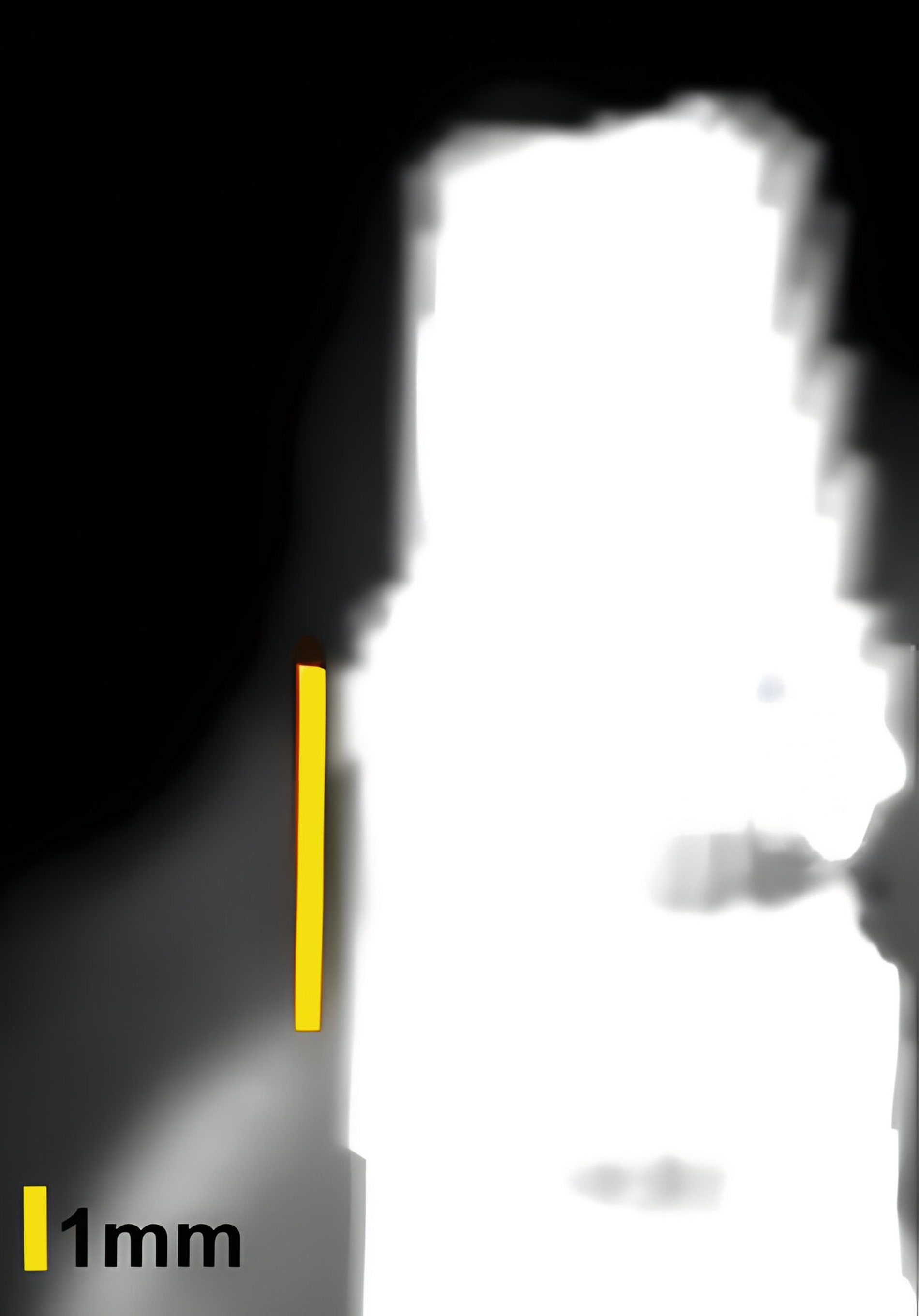
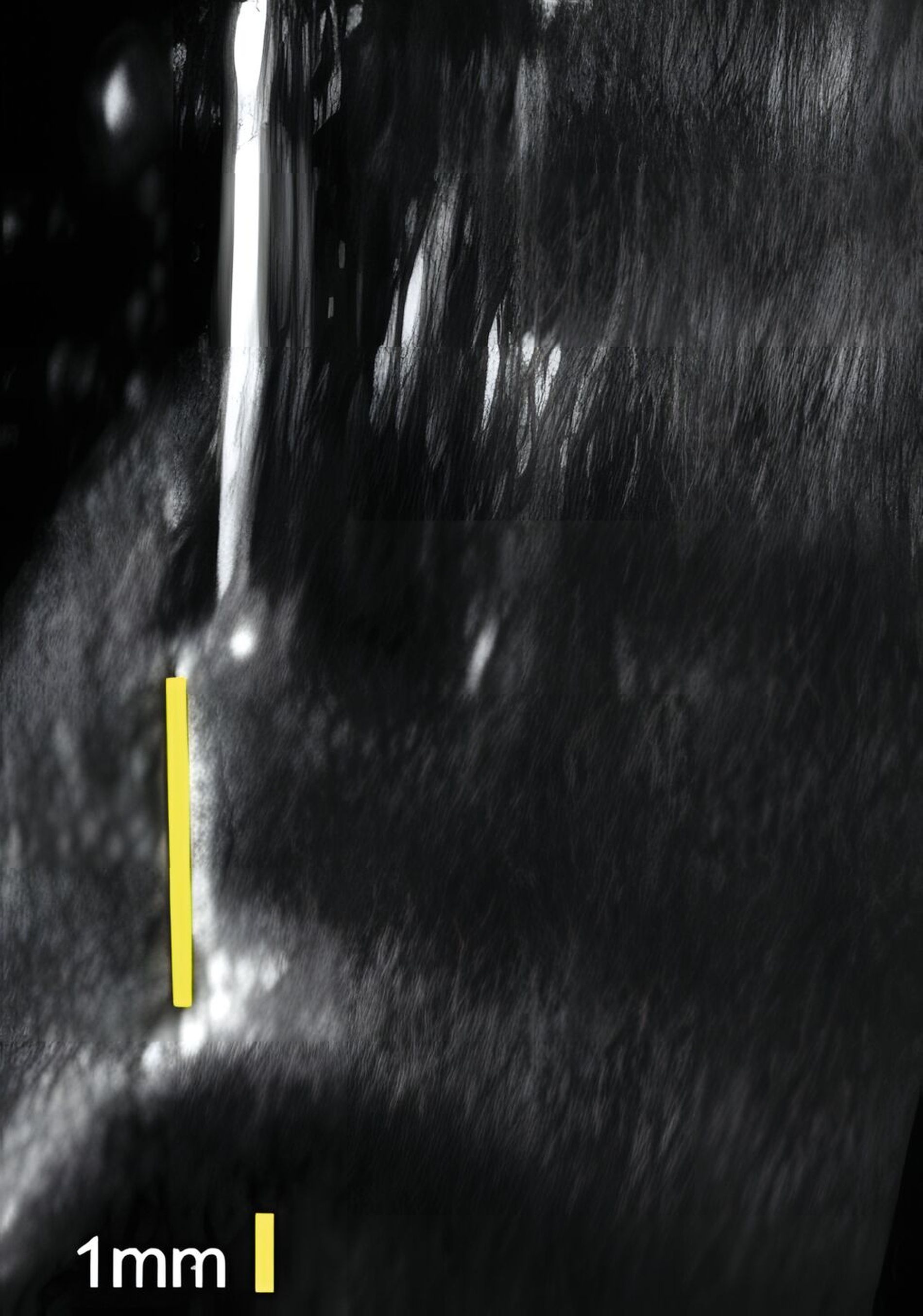
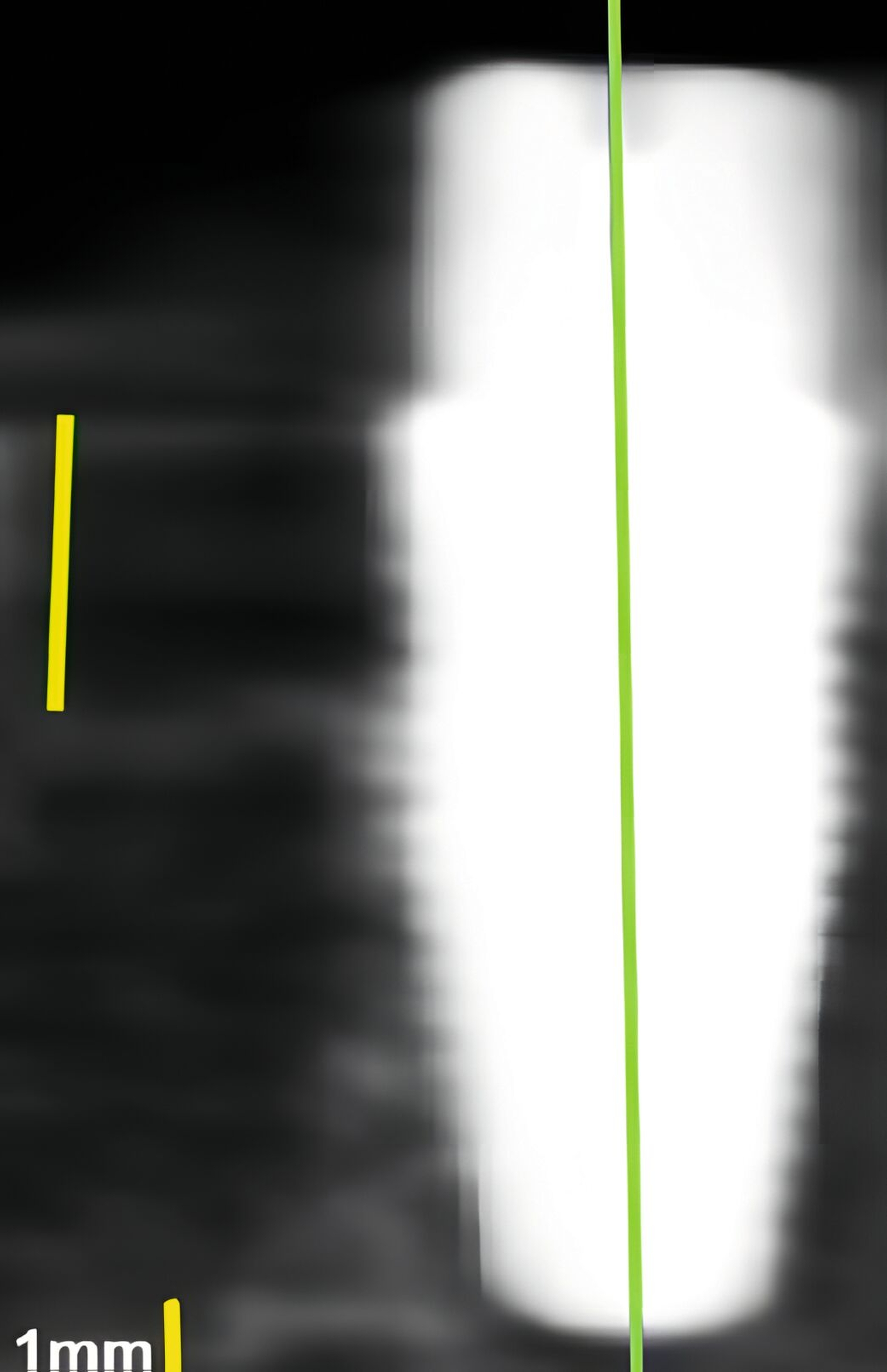
An Zähnen und Implantaten konnten das krestale Knochenniveau und die Weichgewebsdimension exakt anatomisch dargestellt werden (Abbildungen 3 und 4). An Implantaten erfolgte in einer humanen Kadaverstudie der Vergleich zwischen US- und direkten Messungen in Bezug auf die Höhe und die Dicke des Knochenniveaus und des Weichgewebes [Chan et al., 2018]. Die Korrelationen zwischen den US- und den direkten Messungen reichten von 0,92 bis 0,98 (p < 0,0001).
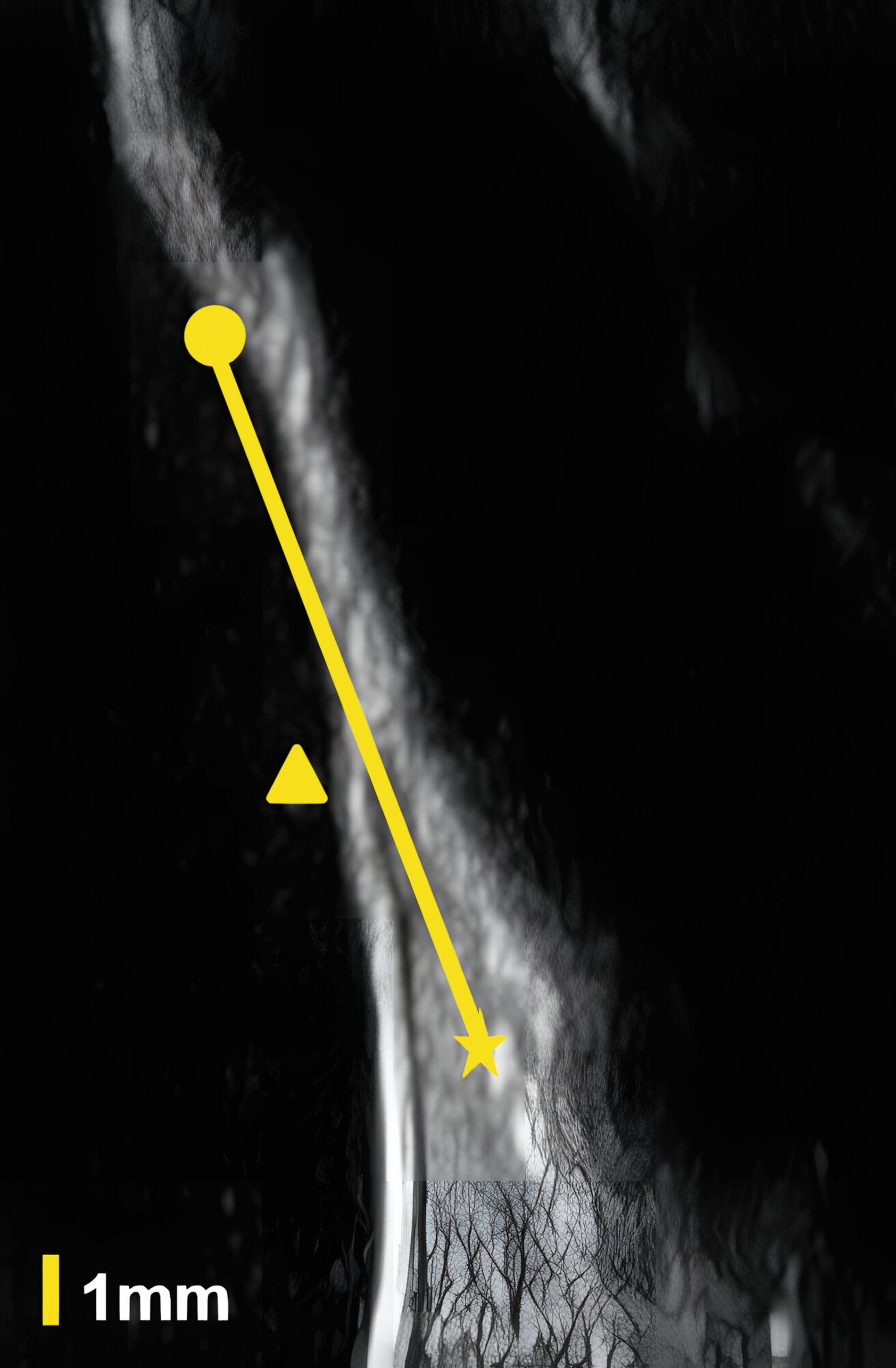
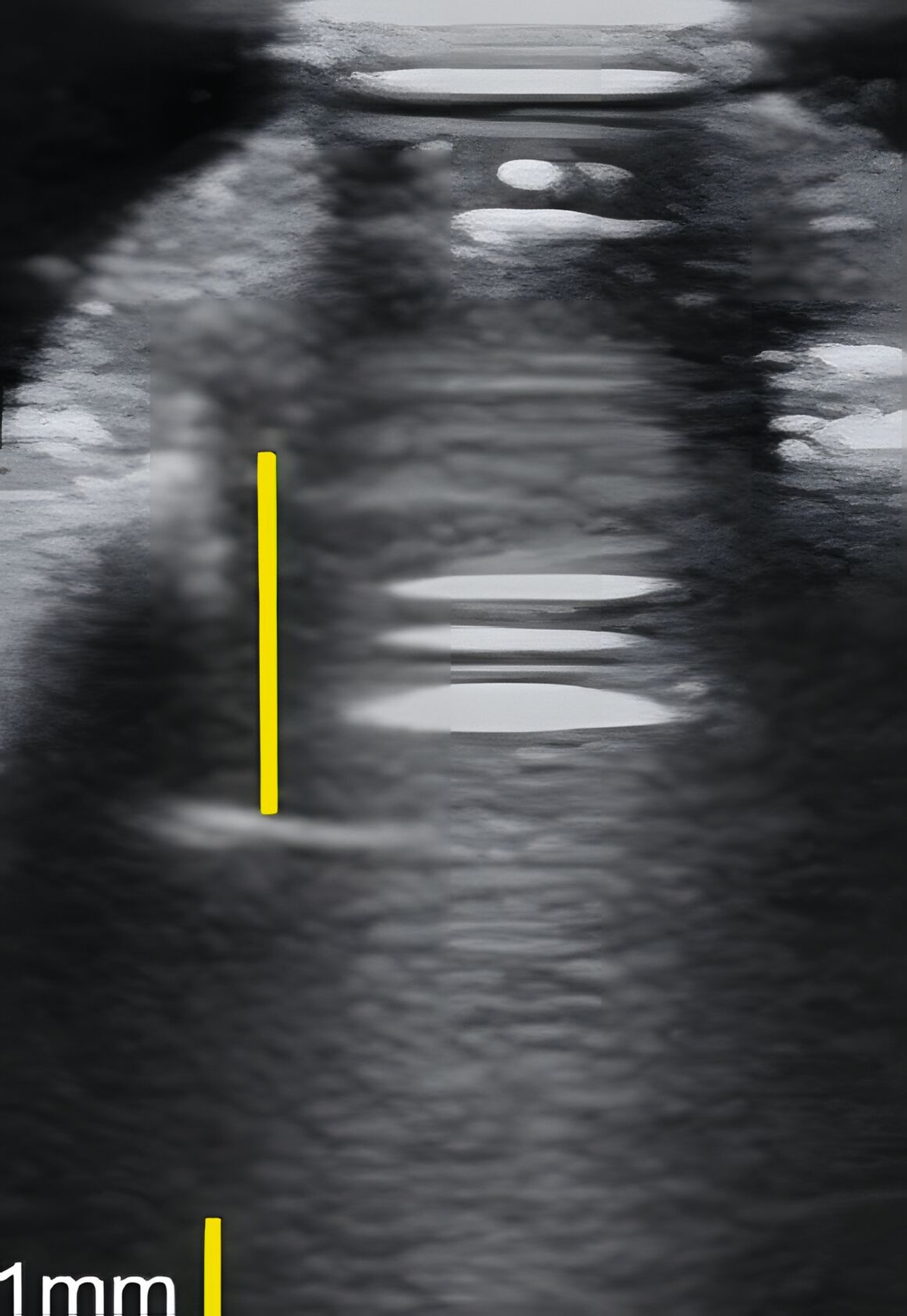
In einer eigenen klinischen Fallserien-Studie an Patienten mit Implantaten konnte erstmals gezeigt werden, dass auch periimplantäre Knochendefekte (Dehiszenzen, Fenestrationen, dreiwandige Defekte) sonografisch vermessen werden können [Thöne-Mühling et al., 2012] (Abbildung 5).
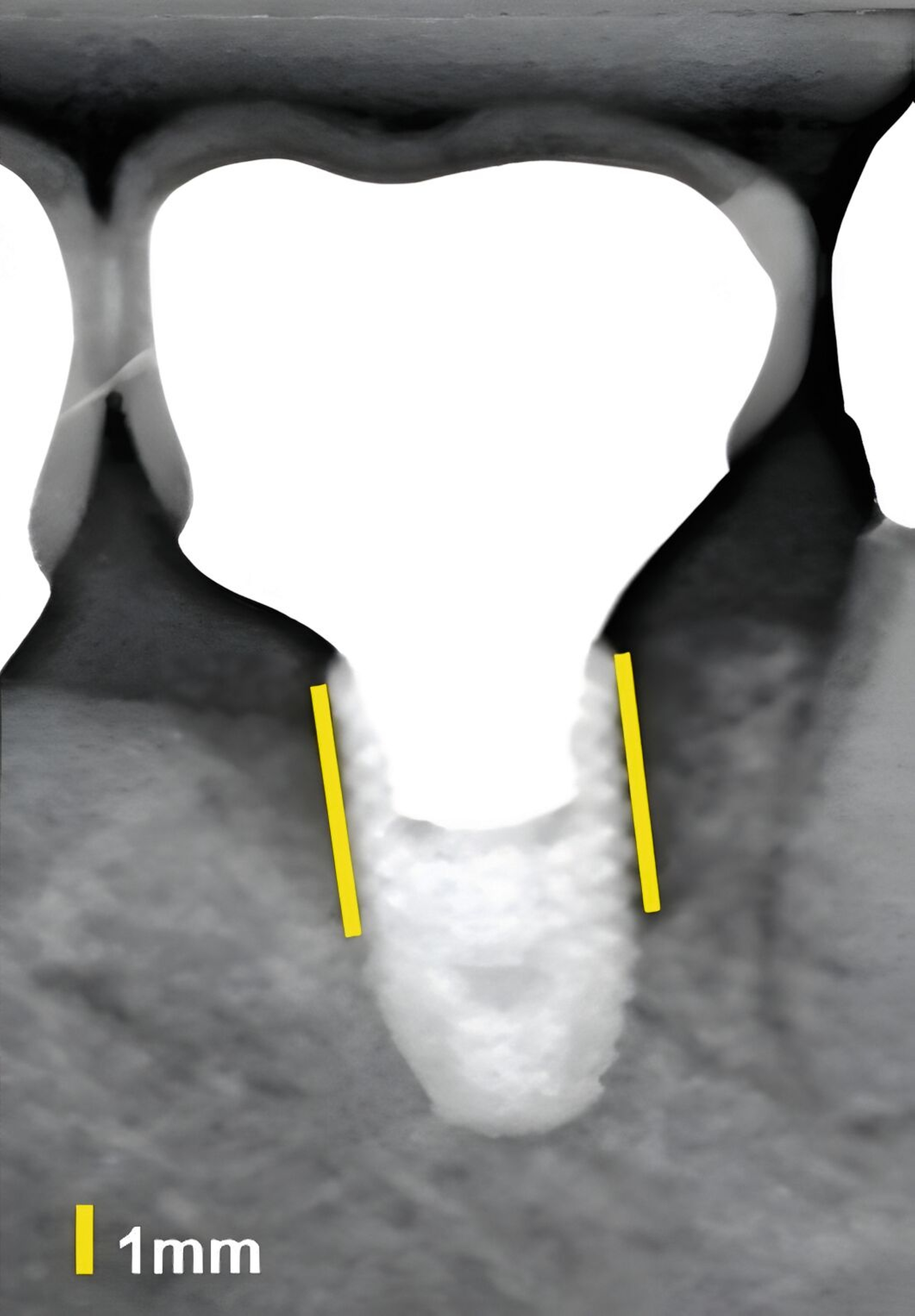
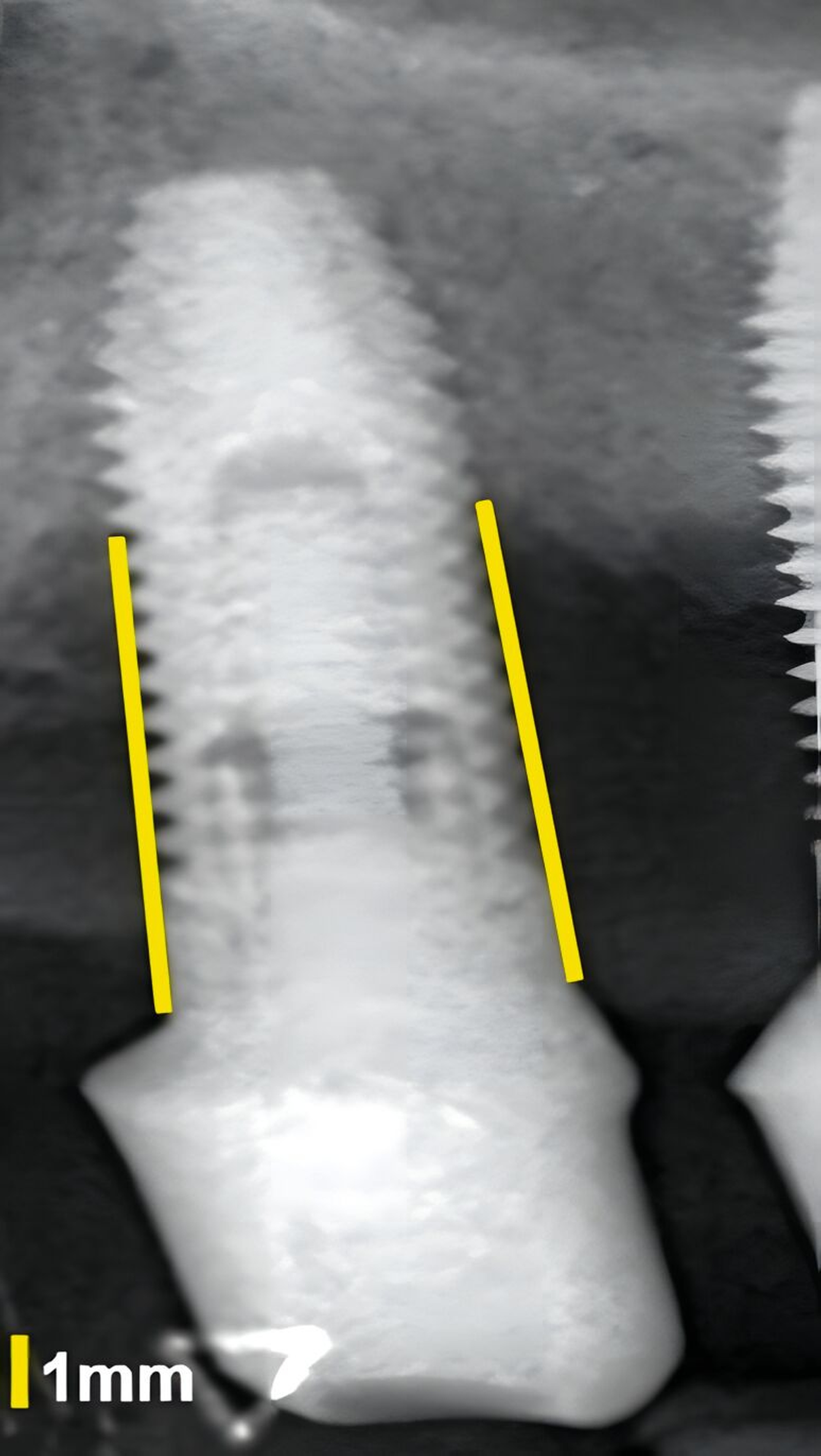
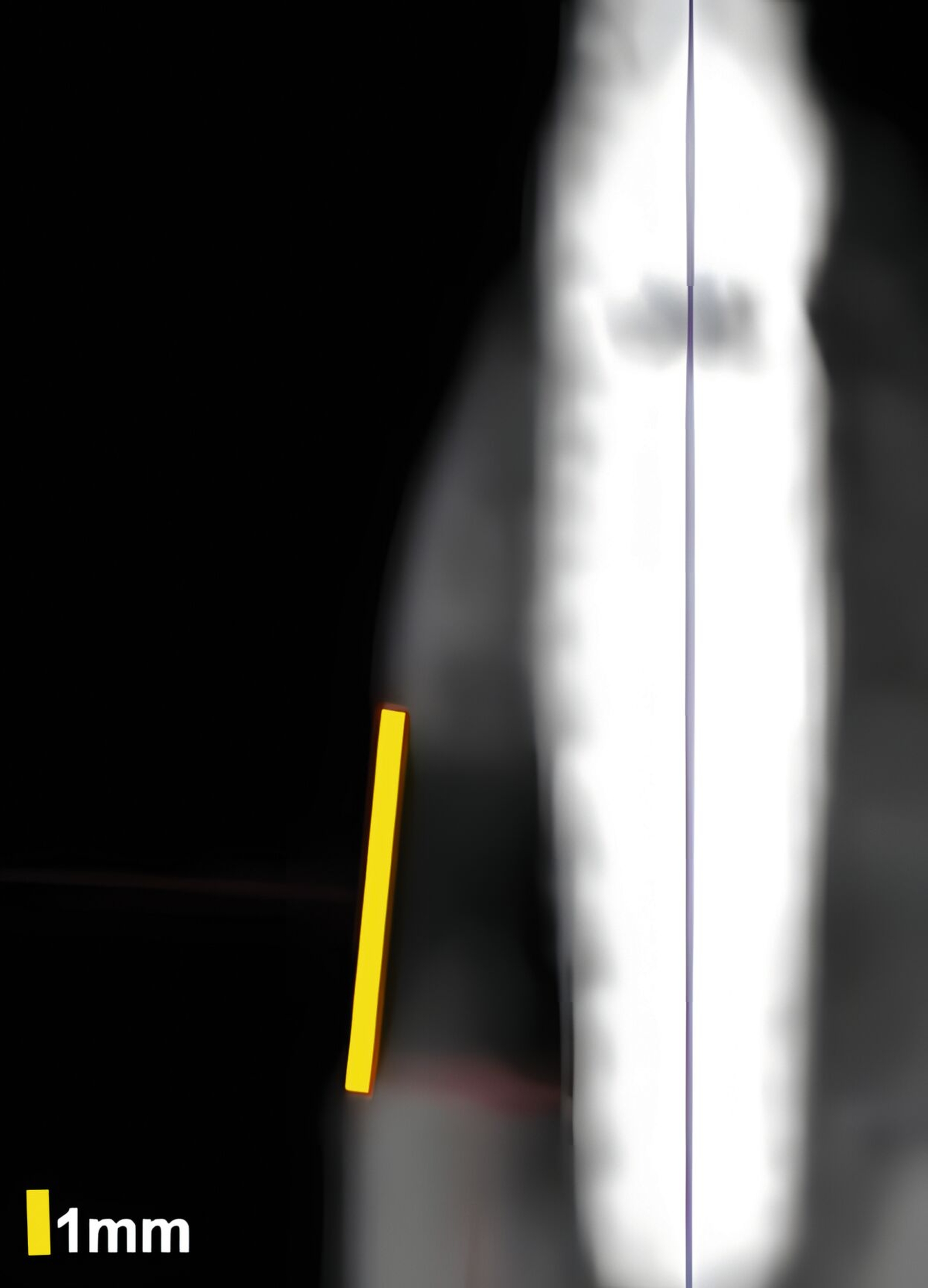
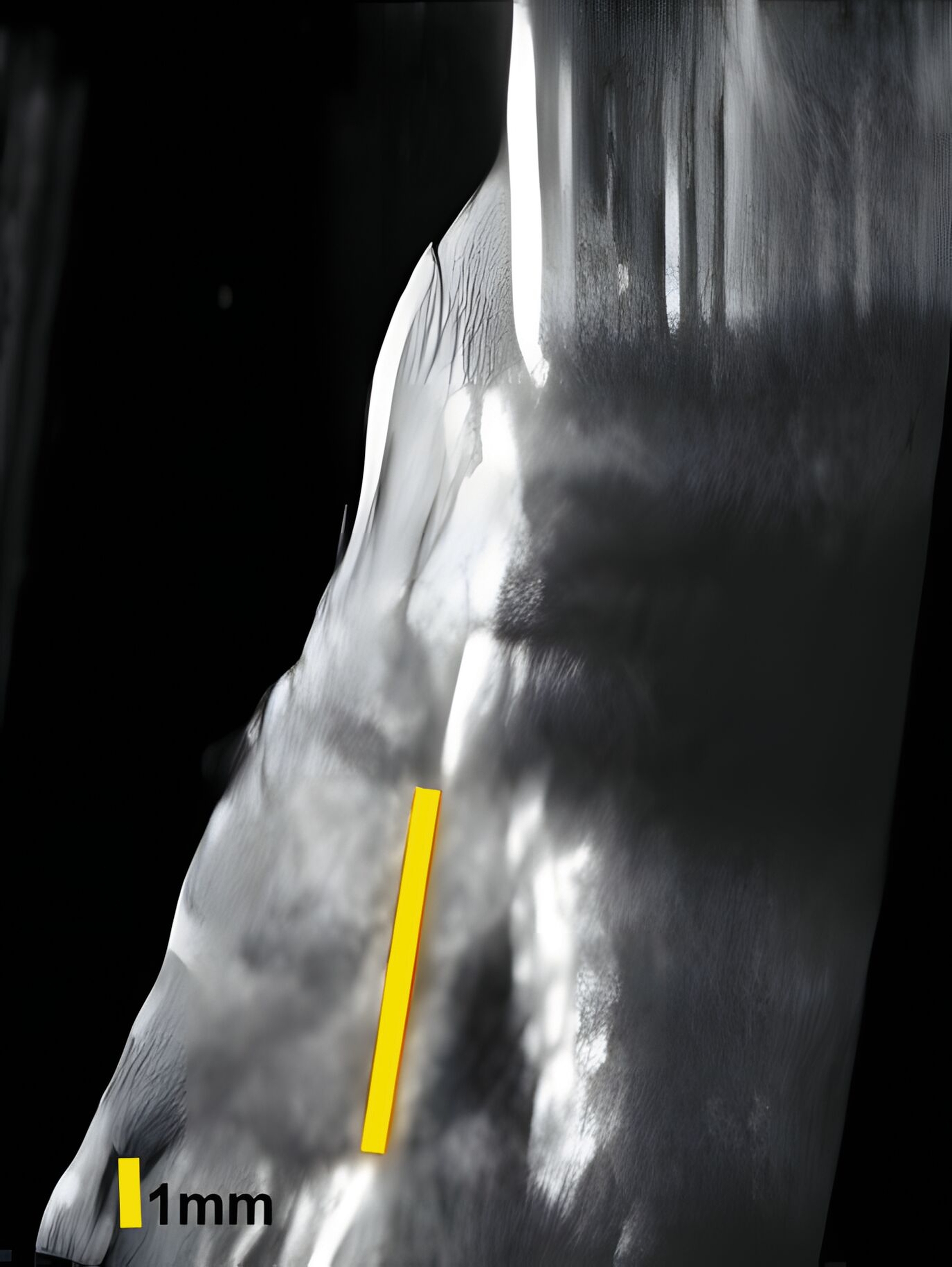
Dies konnte in einer ebenfalls eigenen humanen Kadaverstudie bestätigt werden [Bykhovsky et al., 2024]. Dabei wurden an Implantaten standardisiert Fenestrationen (n = 7), Dehiszenzen (n = 14) und dreiwandige Knochendefekte (n = 6) präpariert (Abbildungen 6 bis 8). Die Defekte wurden mit US- und DVT-Aufnahmen untersucht und die Messungen mit den direkten Messungen verglichen. Die US-Messungen zeigten eine starke Korrelation mit den direkten und den DVT-Messungen. Die sonografische Messgenauigkeit war bei Dehiszenzen am höchsten, gefolgt von Fenestrationen und dreiwandigen Knochendefekten.
In einer aktuellen klinischen Fallserien-Studie wurden impaktierte Oberkiefer-Eckzähne mittels DVT und US-Scanner (30-MHz -Sonde, L-30-8, ZS3, Mindray, Mountain View CA, USA) untersucht [Yatabe et al., 2024]. Der US zeigte sich effektiv in der Lokalisierung der Zähne und in der Beurteilung von Weichgewebsdicke und Gefäßstrukturen, was die chirurgische Planung erleichtert.
Zusammenfassend zeigen die anatomischen US-Untersuchungen des Weich- und Hartgewebes am Zahn und am Implantat sehr gute Ergebnisse. Die Weichgewebsdimension, das Knochenniveau und periimplantäre Knochendefekte können durch US-Aufnahmen verlässlich dargestellt werden.
Beurteilung oraler Entzündungszustände
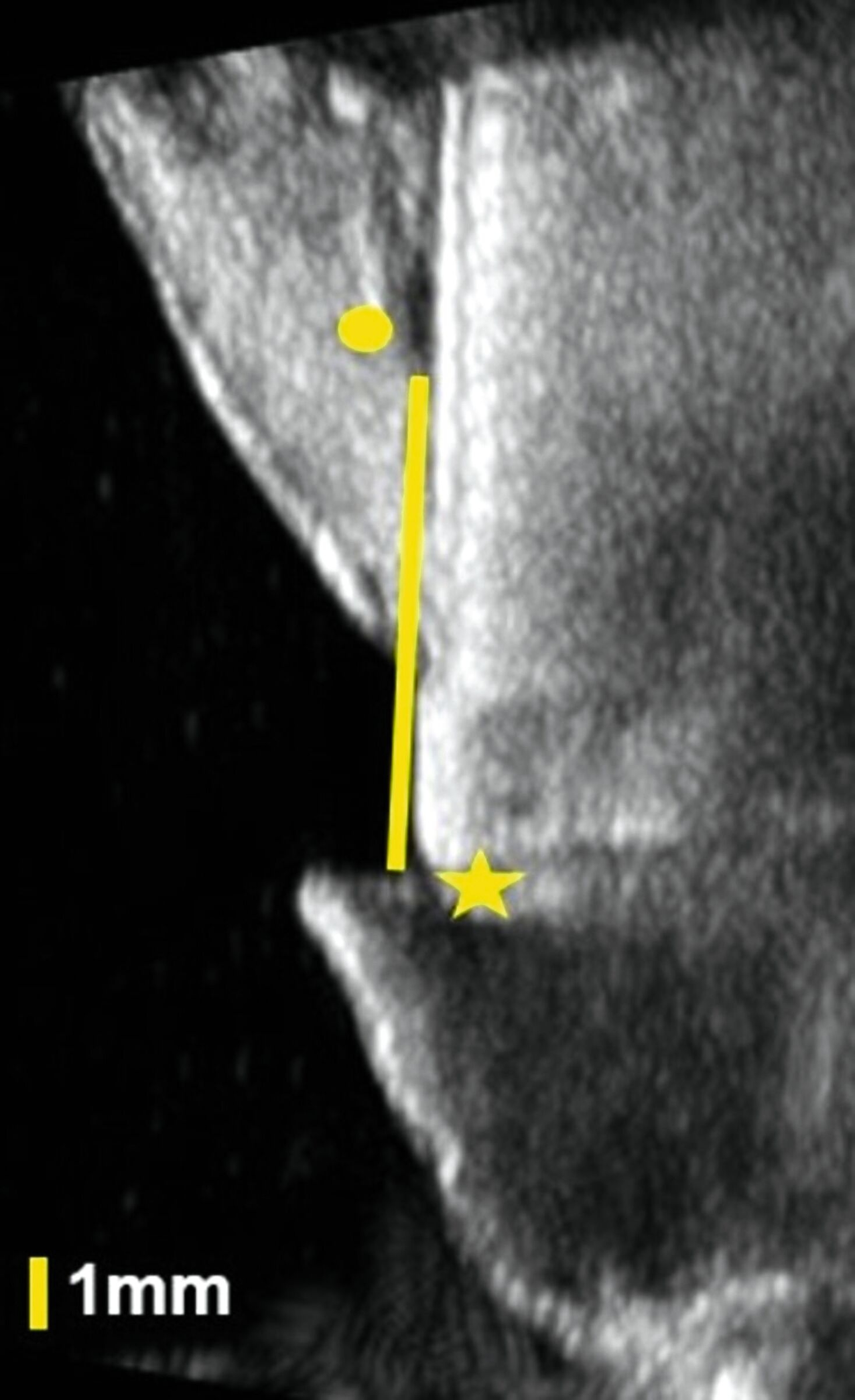
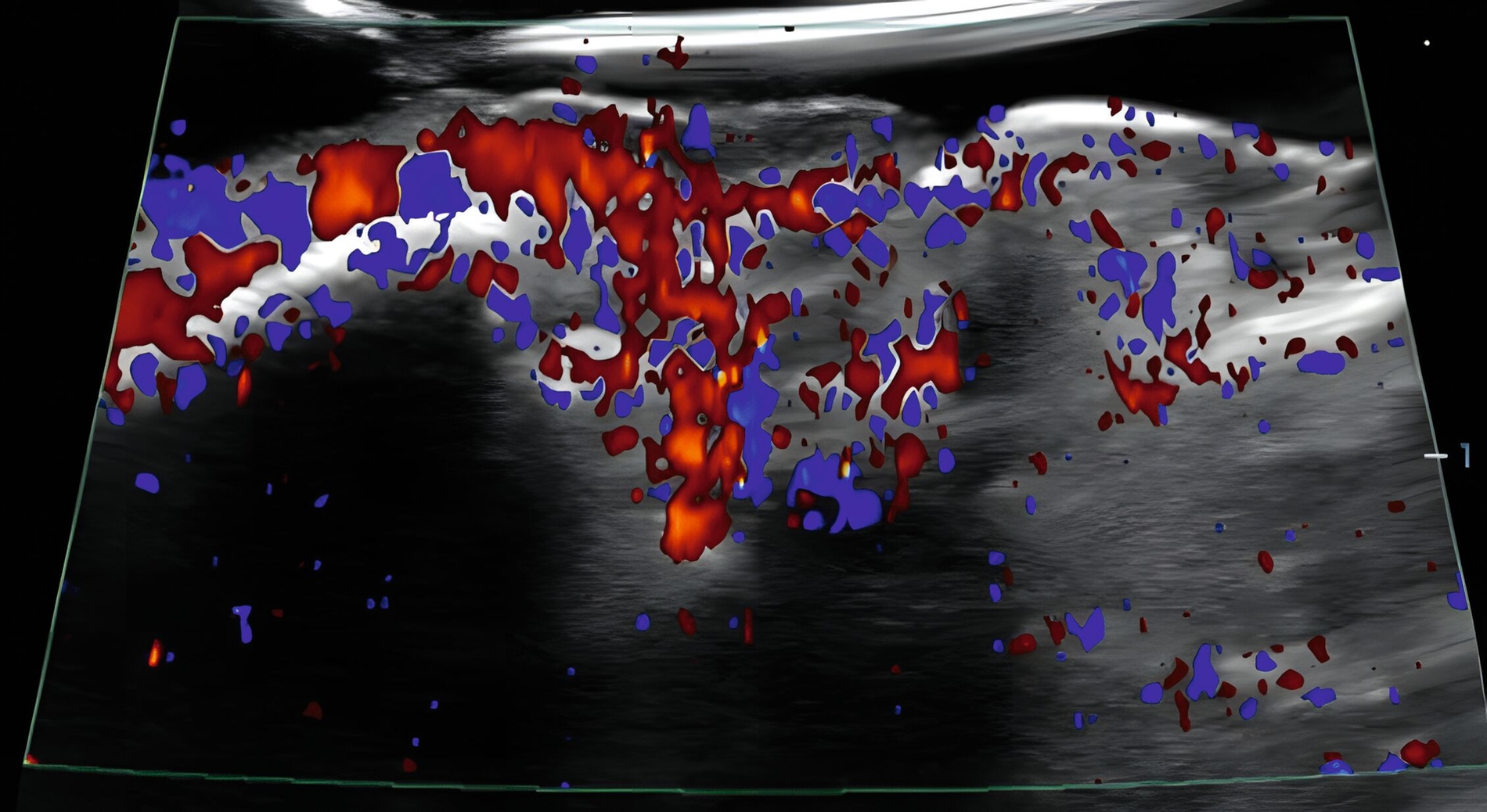
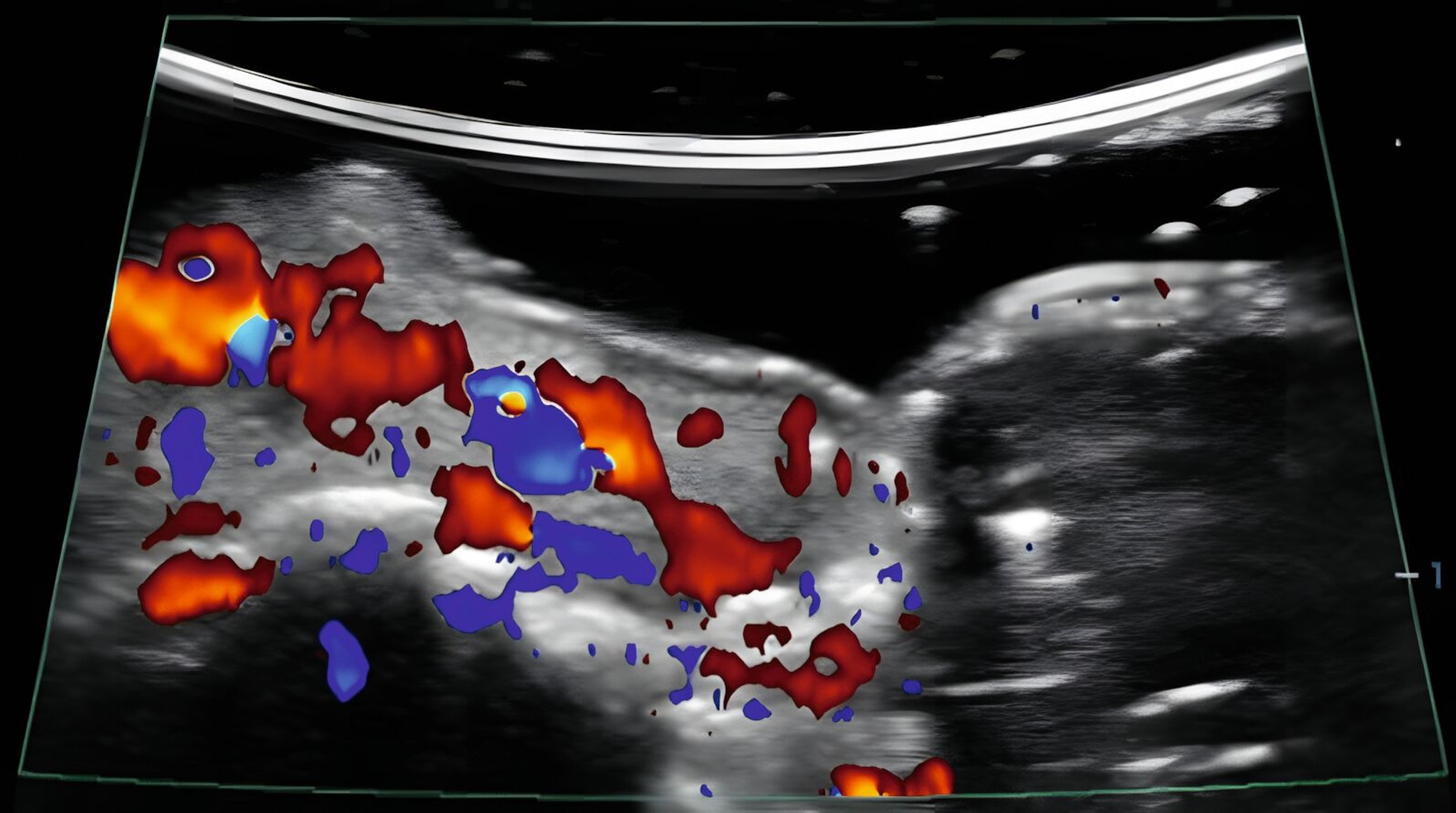
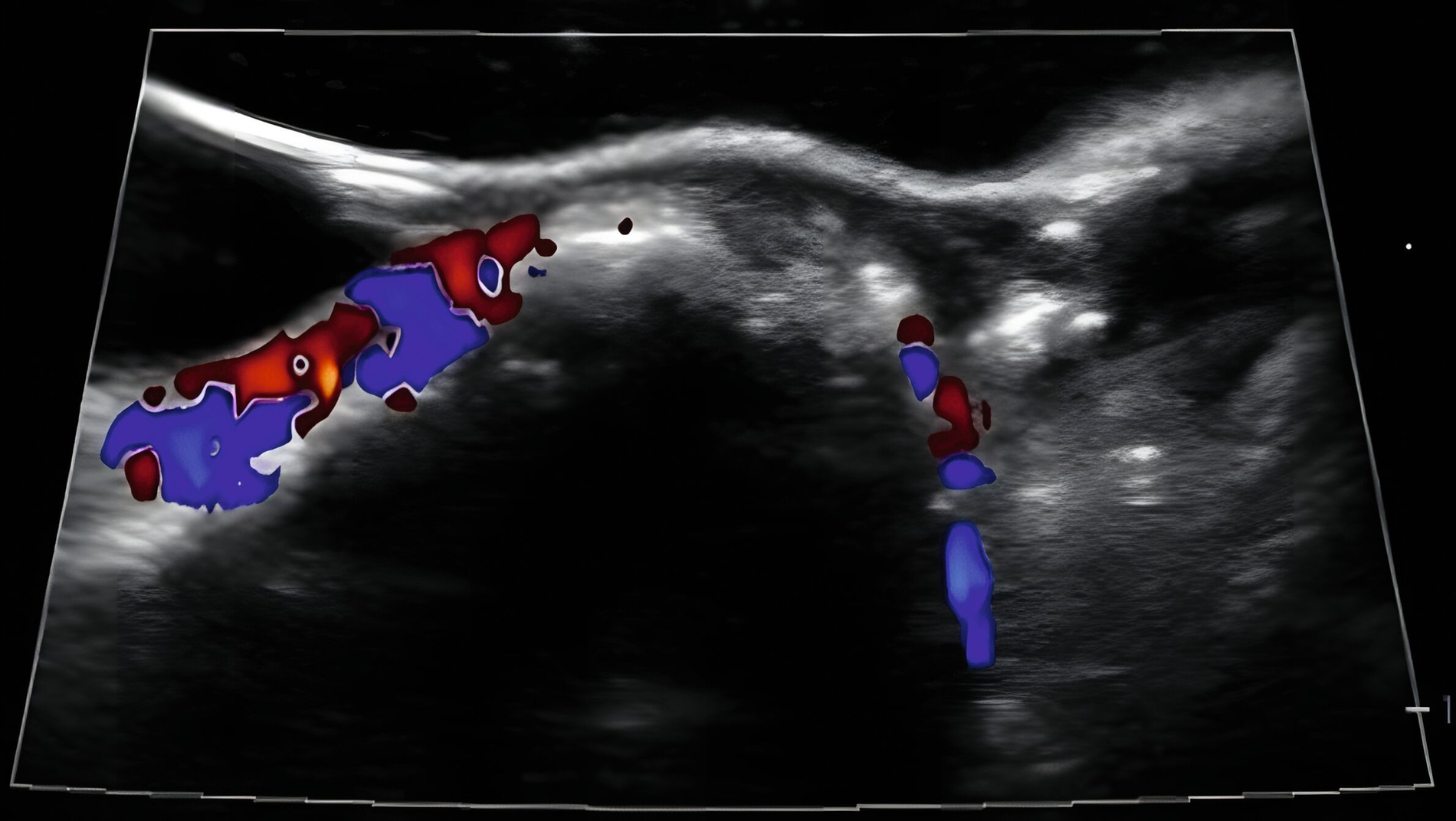
In klinischen Studien konnte gezeigt werden, dass die Sonografie des oralen Weichgewebes zur Beurteilung der dynamischen Gewebeperfusion und von Blutflussschwankungen angewendet werden kann [Chan et al., 2020; Barootchi et al., 2022; Chan & Kripfgans, 2020; Tavelli et al., 2023]. Am Implantat wurde in einer klinischen Studie erstmals mit einer 30-MHz-US-Sonde (ZS3, L30-8, Mindray, Mountain View CA, USA) die Differenzierung zwischen periimplantärer Gesundheit und Erkrankungen beschrieben [Chan et al., 2020] (Abbildung 9).
In einer weiteren klinischen Studie wurde die Aussagekraft der funktionellen Sonografie des periimplantären Weichgewebes bei Implantaten mit unterschiedlichen klinischen Diagnosen (gesund, periimplantäre Mukositis oder Periimplantitis) untersucht [Barootchi et al., 2022]. Der US-Farbfluss konnte die periimplantäre Durchblutung messen und die US-Messungen stimmten mit den klinischen Diagnosen überein.
Zusammenfassend zeigen die Ergebnisse, dass die funktionelle Sonografie (Gewebeperfusion und Blutflussschwankungen) zur Differenzierung des oralen, weichgewebigen Entzündungsgrades angewendet werden kann.
Diskussion
Die intraorale Sonografie ist eine frei von Röntgenstrahlung arbeitende, nicht-invasive, in Echtzeit und „chairside“ anzuwendende Technik, die in der zahnärztlichen Diagnostik ein vielversprechendes Potenzial aufweist. Sie ermöglicht an Zähnen und an Implantaten eine verlässliche Darstellung der Dicke und der Höhe von Weichgewebe sowie der krestalen Knochendicke, des Knochenniveaus und der Knochendefekte. Ein bedeutender Vorteil von US-Aufnahmen besteht darin, dass beim Vorhandensein von Metallen, zum Beispiel bei Implantaten und Kronen, keine störenden Artefakte auftreten und dennoch eine hohe räumliche Auflösung und ein hoher Bildkontrast erzielt werden können [Siqueira et al., 2021].
Neben der anatomischen Darstellung wird auch die funktionelle Bildgebung zur Beurteilung der Gewebedurchblutung mittels Farbfluss (traditionell Farb-Doppler genannt) intensiv untersucht. In klinischen Studien konnte die Sonografie zur Differenzierung parodontaler und periimplantärer Erkrankungen erfolgreich angewendet werden.
Trotz der vielen Vorteile der US-Anwendung in der täglichen Diagnostik müssen die Nachteile benannt werden:
Die Bildqualität hängt stark von den technischen Fähigkeiten des Behandlers ab und erfordert eine gute Anlagerung des Koppelmediums zwischen Sondenkopf und zu untersuchender Oberfläche. Die Sonde sollte möglichst parallel zur Längsachse des Zahns/Implantats platziert werden, um Verzerrungen zu vermeiden und ein maßstabsgetreues Bild zu erhalten.
In einigen Fällen verhindern anatomische Hindernisse wie etwa ein hoher Mundboden eine angemessene Sondenausrichtung. Die Visualisierung von tiefen infraossären Defekten mit dicken bukkalen Knochenwänden und mehrwandigen Knochentaschen ist aufgrund der erschwerten Sondenausrichtung nicht immer zuverlässig. Bei der Beurteilung von Weichgewebe und vom krestalen Knochenniveau schränken das Ausmaß und die Schwere des krestalen Knochenverlusts die Aussagekraft der US-Bildgebung ein, so dass ein fortgeschrittener Knochenverlust (> 6 mm) weniger genau ist als ein geringerer Knochenverlust.
US-Aufnahmen können nur einen fokussierten Bereich im Querschnittsbild darstellen, eine Gesamtdarstellung aller Zähne und Implantate wie in einer Panoramaschichtaufnahme ist daher zeitaufwendig.
Einige dieser Nachteile werden durch die rasante technische Weiterentwicklung der US-Technologie in der Zukunft vermutlich eliminiert werden können. Durch die Erhöhung der US-Auflösung (< 64 µm für 30 MHz und höher) werden zukünftig der Weichgewebekontrast, die Beurteilung der Hartgewebetopografie sowie die funktionelle Darstellung des oralen Weichgewebes verbessert. Die Entwicklung von kleineren und flexibleren Sonden wird die intraorale Handhabung deutlich vereinfachen. Insbesondere die Kombination von US-Bildgebung mit Künstlicher Intelligenz (KI) ist vielversprechend und hat das Potenzial, die Genauigkeit und die Effizienz von US-Aufnahmen zu verbessern.
Weiterhin zeichnet sich die KI durch die automatische Erkennung komplexer Muster und die quantitative Bewertung von Bildgebungsdaten aus. Sie kann den Behandler bei der zuverlässigen und reproduzierbaren US-Diagnostik unterstützen und spart somit Zeit (für Patienten und Behandler) bei der Untersuchung [Pan et al., 2022]. Durch diese technischen Verbesserungen könnten künftig chirurgische Eingriffe wie Implantationen, Knochenaufbauten, Transplantate, Kieferhöhlenaufbauten und parodontale Eingriffe optimal geplant werden.
Mundschleimhauterkrankungen, Tumore und andere orale Anomalien werden besser visualisiert. Ein weiterer Einsatzbereich der Sonografie ist die Untersuchung der Kiefergelenke, um die Position und die Beweglichkeit der Kiefergelenke zu beurteilen und mögliche Probleme wie Entzündungen oder Verletzungen zu erkennen. Auch in der Kieferorthopädie ist bei Kindern die frühzeitige Diagnostik der Gaumennaht und die Überwachung der Zahnentwicklung durch die nichtinvasiv und strahlungsfrei arbeitende US-Diagnostik sehr vielversprechend [Cook et al., 2022, Yatabe et al., 2024].
Zusammenfassend ist festzustellen, dass die Sonografie eine wertvolle Ergänzung zur zahnärztlichen Diagnostik darstellt, gerade in Bereichen, in denen herkömmliche Methoden Einschränkungen aufweisen. Sie wird jedoch in absehbarer Zeit die klinische und die radiologische Untersuchung nicht ersetzen, sondern vielmehr sinnvoll ergänzen.
Literaturliste
Barootchi S, Tavelli L, Majzoub J, Chan HL, Wang HL, Kripfgans OD. Ultrasonographic Tissue Perfusion in Peri-implant Health and Disease. J Dent Res. 2022 Mar;101(3):278-285. doi: 10.1177/00220345211035684. Epub 2021 Sep 13. PMID: 34515570; PMCID: PMC8982012.
Baum, G., Greenwood, I., & Slawski, L. (1963). Ultrasonics in Oral Diagnosis. Journal of Dental Research, 42(6), 1464-1471.
Bhaskar V, Chan HL, MacEachern M, Kripfgans OD. Updates on ultrasound research in implant dentistry: a systematic review of potential clinical indications. Dentomaxillofac Radiol. 2018 Jul;47(6):20180076. doi: 10.1259/dmfr.20180076. Epub 2018 Jun 6. PMID: 29791198; PMCID: PMC6196056.
Bykhovsky I, Hildner A, Kripfgans OD, Mengel R. Sonography in the diagnosis of peri-implant bone defects: An in vitro study on native human mandibles. Clin Oral Implants Res. 2024 Jun 4. doi: 10.1111/clr.14302. Epub ahead of print. PMID: 38837465.
Chan HL, Kripfgans OD. Ultrasonography for diagnosis of peri-implant diseases and conditions: a detailed scanning protocol and case demonstration. Dentomaxillofac Radiol. 2020 Oct 1;49(7):20190445. doi: 10.1259/dmfr.20190445. Epub 2020 Feb 6. PMID: 32017634; PMCID: PMC7549532.
Chan, H.L, & Kripfgans, O.D. (2021). Dental ultrasound in periodontology and implantology examination, Diagnosis and treatment outcome evaluation. Page 2-3 ISBN 978-3-030-51287-3, doi.org/10.1007/978-3-030-51288-0
Chan HL, Sinjab K, Chung MP, Chiang YC, Wang HL, Giannobile WV, Kripfgans OD. Non-invasive evaluation of facial crestal bone with ultrasonography. PLoS One. 2017 Feb 8;12(2):e0171237. doi: 10.1371/journal.pone.0171237. PMID: 28178323; PMCID: PMC5298227.
Chan HL, Sinjab K, Li J, Chen Z, Wang HL, Kripfgans OD. Ultrasonography for noninvasive and real-time evaluation of peri-implant tissue dimensions. J Clin Periodontol. 2018 Aug;45(8):986-995. doi: 10.1111/jcpe.12918. Epub 2018 Jun 25. PMID: 29757464.
Chifor R, Li M, Nguyen KT, Arsenescu T, Chifor I, Badea AF, Badea ME, Hotoleanu M, Major PW, Le LH. Three-dimensional periodontal investigations using a prototype handheld ultrasound scanner with spatial positioning reading sensor. Med Ultrason. 2021 Aug 11;23(3):297-304. doi: 10.11152/mu-2837. Epub 2021 Mar 3. PMID: 33657191.
Cook, J., Chan, H.L., Yatabe, M., Soki, F., & Kripfgans, O.D. (2022) Novel intraoral ultrasonography to assess midpalatal suture anatomy. Oral Surgery, Oral Medicine, Oral Pathology and Oral Radiology. 134 (3), e76-e77. doi.org/10.1016/j.oooo.2022.04.024.
Irion KM, Löst W. (1984). Bestimmung der Ultraschhallausbreitung in Zahnhartsubstanzen und im Alveolarknochen. Biomed Technik. Band 29 (Ergänzungsband).131-132.
Irion KM, Nüssle W, Löst C, Faust U. Bestimmung akustischer Kenngrössen von Schmelz, Dentin und Alveolarknochen [Determination of the acoustical properties of enamel, dentin and alveolar bone]. Ultraschall Med. 1986 Apr;7(2):87-93. German. doi: 10.1055/s-2007-1011921. PMID: 3520818.
Kripfgans, O.D., & Chan, H.L. (2021). System requirements for intraoral ultrasonic scanning. Dental ultrasound in periodontology and implantology: Examination, diagnosis and treatment outcome evaluation, page 59-78.
Löst C, Irion KM, Nüssle W. Periodontal ultrasonic diagnosis: experiments on thin bony platelets and on a simulated periodontal ligament space. J Periodontal Res. 1988 Nov;23(6):347-51. doi: 10.1111/j.1600-0765.1988.tb01612.x. PMID: 2975327.
Löst C, Irion KM, Nüssle W (1986b). Messung der Schallausbreitungsgeschwindigkeit in Zahnhartsubstanzen und Alveolarknochen. Deutsche Zahnärztiche Zeitschrift; 41: 1082-1087.
Müller HP, Schaller N, Eger T. Ultrasonic determination of thickness of masticatory mucosa: a methodologic study. Oral Surg Oral Med Oral Pathol Oral Radiol Endod. 1999 Aug;88(2):248-53. doi: 10.1016/s1079-2104(99)70123-x. PMID: 10468471.
Müller HP, Barrieshi-Nusair KM, Könönen E. Repeatability of ultrasonic determination of gingival thickness. Clin Oral Investig. 2007 Dec;11(4):439-42. doi: 10.1007/s00784-007-0125-0. Epub 2007 May 24. PMID: 17522899.
Müller HP, Könönen E. Variance components of gingival thickness. J Periodontal Res. 2005 Jun;40(3):239-44. doi: 10.1111/j.1600-0765.2005.00798.x. PMID: 15853970.
Pan YC, Chan HL, Kong X, Hadjiiski LM, Kripfgans OD. Multi-class deep learning segmentation and automated measurements in periodontal sonograms of a porcine model. Dentomaxillofac Radiol. 2022 Mar 1;51(3):20210363. doi: 10.1259/dmfr.20210363. Epub 2021 Nov 23. PMID: 34762512; PMCID: PMC8925874.
Reda R, Zanza A, Cicconetti A, Bhandi S, Miccoli G, Gambarini G, Di Nardo D. Ultrasound Imaging in Dentistry: A Literature Overview. J Imaging. 2021 Nov 14;7(11):238. doi: 10.3390/jimaging7110238. PMID: 34821869; PMCID: PMC8624259.
Resende EA, Gomes NR, Abreu LG, Castro MAA, Aguiar MCF. The applicability of ultrasound in the diagnosis of inflammatory and obstructive diseases of the major salivary glands: a scoping review. Dentomaxillofac Radiol. 2022 May 1;51(4):20210361. doi: 10.1259/dmfr.20210361. Epub 2021 Nov 23. PMID: 34762496; PMCID: PMC9499200.
Rodriguez Betancourt A, Samal A, Chan HL, Kripfgans OD. Overview of Ultrasound in Dentistry for Advancing Research Methodology and Patient Care Quality with Emphasis on Periodontal/Peri-implant Applications. Z Med Phys. 2023 Aug;33(3):336-386. doi: 10.1016/j.zemedi.2023.01.005. Epub 2023 Mar 13. PMID: 36922293; PMCID: PMC10517409.
Siqueira R, Sinjab K, Pan YC, Soki F, Chan HL, Kripfgans O. Comprehensive peri-implant tissue evaluation with ultrasonography and cone-beam computed tomography: A pilot study. Clin Oral Implants Res. 2021 Jul;32(7):777-785. doi: 10.1111/clr.13758. Epub 2021 May 3. PMID: 33866602; PMCID: PMC8266744.
Tavelli L, Barootchi S, Majzoub J, Chan HL, Giannobile WV, Wang HL, Kripfgans OD. Ultrasonographic tissue perfusion analysis at implant and palatal donor sites following soft tissue augmentation: A clinical pilot study. J Clin Periodontol. 2021 Apr;48(4):602-614. doi: 10.1111/jcpe.13424. Epub 2021 Feb 3. PMID: 33465812; PMCID: PMC8058327.
Thöne-Mühling M, Kripfgans OD, Mengel R. Ultrasonography for noninvasive and real-time evaluation of peri-implant soft and hard tissue: a case series. Int J Implant Dent. 2021 Sep 14;7(1):95. doi: 10.1186/s40729-021-00375-2. PMID: 34518926; PMCID: PMC8438098.
Yatabe M, Kripfgans O, Chan HL, Xu J, Cook J, Soki F. Ultrasonography as an additional tool to localize impacted canines. Oral Radiol. 2024 Aug 10. doi: 10.1007/s11282-024-00769-z. Epub ahead of print. PMID: 39126535.