Das gute Virus
Die Entdeckung der Bakteriophagen geht auf die Wissenschaftler Félix Hubert d'Hérelle und Frederick Twort zurück, die zu Beginn des 20. Jahrhunderts unabhängig voneinander ein Agens beschrieben, das Bakterien aktiv zerstört. D’Hérelle erschuf daraufhin den Begriff „Bakteriophage“, was so viel bedeutet wie „Bakterienfresser“ und sich von dem griechischen „phagein“ (essen, fressen) ableitet.
Der erste klinische Einsatz von Phagen wird ebenfalls d’Hérelle zugeschrieben. Er isolierte Phagen aus Stuhlproben von Soldaten, die an Shigellose („Bakterien-Ruhr“) litten, jedoch auf dem Weg der Genesung waren, und verabreichte diese wiederum an erkrankte Patienten, die sich daraufhin ebenfalls erholten [d'Hérelle, 1917]. Mit dem Bakteriologen Georgi Eliava gründete d’Hérelle 1938 das „G. Eliava Institute of Bacteriophages, Microbiology and Virology“ in Tbilissi, Georgien, das bis heute besteht und weltweit über bedeutende klinische Erfahrungen in der Phagen-Therapie verfügt [Sulakvelidze et al., 2001].
Phagen sind hochspezifisch – sie befallen meist nur eine bestimmte Bakterienart. Sie heften sich zuerst an unterschiedliche Erkennungsmoleküle an der Oberfläche der Bakterien an, schleusen anschließend ihr Erbgut in die Bakterienzelle ein und vermehren sich darin. Dabei gibt es zwei mögliche Vermehrungsstrategien (Abbildung 2). Im lytischen Zyklus findet direkt die virale Replikation statt und die fertigen Viren zerstören das Bakterium, um die Nachkommenviren freizulassen, die wiederum weitere Bakterien infizieren. Eben diese lytischen Phagen sind für therapeutische Anwendungen besonders vielversprechend.
Einige Bakteriophagen können jedoch auch einen sogenannten lysogenen Zyklus durchlaufen, bei dem sie ihr Erbgut in das ihres Bakterienwirts integrieren, ohne sie dabei sofort zu zerstören. Dann werden sie als Prophagen bezeichnet. Prophagen besitzen oftmals Virulenzgene und haben Einfluss auf die Pathogenität ihres Wirtsbakteriums [Canchaya et al., 2003]. Sie können zudem einen lateralen Gentransfer ermöglichen, was im Hinblick auf die Ausbreitung von Antibiotika-Resistenzgenen ein Risiko darstellt. Deshalb werden lysogene und transduzierende Phagen für medizinische Zwecke nicht in Betracht gezogen.
Wichtig ist auch, dass spezielle Enzyme von Bakteriophagen in der Lage sind, bestimmte Strukturen eines Biofilms zu zerstören. Biofilme bestehen grundsätzlich aus einer Vielzahl an Bakterien, die in eine Matrix aus extrazellulären polymeren Substanzen (EPS) wie Polysaccharide und Proteine eingebettet sind. Diese Matrix dient in Biofilmen zur mechanischen Stabilität, als Nahrungsreservoir und als Schutz vor äußeren schädlichen Einflüssen. Einige Bakteriophagen produzieren Enzyme, sogenannte Depolymerasen, die gezielt Komponenten dieser EPS-Matrix abbauen können [Pires et al., 2016; Liu et al., 2022].
Diese Eigenschaften sind besonders in der Zahnmedizin von Bedeutung. Jeder Mensch besitzt Biofilme im oralen Bereich, der allgemein auch als „Plaque“ bezeichnet wird. Er besteht aus synergistischen und antagonistischen Mikroorganismen, die sich bei oraler Gesundheit in einem Zustand der Homöostase befinden. Durch unterschiedliche Einflüsse kann dieses Gleichgewicht jedoch zerstört werden, so dass eine Dysbiose entsteht. Durch diesen Zustand können im supragingivalen Bereich säuretolerante und säureproduzierende kariespathogene Keime wie Streptococcus mutans, Lactobacillus spp., Actinomyces spp. und Bifidobacterium spp. dominieren.
Im subgingivalen Bereich dominieren parodontalpathogene Mikroorganismen wie Porphyromonas gingivalis, Tanerella forsythia, Fusobacterium nucleatum und Aggregatibacter actinomycetemcomitans [Lamont et al., 2018]. Endodontische Erkrankungen entstehen durch das Eindringen von Mikroorganismen in den Pulpa-Dentin-Komplex infolge tiefer kariöser Läsionen oder parodontaler Erkrankungen. Ein Keim, der bei persistierenden endodontischen Infektionen sehr häufig im infizierten Wurzelkanalsystem nachgewiesen wurde, ist Enterococcus faecalis.
Die Therapie dieser Biofilm-assoziierten oralen Erkrankungen zielt darauf ab, den pathogenen Biofilm durch verschiedene mechanische, chemische und chirurgische Maßnahmen zu eliminieren beziehungsweise zu kontrollieren, um eine Wiederherstellung der Homöostase zu erreichen. Hierbei wird eine verantwortungsvolle Verwendung von Antibiotika und Antiseptika in der Zahnmedizin in den vergangenen Jahren vermehrt hervorgehoben, dennoch ist der Einsatz nach wie vor hoch. Die damit assoziierte antimikrobielle Resistenz (AMR) ist eine ständig wachsende Bedrohung für die moderne Medizin.
Die Anwendung von Bakteriophagen oder Bakteriophagen-basierten Wirkstoffen wie Endolysinen ist möglicherweise eine alternative Möglichkeit zur spezifischen Behandlung persistenter oraler Infektionserkrankungen. Durch eine zielgerichtete Eliminierung pathogener Keime im dysbiotischen Biofilm könnte eine Nische für verdrängte niedrig-pathogene Spezies entstehen und die Voraussetzung für die Etablierung eines apathogenen Biofilms geschaffen werden. In der Zahnmedizin ist der klinische Einsatz von Phagen im Vergleich zu anderen Bereichen bislang wenig erforscht [Zhu et al., 2025]. Dennoch gibt es bereits viele Ansätze, sich die lytische Wirkung von Phagen zur Therapie von Infektionen in der Mundhöhle zunutze zu machen.
Mit einer geschätzten Anzahl von 1031 Virionen zählen Bakteriophagen zu den am häufigsten vorkommenden Spezies dieses Planeten und sind dadurch maßgeblich an der Regulierung unterschiedlichster mikrobieller Ökosysteme beteiligt [Mushegian, 2020]. Es gibt zahlreiche Studien zu Bakteriophagen in unterschiedlichen Ökosystemen, jedoch fokussieren sich mehr und mehr Arbeiten auf die menschliche Mikrobiota, wie den Darm [Dion et al., 2020]. Der Bestand von Bakteriophagen in einem Bereich wird auch als Phageom bezeichnet. Auch die Mundhöhle besitzt ein Phageom [Szafrański et al., 2021], dies ist jedoch noch relativ unerforscht und birgt großes Potenzial. Dieses Phageom unterscheidet sich zwischen den Individuen ähnlich wie das Mikrobiom und kann ebenso innerhalb einer Familie, zwischen Paaren oder bei Menschen, die im selben Haushalt leben, übertragen werden [Szafrański et al., 2021; Robles-Sikisaka et al., 2013].
Woran wird geforscht?
Orale Biofilm-assoziierte Erkrankungen wie Karies und Parodontitis gehören laut WHO neben Krebserkrankungen der Mundhöhle zu den häufigsten Munderkrankungen mit erheblichen gesundheitlichen, sozialen und wirtschaftlichen Auswirkungen. Eine systematische Analyse ergab, dass weltweit 3,5 Milliarden Menschen an oralen Erkrankungen leiden, davon 2,3 Milliarden mit unbehandelter Karies und 796 Millionen mit schwerer Parodontitis [WHO, 2022].
Die Anwendung von Bakteriophagen in der Endodontologie, der Kariologie und der Parodontologie könnte einen vielversprechenden und nachhaltigen Ansatz in der Zahnmedizin darstellen und als Alternative beziehungsweise Ergänzung zu herkömmlichen Strategien angewendet werden – mit dem Potenzial, bakterielle Infektionen selektiv zu kontrollieren und langfristig zur Mundgesundheit beizutragen.
Während Antibiotika und antimikrobielle Mundspüllösungen oft auch nützliche Mikroorganismen der Mundflora beeinträchtigen und Resistenzen fördern können, bieten Phagen aufgrund ihrer hohen Spezifität das Potenzial für eine gezielte Bekämpfung von pathogenen Bakterien, die beispielsweise mit Wurzelkanalinfektionen, Karies oder Parodontitis assoziiert sind. Aktuelle Forschungsansätze konzentrieren sich darauf, spezifische Phagen gegen endodontische, kariogene und parodontalpathogene Keime wie Enterococcus faecalis, Streptococcus mutans oder Aggregatibacter actinomycetemcomitans zu identifizieren und deren Wirksamkeit in präklinischen und klinischen Studien zu evaluieren. Gleichzeitig stehen Fragestellungen zu den Eigenschaften und zur Stabilität der Bakteriophagen, mögliche Applikationsformen sowie Wechselwirkungen mit dem oralen Mikrobiom im Fokus wissenschaftlicher Untersuchungen.
Endodontologie
In der Endodontie wird daran geforscht, die antimikrobiellen Eigenschaften von Bakteriophagen zu nutzen. Hauptaugenmerk liegt in den meisten Studien vor allem auf einer Eliminierung von E.-faecalis-Biofilmen in unterschiedlichen Modellversuchen, obwohl mittels moderner Nachweismethoden wie „next generation sequencing“ (NGS) mittlerweile eine Vielzahl von Erregern bei endodontischen Infektionen nachgewiesen wurde [Manoil et al., 2020]. E. faecalis wird vor allem mit sekundären und persistierenden Infektionen mit einer Prävalenz von bis zu 77 Prozent assoziiert [Stuart et al., 2006; Rôças et al., 2004]. Dessen Rolle bei der Entstehung der apikalen Parodontitis wird jedoch kontrovers diskutiert.
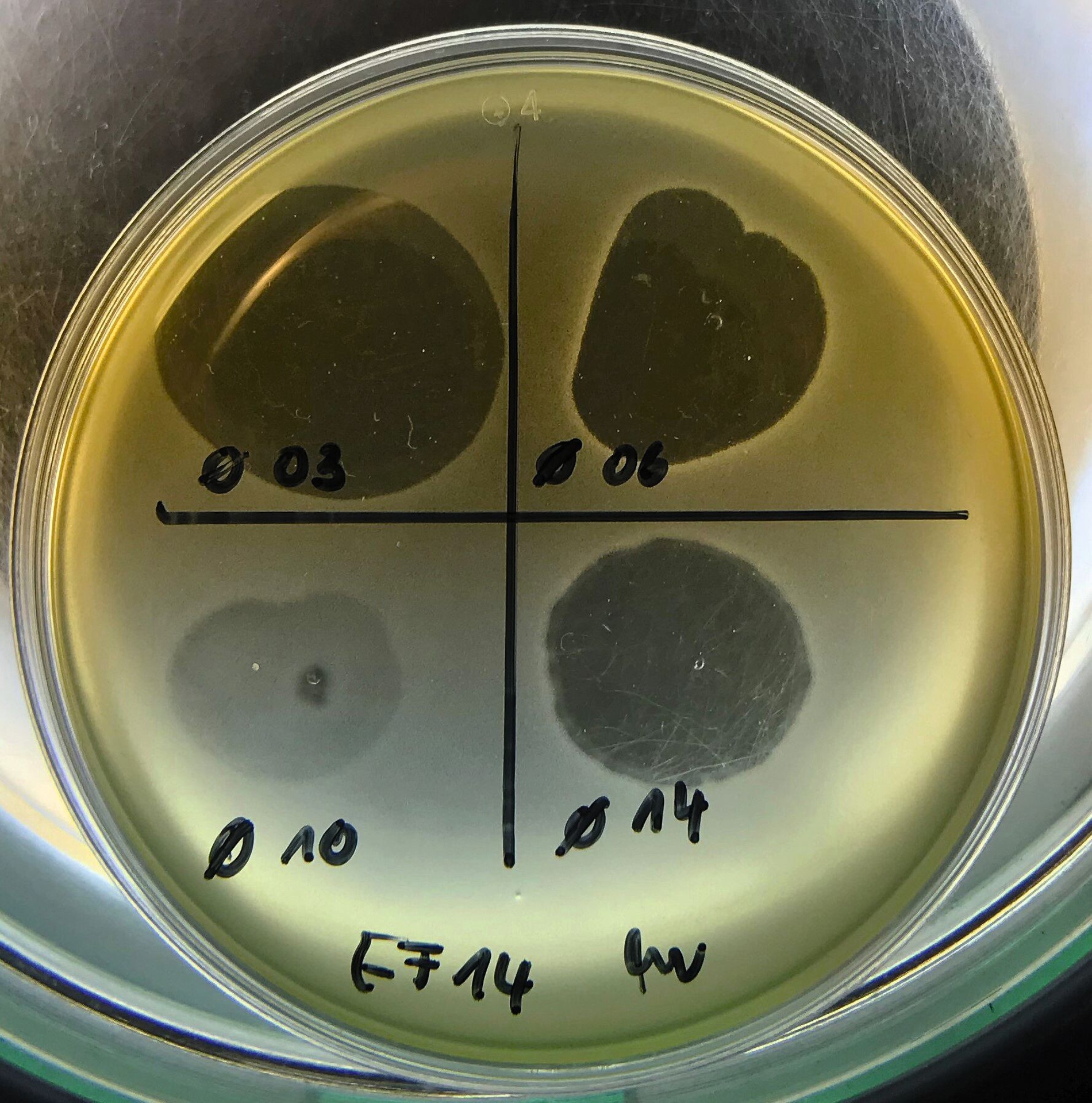
Aufgrund ihrer hohen Spezifität kann eine Therapie mit Phagen nur erfolgen, wenn der passende Phage für die jeweilige Wirtszelle gefunden wurde. So wurde bereits mehrfach gezeigt, dass sich Abwässer aus Krankenhäusern und Klärwerken hervorragend dazu eignen, passende Phagen gegen E. faecalis kostengünstig und effizient zu finden. Weiterhin zeigten Versuche, dass Phagen resistent gegen starke Temperaturschwankungen (4°–60° C) sind und saures sowie basisches Milieu tolerieren. Manche Phagen tolerieren ebenfalls die in der Endodontie gängigen Spüllösungen CHX, EDTA und NaOCl [Moryl et al., 2022; Lee et al., 2019]. Neben dieser Grundlagenforschung gibt es einige Ansätze, die Wirkung von Phagen in Wurzelkanalmodellen zu untersuchen und somit die Phagen-Therapie unter realitätsnäheren Bedingungen zu simulieren. Dazu werden endodontisch aufbereitete Wurzelkanalmodelle aus einwurzeligen bovinen oder menschlichen Zähnen verwendet.
Moryl et al. verwendeten in ihrem Versuch bovine Incisivi, in denen ein E.-faecalis-Biofilm gewachsen war. Sie wiesen nach, dass eine Phagen-Lösung, die für 48 Stunden in den Kanal eingebracht wurde, den Biofilm um mehr als die Hälfte reduzierte [Moryl et al., 2022]. Mehrere Versuche mit humanen Wurzelkanalmodellen zeigten ähnliche Ergebnisse. Für diese Experimente wurde ein sogenanntes Ex-vivo-Two-Chamber-Leakage-Zahnmodell verwendet, bei dem die Dichtigkeit der Wurzelfüllung am Apex auf bakterielles Leakage untersucht wurde.
Dabei ragt die Wurzelspitze in ein flüssiges Medium, das sich bei noch vorhandener bakterieller Kontamination trübt. Es konnte gezeigt werden, dass eine Spülung mit Phagen-Lösung vor der Obturation zu einer kompletten Eliminierung des bakteriellen Leakages am Apex führte. Dies wurde durch Laser-Scanning-Mikroskopie bestätigt, die in den Zähnen, die mit der Phagen-Lösung behandelt wurden, keine E.-faecalis-Bakterien mehr detektieren konnte. Im Gegensatz dazu waren die Dentintubuli der Wachstumskontrolle mit E. faecalis kontaminiert. Dies legt nahe, dass Phagen ebenfalls in der Lage sind, in die Dentintubuli zu penetrieren und die dort vorhandenen Zellen zu lysieren [Khalifa et al., 2015; El-Telbany et al., 2021].
Diese vielversprechenden Ergebnisse wurden bereits in einem In-vivo-Modell mit Ratten umgesetzt. Dazu wurden bei den Tieren die Pulpa von Backenzähnen eröffnet, mit einer E.-faecalis-Lösung infiziert, anschließend eine Phagen-Lösung injiziert und die Kavität verschlossen. Nach vier Wochen wurden die Zähne und das umliegende Gewebe entnommen, um mittels Färbetechnik und Computertomografie-Scan die apikalen Strukturen zu untersuchen. Es zeigte sich, dass bei der Negativkontrollgruppe sowie der Gruppe mit der Phagen-Lösung das apikale Gewebe keine Pathologien aufwies [Xiang et al., 2022].
So Erfolg versprechend diese Ergebnisse sind, bringt die Phagen-Therapie auch einige Nachteile mit sich. So können beispielsweise die Wirtszellen Resistenzmechanismen gegenüber den Phagen entwickeln [Labrie et al., 2010]. Die Anwendung von Phagen in Kombination mit Antibiotika, genetisch veränderte Phagen oder die Applikation von sogenannten Phagen-Cocktails versuchen, der Resistenzentwicklung entgegenzuwirken und die antimikrobielle Wirkung zu erhöhen.
Zum Beispiel wiesen Voit et al. in einem In-vitro-Modell nach, dass Phagen in Kombination mit Gentamicin in der Lage sind, einen E.-faecalis-Biofilm komplett zu zerstören. Bei weiteren E.-faecalis-Stämmen, die unter anderem mit Phagen und Vancomicin behandelt wurden, zeigte sich ebenfalls eine Reduktion des Biofilms, jedoch konnte ein erneutes bakterielles Wachstum nachgewiesen werden, was als Resistenzbildung gewertet wurde. Die Ergebnisse der Evaluation der Resistenzbildung gegen die verwendeten Phagen bestätigten den Verdacht, zeigten aber auch, dass die Resistenzbildung gegen einen Phagen die Empfindlichkeit gegenüber einem anderen Phagen fördern kann [Voit et al., 2022]. Um dieses Phänomen zu nutzen, kommen in anderen Studien bereits sogenannte Phagen-Cocktails erfolgreich zum Einsatz [Shlezinger et al., 2019; Merabishvili et al., 2024].
Darüber hinaus gibt es den Ansatz, als Alternative zur klassischen endodontischen Desinfektion, die Phagen-Therapie mit der antimikrobiellen photodynamischen Therapie (aPDT) zu kombinieren. Aufgrund ihrer hohen Spezifität eignen sich modifizierte Phagen sehr gut für die aPDT, da sie mit ihren spezifischen Rezeptoren nur an die Zielzellen binden. Dong et al. untersuchten die antimikrobielle Wirkung eines Phagen, der mit einem Chlorophyll-basiertem Photosensitizer kombiniert wurde, gegen eine C.-albicans-Kultur. Nach der aPDT wurde beobachtet, dass die C.-albicans-Kultur ihr Wachstum einstellte und abstarb. Hefezellen, die nur mit Phagen behandelt wurden, zeigten ähnliche Reaktionen wie zuvor beschrieben, jedoch in einem deutlich geringeren Ausmaß [Dong et al., 2018].
Um die antimikrobielle Wirkung von Phagen zu verbessern, gibt es Ansätze, diese genetisch zu verändern. Tinoco et al. zeigten, dass es möglich ist, einen temperenten E.-faecalis-Phagen so zu modifizieren, dass keine lysogenen Eigenschaften mehr vorhanden waren und die lytische Fähigkeit mittels Promoter kontrollierbar war. Außerdem zeigte der genetisch veränderte Phage ein größeres Wirtsspektrum [Tinoco et al., 2016].
In den meisten Versuchen werden die Phagen als eine Art Spüllösung im Kanalmodell verwendet. Es gibt aber auch den Versuch, Phagen als eine Art medikamentöse Einlage in einem Release-System mit Hydrogelen zu verwenden. Hydrogele werden in der Medizin eingesetzt, um Arzneimittel lokal über einen längeren Zeitraum kontrolliert freizusetzen [Russo und Villa, 2019]. In ihrem Versuchsaufbau verwendeten Slezinger et al. dafür das Poloxamer P407. Es konnte nachgewiesen werden, dass über einen Zeitraum von einem Monat konstant Phagen aus dem Material freigesetzt wurden, die weiterhin eine lytische Wirkung gegen E. faecalis zeigten.
Diese Ergebnisse wurden auf ein In-vivo-Modell mit Mäusen übertragen, bei denen die Oberkieferschneidezähne endodontisch aufbereitet und anschließend mit einer E.-faecalis-Lösung infiziert wurden. Die eröffneten Pulpen wurden nicht verschlossen und 30 Tage dem oralen Mikrobiom ausgesetzt, um eine apikale Entzündung zu forcieren. Die Anwendung des Hydrogels im Kanal zeigte nach drei Wochen eine Reduktion des Biofilms um bis zu 99 Prozent. Die histologische Auswertung zeigte zusätzlich eine reduzierte apikale Entzündung [Shlezinger et al., 2019].
Kariologie
Karies ist eine der weltweit am meisten verbreiteten Zahnerkrankungen und wird unter anderem durch Streptokokken-Arten wie Streptococcus mutans verursacht. Sie spielen eine zentrale Rolle bei der Entstehung von Zahnplaque, wobei wasserunlösliches Glucan produziert wird, das als Hauptbestandteil der Plaque dient. Gleichzeitig fermentieren Streptokokken Zucker zu Säuren, die den Zahnschmelz angreifen und letztlich zur Demineralisierung der Zähne führen [Sugai et al., 2023]. Ein vielversprechender neuer Ansatz zur Bekämpfung von Streptokokken gegen Karies ist der Einsatz von Bakteriophagen. Besonders bemerkenswert ist, dass die größte und vielfältigste Phagenpopulation im oralen Mikrobiom gegen Streptokokken-Arten gerichtet ist [Szafrański et al., 2021; Szafrański et al., 2017]. Diese Entdeckung legt nahe, dass Bakteriophagen bereits eine natürliche Rolle bei der Kontrolle der oralen Mikroflora spielen und somit als therapeutische Werkzeuge geeignet sein könnten.
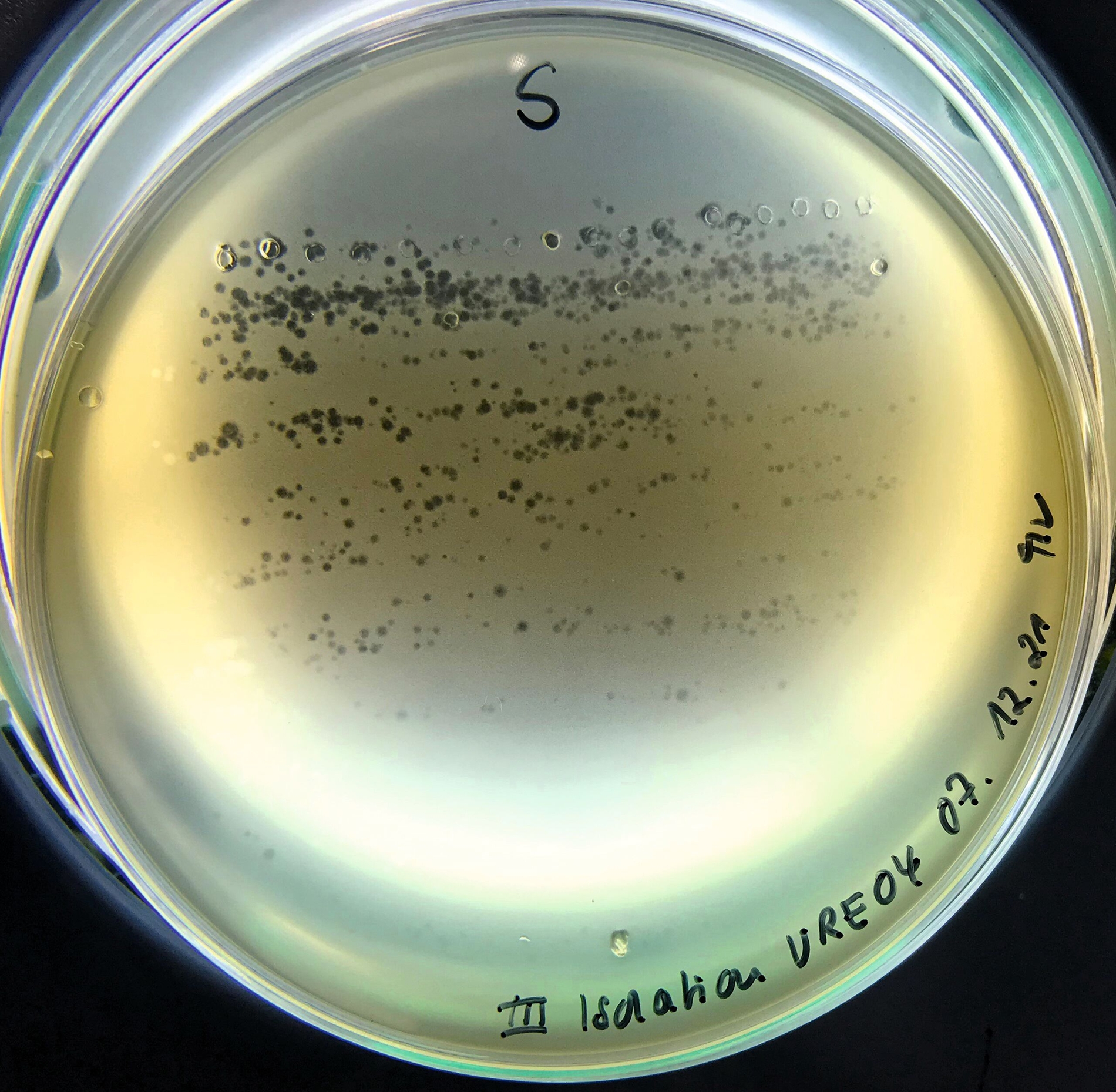
Am Fraunhofer-Institut für Grenzflächen- und Bioverfahrenstechnik IGB in Stuttgart wurde eine Machbarkeitsstudie durchgeführt, um das Potenzial von Bakteriophagen zur gezielten Bekämpfung von Karieserregern zu erheben. Das Projekt Kari-EX, initiiert von Prof. Dr. Susanne Bailer und Jens Wetschky, bildete die Grundlage für diese Studie. Eine Idee ist die Entwicklung eines Kaugummis, der Bakteriophagen enthält und diese kontrolliert in der Mundhöhle freisetzt (Abbildung 8). Im Rahmen des Projekts Kari-EX wurde untersucht, ob der gut erforschte Bakteriophage M102, der spezifisch gegen Streptococcus mutans wirkt, nach einer Verkapselung in lebensmitteltauglichem Alginat – einer gelartigen Substanz – seine Aktivität behält. Die Verkapselung ermöglichte es, die Phagen mit etwas Flüssigkeit in kleineren Sphären einzubetten (Abbildung 9). Bereits ohne weitere Optimierung konnte durch die gezielte Auflösung der Kapseln eine große Zahl aktiver Phagen freigesetzt und nachgewiesen werden. Da Bakteriophagen hochspezifisch wirken, könnte die Entwicklung eines Kari-EX-Kaugummis das Risiko für Dysbiosen reduzieren und gleichzeitig das nützliche orale Mikrobiom schonen.
Parodontologie
Bei Parodontitis wird ebenfalls diskutiert, ob und wie der Einsatz von Bakteriophagen zur Bekämpfung parodontaler Keime erfolgen kann. Insbesondere Aggregatibacter actinomycetemcomitans, Porphyromonas gingivalis und Tannerella forsythia spielen eine zentrale Rolle in der Pathogenese der Parodontitis. Diese Keime können Entzündungsreaktionen auslösen, die das Immunsystem langfristig beeinflussen und das Risiko für systemische Erkrankungen erhöhen. Eine gezielte Bekämpfung dieser Mikroorganismen könnte daher nicht nur die Mundgesundheit, sondern auch die allgemeine Gesundheit fördern. Da Parodontitis nicht nur zu Zahnverlust führt, sondern auch in Zusammenhang mit verschiedenen allgemeinmedizinischen und systemischen Erkrankungen wie Herz-Kreislauf-Erkrankungen [Dietrich et al., 2017; Sanz et al., 2020], Schlaganfällen [Leira et al., 2017] und chronisch-obstruktiven Lungenerkrankungen [Molina et al., 2023] steht, könnten Bakteriophagen als vielversprechende Präventionsmaßnahme oder als unterstützendes Agens bei der zahnärztlichen Behandlung dienen.
Am IGB wird in Zusammenarbeit mit der Poliklinik für Zahnerhaltungskunde am Universitätsklinikum Heidelberg und anderen Partnern intensiv daran geforscht, Bakteriophagen für den zahnmedizinischen Einsatz zu identifizieren und nutzbar zu machen. Unterschiedliche Screening-Verfahren werden genutzt und optimiert, um gezielt nach Bakteriophagen wie beispielsweise gegen Aggregatibacter actinomycetemcomitans zu suchen. Vergleichbare Screening-Verfahren und die Identifikation eines neuen Phagen, der spezifisch im pathogenen Biofilm angreifen kann, sind in der Literatur bereits für Aggregatibacter actinomycetemcomitans [Castillo-Ruiz et al., 2011] sowie Fusobacterium nucleatum [Kabwe et al., 2019] beschrieben. Allerdings sind parodontale Keime sehr schwer zu kultivieren und Bakteriophagen entsprechend selten zu finden. Für Porphyromonas gingivalis oder Tannerella forsythia wurden bisher noch keine lytischen Bakteriophagen identifiziert.
Die Rolle von Bakteriophagen innerhalb der oralen Mikrobiota ist jedoch noch nicht geklärt. Ein bioinformatischer Ansatz soll dabei unterstützen, bislang unbekannte Phagen zu identifizieren und deren Wechselwirkungen mit dem oralen Mikrobiom zu verstehen. Metagenomische Datensätze sind essenziell für die Untersuchung der Zusammensetzung und Variation von Bakteriophagen in der Mundhöhle. Unterschiedliche Studien [Szafrański et al., 2021; Labrie et al., 2010; Voit et al., 2022] weisen auf eine mögliche Verbindung zwischen Bakteriophagen und der mikrobiellen Gemeinschaftsstruktur hin. Während das orale Mikrobiom nachweislich eine Rolle bei der Entstehung von Parodontalerkrankungen und Periimplantitis spielt, ist die spezifische Funktion von Viren in diesen mikrobiellen Netzwerken bislang unzureichend erforscht.
In Zusammenarbeit mit dem Institut für Informatik der Universität Tübingen wurden metagenomische Datensätze von Speichel-, Plaque- und Sulkusfluid-Proben von 72 Patienten analysiert – beteiligt waren 23 gesunde Probanden, 30 Karies-Patienten und 19 Patienten mit Parodontitis [Anderson et al., 2023]. Die Programme Kraken 2 [Wood et al., 2019], DeepVirFinder [Ren et al., 2020] und VirSorter2 [Guo et al., 2021] werden eingesetzt, um virales Sequenzmaterial zu identifizieren. Allerdings ergab die Analyse trotz hoher Zahl als viral vorhergesagter Sequenzen pro Programm nur eine geringe Schnittmenge zwischen den einzelnen Programmen und wenige Unterschiede zwischen den Patientengruppen, was die Schwierigkeiten bei der Identifikation und Zuordnung unterstreicht (Abbildung 10). Es ist jedoch zu beachten, dass lediglich Kraken 2 ausschließlich nach in Datenbanken bekannten viralen Sequenzen sucht. Die höhere Trefferzahl für VirSorter2 und insbesondere DeepVirFinder könnte daher auf das Vorhandensein bisher unbekannter Phagen hindeuten.
Periimplantitis
Periimplantäre Infektionen sind Biofilm-assoziierte Erkrankungen, die in das Implantat umgebenden Geweben auftreten [Dieckow et al., 2024]. Sie sind durch eine Entzündung des periimplantären Weichgewebes und den anschließenden fortschreitenden Verlust des stützenden Knochens gekennzeichnet und weisen klinische Anzeichen von Entzündungen, unter anderem Blutungen auf Sondierung und erhöhte Sondierungstiefen, auf [Berglundh et al., 2018]. Die Phagentherapie stellt einen in der Forschung viel diskutierten Ansatz zur Behandlung periimplantärer Infektionen dar [Szafrański et al., 2017], der insbesondere im Zusammenhang mit Antibiotika-resistenten Keimen zukünftig noch an Bedeutung gewinnen wird.
Wir wissen heute, dass Phagen eine entscheidende Rolle in der Dynamik von Bakterienpopulationen und der Beeinflussung der Biofilmphysiologie bei periimplantären Infektionen spielen, so dass der Charakterisierung des periimplantären Phageoms eine besondere Bedeutung zukommt [Szafrański et al., 2021]. In der Medizinischen Hochschule Hannover wurden darum in einer Kohorte von Implantatpatienten mit periimplantären Infektionen und einer Vergleichsgruppe mit gesunden Implantaten Transkriptomanalysen von Phagengenen, durchgeführt (Transkriptom: Gesamtheit aller RNA-Moleküle in einer Probe). Es konnte eine bemerkenswerte Vielfalt aktiver oraler Phagen und phagenähnlicher Elemente innerhalb des periimplantären Ökosystems aufgedeckt werden.
Darüber hinaus konnten diese durchweg als wichtige Bestandteile des Biofilms in verschiedenen diagnostischen Gruppen und mikrobiellen Gemeinschaften identifiziert werden. Es zeigte sich eine signifikant unterschiedliche Phagenpopulation in Abhängigkeit von der Diagnose Periimplantitis, Mukositis oder gesunde Implantate und es zeigte sich jeweils eine hohe Aktivität von Phagen, die auf typische orale Mikroorganismen abzielen. So zeigten Phagen, die auf Fusobacterium und Prevotella abzielten, bei Periimplantitis eine höhere Aktivität als bei Mukositis oder bei gesunden Implantaten, bei denen Phagen, die auf Streptococcus und Haemophilus abzielten, aktiver waren.
Während die meisten Phagen mit ihren vorhergesagten bakteriellen Wirten übereinstimmen, zeigen sich auch weitere Assoziationen, zum Beispiel zwischen Tannerella forsythia und Fusobacterium-Phagen, die darauf hindeuten, dass die durch Phagen induzierte Lyse bestimmter Bakterien die Ausbreitung anderer anspruchsvoller Arten wie beispielsweise Tannerella forsythia begünstigen kann. Diese Ergebnisse müssen bei der Entwicklung zukünftiger therapeutischer Strategien Berücksichtigung finden, da eine nischenspezifische Koevolution die Entwicklung von wechselseitigen Beziehungen zwischen Mitgliedern bestimmter Bakterien und Phagentypen begünstigen kann. Um dies weiter aufzuklären, konnten in der Vergangenheit Klassifizierungsschemata für Aggregatibacter- und Haemophilus-Prophagen erstellt und die Muster ihrer Diversität beschrieben werden [Szafrański et al., 2019]. Weitere Arbeiten sind erforderlich, um die potenziellen mechanistischen Grundlagen der Prophagenmuster im Hinblick auf eine mögliche therapeutische Nutzung lytischer Phagen zu erforschen.
Die bisherigen wissenschaftlichen Erkenntnisse deuten darauf hin, dass die Phagentherapie eine vielversprechende, selektive und biologisch verträgliche Alternative zur Antibiotikatherapie bei Periimplantitis darstellen könnte. Zukünftige klinische Studien sind hier erforderlich, um deren Wirksamkeit und Sicherheit bei der Behandlung periimplantärer Infektionen zu bestätigen.
Ausblick
Trotz bemerkenswerter Fortschritte besteht weiterhin erheblicher Forschungsbedarf. Entscheidend bei der Erforschung von Bakteriophagen in der Zahnmedizin ist nicht nur die grundlegende Entwicklung alternativer Therapieansätze, sondern auch deren Praktikabilität und Sicherheit in der klinischen Anwendung. Orale Erkrankungen wie Karies und Parodontitis stehen im Zusammenhang mit komplexen dysbiotischen Biofilmen. Ein mögliches Risiko bei der Anwendung von Bakteriophagen könnte die Freisetzung bakterieller Toxine, wie Endotoxine oder Lipopolysaccharide (LPS), bei einer Phagen-assoziierten Lyse sein.
Eine weitere zentrale Frage ist, wie der Einsatz von Bakteriophagen in der zahnärztlichen Praxis konkret gestaltet werden könnte. Denkbar wäre die Verabreichung in Form eines Kaugummis, einer Mundspülung, in Gelen oder in Form anderer topischer Präparate. Dabei stellt sich jedoch die Frage, wie solche Ansätze im Vergleich zu etablierten Methoden wie Antiseptika, Antibiotika oder der mechanischen Biofilmkontrolle langfristig eingeordnet werden können. Von entscheidender Bedeutung ist hierbei, ob und wie tief Phagen in Biofilme eindringen können, um pathogene Mikroorganismen effektiv zu eliminieren.
Weiterhin scheint die Stammspezifität der Phagen einer schnellen Anwendung in der Praxis im Weg zu stehen. Bakterienstämme müssten isoliert und kultiviert werden. Sollte keine Phagen-Bank bestehen, ist es notwendig, Umweltproben auf entsprechende Phagen hin zu screenen, die dann im Labor produziert werden müssen, bevor es zu einer oralen Anwendung kommen kann. Es handelt sich also um eine aufwendige Individualtherapie, die vorerst nicht für den alltäglichen Gebrauch in der Zahnarztpraxis passend erscheint. Gelingt es, Phagen-Cocktails zu konzipieren oder Phagen genetisch so zu verändern, dass ein breites Wirkspektrum bedient wird, könnte dies den klinischen Einsatz erleichtern. Außerdem muss vor der praktischen Anwendung geklärt werden, welche Rolle die Resistenzbildung gegen Phagen in der Behandlung spielt. Beispielsweise steht in der Endodontie noch der Nachweis aus, ob diese Resistenzbildung eine apikale Ausheilung beeinflusst, auch wenn der Biofilm ausreichend reduziert wurde und durch eine hermetische Versiegelung des Kanals das Eindringen von neuem Substrat verhindert werden konnte.
Gleichzeitig ist es wichtig, die Integration von Bakteriophagen-Therapien in bereits bestehende und bewährte Behandlungskonzepte zu berücksichtigen. Ob sie als ergänzende Maßnahme zum Beispiel synergistisch zu Antibiotika oder als eigenständige Alternative eingesetzt werden, bleibt eine Frage zukünftiger Studien, aber auch gesetzlicher Vorgaben. Eine breite klinische Anwendung hängt maßgeblich von Änderungen der Zulassungsanforderungen ab, die insbesondere in Deutschland den Einsatz von Bakteriophagen derzeit verhindern. Lediglich im Rahmen individueller Heilversuche bei bereits austheapierten lebensbedrohlich erkrankten Patienten dürfen spezifische Phagencocktails im Rahmen von klinischen Studien eingesetzt werden [Rieper et al., 2022]. Um die rechtlichen Hürden zu umschiffen, könnte die Erforschung zielgerichteter Phagen-basierter Wirkstoffe, sogenannter Lysine, zukünftig eine große Rolle spielen. Trotz dieser Herausforderungen und gesetzlichen Hürden eröffnen Bakteriophagen ein vielversprechendes Potenzial, die zahnmedizinische Versorgung zu bereichern und möglicherweise effektiver und gezielter gegen einzelne Pathogene in der Mundhöhle vorzugehen.
Literaturliste
Anderson, A.C., et al., The oral microbiota is a reservoir for antimicrobial resistance: resistome and phenotypic resistance characteristics of oral biofilm in health, caries, and periodontitis. Annals of clinical microbiology and antimicrobials, 2023. 22(1): p. 37.
Berglundh, T., et al., Peri-implant diseases and conditions: Consensus report of workgroup 4 of the 2017 World Workshop on the Classification of Periodontal and Peri-Implant Diseases and Conditions. J Clin Periodontol, 2018. 45 Suppl 20: p. S286-s291.
Canchaya, C., et al., Prophage Genomics. Microbiology and Molecular Biology Reviews, 2003. 67(2): p. 238-276.
Castillo-Ruiz, M., et al., Isolation of a Novel Aggregatibacter actinomycetemcomitans Serotype b Bacteriophage Capable of Lysing Bacteria within a Biofilm. Applied and Environmental Microbiology, 2011. 77(9): p. 3157-3159.
D'Herelle, F., On an invisible microbe antagonistic toward dysenteric bacilli: brief note by Mr. F. D'Herelle, presented by Mr. Roux. 1917. Res Microbiol, 2007. 158(7): p. 553-4.
Dieckow, S., et al., Structure and composition of early biofilms formed on dental implants are complex, diverse, subject-specific and dynamic. NPJ Biofilms Microbiomes, 2024. 10(1): p. 155.
Dietrich, T., et al., Evidence summary: the relationship between oral and cardiovascular disease. British Dental Journal, 2017. 222(5): p. 381-385.
Dion, M.B., F. Oechslin, and S. Moineau, Phage diversity, genomics and phylogeny. Nature Reviews Microbiology, 2020. 18(3): p. 125-138.
Dong, S., et al., Difunctional bacteriophage conjugated with photosensitizers for Candida albicans-targeting photodynamic inactivation. Int J Nanomedicine, 2018. 13: p. 2199-2216.
El-Telbany, M., et al., Bacteriophages to Control Multi-Drug Resistant Enterococcus faecalis Infection of Dental Root Canals. Microorganisms, 2021. 9(3).
Guo, J., et al., VirSorter2: a multi-classifier, expert-guided approach to detect diverse DNA and RNA viruses. Microbiome, 2021. 9(1): p. 37.
Kabwe, M., et al., Genomic, morphological and functional characterisation of novel bacteriophage FNU1 capable of disrupting Fusobacterium nucleatum biofilms. Scientific Reports, 2019. 9(1): p. 9107.
Khalifa, L., et al., Targeting Enterococcus faecalis biofilms with phage therapy. Appl Environ Microbiol, 2015. 81(8): p. 2696-705.
Labrie, S.J., J.E. Samson, and S. Moineau, Bacteriophage resistance mechanisms. Nat Rev Microbiol, 2010. 8(5): p. 317-27.
Lamont, R.J., H. Koo, and G. Hajishengallis, The oral microbiota: dynamic communities and host interactions. Nature Reviews Microbiology, 2018. 16(12): p. 745-759.
Lee, D., et al., The Novel Enterococcus Phage vB_EfaS_HEf13 Has Broad Lytic Activity Against Clinical Isolates of Enterococcus faecalis. Front Microbiol, 2019. 10: p. 2877.
Leira, Y., et al., Association between periodontitis and ischemic stroke: a systematic review and meta-analysis. European Journal of Epidemiology, 2017. 32(1): p. 43-53.
Liu, S., et al., Phages against Pathogenic Bacterial Biofilms and Biofilm-Based Infections: A Review. Pharmaceutics, 2022. 14(2): p. 427.
Manoil, D., K. Al-Manei, and G.N. Belibasakis, A Systematic Review of the Root Canal Microbiota Associated with Apical Periodontitis: Lessons from Next-Generation Sequencing. Proteomics Clin Appl, 2020. 14(3): p. e1900060.
Merabishvili, M., J.P. Pirnay, and D. De Vos, Guidelines to Compose an Ideal Bacteriophage Cocktail. Methods Mol Biol, 2024. 2734: p. 49-66.
Molina, A., et al., The association between respiratory diseases and periodontitis: A systematic review and meta-analysis. Journal of Clinical Periodontology, 2023. 50(6): p. 842-887.
Moryl, M., et al., Benefits and Challenges of the Use of Two Novel vB_Efa29212_2e and vB_Efa29212_3e Bacteriophages in Biocontrol of the Root Canal Enterococcus faecalis Infections. J Clin Med, 2022. 11(21).
Mushegian, A.R., Are There 1031 Virus Particles on Earth, or More, or Fewer? Journal of Bacteriology, 2020. 202(9): p. 10.1128/jb.00052-20.
Pires, D.P., et al., Bacteriophage-encoded depolymerases: their diversity and biotechnological applications. Applied Microbiology and Biotechnology, 2016. 100(5): p. 2141-2151.
Ren, J., et al., Identifying viruses from metagenomic data using deep learning. Quant Biol, 2020. 8(1): p. 64-77.
Rieper F, K.I., Wienecke S, Ziehr H. , Die Phagentherapie – ein Ausweg aus der Antibiotika-Krise? Zahnärztliche Mitteilungen, 11/2022.
Robles-Sikisaka, R., et al., Association between living environment and human oral viral ecology. The ISME Journal, 2013. 7(9): p. 1710-1724.
Rôças, I.N., J.F. Siqueira, Jr., and K.R. Santos, Association of Enterococcus faecalis with different forms of periradicular diseases. J Endod, 2004. 30(5): p. 315-20.
Russo, E. and C. Villa, Poloxamer Hydrogels for Biomedical Applications. Pharmaceutics, 2019. 11(12).
Sanz, M., et al., Periodontitis and cardiovascular diseases: Consensus report. Journal of Clinical Periodontology, 2020. 47(3): p. 268-288.
Shlezinger, M., et al., Phages in a thermoreversible sustained-release formulation targeting E. faecalis in vitro and in vivo. PLoS One, 2019. 14(7): p. e0219599.
Stuart, C.H., et al., Enterococcus faecalis: its role in root canal treatment failure and current concepts in retreatment. J Endod, 2006. 32(2): p. 93-8.
Sugai, K., et al., Isolation of Streptococcus mutans temperate bacteriophage with broad killing activity to clinical isolates. iScience, 2023. 26(12).
Sulakvelidze, A., Z. Alavidze, and J.G. Morris, Bacteriophage Therapy. Antimicrobial Agents and Chemotherapy, 2001. 45(3): p. 649-659.
Szafrański, S.P., A. Winkel, and M. Stiesch, The use of bacteriophages to biocontrol oral biofilms. Journal of Biotechnology, 2017. 250: p. 29-44.
Szafrański, S.P., A. Winkel, and M. Stiesch, The use of bacteriophages to biocontrol oral biofilms. J Biotechnol, 2017. 250: p. 29-44.
Szafrański, S.P., J. Slots, and M. Stiesch, The human oral phageome. Periodontol 2000, 2021. 86(1): p. 79-96.
Szafrański, S.P., et al., Diversity patterns of bacteriophages infecting Aggregatibacter and Haemophilus species across clades and niches. Isme j, 2019. 13(10): p. 2500-2522.
Tinoco, J.M., et al., Effect of a genetically engineered bacteriophage on Enterococcus faecalis biofilms. Arch Oral Biol, 2016. 71: p. 80-86.
Voit, M., A. Trampuz, and M. Gonzalez Moreno, In Vitro Evaluation of Five Newly Isolated Bacteriophages against E. faecalis Biofilm for Their Potential Use against Post-Treatment Apical Periodontitis. Pharmaceutics, 2022. 14(9).
World Health Organization, Global oral health status report: towards universal health coverage for oral health by 2030. 2022: World Health Organization.
Wood, D.E., J. Lu, and B. Langmead, Improved metagenomic analysis with Kraken 2. Genome Biol, 2019. 20(1): p. 257.
Xiang, Y., et al., Phage therapy for refractory periapical periodontitis caused by Enterococcus faecalis in vitro and in vivo. Appl Microbiol Biotechnol, 2022. 106(5-6): p. 2121-2131.
Zhu, M., et al., Phage therapy as an alternative strategy for oral bacterial infections: a systematic review. BMC Oral Health, 2025. 25(1): p. 44.












