Allgemeine Gesundheit und Parodontitis
Der Hintergrund dieses Zusammenhangs [Jepsen et al., 2011; Hajishengallis, 2015] lässt sich teilweise bereits durch die Ätiopathogenese der Parodontitis erklären. Parodontalpathogene Bakterien, die in einem gut strukturierten Biofilm auf der Wurzeloberfläche organisiert sind, beeinflussen die individuelle Immunantwort. Diese Immunantwort wiederum kann ein individuell unterschiedliches Ausmaß annehmen und damit umgekehrt auf die Konstitution des bakteriellen Biofilms mit einwirken. So können besonders pathogene Bakterien wie Porphyromonas gingivalis überleben und sogar in ihrem Wachstum gefördert werden [Marsh and Devine, 2011; Hajishengallis, 2014]. Eine sogenannte unangemessene Immunantwort führt im Verlauf der Erkrankung zu einem unwiderruflichen Verlust der parodontalen Stützgewebe [Jepsen and Dommisch, 2014; Meyle and Chapple, 2015].
Im Rahmen der entzündlichen Reaktion wird der interzelluläre Verbund der parodontalen Zellen gelöst und Bakterien sowie deren Stoffwechselprodukte können leicht in tiefere Gewebeschichten und ultimativ in den Blutstrom gelangen. Tatsächlich kann eine Bakteriämie – ausgelöst zum Beispiel durch die häusliche Mundhygiene, eine Zahnextraktion, eine professionelle Zahnreinigung sowie Scaling und Wurzelglättung – bereits nach wenigen Minuten bei Patienten mit Parodontitis nachgewiesen werden [Lockhart et al., 2009; Lockhart et al., 2008; Castillo et al., 2011; Zhang et al., 2013]. Das Ausmaß einer Bakteriämie ist vom Schweregrad der parodontalen Destruktion abhängig [Forner et al., 2006; Kinane et al., 2005].
Parodontalpathogene Bakterien im Blutstrom können fern der Mundhöhle eine Reihe von Wirkungen entfalten. Zu den wichtigsten Wirkungsweisen gehört sicherlich die direkte Stimulation von Immunzellen, die ihrerseits pro-inflammatorische Mediatoren in Form von zum Beispiel verschiedenen Interleukinen synthetisieren und damit im gesamten Körper immun-entzündliche Abläufe modifizieren können. Hinzu kommt, dass parodontal-pathogene Bakterien menschliches Gewebe fern der Mundhöhle direkt beeinflussen können [Jepsen et al., 2015; Hajishengallis, 2015].
Das gesamte Ausmaß der parodontalen Entzündung kann als inflammatorische Fläche erfasst werden, die die eigentliche systemische „Entzündnungslast“ der parodontalen Destruktion illustriert (Abbildung 1) [Nesse et al., 2008]. Vor diesem Hintergrund wird deutlich, dass eine komplexe Entzündungserkrankung wie Parodontitis andere Erkrankungen mit einer ätiopathologisch entzündlichen Ursache – wie Diabetes mellitus, Gefäßerkrankungen und Rheumatoide Arthritis – mit beeinflussen kann.
Dieser Artikel soll einen Überblick über einige Aspekte möglicher Zusammenhänge zwischen Parodontitis und Allgemeinerkrankungen geben, ohne genetische Risikofaktoren beziehungsweise genetische Erkrankungen mit Parodontitis als Symptom einzubeziehen.
Parodontitis und Diabetes
Der Diabetes mellitus ist eine Stoffwechselerkrankung mit dem Leitsymptom der chronischen Hyperglykämie (erhöhter Blutzuckerspiegel im Blut). Man unterscheidet zwei wesentliche Formen des Diabetes mellitus, Typ 1 (T1DM) und Typ 2 (T2DM). T1DM kann bereits in jüngeren Lebensjahren auftreten und wird auch als Insulin-pflichtiger Diabetes mellitus bezeichnet, da die Insulinproduktion in den Zellen des Pankreas aufgrund spezifischer Autoimmunantikörper ausbleibt. Im Unterschied zum T1DM handelt es sich beim T2DM um die oftmals in späteren Lebensjahren erworbene Form des Diabetes mellitus. Darüber hinaus existieren eine Reihe anderer, seltener Erkrankungsformen des Diabetes sowie des Gestationsdiabetes.
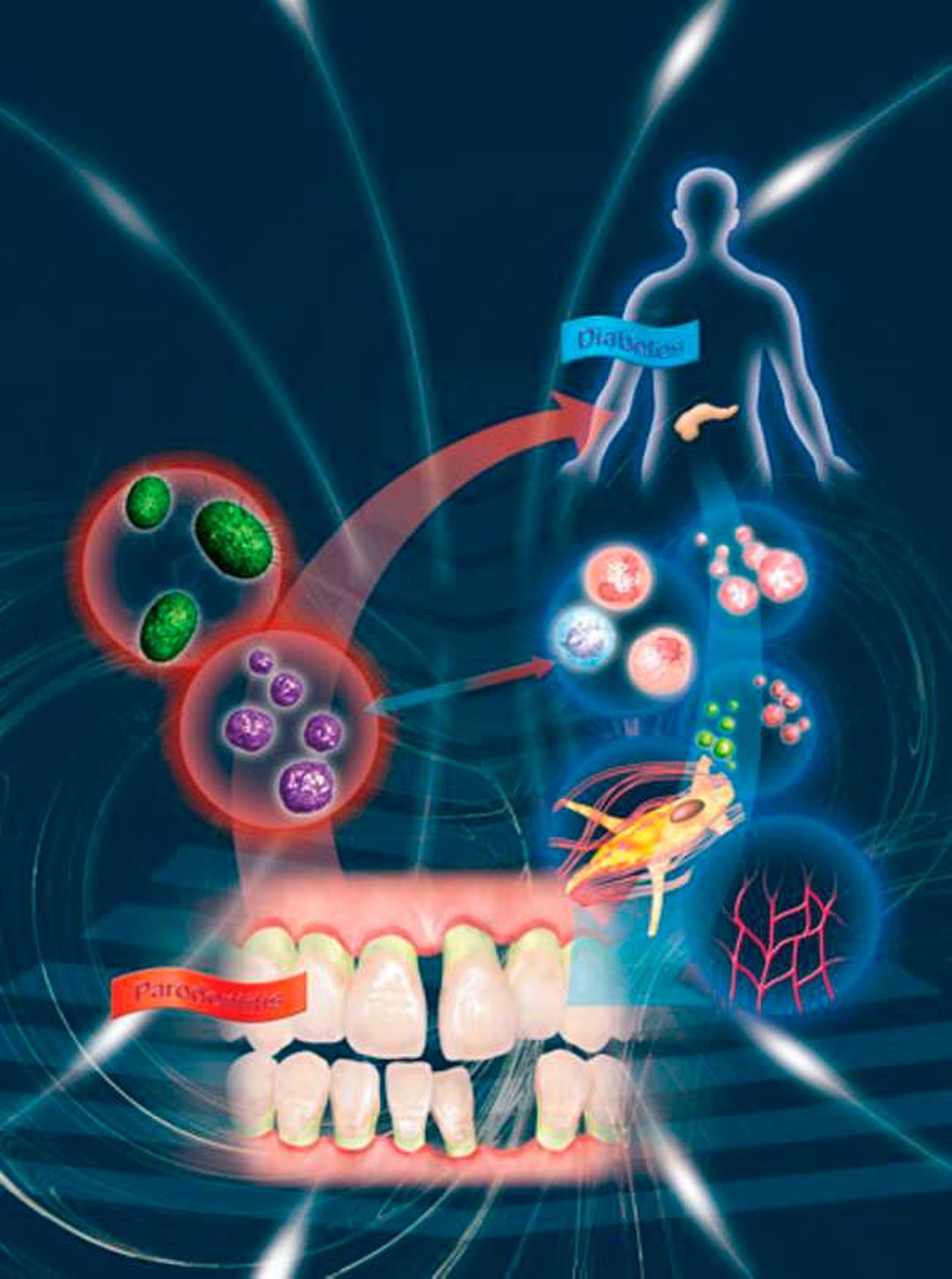
Parodontitis und Diabetes mellitus können sich bekanntlich gegenseitig beeinflussen (Abbildung 2) [Preshaw et al., 2012; Jepsen et al., 2015]. Dies gilt nicht nur für die jeweilige Pathogenese, sondern auch für den Einfluss der Therapie der einen auf die jeweils andere Erkrankung [Chapple et al., 2013].
Diabetes mellitus ist – wie auch die Parodontitis – eine hoch prävalente Erkrankung in der Weltbevölkerung [Zimmet et al., 2016; Kassebaum et al., 2014]. Deutschland gehört mit 7,6 Millionen Diabetes-Patienten (davon rund 95 Prozent T2DM) zu den zehn Ländern mit der höchsten Anzahl an Diabetikern [Tamayo and Rathmann, 2016]. Der chronisch erhöhte Blutzucker führt im Verlauf der Erkrankung zu einer Vielzahl unterschiedlicher Folgeerkrankungen (Komplikationen des Diabetes mellitus) wie Makroangiopathien (Erkrankungen des Herz-Kreislauf-Systems) und Mikroangiopathien (Retino-, Makulo-, Nephro- und Neuropathie) [Bundesärztekammer, 2013]. Als weitere Folgeerkrankung der chronischen Hyperglykämie wurde Parodontitis bereits 1993 von Harald Löe beschrieben [Löe, 1993]. Weitere Hintergründe hinsichtlich der Diagnostik des Diabetes mellitus wurden bereits in den zm 3/2017 ausgeführt [Kuzmanova et al., 2017].
Einfluss des Diabetes mellitus auf Parodontitis
Zahlreiche Studien haben in den vergangenen Jahrzehnten den Einfluss von Diabetes mellitus auf die parodontale Gesundheit untersucht. Allgemeiner Konsens ist, dass Diabetes mellitus einen wichtigen Risikofaktor für Parodontitis darstellt [Chapple et al., 2013]. Es konnte gezeigt werden, dass Patienten mit Diabetes, unabhängig vom Alter, höhere Werte für die mittlere Taschensondierungstiefe sowie für den mittleren klinischen Attachmentverlust aufzeigen [Genco and Borgnakke, 2013; Khader et al., 2006; Lalla et al., 2006]. Die Progression des Knochenabbaus ist ebenso wie das Risiko für frühzeitigen Zahnverlust bei Diabetikern erhöht [Costa et al., 2013; Salvi et al., 2008]. Das Ausmaß dieser klinisch messbaren Folgen des Diabetes mellitus ist direkt mit der Einstellung des Blutzuckers (validierbar durch die Bestimmung des Anteils an glykiertem Hämoglobin im Blut, HbA1c-Wert in Prozent) verknüpft. Bei Patienten mit einem gut eingestellten Diabetes (HbA1c 6,5 bis 7,5 Prozent) unterscheidet sich der parodontale Zustand nicht von dem eines Nichtdiabetikers [Borgnakke, 2014].
Bei Diabetikern beeinflusst der chronische hyperglykämische Zustand direkt die Funktionalität einiger Immunzellen (wie zum Beispiel der Monozyten und der neutrophilen Granulozyten aufgrund einer Dysregulation der Synthese pro-inflammatorischer Zytokine [Taylor et al., 2013]. Weiterhin führt der erhöhte Blutzucker nicht nur zu einer Glykierung des Hämoglobins in Erythrozyten, sondern zu einer Vielzahl unterschiedlicher Proteine, was schließlich in eine Art „Sackgasse des Stoffwechsels“ mündet. Es handelt sich um die Ausbildung irreversibler Endprodukte (fortgeschrittene Glykierung; advanced glycation end products, AGEs), die sich in nahezu allen Gewebetypen und so auch in parodontalen Geweben anreichern können. Die AGEs können an einem spezifischen Zelloberflächenrezeptor, dem sogenannten RAGE (receptor for advanced glycation end products), auf Immunzellen binden und nach dessen Aktivierung zum Beispiel die Synthese pro-inflammatorischer Mediatoren und die Freisetzung aktiver Sauerstoffspezies bewirken [Polak and Shapira, 2017; Taylor et al., 2013].
Diese pathophysiologischen Faktoren tragen unter anderem erheblich zu einer Veränderung der körpereigenen Abwehrleistung sowie zu einer Verringerung der Heilungsbereitschaft bei, wodurch der dysbiotische dentale Biofilm eine verstärkte pathologische Wirkung entfaltet und damit bei anfälligen Patienten mit Diabetes mellitus zu einem schwereren Ausmaß der parodontal-entzündlichen Destruktion führen kann [Taylor et al., 2013; Polak and Shapira, 2017].
Einfluss der Parodontitis auf Diabetes mellitus
Grundsätzlich beeinflussen chronische komplex-entzündliche Erkrankungen die physiologische Regulation des Blutzuckers negativ. Parodontitis gehört zu den komplexen Entzündungserkrankungen des Menschen und es ist bekannt, dass die metabolische Einstellung bei Patienten mit Diabetes mellitus und Parodontitis im Vergleich zu parodontal gesunden Patienten mit Diabetes mellitus erschwert ist [Chapple et al., 2013]. Daher misst man bei Patienten mit schwerer Parodontitis höhere HbA1c-Werte [Taylor and Borgnakke, 2008]. Dieses Phänomen tritt durch die Präsenz pro-inflammatorischer Mediatoren wie zum Beispiel des Tumor-Nekrose-Faktors alpha (TNF alpha) im Blutstrom auf. TNF alpha beeinflusst unter anderem den Fettmetabolismus und wirkt als Insulinantagonist [Taylor and Borgnakke, 2008; Polak and Shapira, 2017].
Darüber hinaus kann eine moderate bis schwere Parodontitis ebenfalls die Komplikationen des Diabetes mellitus negativ beeinflussen. Gezeigt werden konnte, dass hier eine Assoziation mit kardio-renaler Mortalität, der Verkalkung atherosklerotischer Plaque, Nierenerkrankungen im Endstadium sowie der Makroalbuminurie besteht [Saremi et al., 2005; Shultis et al., 2007; Chapple et al., 2013; Sharma et al., 2016].
Besonders deutlich wird der Einfluss der Parodontitis auf Diabetes mellitus, wenn man die Veränderung des HbA1c-Wertes nach der aktiven Parodontitistherapie betrachtet. Metaanalysen konnten wiederholt zeigen, dass die Parodontitistherapie bei Patienten mit Diabetes mellitus im Mittel zu einer Reduktion des HbA1c-Wertes um 0,27 bis 0,65 Prozent führte [Engebretson and Kocher, 2013; Simpson et al., 2015; Madianos and Koromantzos, 2017]. Dieses Ausmaß der Reduktion des HbA1c-Wertes ist für eine verbesserte glykämische Einstellung klinisch relevant, wenn eine adäquate Parodontitistherapie durchgeführt wird [Borgnakke et al., 2014].
Basierend auf einem Konsensuspapier von Diabetologen und Parodontologen [Deschner et al., 2011] wird von der DG PARO, der DGZMK und der Deutschen Diabetesgesellschaft (DDG) eine Leitlinie „Diabetes und Parodontitis“ vorbereitet [http://www.awmf.org/leitlinien/detail/anmeldung/1/ll/083–015.html, Registriernummer: 083–015], um die interdisziplinäre Zusammenarbeit zwischen Hausärzten/Internisten beziehungsweise Diabetologen und den parodontologisch tätigen Zahnärzten beziehungsweise Parodontologen bei der Betreuung von Patienten mit Diabetes und/oder Parodontitis zu verbessern. Ein besonderes Augenmerk wird dabei auf der Früherkennung von Risikopatienten durch Screeningmaßnahmen liegen.
Parodontitis und kardiovaskuläre Erkrankungen
Kardiovaskuläre Erkrankungen
Es existiert eine Reihe unterschiedlicher Formen kardiovaskulärer Erkrankungen. Am bekanntesten ist die Atherosklerose, die im Verlauf der Erkrankung zu Gefäßlumenverengungen durch die verdickten Gefäßwände sowie zur Abnahme der Gefäßelastizität und in der Folge zu thrombembolischen Ereignissen wie Herzinfarkt oder Schlaganfall führt. Der Zusammenhang zwischen kardiovaskulären Erkrankungen und Parodontitis konnte in epidemiologischen Studien, in In-vitro- und in In-vivo-Untersuchungen gezeigt werden [Tonetti et al., 2013]. Darüber hinaus gibt es deutliche Hinweise, dass beide Erkrankungen gemeinsame genetische Risikofaktoren aufzeigen [Schaefer et al., 2015; Bochenek et al., 2013; Schaefer et al., 2009].
Einfluss der Parodontitis auf Atherosklerose
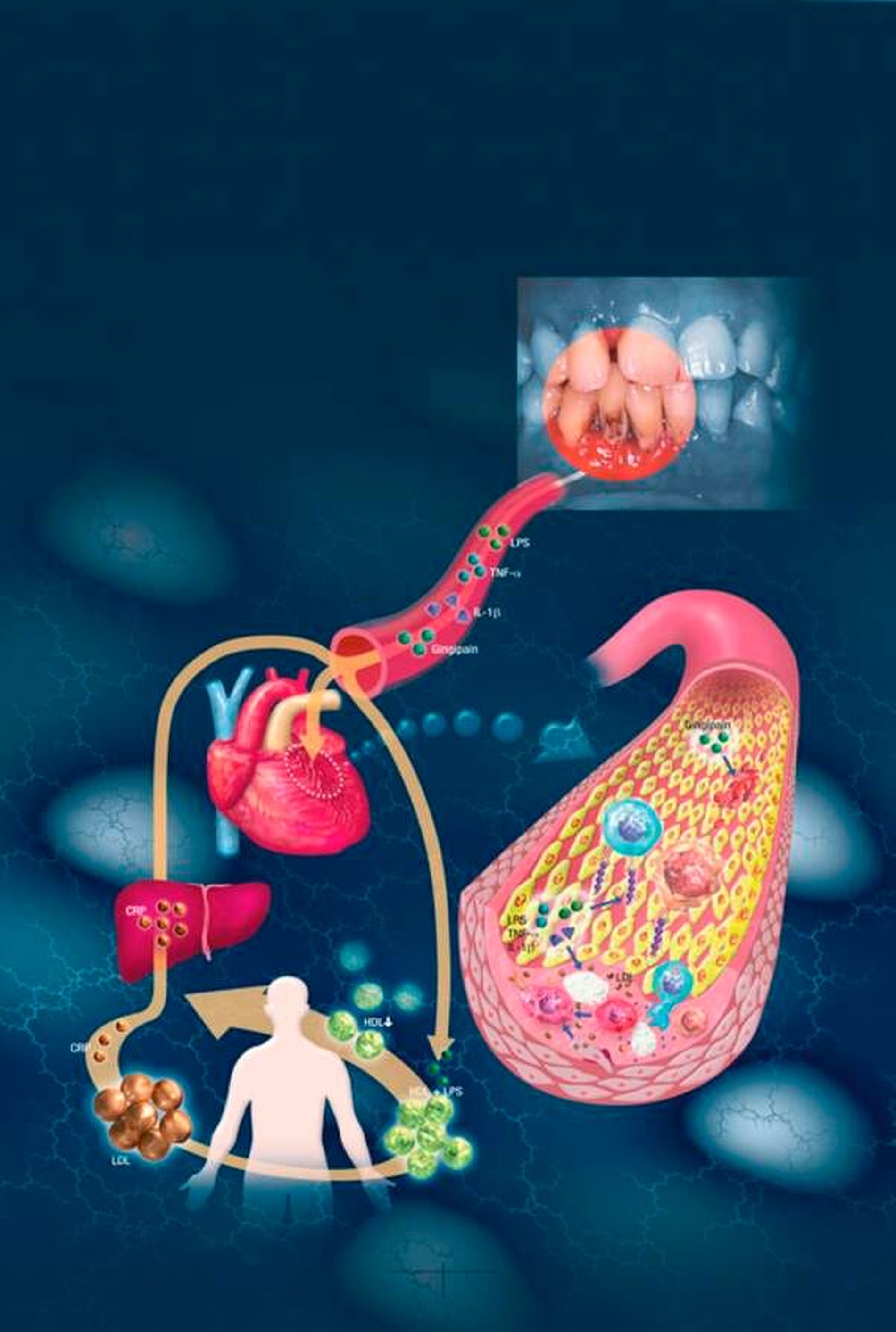
Die im Zuge der Parodontitistherapie auftretende Bakteriämie [Castillo et al., 2011; Zhang et al., 2013] steht seit Längerem im Verdacht, die Ätiopathogenese der Atherosklerose negativ zu beeinflussen. Eine Reihe von Studien stellte, unabhängig von anderen Co-Faktoren, eine Assoziation zwischen Parodontitis und kardiovaskulären Erkrankungen fest [Mustapha et al., 2007; Janket et al., 2003; Friedewald et al., 2009; Humphrey et al., 2008; Bahekar et al., 2007; Han and Wang, 2013]. Ebenfalls wurden Zusammenhänge zwischen Parodontitis und koronarer Herzkrankheit sowie Schlaganfall als Folgeerkrankungen von Gefäßveränderungen beschrieben (Abbildung 3) [Grau et al., 2004; Jimenez et al., 2009; Dietrich et al., 2008; Jepsen et al., 2015; Kebschull and Jepsen, 2011].
In diesem Kontext wurde die Rolle parodontal-pathogener Bakterien näher untersucht. Ergebnis: Es besteht eine Assoziation zwischen spezifischen parodontalen Bakterien (wie Porphyromonas gingivalis, Aggregatibacter actinomycetemcomitans, Tannerella forsythia) und den klinischen Folgen kardiovaskulärer Erkrankungen sowie der Gefäßwandstärke [Iwai, 2009; Desvarieux et al., 2005; Nonnenmacher et al., 2007, Spahr et al., 2006; Renvert et al., 2006; Kozarov, 2012]. Hierbei können parodontal-pathogene Bakterien die vaskulären Gewebe auf unterschiedliche Art und Weise beeinflussen. So fördert das Schlüsselbakterium P. gingivalis direkt den Tod der Gefäßendothelzellen [Bugueno et al., 2016] und inhibiert die proliferative Aktivität [Bartruff et al., 2005]. Auch Fusobacterium nucleatum inhibiert die Proliferation von endothelialen Zellen und behindert Prozesse der Angiogenese [Mendes et al., 2016]. Bakterien des dentalen Biofilms wie P. gingivalis, Eikenella corrodens und Prevotella intermedia können darüber hinaus in Endothelzellen eindringen und somit intrazelluläre Entzündungsprozesse vermitteln [Dorn et al., 2001; Dorn et al., 1999; Khlgatian et al., 2002; Kozarov, 2012; Deshpande et al., 1998]. Im Rahmen der Ätiopathogenese atherosklerotischer Veränderungen spielt die Ausbildung von Schaumzellen aus hyperreaktiven Makrophagen eine besondere Rolle. Diese pathologische Veränderung in der Gefäßwand wird durch P. gingivalis mit bewirkt und unterstützt [Shaik-Dasthagirisaheb et al., 2013; Lei et al., 2011; Giacona et al., 2004; Qi et al., 2003]. Weiterhin kann P. gingivalis die Ausbildung von Thromben in Gefäßen fördern [Roth et al., 2009].
Komplexe chronische Entzündungserkrankungen wie Parodontitis sind nicht nur lokal messbar, sondern können zu erhöhten Level an Akute-Phase-Proteinen wie das C-reaktive Protein (C-RP) und pro-inflammatorischen Mediatoren wie Interleukin 6 (IL-6) im Blutstrom führen [Noack et al., 2001; Loos, 2005; Loos et al., 2000; Lamster and Ahlo, 2007; Ebersole et al., 2002, Ebersole, 2003]. Es wird postuliert, dass die bei Parodontitis erhöhten Level inflammatorischer Mediatoren immunentzündliche Prozesse an der Gefäßwand mit beeinflussen und damit den Verlauf der atherosklerotischen Pathogenese negativ beeinflussen können.
Weitere ätiopathogenetische Co-Faktoren wie zum Beispiel Rauchen und Ernährung beeinflussen die Entstehung beider Erkrankungsformen – kardiovaskuläre Erkrankungen und Parodontitis – zusätzlich und seien daher hier mit erwähnt [Kebschull et al., 2010].

Einfluss der Parodontitistherapie auf das kardiovaskuläre System
Vor diesem Hintergrund stellt sich die Frage, ob die systematische Parodontitis-Therapie einen messbaren Einfluss auf bereits eingetretene vaskuläre Veränderungen wie zum Beispiel die Abnahme der Gefäßelastizität hat. Tatsächlich konnten Tonetti und Mitarbeiter 2007 einen solchen Effekt beschreiben [Tonetti et al., 2007]. Weitere Untersuchungen konnten dieses Phänomen bestätigen [Orlandi et al., 2014]. 60 und 180 Tage nach intensiver Parodontitis zeigte sich eine verbesserte Durchflussdilation der Gefäße nach vorher diagnostizierter endothelialer Dysfunktion. Zusätzlich konnte eine Abnahme von Entzündungszellen (polymorphkernige Granulozyten) sowie des Adhäsionsmoleküls E-Selektin, das eine wichtige Funktion im Rahmen entzündlicher Gefäßveränderungen erfüllt, beobachtet werden [Tonetti et al., 2007]. Eine neuere Studie zeigte die Abnahme der Intima-media-Dicke nach Parodontitistherapie bei Aborigines mit zuvor diagnostizierter kardiovaskulärer Erkrankung [Kapellas et al., 2014]. Grundsätzlich kann aus den bisher vorliegenden wissenschaftlichen Erkenntnissen gefolgert werden, dass die systematische Parodontitistherapie die endotheliale Funktionalität verbessern und zur Reduktion von Biomarkern führen kann, die in der Ätiopathogenese atherosklerotischer Erkrankungen wichtige Funktionen übernehmen [Teeuw et al., 2014]. Diese Erkenntnisse sind allerdings nicht nur bedeutsam für die Therapie, sondern vor allem auch für die Prävention atherosklerotischer Veränderungen. Es ist wahrscheinlich, dass eine adäquate Parodontitistherapie auch zur sekundären Prävention kardiovaskulärer Erkrankungen beitragen kann – allerdings ist hier der Nachweis in Interventionsstudien aus Designgründen sehr schwierig [Kebschull and Jepsen, 2011; Jepsen et al., 2011; Tonetti, 2009: Kebschull et al., 2010].
Parodontitis und Rheuma
Bei der Rheumatoiden Arthritis handelt es sich um eine komplexe Autoimmunerkrankung, die durch Infiltration von Immunzellen (Makrophagen und T-Zellen) in die Synovialmembran der Gelenke charakterisiert ist. In der Folge kommt es zur Hyperplasie der Synovialmembran, zur Knorpel-Degradation sowie -erosion und schließlich zu einer erheblichen Einschränkung der Gelenkfunktion. Die Patienten sind im Alltag und damit in ihrer Lebensqualität erheblich eingeschränkt [Looper et al., 2012; Christodoulou and Choy, 2006; Firestein, 2003].
Einfluss der Parodontitis auf Rheumatoide Arthritis
In den vergangenen Jahren konnten Erkenntnisse hinsichtlich epidemiologischer und klinischer Zusammenhänge zwischen Parodontitis und Rheumatoider Arthritis (RA) in zahlreichen Studien bestätigt werden [Leech and Bartold, 2015]. Grundlagenwissenschaftliche Untersuchungen haben sich mit den molekularen Mechanismen beschäftigt, um Hinweise darauf zu erhalten, wie es zu einem Einfluss der Parodontitis auf die RA kommen kann. Beide Erkrankungen zeigen zwar starke Ähnlichkeiten hinsichtlich der inflammatorischen Genese, jedoch sind die molekularen Zusammenhänge weniger offensichtlich. Für die RA ist die Bildung von Autoantikörpern charakteristisch und diese können oftmals bereits lange vor der klinischen Manifestation der Erkrankungen nachgewiesen werden [Bright et al., 2015]. Die genauen Abläufe im Rahmen der Ätiopathogenese der RA sind bislang nicht abschließend geklärt. Patienten mit RA zeigen Autoantikörper gegen den Fc-Abschnitt von Immunglobulin G, den sogenannten Rheumatoiden Faktor (RF) [Wegner et al., 2010a].
Zur Antikörperbildung tragen biochemische Prozesse wie Carbamylation und Citrullination erheblich bei [Holers, 2013; Demoruelle et al., 2014]. Die Citrullination ist eine enzymatische Reaktion zur post-translationalen Modifikation, bei der die Aminosäure Arginin zu Citrullin konvertiert wird. Dieser Prozess spielt eine wichtige Rolle in der Ätiopathogenese der RA und wird durch ein spezifisches Enzym, die Peptidylarginindeiminase (PAD), initiiert [Vossenaar et al., 2003]. Es existieren mindestens fünf unterschiedliche Formen der PAD, die in verschiedenen Geweben unterschiedliche Funktionen übernehmen [Bicker and Thompson, 2013]. Die Citrullination von Proteinen durch PADs hält in Gelenkräumen die Immunreaktion aufrecht und kann zu Cross-Reaktivität führen [Masson-Bessiere et al., 2001].
Einen wahrscheinlichen Zusammenhang zwischen Parodontitis und RA stellt P. gingivalis dar. Tatsächlich exprimiert P. gingivalis ebenfalls eine PAD, die zur Immuntoleranz führen und eine latente Antikörperreaktion gegen citrullinierte Proteine bewirken kann [Rosenstein et al., 2004]. Weiterhin synthetisiert P. gingivalis ein Enzym, die Enolase, das nach Auto-Citrullinierung zur Antikörperbildung führen kann. Diese cross-reagieren mit Antikörpern gegen die alpha-Enolase von Patienten mit RA [Lundberg et al., 2008]. Die PAD von P. gingivalis kann sowohl bakterielle als auch humane Peptide wie Fibrinogen und alpha-Enolase citrullinieren [Wegner et al., 2010b], ist jedoch evolutionär nicht mit der menschlichen PAD verwandt [McGraw et al., 1999].
Ein weiterer wichtiger Faktor, der zur Antikörperbildung beiträgt, ist die sogenannte Carbamylation [Klareskog et al., 2014]. Diese Reaktion tritt im Rahmen von Entzündungsreaktionen während der Freisetzung der Myeloperoxidase (MPO) von neutrophilen Granulozyten (PMNs) auf [Wang et al., 2007]. Die MPO spielt eine wichtige Rolle in der sogenannten NET-Formation von PMNs und beide Level, der MPO und der NETs, führen zur Erhöhung der Carbamylationsrate von Proteinen [Wang et al., 2009; Brinkmann et al., 2004; Parker et al., 2012]. Antikörper gegen carbamylierte Proteine werden in 45 Prozent der Patienten mit RA gefunden [Shi et al., 2011; Willemze et al., 2012]. Bei Patienten mit Gingivitis und Parodontitis sind lokal PMNs und damit die NET-Formationsrate sowie in diesem Zusammenhang die MPO erhöht [Freire and Van Dyke, 2013; Vitkov et al., 2009, Cooper et al., 2013]. Die erhöhte Konzentration der MPO kann in der Sulkusflüssigkeit entsprechend direkt nachgewiesen werden [Gomes et al., 2009; Leppilahti et al., 2014].
Einfluss der Parodontitistherapie auf die Rheumatoide Arthritis
Die Frage, ob die systematische Therapie der Parodontitis einen Einfluss auf den Verlauf der Rheumatoiden Arthritis zeigen könnte, ist derzeit Gegenstand der Forschung [Kaur et al., 2014]. Es existieren einige Parameter, an denen die „Aktivität“ der Erkrankung nachvollzogen werden kann. Diese Parameter werden als sogenannte „Disease Activity Score“ (Ranking der Erkrankungsaktivität) oder auch „DAS28“ bezeichnet [Fransen and van Riel, 2005]. Die Zahl 28 leitet sich von der Untersuchung von 28 Gelenken des menschlichen Körpers ab. Des Weiteren werden Parameter wie die Erythrozytensedimentationsrate (ESR), das akute Phase-Protein C-reaktives Protein (CRP), der Rheumatoide Faktor (RF), der Tumor-Nekrose-Faktor alpha (TNF alpha), Interleukin 1 (IL-1) und IL-6 im Blut gemessen. Eine visuelle Analogskala wird zum Erfassen der generellen Gesundheit verwendet [Fransen and van Riel, 2005].
Tatsächlich kann die systematische Therapie der Parodontitis zu einer Verbesserung dieser aufgeführten Parameter führen und somit möglicherweise den Verlauf der Erkrankung, vielleicht im Sinne einer Verlangsamung des Prozesses, positiv beeinflussen [Kaur et al., 2014].
Zusammenfassung und Auswirkung auf die Praxis
Dieser Artikel zeigt, dass systemische Erkrankungen durchaus von lokalen Entzündungen beeinflusst werden können (Abbildung 4). Die Parodontitis gehört zu den komplexen Entzündungserkrankungen, die durch multiple ätiologische Faktoren charakterisiert ist. Dazu können auch systemische Erkrankungen wie zum Beispiel Diabetes mellitus gehören, die Verlauf, Schweregrad und Progression der Parodontitis beeinflussen können. Umgekehrt kann sich die bakteriell induzierte parodontale Entzündung auf den gesamten Organismus auswirken, indem parodontal-pathogene Bakterien und/oder Entzündungsmediatoren in der Blutbahn andere Organbereiche des Körpers erreichen und dort pathologische Prozesse mit beeinflussen.
In diesem Zusammenhang sei erwähnt, dass Hinweise für einen Einfluss der Parodontitis auf weitere Erkrankungen wie zum Beispiel Krebserkrankungen, Atemwegserkrankungen, Nierenerkrankungen und Osteoporose in wissenschaftlichen Untersuchungen gefunden werden konnten. Diesen Hinweisen wird in aktuellen wissenschaftlichen Studien nachgegangen.
Die dargestellten Untersuchungsergebnisse in Hinblick auf den Einfluss der Parodontitistherapie auf die Blutzuckereinstellung von Patienten mit Diabetes mellitus, die Gefäßwandeigenschaften bei Patienten mit kardiovaskulären Erkrankungsformen bis hin zum positiven Effekt auf Faktoren des DAS28-Scores bei Patienten mit Rheumatoider Arthritis zeigen, dass die Behandlung dieser komplexen Entzündungserkrankung medizinisch unbedingt erforderlich ist. Für den zahnmedizinischen Alltag bedeutet dies eine gut koordinierte interdisziplinäre Zusammenarbeit mit den Kolleginnen und Kollegen der Humanmedizin, die zu einer umfassenden und kontrollierten Betreuung der Patienten mit Parodontitis beiträgt.
Univ.-Prof. Dr. med. dent. Henrik Dommisch
Direktor der Abteilung für Parodontologie und Synoptische Zahnmedizin
CharitéCentrum ZMK CC 3
Aßmannshauser Str. 4–6, 14197 Berlin
henrik.dommisch@charite.de
PD Dr. Moritz Kebschull
Oberarzt der Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde
Zentrum für ZMK
Welschnonnenstr. 17, 53111 Bonn
Prof. Dr. Dr. Søren Jepsen MS
Direktor der Poliklinik für Parodontologie, Zahnerhaltung und Präventive Zahnheilkunde
Zentrum für ZMK
Welschnonnenstr. 17, 53111 Bonn
Literaturverzeichnis
Bahekar, A. A., Singh, S., Saha, S., Molnar, J. & Arora, R. (2007) The prevalence and incidence of coronary heart disease is significantly increased in periodontitis: a meta-analysis. Am Heart J 154, 830-837. doi:10.1016/j.ahj.2007.06.037.
Bartruff, J. B., Yukna, R. A. & Layman, D. L. (2005) Outer membrane vesicles from Porphyromonas gingivalis affect the growth and function of cultured human gingival fibroblasts and umbilical vein endothelial cells. J Periodontol 76, 972-979. doi:10.1902/jop.2005.76.6.972.
Bicker, K. L. & Thompson, P. R. (2013) The protein arginine deiminases: Structure, function, inhibition, and disease. Biopolymers 99, 155-163. doi:10.1002/bip.22127.
Bochenek, G., Hasler, R., El Mokhtari, N. E., Konig, I. R., Loos, B. G., Jepsen, S., Rosenstiel, P., Schreiber, S. & Schaefer, A. S. (2013) The large non-coding RNA ANRIL, which is associated with atherosclerosis, periodontitis and several forms of cancer, regulates ADIPOR1, VAMP3 and C11ORF10. Hum Mol Genet 22, 4516-4527. doi:10.1093/hmg/ddt299.
Borgnakke, W. S. (2014) Hyperglycemia/Diabetes mellitus and periodontal infection adversely affect each other. In: Periodontal disease and overall health: a clinician`s guide., (eds.) R. Genco & R. C. Williams, 2nd Edition edition, pp. 99-122. Professional Audience Communications, Inc.., Pennsylvania, USA.
Borgnakke, W. S., Chapple, I. L., Genco, R. J., Armitage, G., Bartold, P. M., D'Aiuto, F., Eke, P. I., Giannobile, W. V., Kocher, T., Kornman, K. S., Lang, N. P., Madianos, P. N., Murakami, S., Nishimura, F., Offenbacher, S., Preshaw, P. M., Rahman, A. U., Sanz, M., Slots, J., Tonetti, M. S. & Van Dyke, T. E. (2014) The multi-center randomized controlled trial (RCT) published by the journal of the American Medical Association (JAMA) on the effect of periodontal therapy on glycated hemoglobin (HbA1c) has fundamental problems. J Evid Based Dent Pract 14, 127-132. doi:10.1016/j.jebdp.2014.04.017.
Bright, R., Proudman, S. M., Rosenstein, E. D. & Bartold, P. M. (2015) Is there a link between carbamylation and citrullination in periodontal disease and rheumatoid arthritis? Med Hypotheses 84, 570-576. doi:10.1016/j.mehy.2015.03.006.
Brinkmann, V., Reichard, U., Goosmann, C., Fauler, B., Uhlemann, Y., Weiss, D. S., Weinrauch, Y. & Zychlinsky, A. (2004) Neutrophil extracellular traps kill bacteria. Science 303, 1532-1535. doi:10.1126/science.1092385.
Bugueno, I. M., Khelif, Y., Seelam, N., Morand, D. N., Tenenbaum, H., Davideau, J. L. & Huck, O. (2016) Porphyromonas gingivalis Differentially Modulates Cell Death Profile in Ox-LDL and TNF-alpha Pre-Treated Endothelial Cells. PLoS One 11, e0154590. doi:10.1371/journal.pone.0154590.
Bundesärztekammer (BÄK), K. B. K., Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften (AWMF). (2013) Nationale VersorgungsLeitlinie Therapie des Typ-2-Diabetes – Langfassung, zuletzt geändert: November 2014. Available from: www.dm-therapie.versorgungsleitlinien.de. 1. Auflage. .
Castillo, D. M., Sanchez-Beltran, M. C., Castellanos, J. E., Sanz, I., Mayorga-Fayad, I., Sanz, M. & Lafaurie, G. I. (2011) Detection of specific periodontal microorganisms from bacteraemia samples after periodontal therapy using molecular-based diagnostics. J Clin Periodontol 38, 418-427. doi:10.1111/j.1600-051X.2011.01717.x.
Chapple, I. L., Genco, R. & Working group 2 of joint, E. F. P. A. A. P. w. (2013) Diabetes and periodontal diseases: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Clin Periodontol 40 Suppl 14, S106-112. doi:10.1111/jcpe.12077.
Christodoulou, C. & Choy, E. H. (2006) Joint inflammation and cytokine inhibition in rheumatoid arthritis. Clin Exp Med 6, 13-19. doi:10.1007/s10238-006-0088-5.
Cooper, P. R., Palmer, L. J. & Chapple, I. L. (2013) Neutrophil extracellular traps as a new paradigm in innate immunity: friend or foe? Periodontol 2000 63, 165-197. doi:10.1111/prd.12025.
Costa, F. O., Miranda Cota, L. O., Pereira Lages, E. J., Soares Dutra Oliveira, A. M., Dutra Oliveira, P. A., Cyrino, R. M., Medeiros Lorentz, T. C., Cortelli, S. C. & Cortelli, J. R. (2013) Progression of periodontitis and tooth loss associated with glycemic control in individuals undergoing periodontal maintenance therapy: a 5-year follow-up study. J Periodontol 84, 595-605. doi:10.1902/jop.2012.120255.
Demoruelle, M. K., Deane, K. D. & Holers, V. M. (2014) When and where does inflammation begin in rheumatoid arthritis? Curr Opin Rheumatol 26, 64-71. doi:10.1097/BOR.0000000000000017.
Deschner, J., Haag, T., Jepsen, S., Kocher, T., Mehnert, H., Meyle, J., Schumm-Draeger, P.-M. & Tschöpe, D. (2011) Diabetes mellitus und Parodontitis. Wechselbeziehung und klinische Implikationen. Ein Konsensuspapier. The Internist 52, 466-477.
Deshpande, R. G., Khan, M. B. & Genco, C. A. (1998) Invasion of aortic and heart endothelial cells by Porphyromonas gingivalis. Infect Immun 66, 5337-5343.
Desvarieux, M., Demmer, R. T., Rundek, T., Boden-Albala, B., Jacobs, D. R., Jr., Sacco, R. L. & Papapanou, P. N. (2005) Periodontal microbiota and carotid intima-media thickness: the Oral Infections and Vascular Disease Epidemiology Study (INVEST). Circulation 111, 576-582. doi:10.1161/01.CIR.0000154582.37101.15.
Dietrich, T., Jimenez, M., Krall Kaye, E. A., Vokonas, P. S. & Garcia, R. I. (2008) Age-dependent associations between chronic periodontitis/edentulism and risk of coronary heart disease. Circulation 117, 1668-1674. doi:10.1161/CIRCULATIONAHA.107.711507.
Dorn, B. R., Dunn, W. A., Jr. & Progulske-Fox, A. (1999) Invasion of human coronary artery cells by periodontal pathogens. Infect Immun 67, 5792-5798.
Dorn, B. R., Dunn, W. A., Jr. & Progulske-Fox, A. (2001) Porphyromonas gingivalis traffics to autophagosomes in human coronary artery endothelial cells. Infect Immun 69, 5698-5708.
Ebersole, J. L. (2003) Humoral immune responses in gingival crevice fluid: local and systemic implications. Periodontol 2000 31, 135-166.
Ebersole, J. L., Cappelli, D., Mathys, E. C., Steffen, M. J., Singer, R. E., Montgomery, M., Mott, G. E. & Novak, M. J. (2002) Periodontitis in humans and non-human primates: oral-systemic linkage inducing acute phase proteins. Ann Periodontol 7, 102-111. doi:10.1902/annals.2002.7.1.102.
Engebretson, S. & Kocher, T. (2013) Evidence that periodontal treatment improves diabetes outcomes: a systematic review and meta-analysis. J Clin Periodontol 40 Suppl 14, S153-163. doi:10.1111/jcpe.12084.
Firestein, G. S. (2003) Evolving concepts of rheumatoid arthritis. Nature 423, 356-361. doi:10.1038/nature01661.
Forner, L., Larsen, T., Kilian, M. & Holmstrup, P. (2006) Incidence of bacteremia after chewing, tooth brushing and scaling in individuals with periodontal inflammation. J Clin Periodontol 33, 401-407. doi:10.1111/j.1600-051X.2006.00924.x.
Fransen, J. & van Riel, P. L. (2005) The Disease Activity Score and the EULAR response criteria. Clin Exp Rheumatol 23, S93-99.
Freire, M. O. & Van Dyke, T. E. (2013) Natural resolution of inflammation. Periodontol 2000 63, 149-164. doi:10.1111/prd.12034.
Friedewald, V. E., Kornman, K. S., Beck, J. D., Genco, R., Goldfine, A., Libby, P., Offenbacher, S., Ridker, P. M., Van Dyke, T. E., Roberts, W. C., American Journal of, C. & Journal of, P. (2009) The American Journal of Cardiology and Journal of Periodontology Editors' Consensus: periodontitis and atherosclerotic cardiovascular disease. Am J Cardiol 104, 59-68. doi:10.1016/j.amjcard.2009.05.002.
Genco, R. J. & Borgnakke, W. S. (2013) Risk factors for periodontal disease. Periodontol 2000 62, 59-94. doi:10.1111/j.1600-0757.2012.00457.x.
Giacona, M. B., Papapanou, P. N., Lamster, I. B., Rong, L. L., D'Agati, V. D., Schmidt, A. M. & Lalla, E. (2004) Porphyromonas gingivalis induces its uptake by human macrophages and promotes foam cell formation in vitro. FEMS Microbiol Lett 241, 95-101. doi:10.1016/j.femsle.2004.10.009.
Gomes, D. A., Pires, J. R., Zuza, E. P., Muscara, M. N., Herrera, B. S., Spolidorio, L. C., Toledo, B. E. & Spolidorio, D. M. (2009) Myeloperoxidase as inflammatory marker of periodontal disease: experimental study in rats. Immunol Invest 38, 117-122. doi:10.1080/08820130802457503.
Grau, A. J., Becher, H., Ziegler, C. M., Lichy, C., Buggle, F., Kaiser, C., Lutz, R., Bultmann, S., Preusch, M. & Dorfer, C. E. (2004) Periodontal disease as a risk factor for ischemic stroke. Stroke 35, 496-501. doi:10.1161/01.STR.0000110789.20526.9D.
Graziani, F., Gennai, S., Solini, A. & Petrini, M. (2017) A systematic review and meta-analysis of epidemiological observational evidence on the effect of periodotitis on diabetes. An update of the EFP-AAP review by Borgnakke et al. (2013). Journal of Clinical Periodontology in print.
Hajishengallis, G. (2014) Immunomicrobial pathogenesis of periodontitis: keystones, pathobionts, and host response. Trends Immunol 35, 3-11. doi:10.1016/j.it.2013.09.001.
Hajishengallis, G. (2015) Periodontitis: from microbial immune subversion to systemic inflammation. Nat Rev Immunol 15, 30-44. doi:10.1038/nri3785.
Han, Y. W. & Wang, X. (2013) Mobile microbiome: oral bacteria in extra-oral infections and inflammation. J Dent Res 92, 485-491. doi:10.1177/0022034513487559.
Holers, V. M. (2013) Autoimmunity to citrullinated proteins and the initiation of rheumatoid arthritis. Curr Opin Immunol 25, 728-735. doi:10.1016/j.coi.2013.09.018.
Humphrey, L. L., Fu, R., Buckley, D. I., Freeman, M. & Helfand, M. (2008) Periodontal disease and coronary heart disease incidence: a systematic review and meta-analysis. J Gen Intern Med 23, 2079-2086. doi:10.1007/s11606-008-0787-6.
Iwai, T. (2009) Periodontal bacteremia and various vascular diseases. J Periodontal Res 44, 689-694. doi:10.1111/j.1600-0765.2008.01165.x.
Janket, S. J., Baird, A. E., Chuang, S. K. & Jones, J. A. (2003) Meta-analysis of periodontal disease and risk of coronary heart disease and stroke. Oral Surg Oral Med Oral Pathol Oral Radiol Endod 95, 559-569. doi:10.1067/moe.2003.107.
Jepsen, S. & Dommisch, H. (2014) Die parodontale Entzündung. ZM 104, 32-40.
Jepsen, S., Kebschull, M. & Deschner, J. (2011) [Relationship between periodontitis and systemic diseases]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz 54, 1089-1096. doi:10.1007/s00103-011-1348-4.
Jepsen, S., Stadlinger, B., Terheyden, H. & Sanz, M. (2015) Science transfer: oral health and general health - the links between periodontitis, atherosclerosis and diabetes. J Clin Periodontol 42, 1071-1073. doi:10.1111/jcpe.12484.
Jimenez, M., Krall, E. A., Garcia, R. I., Vokonas, P. S. & Dietrich, T. (2009) Periodontitis and incidence of cerebrovascular disease in men. Ann Neurol 66, 505-512. doi:10.1002/ana.21742.
Kapellas, K., Maple-Brown, L. J., Jamieson, L. M., Do, L. G., O'Dea, K., Brown, A., Cai, T. Y., Anstey, N. M., Sullivan, D. R., Wang, H., Celermajer, D. S., Slade, G. D. & Skilton, M. R. (2014) Effect of periodontal therapy on arterial structure and function among aboriginal australians: a randomized, controlled trial. Hypertension 64, 702-708. doi:10.1161/HYPERTENSIONAHA.114.03359.
Kassebaum, N. J., Bernabe, E., Dahiya, M., Bhandari, B., Murray, C. J. & Marcenes, W. (2014) Global burden of severe periodontitis in 1990-2010: a systematic review and meta-regression. J Dent Res 93, 1045-1053. doi:10.1177/0022034514552491.
Kaur, S., Bright, R., Proudman, S. M. & Bartold, P. M. (2014) Does periodontal treatment influence clinical and biochemical measures for rheumatoid arthritis? A systematic review and meta-analysis. Semin Arthritis Rheum 44, 113-122. doi:10.1016/j.semarthrit.2014.04.009.
Kebschull, M., Demmer, R. T. & Papapanou, P. N. (2010) „Gum bug, leave my heart alone!“--epidemiologic and mechanistic evidence linking periodontal infections and atherosclerosis. J Dent Res 89, 879-902. doi:10.1177/0022034510375281.
Kebschull, M. & Jepsen, S. (2011) Parodontitis und Atherosklerose. ZM, 28-35.
Khader, Y. S., Dauod, A. S., El-Qaderi, S. S., Alkafajei, A. & Batayha, W. Q. (2006) Periodontal status of diabetics compared with nondiabetics: a meta-analysis. J Diabetes Complications 20, 59-68. doi:10.1016/j.jdiacomp.2005.05.006.
Khlgatian, M., Nassar, H., Chou, H. H., Gibson, F. C., 3rd & Genco, C. A. (2002) Fimbria-dependent activation of cell adhesion molecule expression in Porphyromonas gingivalis-infected endothelial cells. Infect Immun 70, 257-267.
Kinane, D. F., Riggio, M. P., Walker, K. F., MacKenzie, D. & Shearer, B. (2005) Bacteraemia following periodontal procedures. J Clin Periodontol 32, 708-713. doi:10.1111/j.1600-051X.2005.00741.x.
Klareskog, L., Amara, K. & Malmstrom, V. (2014) Adaptive immunity in rheumatoid arthritis: anticitrulline and other antibodies in the pathogenesis of rheumatoid arthritis. Curr Opin Rheumatol 26, 72-79. doi:10.1097/BOR.0000000000000016.
Kozarov, E. (2012) Bacterial invasion of vascular cell types: vascular infectology and atherogenesis. Future Cardiol 8, 123-138. doi:10.2217/fca.11.75.
Kuzmanova, D., Jepsen, S. & H., D. (2017) Wie sind Parodontitis und Diabetes mellitus vergesellschaftet? Zähnarztliche Mitteilungen 107, 1-3.
Lalla, E., Cheng, B., Lal, S., Tucker, S., Greenberg, E., Goland, R. & Lamster, I. B. (2006) Periodontal changes in children and adolescents with diabetes: a case-control study. Diabetes Care 29, 295-299.
Lamster, I. B. & Ahlo, J. K. (2007) Analysis of gingival crevicular fluid as applied to the diagnosis of oral and systemic diseases. Ann N Y Acad Sci 1098, 216-229. doi:10.1196/annals.1384.027.
Leech, M. T. & Bartold, P. M. (2015) The association between rheumatoid arthritis and periodontitis. Best Pract Res Clin Rheumatol 29, 189-201. doi:10.1016/j.berh.2015.03.001.
Lei, L., Li, H., Yan, F., Li, Y. & Xiao, Y. (2011) Porphyromonas gingivalis lipopolysaccharide alters atherosclerotic-related gene expression in oxidized low-density-lipoprotein-induced macrophages and foam cells. J Periodontal Res 46, 427-437. doi:10.1111/j.1600-0765.2011.01356.x.
Leppilahti, J. M., Hernandez-Rios, P. A., Gamonal, J. A., Tervahartiala, T., Brignardello-Petersen, R., Mantyla, P., Sorsa, T. & Hernandez, M. (2014) Matrix metalloproteinases and myeloperoxidase in gingival crevicular fluid provide site-specific diagnostic value for chronic periodontitis. J Clin Periodontol 41, 348-356. doi:10.1111/jcpe.12223.
Lockhart, P. B., Brennan, M. T., Sasser, H. C., Fox, P. C., Paster, B. J. & Bahrani-Mougeot, F. K. (2008) Bacteremia associated with toothbrushing and dental extraction. Circulation 117, 3118-3125. doi:10.1161/CIRCULATIONAHA.107.758524.
Lockhart, P. B., Brennan, M. T., Thornhill, M., Michalowicz, B. S., Noll, J., Bahrani-Mougeot, F. K. & Sasser, H. C. (2009) Poor oral hygiene as a risk factor for infective endocarditis-related bacteremia. J Am Dent Assoc 140, 1238-1244.
Loe, H. (1993) Periodontal disease. The sixth complication of diabetes mellitus. Diabetes Care 16, 329-334.
Looper, K. J., Mustafa, S. S., Zelkowitz, P., Purden, M., Baron, M. & McGill Early Arthritis Research, G. (2012) Work instability and financial loss in early inflammatory arthritis. Int J Rheum Dis 15, 546-553. doi:10.1111/1756-185X.12009.
Loos, B. G. (2005) Systemic markers of inflammation in periodontitis. J Periodontol 76, 2106-2115. doi:10.1902/jop.2005.76.11-S.2106.
Loos, B. G., Craandijk, J., Hoek, F. J., Wertheim-van Dillen, P. M. & van der Velden, U. (2000) Elevation of systemic markers related to cardiovascular diseases in the peripheral blood of periodontitis patients. J Periodontol 71, 1528-1534. doi:10.1902/jop.2000.71.10.1528.
Lundberg, K., Kinloch, A., Fisher, B. A., Wegner, N., Wait, R., Charles, P., Mikuls, T. R. & Venables, P. J. (2008) Antibodies to citrullinated alpha-enolase peptide 1 are specific for rheumatoid arthritis and cross-react with bacterial enolase. Arthritis Rheum 58, 3009-3019. doi:10.1002/art.23936.
Madianos, P. & Koromantzos, P. A. (2017) An update on the evidence on the potential impact of periodontal therapy on diabetes outcomes. Journal of Clinical Periodontology in print.
Marsh, P. D. & Devine, D. A. (2011) How is the development of dental biofilms influenced by the host? J Clin Periodontol 38 Suppl 11, 28-35. doi:10.1111/j.1600-051X.2010.01673.x.
Masson-Bessiere, C., Sebbag, M., Girbal-Neuhauser, E., Nogueira, L., Vincent, C., Senshu, T. & Serre, G. (2001) The major synovial targets of the rheumatoid arthritis-specific antifilaggrin autoantibodies are deiminated forms of the alpha- and beta-chains of fibrin. J Immunol 166, 4177-4184.
McGraw, W. T., Potempa, J., Farley, D. & Travis, J. (1999) Purification, characterization, and sequence analysis of a potential virulence factor from Porphyromonas gingivalis, peptidylarginine deiminase. Infect Immun 67, 3248-3256.
Mendes, R. T., Nguyen, D., Stephens, D., Pamuk, F., Fernandes, D., Van Dyke, T. E. & Kantarci, A. (2016) Endothelial Cell Response to Fusobacterium nucleatum. Infect Immun 84, 2141-2148. doi:10.1128/IAI.01305-15.
Meyle, J. & Chapple, I. (2015) Molecular aspects of the pathogenesis of periodontitis. Periodontol 2000 69, 7-17. doi:10.1111/prd.12104.
Mustapha, I. Z., Debrey, S., Oladubu, M. & Ugarte, R. (2007) Markers of systemic bacterial exposure in periodontal disease and cardiovascular disease risk: a systematic review and meta-analysis. J Periodontol 78, 2289-2302. doi:10.1902/jop.2007.070140.
Nesse, W., Abbas, F., van der Ploeg, I., Spijkervet, F. K., Dijkstra, P. U. & Vissink, A. (2008) Periodontal inflamed surface area: quantifying inflammatory burden. J Clin Periodontol 35, 668-673. doi:10.1111/j.1600-051X.2008.01249.x.
Noack, B., Genco, R. J., Trevisan, M., Grossi, S., Zambon, J. J. & De Nardin, E. (2001) Periodontal infections contribute to elevated systemic C-reactive protein level. J Periodontol 72, 1221-1227. doi:10.1902/jop.2000.72.9.1221.
Nonnenmacher, C., Stelzel, M., Susin, C., Sattler, A. M., Schaefer, J. R., Maisch, B., Mutters, R. & Flores-de-Jacoby, L. (2007) Periodontal microbiota in patients with coronary artery disease measured by real-time polymerase chain reaction: a case-control study. J Periodontol 78, 1724-1730. doi:10.1902/jop.2007.060345.
Orlandi, M., Suvan, J., Petrie, A., Donos, N., Masi, S., Hingorani, A., Deanfield, J. & D'Aiuto, F. (2014) Association between periodontal disease and its treatment, flow-mediated dilatation and carotid intima-media thickness: a systematic review and meta-analysis. Atherosclerosis 236, 39-46. doi:10.1016/j.atherosclerosis.2014.06.002.
Parker, H., Albrett, A. M., Kettle, A. J. & Winterbourn, C. C. (2012) Myeloperoxidase associated with neutrophil extracellular traps is active and mediates bacterial killing in the presence of hydrogen peroxide. J Leukoc Biol 91, 369-376. doi:10.1189/jlb.0711387.
Polak, D. & Shapira, L. (2017) An udate for the evidence for pathogenic mechanisms that may link periodontitis and diabetes. Journal of Clinical Periodontology in print.
Preshaw, P. M., Alba, A. L., Herrera, D., Jepsen, S., Konstantinidis, A., Makrilakis, K. & Taylor, R. (2012) Periodontitis and diabetes: a two-way relationship. Diabetologia 55, 21-31. doi:10.1007/s00125-011-2342-y.
Qi, M., Miyakawa, H. & Kuramitsu, H. K. (2003) Porphyromonas gingivalis induces murine macrophage foam cell formation. Microb Pathog 35, 259-267.
Renvert, S., Pettersson, T., Ohlsson, O. & Persson, G. R. (2006) Bacterial profile and burden of periodontal infection in subjects with a diagnosis of acute coronary syndrome. J Periodontol 77, 1110-1119. doi:10.1902/jop.2006.050336.
Rosenstein, E. D., Greenwald, R. A., Kushner, L. J. & Weissmann, G. (2004) Hypothesis: the humoral immune response to oral bacteria provides a stimulus for the development of rheumatoid arthritis. Inflammation 28, 311-318. doi:10.1007/s10753-004-6641-z.
Roth, G. A., Aumayr, K., Giacona, M. B., Papapanou, P. N., Schmidt, A. M. & Lalla, E. (2009) Porphyromonas gingivalis infection and prothrombotic effects in human aortic smooth muscle cells. Thromb Res 123, 780-784. doi:10.1016/j.thromres.2008.07.008.
Salvi, G. E., Carollo-Bittel, B. & Lang, N. P. (2008) Effects of diabetes mellitus on periodontal and peri-implant conditions: update on associations and risks. J Clin Periodontol 35, 398-409. doi:10.1111/j.1600-051X.2008.01282.x.
Saremi, A., Nelson, R. G., Tulloch-Reid, M., Hanson, R. L., Sievers, M. L., Taylor, G. W., Shlossman, M., Bennett, P. H., Genco, R. & Knowler, W. C. (2005) Periodontal disease and mortality in type 2 diabetes. Diabetes Care 28, 27-32.
Schaefer, A. S., Bochenek, G., Jochens, A., Ellinghaus, D., Dommisch, H., Guzeldemir-Akcakanat, E., Graetz, C., Harks, I., Jockel-Schneider, Y., Weinspach, K., Meyle, J., Eickholz, P., Linden, G. J., Cine, N., Nohutcu, R., Weiss, E., Houri-Haddad, Y., Iraqi, F., Folwaczny, M., Noack, B., Strauch, K., Gieger, C., Waldenberger, M., Peters, A., Wijmenga, C., Yilmaz, E., Lieb, W., Rosenstiel, P., Doerfer, C., Bruckmann, C., Erdmann, J., Konig, I., Jepsen, S., Loos, B. G. & Schreiber, S. (2015) Genetic evidence for PLASMINOGEN as a shared genetic risk factor of coronary artery disease and periodontitis. Circ Cardiovasc Genet 8, 159-167. doi:10.1161/CIRCGENETICS.114.000554.
Schaefer, A. S., Richter, G. M., Groessner-Schreiber, B., Noack, B., Nothnagel, M., El Mokhtari, N. E., Loos, B. G., Jepsen, S. & Schreiber, S. (2009) Identification of a shared genetic susceptibility locus for coronary heart disease and periodontitis. PLoS Genet 5, e1000378. doi:10.1371/journal.pgen.1000378.
Shaik-Dasthagirisaheb, Y. B., Huang, N., Baer, M. T. & Gibson, F. C., 3rd (2013) Role of MyD88-dependent and MyD88-independent signaling in Porphyromonas gingivalis-elicited macrophage foam cell formation. Mol Oral Microbiol 28, 28-39. doi:10.1111/omi.12003.
Sharma, P., Dietrich, T., Ferro, C. J., Cockwell, P. & Chapple, I. L. (2016) Association between periodontitis and mortality in stages 3-5 chronic kidney disease: NHANES III and linked mortality study. J Clin Periodontol 43, 104-113. doi:10.1111/jcpe.12502.
Shi, J., Knevel, R., Suwannalai, P., van der Linden, M. P., Janssen, G. M., van Veelen, P. A., Levarht, N. E., van der Helm-van Mil, A. H., Cerami, A., Huizinga, T. W., Toes, R. E. & Trouw, L. A. (2011) Autoantibodies recognizing carbamylated proteins are present in sera of patients with rheumatoid arthritis and predict joint damage. Proc Natl Acad Sci U S A 108, 17372-17377. doi:10.1073/pnas.1114465108.
Shultis, W. A., Weil, E. J., Looker, H. C., Curtis, J. M., Shlossman, M., Genco, R. J., Knowler, W. C. & Nelson, R. G. (2007) Effect of periodontitis on overt nephropathy and end-stage renal disease in type 2 diabetes. Diabetes Care 30, 306-311. doi:10.2337/dc06-1184.
Simpson, T. C., Weldon, J. C., Worthington, H. V., Needleman, I., Wild, S. H., Moles, D. R., Stevenson, B., Furness, S. & Iheozor-Ejiofor, Z. (2015) Treatment of periodontal disease for glycaemic control in people with diabetes mellitus. Cochrane Database Syst Rev, CD004714. doi:10.1002/14651858.CD004714.pub3.
Spahr, A., Klein, E., Khuseyinova, N., Boeckh, C., Muche, R., Kunze, M., Rothenbacher, D., Pezeshki, G., Hoffmeister, A. & Koenig, W. (2006) Periodontal infections and coronary heart disease: role of periodontal bacteria and importance of total pathogen burden in the Coronary Event and Periodontal Disease (CORODONT) study. Arch Intern Med 166, 554-559. doi:10.1001/archinte.166.5.554.
Tamayo, T. & Rathmann, W. (2016) Epidemiologie des Diabetes in Deutschland. . In: diabetesDE - Deutscher Gesundheitsbericht Diabetes 2016., (ed.) D. Diabetes-Hilfe, pp. 9-17. Kirchheim & Co GmbH, Mainz,.
Taylor, G. W. & Borgnakke, W. S. (2008) Periodontal disease: associations with diabetes, glycemic control and complications. Oral Dis 14, 191-203. doi:10.1111/j.1601-0825.2008.01442.x.
Taylor, J. J., Preshaw, P. M. & Lalla, E. (2013) A review of the evidence for pathogenic mechanisms that may link periodontitis and diabetes. J Clin Periodontol 40 Suppl 14, S113-134. doi:10.1111/jcpe.12059.
Teeuw, W. J., Slot, D. E., Susanto, H., Gerdes, V. E., Abbas, F., D'Aiuto, F., Kastelein, J. J. & Loos, B. G. (2014) Treatment of periodontitis improves the atherosclerotic profile: a systematic review and meta-analysis. J Clin Periodontol 41, 70-79. doi:10.1111/jcpe.12171.
Tonetti, M. S. (2009) Periodontitis and risk for atherosclerosis: an update on intervention trials. J Clin Periodontol 36 Suppl 10, 15-19. doi:10.1111/j.1600-051X.2009.01417.x.
Tonetti, M. S., D'Aiuto, F., Nibali, L., Donald, A., Storry, C., Parkar, M., Suvan, J., Hingorani, A. D., Vallance, P. & Deanfield, J. (2007) Treatment of periodontitis and endothelial function. N Engl J Med 356, 911-920. doi:10.1056/NEJMoa063186.
Tonetti, M. S., Van Dyke, T. E. & Working group 1 of the joint, E. F. P. A. A. P. w. (2013) Periodontitis and atherosclerotic cardiovascular disease: consensus report of the Joint EFP/AAP Workshop on Periodontitis and Systemic Diseases. J Clin Periodontol 40 Suppl 14, S24-29. doi:10.1111/jcpe.12089.
Vitkov, L., Klappacher, M., Hannig, M. & Krautgartner, W. D. (2009) Extracellular neutrophil traps in periodontitis. J Periodontal Res 44, 664-672. doi:10.1111/j.1600-0765.2008.01175.x.
Vossenaar, E. R., Zendman, A. J., van Venrooij, W. J. & Pruijn, G. J. (2003) PAD, a growing family of citrullinating enzymes: genes, features and involvement in disease. Bioessays 25, 1106-1118. doi:10.1002/bies.10357.
Wang, Y., Li, M., Stadler, S., Correll, S., Li, P., Wang, D., Hayama, R., Leonelli, L., Han, H., Grigoryev, S. A., Allis, C. D. & Coonrod, S. A. (2009) Histone hypercitrullination mediates chromatin decondensation and neutrophil extracellular trap formation. J Cell Biol 184, 205-213. doi:10.1083/jcb.200806072.
Wang, Z., Nicholls, S. J., Rodriguez, E. R., Kummu, O., Horkko, S., Barnard, J., Reynolds, W. F., Topol, E. J., DiDonato, J. A. & Hazen, S. L. (2007) Protein carbamylation links inflammation, smoking, uremia and atherogenesis. Nat Med 13, 1176-1184. doi:10.1038/nm1637.
Wegner, N., Lundberg, K., Kinloch, A., Fisher, B., Malmstrom, V., Feldmann, M. & Venables, P. J. (2010a) Autoimmunity to specific citrullinated proteins gives the first clues to the etiology of rheumatoid arthritis. Immunol Rev 233, 34-54. doi:10.1111/j.0105-2896.2009.00850.x.
Wegner, N., Wait, R., Sroka, A., Eick, S., Nguyen, K. A., Lundberg, K., Kinloch, A., Culshaw, S., Potempa, J. & Venables, P. J. (2010b) Peptidylarginine deiminase from Porphyromonas gingivalis citrullinates human fibrinogen and alpha-enolase: implications for autoimmunity in rheumatoid arthritis. Arthritis Rheum 62, 2662-2672. doi:10.1002/art.27552.
Willemze, A., Toes, R. E., Huizinga, T. W. & Trouw, L. A. (2012) New biomarkers in rheumatoid arthritis. Neth J Med 70, 392-399.
Yoshie, H., Stadlinger, B., Terheyden, H. & Frankenberger, R. (2013) Illustrierte Beiträge aus der zahnmedizinischen Forschung und Praxis. Quintessenz Verlag, pp. 100.
Zhang, W., Daly, C. G., Mitchell, D. & Curtis, B. (2013) Incidence and magnitude of bacteraemia caused by flossing and by scaling and root planing. J Clin Periodontol 40, 41-52. doi:10.1111/jcpe.12029.
Zimmet, P., Alberti, K. G., Magliano, D. J. & Bennett, P. H. (2016) Diabetes mellitus statistics on prevalence and mortality: facts and fallacies. Nat Rev Endocrinol 12, 616-622. doi:10.1038/nrendo.2016.105.