Via Selbsttest zum Screening
Obwohl deren Prävalenz in den vergangenen Dekaden offenbar gesunken ist [Holtfreter et al., 2014], gilt die chronische Parodontitis noch immer als eine weltweit hochprävalente Erkrankung [Kassebaum et al., 2014; Holtfreter et al., 2014]. Allein in Deutschland sind über 50 Prozent der 35- bis 44-Jährigen und fast zwei Drittel der 65- bis 74-Jährigen von einer moderaten oder schweren Parodontitis (nach der Definition der Centers for Disease Control / American Academy of Periodontology (CDC/AAP) [Page and Eke, 2007] betroffen [Jordan/Micheelis, 2016].
Der Parodontitis-Risiko-Score – ein Selbsttest
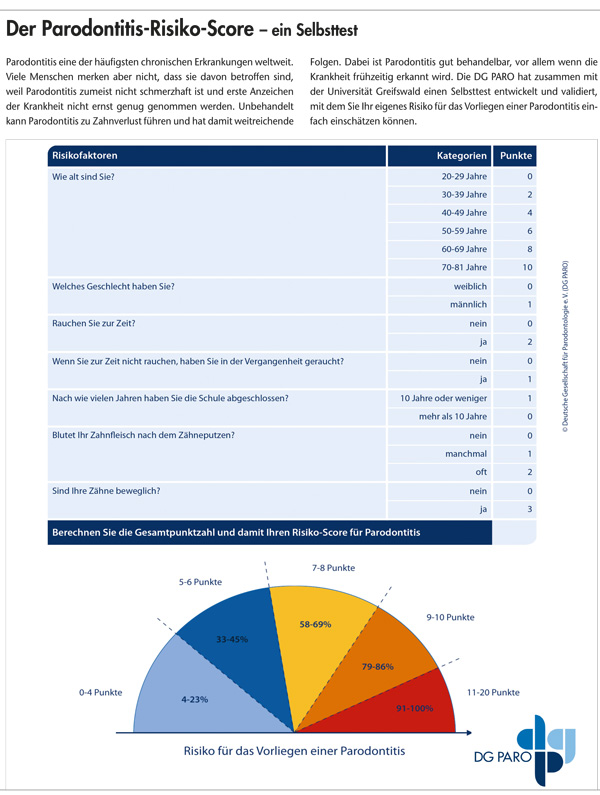
Parodontitis eine der häufigsten chronischen Erkrankungen weltweit. Viele Menschen merken aber nicht, dass sie davon betroffen sind, weil Parodontitis zumeist nicht schmerzhaft ist und erste Anzeichen der Krankheit nicht ernst genug genommen werden. Unbehandelt kann Parodontitis zu Zahnverlust führen und hat damit weitreichende Folgen. Dabei ist Parodontitis gut behandelbar, vor allem wenn die Krankheit frühzeitig erkannt wird. Die DG PARO hat zusammen mit der Universität Greifswald einen Selbsttest entwickelt und validiert, mit dem Sie Ihr eigenes Risiko für das Vorliegen einer Parodontitis einfach einschätzen können.
Die aktuellen DMS-V-Daten weisen in diesem Zusammenhang auf die eigentliche Problematik hin: Zumindest in Deutschland werden präventive Maßnahmen und Parodontalbehandlungen augenscheinlich nur unzureichend in Anspruch genommen [Jordan/Micheelis, 2016; Mund et al., 2016]. Demnach wurde bei 21,8 Prozent der 35- bis 44-Jährigen und bei 22,8 Prozent der 65- bis 74-Jährigen mindestens eine professionelle Zahnreinigung (PZR) innerhalb der vergangenen fünf Jahre durchgeführt. Eine Parodontalbehandlung fand in diesem Zeitraum dagegen bei nur 14,2 Prozent der 35- bis 44-Jährigen und bei 24,5 Prozent der 65- bis 74-Jährigen statt. Eine mögliche Ursache für die mangelnde Inanspruchnahme präventiver und therapeutischer Maßnahmen könnte eine unzureichende Wahrnehmung der eigenen parodontalen Situation seitens der Patienten und damit ein mangelndes Problembewusstsein sein.
Klinische Prädiktionsmodelle und punkte-basierte Risiko-Score-Systeme sind beliebte statistische Mittel, um den Zusammenhang zwischen einem Set aus Risikofaktoren und der Wahrscheinlichkeit für das Vorliegen beziehungsweise Neuauftreten einer Erkrankung oder unerwünschter Ereignisse darzustellen. Sie erlauben eine objektive Quantifizierung der Erkrankungswahrscheinlichkeit anstelle einer subjektiven, eher intuitiven klinischen Einschätzung auf Basis der vorliegenden Risikofaktoren.
In der kardiovaskulären Medizin werden Prädiktionsmodelle und Risiko-Score-Systeme bereits seit über 50 Jahren verwendet, wobei der Framingham-Risk-Score [Kannel et al., 1961] zur Vorhersage des kardiovaskulären Risikos sicherlich eines der ältesten und am besten weiterentwickelten punktebasierten Risiko-Score-Systeme ist.
Auch in der parodontalen Zahnmedizin wurden jüngst verschiedene Prädiktionsmodelle entwickelt. Die Oral Health Information Suite (OHIS) [Page/Martin, 2007] ist eine Kombination aus einem Disease Score und einem Risk Score, mit der der Verlauf des Parodontalstatus bewertet werden kann. Das Periodontal Risk Assessment (PRA) Tool (die sogenannte „Spinne“) [Lang/Tonetti, 2003] dient der Einschätzung des Risikos eines Rezidivs der Parodontitis und hilft bei der Bestimmung der Recallintervalllänge. Der Dental Risk Score (DRS) ist ein webbasiertes Analysetool, das eine aktuelle Risikobewertung auf Probandenebene sowie eine Voraussage der parodontalen Progression auf Zahnebene ermöglicht [Lindskog et al., 2010].
Neben der Risikoeinschätzung für ein zukünftiges Erkrankungs- oder Rezidivrisiko können solche Modelle auch der Einschätzung einer (gegenwärtigen) Erkrankungswahrscheinlichkeit dienen. In der Inneren Medizin werden sie etwa zur Risikoeinschätzung für Diabetes beziehungsweise Prä-Diabetes genutzt. (Deutscher Diabetes-Risiko-Test [Paprott et al., 2016]).
Basierend auf dem von Zhan et al. 2014 entwickelten und umfangreich validierten Diagnose-Modell für eine moderate oder schwere Parodontitis (nach der CDC/AAP-Definition [Page/Eke, 2007]) stellen wir hier ein punktebasiertes Risiko-Score-System vor, das die Patienten unabhängig von der Erhebung klinischer Befunddaten anwenden können. Sowohl die interne als auch die externe Validierung des Parodontitis-Risiko-Scores erfolgt anschließend anhand der populationsbasierten Studies of Health in Pomerania (SHIP-0 und SHIP-Trend-0). Patienten können so ihr Risiko einer aktuellen moderaten oder schweren Parodontitis selbst berechnen. Mithilfe einer Farbcodierung (von blau zu rot) können sie dann selbst entscheiden, ob ein Besuch beim Zahnarzt oder Parodontologen notwendig ist.
Darstellung
Das Risiko-Score-System ist in Tabelle 2 ausführlich dargestellt. Für die einzelnen Variablen sind die möglichen Kategorien und die entsprechenden Score-Werte aufgelistet. Für die SHIP-0-Daten ergab sich eine annähernde Normalverteilung der Score-Werte (Abbildung 1). Die minimale Gesamtpunktzahl ist null, die maximale Gesamtpunktzahl ist 20, der Median liegt bei sieben (Q25-Prozent = fünf; Q75-Prozent = zehn).
Die Wahrscheinlichkeit einer Parodontitis in Abhängigkeit vom Risiko-Score ist in Abbildung 2 dargestellt. Mit einem steigenden Risiko-Score nimmt auch die Wahrscheinlichkeit für das Vorliegen einer Parodontitis zu (moderat oder schwer, nach CDC/AAP-Definition). Für einen Probanden mit einem Risiko-Score von null liegt die Wahrscheinlichkeit bei 3,8 Prozent, mit einem Risiko-Score von sieben bei 57,5 Prozent. Das höchste Risiko hätte ein Proband mit einem Risiko-Score von 20 (99,9 Prozent).
Evaluierung
Um anschließend das vorhergesagte Risiko einer Parodontitis zwischen dem Risiko-Score und dem ursprünglichen logistischen Regressionsmodell zu vergleichen (Tabelle 3), wurden die Parodontitisrisiken für vier fiktive Personen bestimmt und gegenübergestellt. Ergebnis: Was das geschätzte Risiko einer Parodontitis betrifft, ist der Risiko-Score vergleichbar mit dem logistischen Modell. Die Differenz beider Werte lag für die vier fiktiven Fälle zwischen 0,002 (0,2 Prozent) und 0,063 (6,3 Prozent).
Material und Methoden
Studienpopulationen SHIP-0 und SHIP-Trend-0
Die „Study of Health in Pomerania“ (SHIP) ist eine populationsbasierte Kohortenstudie in Vorpommern. Nach dem Vorbild des „World Health Organization Monitoring Trends and Determinants in Cardiovascular Disease“(MONICA)-Projekts in Augsburg [Keil et al., 1988] wurde ein zweistufiges Cluster-Design umgesetzt [John et al., 2001]. Von 7.008 ausgewählten Erwachsenen im Alter von 20 bis 79 Jahren befanden sich 6.262 in der Rekrutierungsbasis. Davon wurden 4.308 Personen (68,8 Prozent) in der Basisstudie SHIP-0 (1997–2001) untersucht.
SHIP-Trend ist eine zweite unabhängige Kohorte. Für die Basisuntersuchung (SHIP-Trend-0) wurden 10.000 Erwachsene aus der mit SHIP identischen Region eingeladen. Die alters- und geschlechtsstratifizierte, randomisierte Stichprobe aus den zentralisierten Registerdaten Mecklenburg-Vorpommerns ergab eine Teilnahme von 4.420 Erwachsene an der Untersuchung. Dies entspricht einem Response von 50,1 Prozent.
Parodontalstatus in SHIP
Der klinische Attachmentverlust (AV) und die Sondierungstiefe (ST) wurden mit einer Parodontalsonde (SHIP-0: PCP-11, SHIP-Trend-0: PCP-15; Hu-Friedy, Chicago, IL, USA) halbseitig (1./4. oder 2./3. Quadrant, ohne 8er) an vier Flächen pro Zahn (distobukkal, mittbukkal, mesiobukkal, mittlingual/mittpalatinal) erhoben und auf ganze Millimeter gerundet. Die acht zahnärztlichen Untersucher wurden alle sechs bis zwölf Monate zertifiziert. Für den AV wurden Intra-Observer-Korrelationen von 0,82–0,91 und Inter-Observer-Korrelationen von 0,84 erzielt [Hensel et al., 2003]. Die Probanden wurden anhand der CDC/AAP-Fallklassifikation [Page/Eke, 2007] in Gruppen mit keiner oder milder, moderater oder schwerer Parodontitis unterteilt.
Das zugrunde liegende Modell
Alle Analysen wurden mit Stata/SE 14.2 [StataCorp, 2015] durchgeführt. Der Risiko-Score wurde basierend auf dem von Zhan et al. publizierten Modell zur Vorhersage der Parodontitis (CDC/AAP-Definition; Modell 1) erstellt [Zhan et al., 2014]. Das Modell diskriminierte Probanden ohne (keine oder milde Parodontitis) und mit Parodontitis (moderate oder schwere Parodontitis nach CDC/AAP-Definition) mit einer C-Statistik von 0,84 (95 Prozent Konfidenzintervall (KI): 0,82; 0,86, Tabelle 1), das heißt, dass in 84 Prozent der Fälle ein zufällig ausgesuchter erkrankter Proband ein höheres Erkrankungsrisiko aufwies als ein zufällig ausgesuchter gesunder Proband.
Vorgehen bei dem Risiko-Score
Der Risiko-Score wurde wie in Sullivan et al. beschrieben aufgestellt [Sullivan et al., 2004]. Um abzuschätzen, ob sich durch die Umstellung auf den Risiko-Score die Vorhersagegüte verändert hat, wurde das vorhergesagte Risiko einer Parodontitis zwischen dem Risiko-Score und dem ursprünglichen logistischen Regressionsmodell verglichen, indem Parodontitisrisiken für verschiedene fiktive Personen bestimmt wurden.
Weiterhin wurden die Probanden anhand des Risiko-Scores in fünf gleich große Gruppen unterteilt. Die Farbcodierung gibt die fünf Risiko-Straten wieder. Die Verteilung der CDC/AAP-Definition innerhalb der fünf Risiko-Gruppen ist in Abbildung 2 dargestellt. Der Anteil steigt über die einzelnen Straten kontinuierlich an: von 12,9 Prozent für Stratum eins (niedrigstes Risiko) bis auf 90,0 Prozent für Stratum fünf (höchstes Risiko). Zwischen den Straten war jeweils ein Anstieg des Anteils parodontal erkrankter Probanden um mindestens 12 Prozent zu beobachten. Der höchste Anstieg trat zwischen Stratum zwei und Stratum drei auf (Δ = 27,8 Prozent).
Anschließend wurden die Risiko-Scores und das logistische Ausgangsmodell hinsichtlich deren Vorhersagegüte verglichen. Die C-Statistik in Bezug auf das Risiko einer Parodontitis lag für den Risiko-Score bei 0,83 (95 Prozent KI: 0,83; 0,85) und für das logistische Modell bei 0,84 (95 Prozent KI: 0,82; 0,86). Diese Differenz ist durchaus vernachlässigbar und spricht für das Risiko-Score-System, das trotz einfacherer Erfassung (über das Punktesystem) eine vergleichbare Schätzung des Parodontitis-Risikos ermöglicht.
Validierung
Die Validierung des Risiko-Scores erfolgte an den SHIP-Trend-0-Daten, mit denen für jeden Probanden der Risiko-Score berechnet und in einem Histogramm dargestellt wurde (Abbildung 3). Der minimale Risiko-Score ist 0, der maximale Risiko-Score ist 17; der Median liegt bei acht (Q25-Prozent = fünf; Q75-Prozent = zehn). Bezüglich der Parodontitis-Definition (CDC/AAP-Definition; moderate und schwere Parodontitis) unterschied der berechnete Risiko-Score mit einer sehr guten Genauigkeit: Die C-Statistik lag bei 0,82 (95 Prozent KI: 0,80; 0,83).
Anschließend wurden die Probanden in die fünf Straten eingeteilt und der eigentlichen CDC/AAP-Definition gegenübergestellt. Die Verteilung der CDC/AAP-Definition innerhalb der fünf Risiko-Gruppen ist in Abbildung 4 dargestellt. Der Anteil steigt über die einzelnen Straten kontinuierlich an: von 11,2 Prozent für Stratum eins (niedrigstes Risiko) bis auf 87,6 Prozent für Stratum fünf (höchstes Risiko). Zwischen den Straten war jeweils ein Anstieg des Anteils parodontal erkrankter Probanden um mindestens 16 Prozent zu beobachten. Der höchste Anstieg war zwischen Stratum drei und Stratum vier zu verzeichnen (Δ = 22,7 Prozent).
Um eine breite Anwendung des Risiko-Scores in medizinischen Praxen zu ermöglichen, wurde eine Vorlage entwickelt (Abbildung 5), die über die Internetseite www.dgparo.de/media heruntergeladen werden kann.
Der Risiko-Score kann somit anhand der Vorlage auch von zahnmedizinischen Laien einfach ermittelt werden. In Abhängigkeit von der Gesamtpunktzahl wird das Risiko für das Vorliegen einer moderaten oder schweren Parodontitis bestimmt. Der Patient erhält über die Farbcodierung (von blau zu rot) ein direktes Feedback zum eigenen ermittelten Parodontitis-Risiko. Dadurch soll für den Patienten ein Anreiz entstehen, gezielt den Zahnarzt aufzusuchen.
Diskussion
Der Parodontitis-Risiko-Score stellt ein valides Mittel zur Selbsteinschätzung der Wahrscheinlichkeit einer aktuell vorliegenden Parodontitis nach den CDC/AAP-Kriterien dar. Die zur Aufstellung des Risiko-Scores verwendete Methode wurde häufig in der Medizin umgesetzt – unter anderem bei der Erstellung des Framingham-Scores [Sullivan et al., 2004]. Der hier aufgestellte Risiko-Score erreichte in der internen wie auch in der externen Validierung sehr gute Ergebnisse, mit C-Statistiken jeweils über 0,8. So konnte in der internen wie in der externen Validierung ein kontinuierlicher Anstieg des prozentualen Anteils der Probanden mit Parodontitis über die fünf Straten, die anhand des Risiko-Scores definiert wurden, beobachtet werden.
Da Diabetiker ein erhöhtes Risiko für Parodontitis haben [Chapple/Genco, 2013; Demmer et al., 2012], könnte dieses Formular zum Beispiel auch im Wartezimmer von Diabetologen zum Parodontitis-Screening eingesetzt werden. Hausärzte und Diabetologen nehmen zwar keine zahnärztliche Untersuchung vor, sollten aber ihre Patienten motivieren, einen Zahnarzt zur parodontalen Untersuchung und gegebenenfalls zur Behandlung aufzusuchen.
In den vergangenen Jahren wurde Parodontitis häufig als sogenannte „silent disease“ beschrieben, da sie schleichend und weitestgehend schmerzfrei fortschreitet und häufig vom Patienten erst dann wahrgenommen wird, wenn Zahnbeweglichkeit und Zahnverlust auftreten. Das eigentliche Problem lag somit in der unzureichenden Aufklärung, als auch in der unzureichenden Selbstwahrnehmung der Parodontitis durch die Patienten selbst. Da die Parodontitis immer mehr als eine chronische Erkrankung mit (möglicherweise) vielschichtigen systemischen Auswirkungen [Chapple/Genco, 2013; Linden et al., 2013; Tonetti/Van Dyke, 2013] wahrgenommen wird, kann man davon ausgehen, dass sich auch die Wahrnehmung in der Bevölkerung verbessert hat.
So konnte unsere Arbeitsgruppe kürzlich zeigen, dass die Schwere der Parodontitis mit der Selbstwahrnehmung der eigenen Mundgesundheit assoziiert war [Schutzhold et al., 2014]. Dennoch war die Selbstwahrnehmung von Zahnverlust, Karies und prothetischer Versorgung stärker ausgeprägt. Die Assoziation zwischen der Schwere der Parodontitis und der Selbsteinschätzung der Mundgesundheit wurde durch frühere Studien bestätigt [Cunha-Cruz et al., 2007; Gift et al., 1998; Locker et al., 2005]. Weiterhin bekräftigte ein kürzlich erschienener Review den Zusammenhang zwischen der Schwere und dem Ausmaß der Parodontalerkrankungen und der mundgesundheitsbezogenen Lebensqualität [Buset et al., 2016]. Insgesamt deuten die Studien auf eine zunehmend bessere Wahrnehmung der parodontalen Situation in der Allgemeinbevölkerung hin.
Zusammenfassend stellt der ParodontitisRisiko-Score ein valides Instrument dar, um das eigene Parodontitis-Risiko ohne die Notwendigkeit klinischer Daten zu bestimmen. Eine bevölkerungsweite Anwendung könnte zur Verbesserung der Selbstwahrnehmung des eigenen Parodontalstatus beitragen und langfristig über eine daraus resultierende frühzeitige Diagnostik und Therapie zu einer Senkung der bevölkerungsweiten Prävalenz beitragen.
Dr. Birte Holtfreter
Abteilung für Parodontologie
Poliklinik für Zahnerhaltung, Parodontologie, Endodontologie, Kinderzahnheilkunde und Präventive Zahnheilkunde
Universitätsmedizin Greifswald
birte.holtfreter@uni-greifswald.de
Prof. Thomas Dietrich
Department of Oral Surgery
School of Dentistry
University of Birmingham
Birmingham, UK
Dr. Bettina Dannewitz
Poliklinik für Parodontologie
Zentrum der Zahn-, Mund- und Kieferheilkunde (Carolinum) der Johann Wolfgang Goethe-Universität Frankfurt am Main
Dr. Henry Völzke
Abteilung Study of Health in Pomerania / Klinisch-Epidemiologische Forschung (SHIP-KEF)
Institut für Community Medicine
Universitätsmedizin Greifswald
Prof. Thomas Kocher
Abteilung für Parodontologie
Poliklinik für Zahnerhaltung, Parodontologie, Endodontologie, Kinderzahnheilkunde und Präventive Zahnheilkunde
Universitätsmedizin Greifswald













