Wie kann KI uns nützen?
Der Begriff KI wurde Mitte der 1950er-Jahre geprägt, jedoch veränderte sich die Definition über die Zeit. Im American National Standard Dictionary of Information Technology [ANSDIT, 1996] wird KI definiert als die „Fähigkeit eines Geräts, Funktionen auszuführen, die normalerweise mit menschlicher Intelligenz verbunden sind, wie Denken, Lernen und Selbstverbesserung“.
Die beeindruckenden KI-Anwendungen von heute wurden durch eine Reihe technologischer Weiterentwicklungen ermöglicht (Abbildung 1):
Die Evolution von Hardware: Die Weiterentwicklung von Computerchips und vor allem Grafikkarten hat rechenintensive Anwendungen wie das Maschinelle Sehen (siehe unten) ermöglicht. Die Idee, Maschinen „sehen zu lassen“ und hierdurch Bilder analysieren zu können, ist bereits mehr als 50 Jahre alt. Allerdings standen jahrzehntelang nicht ausreichend Rechenkapazitäten zur Verfügung, um die aufwendigen Algorithmen, die ein solches Sehen ermöglichen, einzusetzen.
Die „Demokratisierung“ von Software: Heute stehen nicht nur großen universitären Forschungszentren oder Industriegiganten Algorithmen und Prozeduren zur Verfügung, um KI-Applikationen zu entwickeln. Ganz im Gegenteil; Software für die Entwicklung von KI-Algorithmen wird inzwischen frei erhältlich im Internet zur Verfügung gestellt. Der einfache Zugriff auf diese Technologie ermöglicht auch kleineren Unternehmen und Start-ups die Entwicklung von KI-Software und trägt damit mit zur rasanten Verbreitung solcher Applikationen bei.
Die vorhandenen Datenmengen sind explodiert. Die digitale Durchdringung aller Arbeits- und Lebensbereiche führt zu einer nie dagewesenen Verfügbarkeit riesiger Datenmengen. In 2020 stehen geschätzt etwa fünf- bis zehnmal so viele Daten zur Verfügung wie noch 2015. Daten gelten als „das neue Öl“; mit Daten verdienen Konzerne wie Google, Facebook oder Amazon ihr Geld. Gleichzeitig sind sie aber auch der Motor für KI-Weiterentwicklungen in Medizin und Zahnmedizin [Mertz, 2018]. Die bessere Nutzung von Daten wird auch für die Zahnmedizin ein zentrales Thema in den nächsten 30 Jahren sein [Schwendicke et al., 2019].
In der Medizin werden diese drei Entwicklungen ergänzt durch Fortschritte in der sogenannten Systemmedizin: Die „Omics“-Forschung, also beispielsweise Microbiomics (die Analyse des menschlichen Mikrobioms, unter anderem in der Mundhöhle), Genomics (die Analyse des menschlichen Genoms) oder auch Proteomics (die Analyse von an bestimmten Stoffwechselvorgängen oder Krankheiten beteiligten Proteinen) ermöglichen ein nie gekanntes Maß an Detailverständnis zu physiologischen und pathologischen Vorgängen im menschlichen Körper [Grapov et al., 2018]. Auch hier fallen die Möglichkeiten, entsprechende Analysen durchführen zu können (Hardwareentwicklung) mit der Möglichkeit zusammen, die generierten riesigen Datenmengen zu analysieren (Softwareentwicklung). In der Zahnmedizin sind diese Omics-Technologien bisher weniger relevant, allerdings werden sinkende Preise im Bereich von Omics-Hardware eine Verbreitung dieser Methoden in der Zahnmedizin mittelfristig vorantreiben.
Diese skizzierten Trends haben das Feld der KI in der vergangenen Dekade enorm beschleunigt und zahlreiche Anwendungsbereiche eröffnet. Hierzu gehören das bereits benannte Maschinelle Sehen (a), die Sprachverarbeitung (b), die Robotik (c) und Virtual Reality oder Simulationssysteme (d). Für diese Felder finden sich auch in der medizinischen Arena zahlreiche Anwendungsfelder [Yu et al., 2018]:
a) Die Analyse von medizinischen Bildern mittels Maschinellem Sehen (histologische Bilder, Röntgenbilder oder klinische Fotos) hat enormes Potenzial zur Qualitätsverbesserung und Zeiteinsparung [Miller & Brown, 2019].
b) Die Sprachverarbeitung durch Maschinen erlaubt eine sprachbasierte, semi-automatische Dokumentation sowie die sinnvolle Systematisierung und Verknüpfung bereits archivierter und neu hinzukommender Informationen in Patientenakten; selbst die Interaktion von Maschinen mit Patienten ist heute bereits durch Sprache möglich (zum Beispiel Onko-Bots oder Pflegeroboter) [Bhavaraju, 2018; Avati et al., 2018].
c) In der Chirurgie sind Operationsroboter bereits relativ weit verbreitet; auch in der Zahnmedizin kann theoretisch heute schon robotergestützt operiert werden. So ist beispielsweise eine vollautomatische Implantation durch einen autonom agierenden Roboter heute bereits technisch möglich – hier ist es aber vor allem der Preis einer solchen Prozedur, der einen routinemäßigen Einsatz unwahrscheinlich macht [Wu et al., 2019].
d) Simulationssysteme werden heute in der Pharmaforschung bereits standardmäßig zur Identifikation neuer Wirkstoffe eingesetzt und die Simulation von physiologischen Vorgängen des stomatognathen Systems unter Rückgriff auf Scan- und andere Erfassungssysteme ist bereits heute Teil des digitalen Workflows in Chirurgie oder Prothetik [Schwendicke et al., 2020].
Die Erwartungen an KI-Anwendungen sind heute so hoch wie selten zuvor (Abbildung 2). Allerdings hat das Feld der KI schon diverse Höhen und Tiefen erlebt: Auf jede Euphorie folgte bisher stets Ernüchterung. Wie weiter unten dargelegt, sind in der medizinischen KI-Anwendung noch zahlreiche Fragen offen. Diese sollten rasch und systematisch beantwortet werden: Nur belastbare, robuste, vertrauenswürdige KI-Anwendungen werden es schaffen, aus der aktuellen Euphorie eine lang anhaltende Akzeptanz dieser neuen Technologie zu schöpfen.
Maschinelles Lernen
Eine zentrale technische Komponente vieler der geschilderten KI-Anwendungen ist das sogenannte Maschinelle Lernen (ML). Beim ML ist es nicht der menschliche Programmierer, der der Maschine die Regeln vorgibt. Stattdessen lernt die Maschine selbst, sich Regeln aus vorhanden Daten abzuleiten. Dies erfolgt folgendermaßen:
Bestimmten Datenobjekten, zum Beispiel Bildern, werden durch einen Menschen (den sogenannten Annotator) bestimmte Informationen zugeordnet. Dies würden bei Bilddaten beispielsweise Bildinformationen sein („Auf diesem Bild ist ein Bus zu sehen.“). Diese Form des Maschinellen Lernens, in der Beispiele und dazugehörige Antworten zum Lernen genutzt werden, bezeichnen wir als überwachtes Lernen („supervised learning“). Anders als bei der Annotation von Fotos aus der Alltagswelt (wo Busse, Ampeln oder Hydranten identifiziert werden müssen) gilt es bei medizinischen Annotationen zu beachten, dass Expertenwissen notwendig ist. Medizinische Annotationen sind daher oft teurer und auch schwieriger (Ein einzelner Annotator kann mit hoher Sicherheit eine Ampel detektieren, hat aber bei der Detektion von Pathologien auf Bildern gewisse Grenzen.).
Aus den zwei „Hauptzutaten“ (1) Datensatz (also beispielsweise Tausende von Bildern mit Bussen, Katzen und Hunden) und (2) Informationen (zum Beispiel Bildinformationen) können Maschinen nun in einem iterativen Prozess statische Muster in den Daten verstehen und abstrahieren lernen. Hierbei lernen die Maschinen schrittweise aus ihren eigenen Fehlern: Der Algorithmus generiert zunächst zu einem Datenpunkt (Bild) eine (gegebenenfalls zufällige) Information (zum Beispiel Bus). Nun wird das Ergebnis mit der wahren Information des Datenpunkts abgeglichen. Aus der Übereinstimmung oder der Nicht-Übereinstimmung und über zahlreiche Wiederholungsschritte („Epochen“) wird der Algorithmus iterativ und schrittweise optimiert, so dass am Ende des Trainingsprozesses die Fehlerquote minimiert wird.
Am Ende sollte ein so trainierter Algorithmus in der Lage sein, auch auf bisher nicht gesehenen Datensätzen selbstständig korrekt die zugehörigen Informationen zu generieren.
ML steckt auch hinter der heute am weitesten verbreiteten KI-Anwendung in der Medizin, dem sogenannten Maschinellen Sehen.
Wie sehen Maschinen?
Maschinen realisieren das Sehen völlig anders als Menschen. Menschen sehen auf Bildern Farben, Formen, Muster und Strukturen, die sich uns als Objekte mit Namen und Bezeichnungen erschließen. Maschinen hingegen sehen in Bildern nur Zahlen, die den Intensitätswerten der einzelnen Bildpunkte (Pixel) entsprechen. Um Maschinen das Sehen beizubringen, müssen zuerst Bildeigenschaften extrahiert und diese in prozessierbare Einheiten überführt werden. Dazu werden Bildfilter genutzt, die bestimmte Bildeigenschaften (Kanten, Rundungen, Farben, Texturen, ...) hervorheben. Diese Filter scannen das gesamte Bild und sobald eine entsprechende Struktur erkannt wird, schlägt der Filter aus. Jeder Filter erzeugt dadurch eine eigene Repräsentation des Originalbildes. Manche Filter erkennen Kanten, andere Rundungen und wieder andere eine bestimmte Farbe. Durch den Einsatz von vielen Hunderten von Filtern auf demselben Bild wird eine riesige Anzahl an Bildrepräsentationen erstellt, die Inhalte und Strukturen im Originalbild beschreiben.
Diese multidimensionale numerische Abbildung der Realität ist für den Menschen nicht mehr interpretierbar, beschreibt aber für die Maschine – abstrahiert in Zahlen – den Inhalt des Bildes. Diese als Tensor bezeichnete Datenstruktur kann nun mittels Methoden des ML analysiert werden, wobei gerade für Bilddaten eine besondere Form des ML, das sogenannte Tiefe Lernen („Deep Learning“) eingesetzt wird. Hierbei werden künstliche neuronale Netzwerke (KNN) eingesetzt, die aufgrund ihrer mathematischen Eigenschaften als „universelle Approximationsmaschinen“ gelten. Diese KNN werden wie oben dargelegt mit annotierten Bilddatensätzen trainiert und erlernen iterativ, der stark abstrahierten und oft sehr komplexen Datenstruktur des Tensors ein Ergebnis (meist die Bezeichnung einer Objektklasse, zum Beispiel „Auto“) zuordnen. KNN sind hierbei dem Menschen bereits heute in vielen Anwendungsfällen des Maschinellen Sehens, so beispielsweise bei der Bildklassifikation oder Objektdetektion, weit überlegen.
Künstliche Intelligenz in Medizin und Zahnmedizin
Neben den bereits umschriebenen Anwendungen im Bereich der Sprachauswertung und der Robotik hat es gerade das Maschinelle Sehen in den vergangenen Jahren in Medizin und Zahnmedizin weit gebracht; vor allem bei der automatisierten Analyse von medizinischen Bildern können Maschinen den menschlichen Experten unterstützen [Wagner, 2019]. So kann zum Beispiel das manuelle Auswerten von histopathologischen Bildern durch eine Maschine massiv beschleunigt werden [Niazi et al., 2019]; Pathologen können ihr Fachwissen nun auf wenige kritische unsichere Bereiche lenken, während die Maschine die arbeitsintensive Segmentierung von Zellkernen und Zellumrissen automatisiert erledigen und somit die Arbeitsgeschwindigkeit von Pathologen enorm erhöhen kann.
Ebenso kann in der Dermatologie durch KI-Anwendungen die Klassifikation von dermatologischen Krankheitsbildern auf fotografischen Bildern unterstützt und der Dermatologe entlastet werden. Bei beiden Anwendungsbeispielen ist die Maschine möglicherweise nicht genauer als der Mensch, sie ist jedoch um ein Vielfaches schneller und kann helfen, die knappe „Ressource“ Pathologe oder Dermatologe zu entlasten. KI kann demnach helfen, medizinische Versorgung effizienter zu machen: Einen Termin beim Dermatologen erhalten dann vor allem (und zeitnah) Patienten, bei denen der Hausarzt, unterstützt durch KI, eine unklare oder möglicherweise schwerwiegende Diagnose vermutet.
Ähnliche Anwendungsbeispiele finden sich auch in der Augenheilkunde, wo lange Wartezeiten auf Befundungstermine (zum Beispiel für Spiegelungen des Augenhintergrunds) nicht unüblich sind. Hier kann KI helfen, dringliche Konsultationen (zum Beispiel für feuchte Makuladegeneration) zu priorisieren, weil bereits der Hausarzt eine solche Diagnose KI-gestützt gestellt hat [Balyen und Peto, 2019]. Auch bei der Befundassistenz von komplexen Röntgenbildern, beispielsweise CT- oder DVT-Bildern, kann KI hilfreich sein. So sind heute bereits zahlreiche KI-Modelle im Einsatz, die in Bauch- oder Thorax-CTs Organe segmentieren und den Arzt hierdurch entlasten. In allen beschriebenen Fällen ist es so, dass KI den Arzt unterstützt und nicht ersetzt [Syed und Zoga, 2018]. Die finale Diagnose und Entscheidung liegen allein beim Arzt.
Auch in der Zahnmedizin wird zunehmend an KI-Anwendungen geforscht. Vor allem im Bereich des Maschinellen Sehens findet zurzeit eine Wissensexplosion statt (Abbildung 3). Die Zahl der Publikationen zu KI im Bereich Zahnmedizin stieg vor allem in den vergangenen fünf Jahren sehr stark an. Ein zentrales Anwendungsfeld ist hierbei die Röntgenbildanalyse. So arbeiten weltweit mehrere Gruppen daran, KI-Modelle zu entwickeln, die Zahnärzte bei der Befundung von Panoramaschichtaufnahmen, Einzelbildern, Bissflügelaufnahmen oder Fernröntgenseitenaufnahmen unterstützen [Endres et al., 2020; Schwendicke et al., 2020; Cantu et al., 2020; Leite et al., 2020; Hiraiwa et al., 2019]. Diese Unterstützung umfasst sowohl die Detektion und Klassifikation von Pathologien (apikale Läsionen, parodontaler Knochenabbau, Karies, aber auch Osteoporose oder Frakturen) als auch die Detektion und Klassifikation von physiologischen Strukturen oder zahnärztlich verarbeiteten Materialien wie zum Beispiel Füllungen, Kronen, Implantate [Schwendicke et al., 2020].
Beim Einsatz von KI stehen drei Vorteile im Vordergrund:
1. Die Detektion von anatomischen Strukturen, Füllungen, Kronen oder Implantaten entlastet den Zahnarzt. Durch eine Zuordnung der Detektionen zu bestimmten Zähnen kann ein „Vorbefund“ erzeugt werden, der umfänglich und systematisch ist und vom Zahnarzt nur noch einmal kontrolliert werden muss. Hierbei wird Zeit gespart und die Dokumentationsqualität erhöht.
2. Zur Pathologiedetektion sollten die entwickelten Modelle mindestens genauso gut wie ausgebildete Zahnärzte sein; nicht selten jedoch übertreffen KI-Modelle auch zahnärztliche Experten. In einer kürzlich publizierten Studie konnte gezeigt werden, dass KI-Modelle frühe Karies auf Bissflügelröntgenbildern teilweise deutlich besser erkennen als Zahnärzte [Cantu et al., 2020]. Interessanterweise war der Unterschied zwischen KI und Zahnärzten bei der Detektion vorangeschrittener kariöser Läsionen nur minimal, während die KI beim Erkennen der Karies-Frühstadien deutlich besser abschnitt.
3. Ein dritter Vorteil ist der Einsatz von KI-Anwendungen zur Patientenkommunikation. Bestimmte KI-Lösungen, wie die weiter unten vorgestellte Software dentalXrai Pro, erlauben es, Pathologien farblich hervorzuheben: Patienten können so in die Lage versetzt werden, Pathologien nicht nur im schwarz-weißen Bild beschrieben zu bekommen, sondern wirklich zu sehen. Dieser Verständnisgewinn ist ein enormer Vorteil für den Patienten und für eine gemeinsame Entscheidungsfindung.
Chancen und Herausforderungen
Schnellere und effizientere Prozesse, eine Entlastung der Ärzte, eine bessere Patientenkommunikation, eine genauere Detektion und schlussendlich eine bessere Diagnostik- und Therapiequalität – das sind die Vorteile, die KI-Anwendungen versprechen. Zudem soll KI künftig auch mit immer komplexeren medizinischen Daten umgehen können. Am Horizont erscheint die Vision, Diagnostik und Therapie durch intelligente Datennutzung und Verknüpfung personalisierter zu gestalten und Behandlungen präziser durchzuführen. Medizin und Zahnmedizin können früher intervenieren und präventiver sein.
Allerdings stehen dem heute noch zahlreiche Hürden entgegen. Das junge Feld der KI-Forschung in der Medizin ist bisher methodisch nur bedingt in der Lage, belastbare Ergebnisse zu erzeugen. Viele KI-Anwendungen kommen über das Forschungsstadium zunächst nicht hinaus. Es zeigt sich, dass der Schritt von der Forschung in die Anwendung – anders als es die mitunter euphorisch vorgetragenen Visionen vermuten lassen – in der Praxis alles andere als einfach ausfällt, sondern langwierig, komplex und teuer zu werden scheint.
Auch sind viele KI-Anwendungen nur bedingt generalisierbar und robust – die relativ kleinen Datenmengen, die in der Medizin zur Verfügung stehen, schränken nicht nur die Genauigkeit von KI ein, sondern begrenzen auch die Übertragbarkeit von KI-Modellen: Die an Daten einer Population (zum Beispiel kaukasische Ethnien aus zahnärztlich gut versorgten Ländern) trainierten Modelle sind nicht zwingend generalisiert anwendbar auf Daten anderer Populationen (zum Beispiel Südasiaten mit wenig Zugang zu zahnmedizinischen Leistungen). Viele KI-Anwendungen sind zudem nur bedingt validiert worden, eine Validierung an externen Daten oder in prospektiven Studien ist oft nicht erfolgt. Unklar ist auch, inwieweit die demonstrierten Genauigkeitsdaten einer KI-Anwendung sich in Patientennutzen oder Nutzen für das Gesundheitssystem, wie zum Beispiel Effizienzgewinne oder in der Verringerung von Gesundheitsungleichheiten, niederschlagen.
dentalXrai Pro – eine KI-basierte Software für zahnmedizinische Anwendungen
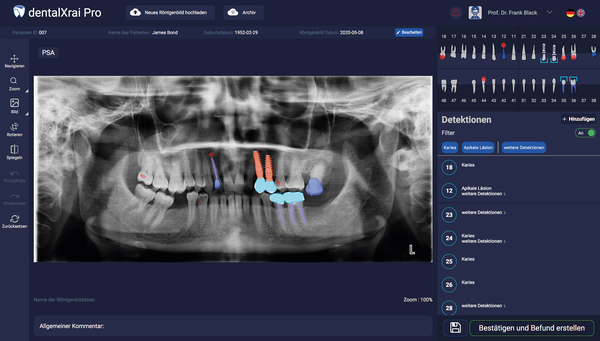
Die Software dentalXrai Pro (Abbildung 6) wurde an der Zahnklinik der Charité, Universitätsmedizin Berlin, entwickelt und wird durch eine Charité-Ausgründung, die dentalXrai GmbH, vertrieben und weiterentwickelt. Die Software ist ein KI-basiertes Diagnoseunterstützungssystem für dentale Röntgenbilddaten. Sie unterstützt die Lokalisierung und die Klassifizierung von Zähnen sowie die Erkennung und die Dokumentation von Pathologien (Karies und apikale Läsionen) sowie von nicht-pathologischen Strukturen (Füllungen, Kronen, Implantate, Brücken und Wurzelkanalfüllungen).
Die maschinell detektierten Befunde können vom Zahnarzt bei Bedarf ergänzt, korrigiert und kommentiert werden. Der diagnostische Befund wird automatisch auf eine Zahnkarte übertragen und kann danach gespeichert oder ausgedruckt werden. Vorhandene Schnittstellen ermöglichen es, die Software mit anderen Softwaresystemen zu verbinden (zum Beispiel PVS) und den Befund innerhalb der IT-Infrastruktur weiterzuverarbeiten. Insgesamt spart die Software dem Zahnarzt Zeit, sichert einen Qualitätsstandard und stellt Arzt und Patient ein farblich augmentiertes Röntgenbild als Gesprächsgrundlage zur Verfügung.
Die Markteinführung von dentalXrai Pro erfolgt voraussichtlich im ersten Quartal 2021. Damit zählt die Software zu den weltweit ersten kommerziell vertriebenen KI-basierten Lösungen für zahnmedizinische Anwendungen.
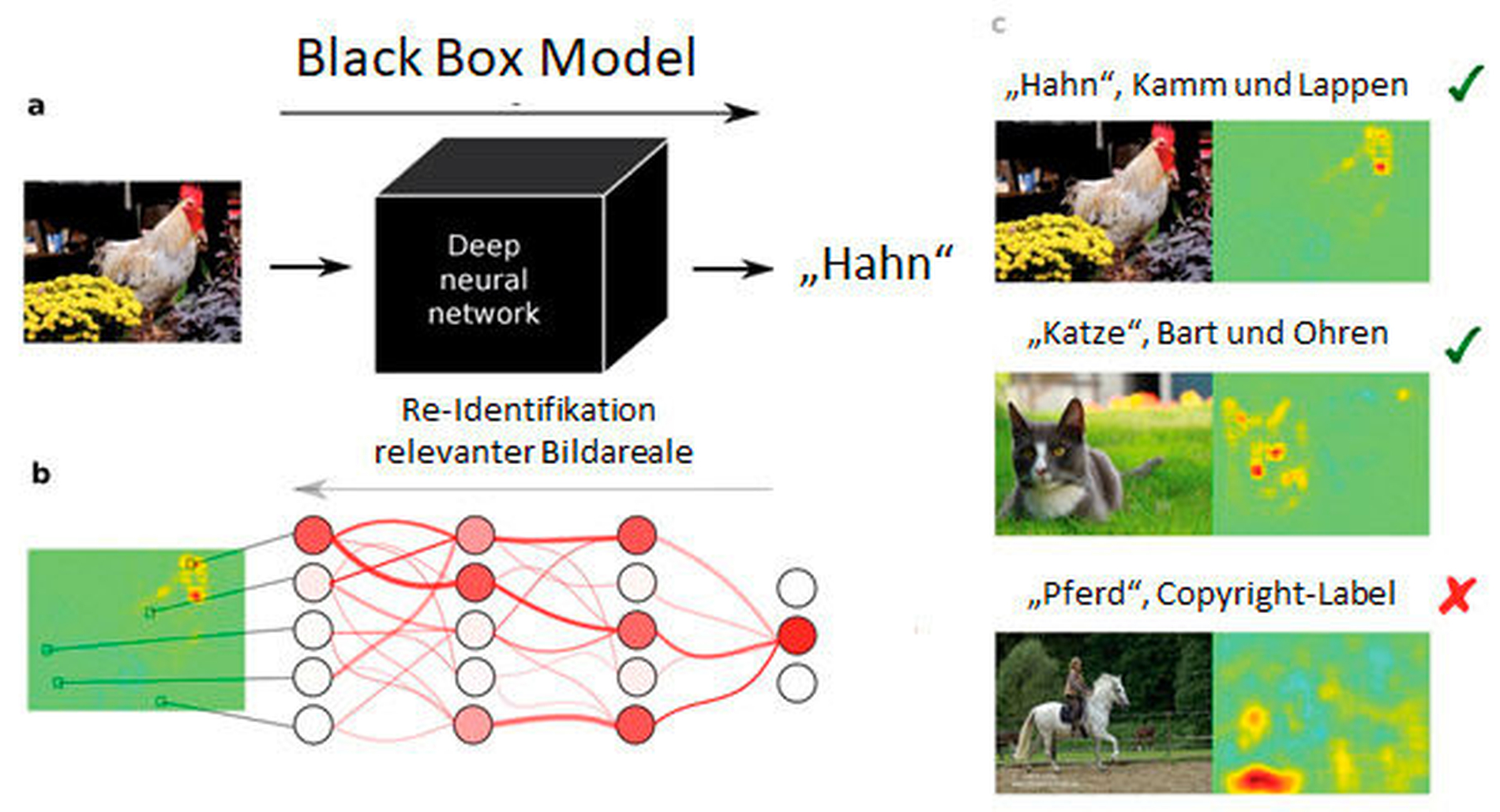
Nicht zuletzt sind viele KI-Modelle durch ihre komplexe intrinsische Struktur nur wenig interpretierbar; man spricht von einem „Black Box Modell“, bei dem für Nutzer nicht erkennbar ist, anhand welcher Kriterien die KI zu einem Ergebnis kommt (Abbildung 4). Neuere technologische Ansätze helfen zu verstehen, worauf KI-Modelle ihre Entscheidungsfindung aufbauen. Erklärbare KI kann das Vertrauen in KI-basierte Anwendung stärken, weil die maschinelle mit der menschlichen Logik abgeglichen und so verifiziert werden kann. Dies ist relevant, weil aus anderen KI-Forschungsfeldern bekannt ist, dass KI-Modelle zu systematischen Verzerrungen neigen.
Aufgrund der beschriebenen Probleme muss sichergestellt werden, dass KI in Medizin und Zahnmedizin robust, generalisierbar, transparent und erklärbar entwickelt und validiert wird. Auch KI-Forschung muss evidenzbasiert erfolgen und KI-Anwendungen müssen sich an den hohen Hürden einer evidenzbasierten Medizin messen lassen. Zahlreiche Initiativen lassen hier jedoch hoffen. So hat beispielsweise die Internationale Telekommunikationsvereinigung (ITU) zusammen mit der Weltgesundheitsorganisation (WHO) eine Gruppe ins Leben gerufen, die Standards für KI-Anwendungen in der Medizin definiert [ITU, 2020]. Die Autoren arbeiten für den Bereich der Zahnmedizin in dieser Gruppe mit. Auch an anderen Stellen wird intensiv an Qualitätsrichtlinien für KI-Forschung in der Medizin und Zahnmedizin gearbeitet. In der Zahnmedizin sollten diese Richtlinien zumindest überblickshaft verstanden werden, um zukünftige KI-Anwendungen entsprechend kritisch beurteilen können. Für den Zahnarzt von morgen wird es genauso wichtig sein, die Qualität von KI-Anwendungen einschätzen zu können, wie die Qualität einer neuen Behandlungseinheit oder eines neuen endodontischen Instruments.
Fazit
Aktuell sind für den zahnärztlichen Bereich nur wenige KI-Anwendungen bereits auf dem Markt erhältlich. Mehrere Anwendungen bieten KI-gestützte Hilfe bei der Vorbefundung von Röntgenbildern an. Für die Kieferorthopädie existiert eine Software, die die Vermessung von Gebiss und Schädel anbietet. Die Leistungsfähigkeit dieser Anwendungen ist aufgrund vielfach fehlender Studien schwer einzuschätzen. Andererseits zeigt sich das Feld der KI-Forschung hochdynamisch und auch in der Zahnmedizin werden in rascher Folge neue Anwendungsfelder für KI erschlossen. Es kann also damit gerechnet werden, dass in naher Zukunft weitere KI-Produkte auf den Markt drängen werden.
Die Chancen von KI für die Zahnmedizin liegen in einer besseren Diagnostik- und Therapiequalität, der integrativeren Nutzung von Daten und somit einer präziseren, präventiveren Zahnmedizin, einer möglichen Zeitersparnis für arbeitsintensive Routineaufgaben und der engeren Einbindung des Patienten in Entscheidungs- und Therapieabläufe. Allerdings sind die Hürden für belastbare, generalisierbare, transparente KI-Anwendungen in Medizin und Zahnmedizin besonders hoch, da es hier letztlich um die Gesundheit der Patienten geht. Eine KI-basierte Software muss sich – wie alle diagnostischen und therapeutischen Methoden in der Medizin – einer Erfolgs- und Nutzenüberprüfung im klinischen wie auch im wissenschaftlichen Rahmen stellen.
Prof. Dr. Falk Schwendicke, MDPH
Leiter der Abteilung für Zahnärztliche Diagnostik, Digitale Zahnheilkunde und Versorgungsforschung
Centrum 3 für Zahn-, Mund- und Kieferheilkunde, Charité – Universitätsmedizin Berlin
Aßmannshauser Str. 4–6, 14197 Berlin
Dr. med. Robert A. Gaudin
Mund-, Kiefer- und Gesichtschirurgie, Charité – Universitätsmedizin Berlin
Hindenburgdamm 30, 12203 Berlin
Dr. rer. nat. Joachim Krois
Abteilung für Orale Diagnostik, Digitale Zahnheilkunde und Versorgungsforschung,
CharitéCentrum 3 für Zahn-, Mund- und Kieferheilkunde, Charité – Universitätsmedizin Berlin
Aßmannshauser Str. 4–6, 14197 Berlin
Literaturliste
ANSDIT, 1996. American national standard dictionary of information technology. New York: Springer.
Avati, A., Jung, K., Harman, S., Downing, L., Ng, A. & Shah, N.H., 2018. Improving palliative care with deep learning. BMC Medical Informatics and Decision Making, 18(Suppl 4). Available at: https://pubmed.ncbi.nlm.nih.gov/30537977/.
Balyen, L. & Peto, T., 2019. Promising artificial intelligence–machine learning–deep learning algorithms in ophthalmology. Asia-Pacific Journal of Ophthalmology, 8(3), pp.264–272. Available at: https://pubmed.ncbi.nlm.nih.gov/31149787/.
Bhavaraju, S., 2018. From subconscious to conscious to artificial intelligence: A focus on electronic health records. Neurology India, 66(5), pp.1270–1275. Available at: pubmed.ncbi.nlm.nih.gov/30232983/.
Cantu, A.G., Gehrung, S., Krois, J., Chaurasia, A., Rossi, J.G., Gaudin, R., et al., 2020. Detecting caries lesions of different radiographic extension on bitewings using deep learning. Journal of Dentistry, 100.
Endres, M.G., Hillen, F., Salloumis, M., Sedaghat, A.R., Niehues, S.M., Quatela, O., et al., 2020. Development of a Deep Learning Algorithm for Periapical Disease Detection in Dental Radiographs. Diagnostics (Basel, Switzerland), 10(6). Available at: http://www.ncbi.nlm.nih.gov/pubmed/32599942 .
Grapov, D., Fahrmann, J., Wanichthanarak, K. & Khoomrung, S., 2018. Rise of deep learning for genomic, proteomic, and metabolomic data integration in precision medicine. OMICS A Journal of Integrative Biology, 22(10), pp.630–636. Available at: https://pubmed.ncbi.nlm.nih.gov/30124358/ .
Hiraiwa, T., Ariji, Y., Fukuda, M., Kise, Y., Nakata, K., Katsumata, A., et al., 2019. A deep-learning artificial intelligence system for assessment of root morphology of the mandibular first molar on panoramic radiography. Dentomaxillofacial Radiology, 48(3). Available at: https://pubmed.ncbi.nlm.nih.gov/30379570/. ITU, 2020: www.itu.int/en/ITU-T/focusgroups/ai4h/Pages/default.aspx, Abruf am 20.10.2020
Leite, A.F., Gerven, A. Van, Willems, H., Beznik, T., Lahoud, P., Gaêta-Araujo, H., et al., 2020. Artificial intelligence-driven novel tool for tooth detection and segmentation on panoramic radiographs. Clinical Oral Investigations. Available at: https://pubmed.ncbi.nlm.nih.gov/32844259/ .
Mertz, L., 2018. Machine Learning Takes on Health Care: Leonard D’Avolio’s Cyft Employs Big Data to Benefit Patients and Providers. IEEE pulse, 9(1), pp.10–11. Available at: pubmed.ncbi.nlm.nih.gov/29373850/.
Miller, D.D. & Brown, E.W., 2019. How cognitive machines can augment medical imaging. American Journal of Roentgenology, 212(1), pp.9–14. Available at: https://pubmed.ncbi.nlm.nih.gov/30422716/.
Niazi, M.K.K., Parwani, A. V. & Gurcan, M.N., 2019. Digital pathology and artificial intelligence. The Lancet Oncology, 20(5), pp.e253–e261. Available at: https://pubmed.ncbi.nlm.nih.gov/31044723/ .
Schwendicke, F., Golla, T., Dreher, M. & Krois, J., 2019. Convolutional neural networks for dental image diagnostics: A scoping review. Journal of Dentistry, 91. Available at: https://pubmed.ncbi.nlm.nih.gov/31704386/.
Schwendicke, F., Elhennawy, K., Paris, S., Friebertshäuser, P. & Krois, J., 2020. Deep learning for caries lesion detection in near-infrared light transillumination images: A pilot study. Journal of Dentistry, 92. Available at: https://pubmed.ncbi.nlm.nih.gov/31821853/.
Schwendicke, F., Samek, W. & Krois, J., 2020. Artificial Intelligence in Dentistry: Chances and Challenges. Journal of Dental Research, 99(7), pp.769–774. Available at: pubmed.ncbi.nlm.nih.gov/32315260/.
Syed, A.B. & Zoga, A.C., 2018. Artificial Intelligence in Radiology: Current Technology and Future Directions. Seminars in Musculoskeletal Radiology, 22(5), pp.540–545. Available at: https://pubmed.ncbi.nlm.nih.gov/30399618/.
Wagner, J.B., 2019. Artificial intelligence in medical imaging. Radiologic Technology, 90(5), pp.489–503. Available at: https://pubmed.ncbi.nlm.nih.gov/31088949/.
Wu, Y., Wang, F., Fan, S. & Chow, J.K.F., 2019. Robotics in Dental Implantology. Oral and Maxillofacial Surgery Clinics of North America, 31(3), pp.513–518. Available at: https://pubmed.ncbi.nlm.nih.gov/31103316/.
Yu, K.H., Beam, A.L. & Kohane, I.S., 2018. Artificial intelligence in healthcare. Nature Biomedical Engineering, 2(10), pp.719–731. Available at: https://pubmed.ncbi.nlm.nih.gov/31015651/.









